改良巴氏染色
精子形态学染色液(巴氏法)
精子形态学染色液(巴氏法)简介:细胞学常规染色普遍使用巴氏(Papanicolaou)法,Papanicolaou Stain 最初仅用于检测阴道上皮雌激素水平以及生殖道念珠菌、滴虫等病原体。
橘黄G6与EA36或EA50联合使用,可将胞浆染成颜色鲜明的绿色、蓝色和粉色。
目前大多数实验室采用成品染液,所以每种染液应注意其改良后的最佳条件。
最终胞浆染色应透明可见,核染色质应很容易辨别出来。
目前改良的巴氏染色液含有多种离子,具有多色性染色效能。
染色后胞质鲜艳、透明性好以及核膜、核仁、染色质结构清晰。
Leagene 精子形态学染色液(巴氏法) 因精子及细胞内不同等电点的蛋白质在相同的酸度下带不同的电荷,能选择性地结合相应的染料而着色。
胞核由酸性物质组成,它与碱性染料的亲和力较强;而胞浆则相反,它含有碱性物质和酸性染料的亲和力较大细胞质染色特别采用针对于精子染色的改良EA50染色液,细胞核染色采用Leagene 自主研发的无毒改良型苏木素染色液,特别适用于精子的染色,亦可用于胸水、腹水、痰液等细胞样本的染色。
组成:自备材料:1、 固定液(如95%乙醇-乙醚固定液)2、 系列乙醇3、 0.5%盐酸乙醇分化液操作步骤(仅供参考):1、 细胞涂片用等量95%乙醇-冰乙酸固定液固。
2、 80%的乙醇浸泡1min 。
3、 70%的乙醇浸泡1min 。
4、 50%的乙醇浸泡1min 。
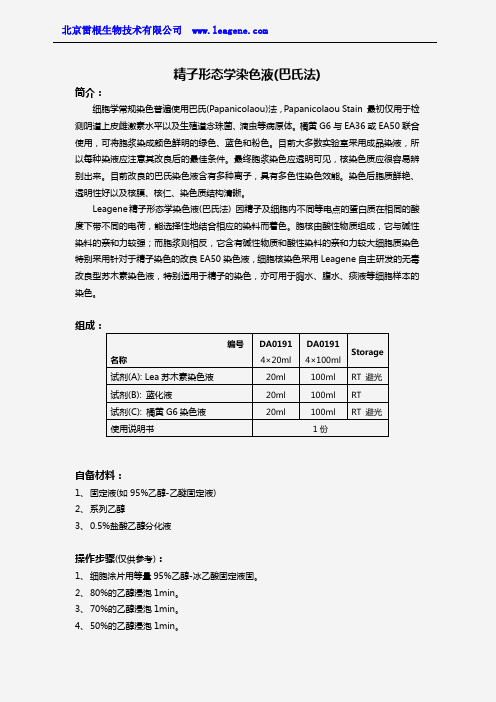
编号 名称DA0191 4×20ml DA0191 4×100ml Storage 试剂(A): Lea 苏木素染色液 20ml 100ml RT 避光 试剂(B): 蓝化液20ml 100ml RT 试剂(C): 橘黄G6染色液 20ml100ml RT 避光使用说明书1份5、 蒸馏水或自来水浸泡或冲洗。
6、Lea 苏木素染色液染色。
7、自来水冲洗。
8、盐酸乙醇分化液分化或盐酸水溶液分化。
9、自来水冲洗。
10、蓝化液中蓝化4min 。
巴氏染色原理

巴氏染色原理
巴氏染色原理是由德国微生物学家巴氏(F. Loeffler)和日本细菌学家小野寺(K. Kitasato)于1884年共同提出的。
该原理是指用一种特定的染色方法,可以
将细菌染色成蓝色或紫色,而其他组织则保持无色或染成红色。
这种染色方法在细菌学和病原微生物学研究中得到了广泛的应用。
巴氏染色原理的核心是利用染色剂与细菌细胞壁的特定化学成分之间的亲和作用,通过染色剂的作用,使细菌细胞壁吸附染色剂,从而使细菌呈现出特定的颜色。
这种染色方法的原理简单,操作方便,且染色效果稳定,因此被广泛应用于细菌学实验室中。
巴氏染色原理的具体步骤包括,将细菌涂片加热固定,然后用甲苯或其他溶剂
处理,使细菌细胞壁透明,接着用染色剂如甲基蓝或结晶紫染色,最后用水洗去余染色剂,晾干即可观察。
通过这种染色方法,可以清晰地观察到细菌的形态、结构和分布情况。
巴氏染色原理的应用不仅局限于细菌学领域,还广泛应用于医学临床诊断中。
通过染色技术,医生可以观察到患者体液或组织中的细菌、病毒等微生物,从而进行疾病的诊断和治疗。
比如在结核病的诊断中,巴氏染色方法可以帮助医生观察到结核杆菌的存在,从而进行准确的诊断。
总的来说,巴氏染色原理是一种简单而有效的细胞染色方法,通过对细菌细胞
壁的特定化学成分的染色作用,使细菌呈现出特定的颜色,从而方便观察和研究。
这种染色方法在细菌学和医学领域都有着重要的应用,对于微生物学研究和临床诊断都具有重要意义。
巴氏染色技术要点

巴氏染色巴氏(Papanicolaou)染色法是脱落细胞染色中最好的染色方法。
其适用于上皮细胞及间皮组织的标本。
是阴道脱落细胞检查中最常用的染色方法。
该染色法不但具有显示细胞核结构清晰,分色明显,透明度好,胞浆受色鲜艳等特点,而且所染标本不易脱色,可长久保存。
对如何染好巴氏染色,笔者有以下几点体会,报告如下。
1 EA 36染液pH值的测试EA 36染液的酸碱度对巴氏染色的成功起着关键性作用,EA 36染液由伊红、亮绿、桔黄及俾麦棕等染料配成。
伊红、亮绿、桔黄及俾麦棕等属于酸性染料。
在溶媒中其发色团是负离子部分。
发色团可与蛋白质中带正电的氨基结合,从而使胞浆显蓝色、绿色、桔黄色或红色。
但蛋白质所带正负电荷的多少是随溶液的pH值而改变的。
在偏碱环境中,蛋白质的羧基游离增多(带负电)。
在偏酸环境中蛋白质氨基游离增多(带正电)。
所以必须把染液pH值调至5.2为宜[1]。
EA 36染液pH的调节,可用石蕊试纸法,也可用酸度计测试。
当然用酸度计法最为准确。
但以上方法均比较麻烦,同时还要受到仪器设备的限制,不方便。
本文采用一种简单方便的方法。
即用10%磷钨酸及饱和碳酸锂溶液直接测试。
具体做法是,拿一张滤纸先滴少量染液于纸上,若滴染液处呈紫色,说明染液偏碱,则滴加少量10%磷钨酸。
若显绿色,说明染液偏酸,则滴加少量饱和碳酸锂。
并充分混匀。
直至染液滴在纸上既显绿色又有红色,颜色鲜艳为宜。
用此法测试染液pH同用石蕊试纸法测试一样,同样可获得满意的染色效果。
磷钨酸在染色过程中,不但作为媒染剂可增加染料的着色力。
同时磷钨酸与碳酸锂还是一对弱酸弱碱,实际上是一对缓冲剂。
可中和分色及蓝化时可能留下的少量酸或碱。
保证染色达到理想效果。
2 分色分色或酸化,对染色效果也很重要。
分色目的是去掉胞浆中染上的多余的苏木素,使胞核着色显示特异性。
因此,经分色后的胞浆在镜下观察应无色为佳。
若胞浆中还残留有苏木素染料,会影响EA 36染液的着色。
巴氏染色原理

巴氏染色原理
巴氏染色原理是一种常用的细胞染色技术,用来对细胞或组织进行染色。
该原理是基于酚醛固定的原理,通过将细胞或组织固定在玻片上,然后处理它们使得它们能够与染料发生反应。
巴氏染色的步骤如下:
1. 固定:将细胞或组织浸泡在酚醛液中,使其固定在玻片上。
酚醛能够保持细胞或组织的形状和某些结构的完整性。
2. 脱水:通过将样本逐渐浸泡在濃度递增的酒精溶液中,使其逐渐失去水分。
这样做是为了减少细胞或组织内的水分,以便尽可能地提高染料对细胞或组织的亲和力。
3. 渗透:将细胞或组织浸泡在骨胶液中,使其充分浸润。
骨胶液能够渗透到细胞或组织的内部,使得染料更容易地与它们发生反应。
4. 染色:将染料溶液滴在样本上,使其与细胞或组织结合。
染料能够结合到不同的细胞或组织结构中,从而显示出不同的颜色或形态。
5. 清洗:将多余的染料以及其他杂质通过浸泡在去离子水中进行清洗。
这样可以让染色的结果更加清晰。
6. 封片:在玻片上涂上封片剂,以保护样本并固定染料。
这样可以使染色的结果保持较长时间。
通过巴氏染色原理,我们可以对细胞或组织进行染色,并观察它们的结构,从而得到更多关于它们的信息。
这种染色方法在细胞学和组织学研究中广泛应用,为我们研究生物体内部的结构和功能提供了重要的工具。
巴氏染色液(Papanicolaou EA65)操作步骤及注意事项
巴氏染色液(Papanicolaou EA65)操作步骤及注意事项货号:G1614规格:4×100ml/4×500ml有效期:6个月有效。
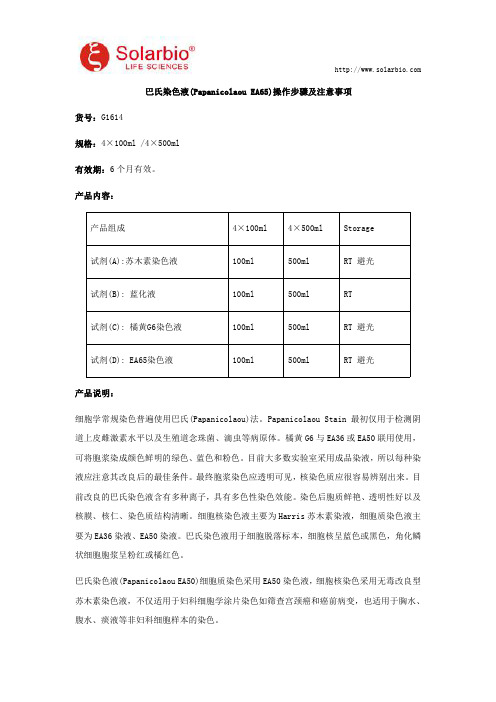
产品内容:产品组成4×100ml4×500ml Storage试剂(A):苏木素染色液100ml500ml RT避光试剂(B):蓝化液100ml500ml RT试剂(C):橘黄G6染色液100ml500ml RT避光试剂(D):EA65染色液100ml500ml RT避光产品说明:细胞学常规染色普遍使用巴氏(Papanicolaou)法。
Papanicolaou Stain最初仅用于检测阴道上皮雌激素水平以及生殖道念珠菌、滴虫等病原体。
橘黄G6与EA36或EA50联用使用,可将胞浆染成颜色鲜明的绿色、蓝色和粉色。
目前大多数实验室采用成品染液,所以每种染液应注意其改良后的最佳条件。
最终胞浆染色应透明可见,核染色质应很容易辨别出来。
目前改良的巴氏染色液含有多种离子,具有多色性染色效能。
染色后胞质鲜艳、透明性好以及核膜、核仁、染色质结构清晰。
细胞核染色液主要为Harris苏木素染液,细胞质染色液主要为EA36染液、EA50染液。
巴氏染色液用于细胞脱落标本,细胞核呈蓝色或黑色,角化鳞状细胞胞浆呈粉红或橘红色。
巴氏染色液(Papanicolaou EA50)细胞质染色采用EA50染色液,细胞核染色采用无毒改良型苏木素染色液,不仅适用于妇科细胞学涂片染色如筛查宫颈癌和癌前病变,也适用于胸水、腹水、痰液等非妇科细胞样本的染色。
自备材料:1、固定液(如95%乙醇-冰乙酸固定液)2、系列乙醇3、显微镜4、盐酸乙醇分化液操作步骤(仅供参考):1、细胞涂片用95%乙醇-冰乙酸固定液固定10~15min。
2、95%的乙醇浸泡1min。
3、80%的乙醇浸泡1min。
4、70%的乙醇浸泡1min。
5、蒸馏水或自来水浸泡或冲洗1min。
6、苏木素染液染色5~10min。
应用改良巴氏染色对男性不育中精子形态缺陷类型研究报告

应用改良巴氏染色对男性不育中精子形态缺陷类型研究报告【摘要】目的:通过对精液常规与巴氏染色结果的分析,探讨少、弱精子症与精子形态之间的关系,为不育症的诊断及所需采取的辅助生殖技术提供依据。
方法:应用北京中科彩色精子质量检测分析系统及改良巴氏染色法对在我院进行诊治的354例少、弱精子症患者进行检查,实验资料采用spss10.0统计软件包进行统计分析。
结果:弱精子症为精液异常的第一位原因,弱精子症组正常形态精子百分率显著低于正常活力组,差异有统计学意义(p0.05),各组间头部缺陷和颈尾部缺陷间的比较亦无统计学意义(p>0.05)。
结论:精液改良巴氏染色检查可以发现精液常规检查正常而单纯为畸形精子症的患者,由于受精率与精子的活力、形态均有关系,因此正常活力而形态异常的精子仍可发生不受精,这类患者须行单精子卵胞浆内注射(icsi)助孕。
【关键词】改良巴氏染色;男性不育;精子形态缺陷在与男性生育能力相关的精液指标中,精子密度、活动力、形态非常重要,是决定男性生育力的主要因素。
精子形态影响精子的受精能力,形态缺陷的精子受精率低下。
为探讨少、弱精子症中精子形态缺陷的情况,本研究用精液常规和改良巴氏染色法对在我院进行诊治的354例少、弱精子症患者进行检查;精液改良巴氏染色检查是who推荐的精子形态分析的经典方法[1],可以详细观察精子的核染色质性状以及顶体的情况;依照2010年who修订精子形态学检查的标准,对精液常规和改良巴氏染色检查的结果进行统计学分析研究,为不育症的诊断及所需采取的辅助生殖技术提供依据。
1 对象与方法1.1对象 2009.1~2012.12在生殖医学中心就诊的354例患者,其中少精子症患者70例,正常密度患者284例(弱精子症患者177例,正常活力患者107例)。
畸形精子症患者193例。
平均年龄30岁。
1.2 方法1.2.1精液常规检查:应用北京中科彩色精子质量检测分析系统,按要求禁欲3~7d,在我中心取精,精液在37℃水浴箱中静置液化,液化时间超过1h按相关操作处理[ 2]。
改良巴氏染色效果观察

改良巴氏染色效果观察
蒲明秋;葛秀峰
【期刊名称】《临床与实验病理学杂志》
【年(卷),期】1995(011)002
【摘要】改良巴氏染色效果观察蒲明秋,葛秀峰巴氏染色广泛应用于食管、阴道脱落细胞染色历时已久,优点甚多。
但此法用药量大,细胞核及核仁着色深,易过染,背景模糊,细胞结构显示不十分理想。
为此,我们参照国外文献巴氏染色改良法,并与传统的方法进行了对比试验,报道如下。
...
【总页数】2页(P162-163)
【作者】蒲明秋;葛秀峰
【作者单位】不详;不详
【正文语种】中文
【中图分类】R329-34
【相关文献】
1.精液常规联合改良巴氏染色检查在辅助生殖技术中的应用 [J], 宋影;刘雨生;周桂香;童先宏;骆丽华;栾红兵;郭通航;金仁桃
2.Testsimplets染色玻片法与改良巴氏染色法分析精子形态的比较 [J], 刁英;杨智敏;谭兵兵;张明哲
3.Diff-Quik与改良巴氏染色法对精子形态染色效果比较 [J], 王彦芳;张洲;寇卉
4.Diff-Quik与改良巴氏染色法对精子形态染色效果比较 [J], 王彦芳;张洲;寇卉
5.应用改良巴氏染色法对前列腺炎合并不育症患者精液标本的分析 [J], 张春雪;朱伟杰;梁蔚波;卓育敏
因版权原因,仅展示原文概要,查看原文内容请购买。
什么是巴氏染色巴氏染色的操作方法

什么是巴氏染色巴氏染色的操作方法巴氏染色有4个步骤,分别是固定、核染色、胞浆染色和透明,那么你对巴氏染色了解多少呢?以下是由店铺整理关于什么是巴氏染色的内容,希望大家喜欢!巴氏染色的操作方法及注意事项染色有4个步骤:1、固定;2、核染色;3、胞浆染色;4、透明。
主要达到以下要求:1、核的结构清晰;2、透明度高;3、分色恰当。
固定固定的目的细胞制片的迅速固定是制片过程中关键的一步,否则会影响细胞学诊断的准确性。
对于不同的标本需要不同的固定方法。
最为常用的固定方法是95%酒精作为固定液的湿固定法。
酒精作为一种脱水剂能够防止细胞内的酶捋蛋白质分解而自容,并凝固细胞内的物质如蛋白质、脂肪和糖类等,使其保持与组织生活相仿的成分,从而使细胞各部分,尤其核染色质易于着色。
对于巴氏染色来说,酒精固定最为重要的。
如果酒精浓度不足引起的固定不佳,可造成细胞的人为变化,并可导致假阳性或假阴性的诊断。
1、固定方法湿固定法:作为用95%酒精固定液固定的细胞学标本一定使用湿固定法。
制片制备完后,趁标本新鲜而又湿润时,立即放入盛有95%酒精的固定缸内。
制片在固定液内至少保持15-30min。
固定时间通常不超过1周。
这种制片染色后,颜色鲜艳,结构清晰。
如果细胞制片需要送至另一实验室或邮寄他处染色时,可以固定15min后,把制片取出后立即密封的容器中或者使用甘油防止制片干燥。
因为无论固定前或固定后的制片,如果发生干燥后都会影响染色的效果。
2、固定注意事项固定液的过滤:为了防止细胞污染,凡是使用过的固定液,必须过滤后才能再使用。
使用过长的固定液,必须用酒精相对密度计测定,酒精浓度低于90%时应该及时更换新液。
湿固定的重要性:标本再新鲜时及时固定时保证染色效果的重要因素。
如苏木素对细胞核的染色,巴氏染色中胞浆的特殊着色作用,均可因标本干燥后固定而大受影响。
制片标本的邮寄:标本再固定15min后取出,立即加甘油数滴于制片上,装入密封的小盒中。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
巴氏染色液说明书
【产品名称】 巴氏染色液 【包装规格】
货号:DA0082
单瓶(盒)包装规格:100ml 、250ml 、500ml 、5000ml ;
套组(盒)包装规格:4×100ml/盒、4×250ml/盒、4×500ml/盒。
【预期用途】
主要用于对脱落细胞的组织细胞学染色。
【检验原理】
细胞学常规染色普遍使用巴氏(Papanicolaou)法,橘黄G 与EA36或EA50联合使用可将胞浆染成颜色鲜明的绿色、蓝色和粉色,细胞中的细胞核是由酸性物质组成,它与碱性染料的亲和力较强;而细胞浆则相反,它含有碱性物质和酸性染料的亲和力较大。
巴氏染色液利用这一特性对细胞进行多色性染色,细胞经染色后能清晰地显示细胞的结构,胞质透亮鲜丽,各种颗粒分明,细胞核染色质非常清楚,从而较容易发现异常细胞。
通过巴氏染色可反映出细胞在炎症刺激下和癌变后的形态学变化,对早期发现和诊断一些病变和肿瘤具有较重要意义。
【主要组成成分】
试剂组成
主要成分 l 、苏木素染色液
苏木素 2、1%盐酸乙醇分化液 盐酸、乙醇 3、橘黄G 染色液
橘黄G
4、EA50染色液或EA36染色液
EA50染色液:淡绿、伊红、磷钨酸、冰乙酸; EA36染色液:淡绿、伊红、磷钨酸
【储存条件及有效期】
5℃~35℃环境保存,原包装未开封染色液的有效期为18个月,在有效期内的已开封染色液建议在开封后6个月内使用完,每次用后应及时拧紧瓶盖,以免挥发或变质。
【样本要求】
新鲜标本涂片后,应尽快用95%乙醇固定,以避免细胞变形。
【检验方法】
1、固定:将细胞涂片置于95%乙醇中固定;
2、染色,按要求进行染色。
3、二甲苯透明,中性树脂封片,镜检。
【检验结果的解释】
【检验方法的局限
性】
仅供形态学初检观察染色使用。
【注意事项】
1、冬季气温较低时,苏木素染色液不易着色,可适当延长染色时间。
细胞核
蓝紫色或黑色 非角化细胞的胞质 淡蓝色或淡绿色 角化细胞的胞质 粉红或橘黄色 红细胞 鲜红色或橙红色 粘液
淡蓝或粉红色
2、橘黄G染色液染色时间不宜过长,且在乙醇中要尽量洗净多余的染色液,否则会影响EA50染色液或EA36染色液的着色。
3、请不要将新旧批号的EA50染色液或EA36染色液混合使用。
4、该试剂盒贮存时,尽量避免高温及光亮环境以免影响品质和效果
5、本产品仅用于体外诊断,应由专业人士使用及进行结果的判读。
6、使用前应详细阅读说明书,并做好个人卫生防护,在有效期内使用,生产日期、生产批号和失效日期见包装。
7、用后应按医院或环保部门要求处置废弃物。
【基本信息】
备案人/生产企业名称:安徽雷根生物技术有限公司
住所:淮北凤凰山经济开发区凤冠路三期标准化厂房三号厂房。
