重亚硫酸盐测序技术介绍
Illumina_HiSeq_2000-BGI

Illumina HiSeq 2000Illumina Hiseq 2000测序系统是一种高通量测序技术,其测序原理和Illumina Genome Analyzer II 测序系统相似,仍然是采用可逆终止法的边合成边测序技术。
这种测序技术通过将基因组DNA的随机片断附着到光学透明的表面,这些DNA片断通过延长和桥梁扩增,形成了具有数以亿计cluster的Flowcell,每个cluster具有约1000拷贝的相同DNA模板,然后用4种末端被封闭的不同荧光标记的碱基进行边合成边测序。
这种新方法确保了高精确度和真实的一个碱基接一个碱基的测序,排除了序列方面的特殊错误,能够测序同聚物和重复序列。
这种技术避免了像传统测序技术那样耗费大量人力、物力进行片段克隆、转化、质粒抽提等繁琐的操作。
而且多种样品制备方法使此技术有一系列的广泛应用,包括基因表达、小RNA的发现,蛋白质核酸相互作用等。
HiSeq 2000测序系统是前所未有的高通量测序系统,不仅提高测序通量,降低了成本,而且具有创新的用户体验。
预先配置、即插即用的试剂,简单的流动槽上样,简单的触摸屏用户界面,这种人机交互设计特征以及轻松的测序流程,使操作更简单,更方便。
HIseq 2000 cBotFlowcell Cluster Image测序实验流程:•基因组DNA打断;• DNA 末端修复;•连接接头;• DNA片段杂交到 Flowcell上;• DNA模板延伸,桥式扩增;• Flowcell制备;• SBS(synthesis-based-sequenceing)边合成边测序;• Hiseq上自动化测序;•图片处理,实时分析,碱基识别;•图片实时分析;•变异分析;•总结报告;技术特点:•每个run平均达到200G的数据通量,读长为2 x 100bp;•每个run可同时运行2张Flow cell, 且每张Flow cell 可进行上下两面扫描;•采用TDI 线性扫描技术,4个相机同时扫描;•预先配置、即插即用的试剂,简单的流动槽上样,触摸屏式的用户界面;•低成本:单次运行即可以~30倍的覆盖度同时对两个人类基因组样品进行测序,或同时绘制200个基因表达谱。
重亚硫酸盐测序技术介绍PPT课件

未来重亚硫酸盐测序技术将进一步优化测序精度,降低测序错误率, 提高数据分析的可靠性。
测序成本不断降低
随着技术的成熟和规模化生产,重亚硫酸盐测序技术的成本将逐渐 降低,使得更多人能够享受到基因测序的益处。
在生物医药领域的应用前景
疾病诊断与预测
重亚硫酸盐测序技术可用于检测与特定疾病相关的基因变 异,从而为疾病的早期诊断和预测提供依据。
其他应用领域
进化生物学研究
利用重亚硫酸盐测序技术,可以对不同物种的基因组 进行比较分析,研究物种进化关系和演化历程。
药物研发
通过重亚硫酸盐测序技术,可以对药物作用靶点进行 精准定位,为新药研发提供有力支持。
生物多样性研究
利用重亚硫酸盐测序技术,可以研究生物多样性,包 括物种分类、种群结构等。
03
比较与选择
重亚硫酸盐测序技术
在DNA序列分析中,重亚硫酸盐测序技术是一种基于连接反应和重亚硫酸盐转化的序列 特异性扩增技术。它具有高灵敏度、高特异性和可检测突变丰度的优点,因此在基因突变 筛查、基因分型和突变体鉴定等领域具有广泛的应用价值。
与其他测序技术的比较
与第二代测序技术相比,重亚硫酸盐测序技术的通量更高,能够检测低丰度的突变;与第 三代测序技术相比,重亚硫酸盐测序技术的准确性更高,适用于对准确性要求较高的应用 。
代表性技术
基于PCR扩增和光学检测的Sanger测序法。
特点
准确性高,但通量低,测序长度短,主要用于完成人类基因组计划等基础研究。
第三代测序技术
代表性技术
基于纳米孔的单分子测序技术(如PacBio RS II)和合成式测序技术(如Illumina MiSeq)。
特点
高通量、长读长,但准确性相对较低,主要用于临床诊断、基因组组装和基因表达分析 等应用。
Illumina_HiSeq_2000-BGI

Illumina HiSeq 2000Illumina Hiseq 2000测序系统是一种高通量测序技术,其测序原理和Illumina Genome Analyzer II 测序系统相似,仍然是采用可逆终止法的边合成边测序技术。
这种测序技术通过将基因组DNA的随机片断附着到光学透明的表面,这些DNA片断通过延长和桥梁扩增,形成了具有数以亿计cluster的Flowcell,每个cluster具有约1000拷贝的相同DNA模板,然后用4种末端被封闭的不同荧光标记的碱基进行边合成边测序。
这种新方法确保了高精确度和真实的一个碱基接一个碱基的测序,排除了序列方面的特殊错误,能够测序同聚物和重复序列。
这种技术避免了像传统测序技术那样耗费大量人力、物力进行片段克隆、转化、质粒抽提等繁琐的操作。
而且多种样品制备方法使此技术有一系列的广泛应用,包括基因表达、小RNA的发现,蛋白质核酸相互作用等。
HiSeq 2000测序系统是前所未有的高通量测序系统,不仅提高测序通量,降低了成本,而且具有创新的用户体验。
预先配置、即插即用的试剂,简单的流动槽上样,简单的触摸屏用户界面,这种人机交互设计特征以及轻松的测序流程,使操作更简单,更方便。
HIseq 2000 cBotFlowcell Cluster Image测序实验流程:•基因组DNA打断;• DNA 末端修复;•连接接头;• DNA片段杂交到 Flowcell上;• DNA模板延伸,桥式扩增;• Flowcell制备;• SBS(synthesis-based-sequenceing)边合成边测序;• Hiseq上自动化测序;•图片处理,实时分析,碱基识别;•图片实时分析;•变异分析;•总结报告;技术特点:•每个run平均达到200G的数据通量,读长为2 x 100bp;•每个run可同时运行2张Flow cell, 且每张Flow cell 可进行上下两面扫描;•采用TDI 线性扫描技术,4个相机同时扫描;•预先配置、即插即用的试剂,简单的流动槽上样,触摸屏式的用户界面;•低成本:单次运行即可以~30倍的覆盖度同时对两个人类基因组样品进行测序,或同时绘制200个基因表达谱。
进行表观基因组学实验的三个步骤

进行表观基因组学实验的三个步骤2008年早期,美国国家卫生研究院NIH宣布了一项涉及1.9亿元,时间长达5年的表观遗传学项目,这一项目作为NIH“路线图计划”(RoadMap Initiative)的组成部分,总体目标包括几个方面,比如绘制正常人类细胞和组织表观遗传系列参考图谱,研发新型研究工具等。
今天这些努力开始初见成效,NIH共同基金与一些私人研究机构已经资助了68项表观遗传学项目,获得了52份表观遗传图谱(不同细胞类型DNA甲基化和组蛋白修饰图谱),在去年9月,相关研究人员发表了30篇论文,介绍了这些研究成果,也解析了相关的转录因子结合位点,染色质高级结构,转录区域,以及将近150个细胞系中的更多人类基因组以外的信息。
而且更重要的是,通过这些研究,我们获得了大量新型表观遗传学和表观基因组学的分析技术,令我们更清楚的了解了基因组水平上细胞内发生的事件。
正如NIH共同基金办公室主任James Anderson 所说的那样,这些才是花费上百万美元的真正收获。
由此Science杂志特以“Epigenomics: The New Technologies of Chromatin Analysis”为题,总结概况了这些技术,文章分为甲基化分析,组蛋白分析,以及分离分选技术。
紧抓“甲基化”获得表观遗传学项目Epigenomics Program资助的一位研究人员,是来自加州大学圣地亚哥分校路德维希癌症研究所的华人科学家任兵(Bing Ren,音译),作为这一项目四大关键表观遗传学图谱研究中心之一的研究院首席研究员PI,任兵的研究方向为胚胎干细胞表观遗传学。
自2008年以来,圣地亚哥表观遗传学中心已经资助了1570万美元,用于绘制人类胚胎干细胞和四种干细胞分化细胞类型的DNA甲基化图谱,以及20个组蛋白修饰的图谱。
任兵表示,表观遗传学项目的重要性“与人类基因组测序技术的重要性相当”,“有了人类基因组图谱,就有了了解人类发育的蓝图,但是如果没有一个详细的表观遗传学解析图谱,我们就无法解读这个蓝图。
全基因组重亚硫酸盐测序和简化代表性重亚硫酸盐测序分析流程

#流程大放送#WGBS和RRBS测序分析流程介绍WGBS全称Whole Genome Bisulfite Seuqneicng,即全基因组重亚硫酸盐测序。
该方法通过Bisulfite处理,将原基因组中未发生甲基化的C碱基转换成U的同时,保留所有甲基化C 的碱基不发生转变,从而帮助科研人员识别发生甲基化的CpG位点。
该种测序技术适用于绘制单碱基分辨率的全基因组DNA甲基化图谱。
RRBS全称Reduced Representation Bisulfite Sequencing,即简化代表性重亚硫酸盐测序。
该方法在Bisulfite处理前,使用MspI(该酶的酶切位点为CCGG)酶切对样本进行处理,去除低CG含量DNA片段,从而使用较小的数据量富集到尽可能多的包含CpG位点的DNA片段。
相比于WGBS技术,RRBS是一种准确、高效且经济的DNA甲基化研究方法,通过酶切,并进行Bisulfite测序,该方法在保证DNA甲基化状态检测的高分辨率的同时提升测序数据的高利用率。
该项技术可用于以下研究1、处于特定时期或特定处理条件下的样本中,研究样本中染色体高精度DNA甲基化模式;2、比较不同细胞、组织、样本间的高精度DNA甲基化修饰模式的差异;3、疾病样本中,与疾病发生发展相关的高精度DNA甲基化表观遗传机理研究和相关高精度DNA甲基化位点分子标志的探索性研究。
数据处理和分析流程图分析结果示例图片展示示例图1 样本中各区域DNA甲基化水平信息统计和样本间差异DNA甲基化分析结果展示[1]示例图2 差异DNA甲基化区域内转录因子基序识别[1]示例图3 DNA甲基化水平变化与基因表达水平变化的关联性分析[1]示例图来源文献[1]. Ng, C.W., et al., Extensive changes in DNA methylation are associated with expression of mutant huntingtin. Proc Natl Acad Sci U S A, 2013. 110(6): p. 2354-9.。
DNA重亚硫酸盐转化
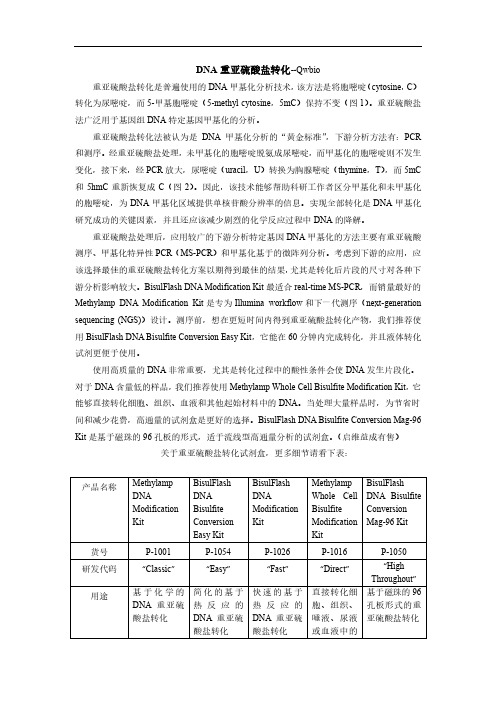
> 85% 平 均 : 200-2000 bp 峰值 800 bp 离心管
> 85% 平 均 : 200-2000 bp 峰值 800 bp 离心管
图 1 重亚硫酸盐处理后胞嘧啶(cytosine)转化为尿嘧啶(uracil)
图 2 重亚硫酸盐处理将胞嘧啶(C)转化为尿嘧啶(U) ,5-甲基胞嘧啶(5-mC)保持不变; 再经 PCR 扩增,U 转换为胸腺嘧啶(T) ,而 5-mC 重新恢复为 C,以此可将基因中的 C 与 5-mC 区别开。
产品名称
货号 研发代码 用途
DNA 产品关键词 Illumina 工 作流程兼容 最稳定可靠 重亚硫酸盐 测序、 NGS 和 各种 MSP 的 理想选择 DNA 50 pg < 2 hours 8-20 μl 99.9% √ Illumina 工 作流程兼容 热循环变性 液体重亚硫 酸盐转化试 剂 DNA 100 pg 1 hour 8-20 μl 99.9% √ 反应快速 real-time MSP 的理想 选择 测序最佳选 择 DNA 200 pg 30 minutes 10-20 μl 99.9% √ 省 略 了 DNA 分 离 的步骤 DNA 含量 低样品的理 想选择 细胞、 组织、 血液 100 个细胞, 1 μl 血液 < 3 hours 8-20 μl 99.9% √ Illumina 工作 流程兼容 流线型高通 量分析 专为大量样 品或者自动转 化设计 DNA < 10 ng < 1 hour 20 minutes 20 μl 99.9% √
起始材料 最低 DNA 用 量 转化所需总 时间 洗脱体积 转化效率 脱磺酸基作 用/清除 回收率 转化后 DNA 片段尺寸 储存管
> 75% 平 均 : 200-2000 bp 峰值 800 bp 离心管
《重亚硫酸盐测序技术介绍》PPT课件

CpG岛的甲基化
CpG岛经常出现在真核生物的 house-keeping基因的调控区,在其 它地方出现时会由于CpG中的C易 被甲基化而形成5'-甲基胞嘧啶,脱 氨基后形成胸腺嘧啶,由于T本身在基因 组中是以岛的形式分布的。
基本原理
重亚硫酸盐使DNA中未发生甲基化的胞嘧啶脱 氨基转变成尿嘧啶,而甲基化的胞嘧啶保持不变, 行PCR扩增(引物设计时尽量避免有CpG,以免受甲 基化因素的影响)所需片段,则尿嘧啶全部转化成 胸腺嘧啶。最后,对PCR产物进行测序,并且与未 经处理的序列比较,判断是否CpG位点发生甲基化。 此方法一种可靠性及精确度很高的方法,能明确目 的片段中每一个CpG位点的甲基化状态。在寻找有 意义的关键性CpG位点上,有其他方法无法比拟的 优点。
重亚硫酸氢盐直接测序技术的优缺点
优点:测序法以CpG岛两侧不含CpG点的一段序 列为引物配对区,能够同时扩增出甲基化和非甲 基化靶序列。
缺点:它的不足是耗费时间和耗资过多,至少要 测序10个以上的克隆才能获得可靠数据,需要大 量的克隆及质粒提取测序,过程较为繁琐、昂贵。 在甲基化变异细胞占少数的混杂的样品中,由于 所用链特异性PCR不是特异扩增变异靶序列,故 灵敏度较MSP差。
重亚硫酸直接测序法对启动子测序 的应用
CpG岛不仅是基因的一种标志,而且还参 与基因表达的调控和影响染色质的结构。 启动子的甲基化能抑制基因的表达。
研究证明启动子区的高甲基化导致抑癌基 因失活是人类肿瘤所具有的共同特征之一, 而且这种高甲基化是导致抑癌基因失活的 又一个机制。
酶切法同亚硫酸氢盐联合法
酶切法:限制性酶切后选用对特 异DNA片段甲 基化序列敏感的限制性内切酶(酶 切位点与甲基 化位点不重叠)进行酶切后,以待测 甲基化位点 外侧序列为扩增起始点进行PCR。该 DNA片段 若存在甲基化,将会有扩增产物出现;若 无甲 基化,则不会有任何片段扩增出现。当用甲基 化不敏感的内切酶消化产物作为PCR模板时,不 论 该部位是否甲基化都不应有片段扩出。PCR 法比 Southem法更为敏感,但只能检测甲基化敏 感的限 制性位点的CpG甲基化,且DNA必须酶 切完全,否 则会出现假阳性。
甲基化测序

DNA甲基化检测实验一、重亚硫酸盐的测序法实验流程(BSP)(Bisulfite Genomic Sequence)原理:结合重亚硫酸盐的测序法是一种灵敏的能直接检测分析基因组DNA甲基化模式的方法。
重亚硫酸盐处理后,用针对改变后的DNA序列设计特异性引物并进行聚合酶链式反应(PCR)。
PCR产物中原先非甲基化的胞嘧啶位点被胸腺嘧啶所替代,而甲基化的胞嘧啶位点保持不变。
PCR产物克隆后进行测序。
通过这个方法能得到特定位点在各个基因组DNA 分子中的甲基化状态。
该方法特点是:•特异性高,它能够提供特异性很高的分析结果,这是所有其他研究甲基化的分析方法所不能比拟的;•灵敏度高,可以用于分析少于100个细胞的检测样品。
用微量的基因组DNA进行分析就能得到各个DNA分子精确的甲基化位点分布图。
重亚硫酸盐测序法技术实验流程A.DNA制备用DNA抽提试剂盒(Promega, cat. no. A1125)抽提组织,细胞培养物,石蜡包埋组织切片样品中的基因组DNA。
B.重亚硫酸盐处理C.DNA纯化用Wizard DNA clean-up kit (Promega, cat. no. A7280)纯化重亚硫酸盐处理后的DNA样品。
D.PCR扩增E.PCR产物琼脂糖电泳后回收纯化F.PCR产物连接到pMD19-T (Takara) 载体中克隆及测序。
G.用分析软件对各样本测序结果进行甲基化程度分析二、甲基化特异性的PCR实验流程(methylation-specific PCR, MSP)原理:甲基化特异性的PCR是一种灵敏度高且操作相对简单的甲基化研究方法。
重亚硫酸盐处理DNA后,基因组DNA发生的由甲基化状态决定的序列改变。
随后进行引物特异性的PCR。
该方法引物设计是关键。
MSP中设计两对引物,即一对结合处理后的甲基化DNA链(引物对M),另一对结合处理后的非甲基化DNA链(引物对U)。
检测MSP扩增产物,如果用引物M能扩增出片段,则说明检测位点存在甲基化;若用引物U扩增出片段,则说明被检测的位点不存在甲基化(图3)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
DNA甲基化含义 DNA甲基化含义
在甲基转移酶的催化下,DNA的CG两个核苷 在甲基转移酶的催化下,DNA的CG两个核苷 酸的胞嘧啶被选择性地添加甲基,形成5 酸的胞嘧啶被选择性地添加甲基,形成5-甲基胞 嘧啶,这常见于基因的5'-CG-3'序列。大多数脊椎 嘧啶,这常见于基因的5'-CG-3'序列。大多数脊椎 动物基因组DNA都有少量的甲基化胞嘧啶,主要 动物基因组DNA都有少量的甲基化胞嘧啶,主要 集中在基因5 集中在基因5'端的非编码区,并成簇存在。甲基 化位点可随DNA的复制而遗传,因为DNA复制后, 化位点可随DNA的复制而遗传,因为DNA复制后, 甲基化酶可将新合成的未甲基化的位点进行甲基 化。DNA的甲基化可引起基因的失活。 化。DNA的甲基化可引起基因的失活。 DNA甲基化主要形成5-甲基胞嘧啶(5 mC) DNA甲基化主要形成5-甲基胞嘧啶(5-mC) 和少量的N6-甲基嘌呤(N6-mA)及7 和少量的N6-甲基嘌呤(N6-mA)及7-甲基鸟嘌 呤(7 mG) 呤(7-mG)
启动子的CpG岛 启动子的CpG岛
CpG岛主要位于基因的启动子和第一 CpG岛主要位于基因的启动子和第一 外显子区域,约有60%以上基因的启动 外显子区域,约有60%以上基因的启动 子含有CpG岛。GC含量大于50%,长度 子含有CpG岛。GC含量大于50%,长度 超过200bp。在启动子(promotor)或 超过200bp。在启动子(promotor)或 “起始”区域周围,甲基化经常被抑 起始” 制。这些区域包含浓度相对较高的 CpG对,与此段区域对应的染色体区 CpG对,与此段区域对应的染色体区 段一起被称作CpG岛。CpG岛与56%的 段一起被称作CpG岛。CpG岛与56%的 基因编码有关。
CpG岛的甲基化 CpG岛的甲基化
CpG岛经常出现在真核生物的 CpG岛经常出现在真核生物的 house-keeping基因的调控区,在其 house-keeping基因的调控区,在其 它地方出现时会由于CpG中的C 它地方出现时会由于CpG中的C易 被甲基化而形成5'被甲基化而形成5'-甲基胞嘧啶,脱 氨基后形成胸腺嘧啶,由于T 氨基后形成胸腺嘧啶,由于T本身 就会存在于DNA中,因此不易被 就会存在于DNA中,因此不易被 修复,所以被淘汰。故CpG在基因 修复,所以被淘汰。故CpG在基因 组中是以岛的形式分布的。
重亚硫酸直接测序法对启动子测序 的应用
CpG岛不仅是基因的一种标志, CpG岛不仅是基因的一种标志,而且还参 岛不仅是基因的一种标志 与基因表达的调控和影响染色质的结构。 与基因表达的调控和影响染色质的结构。 启动子的甲基化能抑制基因的表达。 研究证明启动子区的高甲基化导致抑癌基 因失活是人类肿瘤所具有的共同特征之一, 而且这种高甲基化是导致抑癌基因失活的 又一个机制。
SSCP
将亚硫酸氢盐处理和单链构 象多态性 PCR(PCR.SSCP)结合起来,设计了针 PCR(PCR.SSCP)结合起来,设计了针 对 转化后DNA序列的引物,同时扩增 转化后DNA序列的引物,同时扩增 未甲基化和甲 基化的DNA,由此产生 基化的DNA,由此产生 的两种不同的扩增产物可以 通过SSCP 通过SSCP 区分。此方法可方便地应用于任何序 列的甲基化状态的分析,能对甲基化 的等位基因进行半定量,获得甲基化 和未甲基化等位基因的比例;并且可 以提示甲基化状态的不均匀性。
谢谢!
基本原理
重亚硫酸盐使DNA中未发生甲基化的胞嘧啶脱 重亚硫酸盐使DNA中未发生甲基化的胞嘧啶脱 氨基转变成尿嘧啶,而甲基化的胞嘧啶保持不变, 行PCR扩增(引物设计时尽量避免有CpG,以免受甲 PCR扩增(引物设计时尽量避免有CpG,以免受甲 基化因素的影响) 基化因素的影响)所需片段,则尿嘧啶全部转化成 胸腺嘧啶。最后,对PCR产物进行测序,并且与未 胸腺嘧啶。最后,对PCR产物进行测序,并且与未 经处理的序列比较,判断是否CpG位点发生甲基化。 经处理的序列比较,判断是否CpG位点发生甲基化。 此方法一种可靠性及精确度很高的方法,能明确目 的片段中每一个CpG位点的甲基化状态。在寻找有 的片段中每一个CpG位点的甲基化状态。在寻找有 意义的关键性CpG位点上,有其他方法无法比拟的 意义的关键性CpG位点上,有其他方法无法比拟的 优点。
酶切法同亚硫酸氢盐联合法
联合亚硫酸氢盐限制分析(combined bisul— 联合亚硫酸氢盐限制分析(combined bisul— rite restriction analysis,C0BRA) 亚硫酸氢钠可以使 analysis, DNA未甲基化的C经脱氨基作用转化为u DNA未甲基化的C经脱氨基作用转化为u,通过随 后的PcR, 将转化为T 后的PcR,u将转化为T,但亚硫酸氢钠对已发生 甲基化的C无上述转化作用。故此,DNA经亚硫 甲基化的C无上述转化作用。故此,DNA经亚硫 酸氢钠处理后,进行限制性酶切CpG位点时,限 酸氢钠处理后,进行限制性酶切CpG位点时,限 制性位点的保留与否能反应该DNA片段是否发生 制性位点的保留与否能反应该DNA片段是否发生 甲基化。经电泳后电泳条带长度和强度差异观察, 可以分析DNA甲基化状态和甲基化程度。COBRA 可以分析DNA甲基化状态和甲基化程度。COBRA 集使用方便,定量准确和与石蜡切片良好的兼容 性三 种特色于一身,能定量检测微量DNA样品特 种特色于一身,能定量检测微量DNA样品特 定基 因位点的甲基化状态,但由于涉及PCR和限 因位点的甲基化状态,但由于涉及PCR和限 制性酶 的使用,通常只能分析一个特定的序列
酶切法同亚硫酸氢盐联合法
酶切法:限制性酶切后选用对特 异DNA片段甲 DNA片段甲 基化序列敏感的限制性内切酶( 基化序列敏感的限制性内切酶(酶 切位点与甲基 化位点不重叠) 化位点不重叠)进行酶切后,以待测 甲基化位点 外侧序列为扩增起始点进行PCR。该 DNA片段 外侧序列为扩增起始点进行PCR。该 DNA片段 若存在甲基化,将会有扩增产物出现;若 无甲 基化,则不会有任何片段扩增出现。当用甲基 化不敏感的内切酶消化产物作为PCR模板时,不 化不敏感的内切酶消化产物作为PCR模板时,不 论 该部位是否甲基化都不应有片段扩出。PCR 该部位是否甲基化都不应有片段扩出。PCR 法比 Southem法更为敏感,但只能检测甲基化敏 更为敏感,但只能检测甲基化敏 感的限 制性位点的CpG甲基化,且DNA必须酶 制性位点的CpG甲基化,且DNA必须酶 切完全,否 则会出现假阳性。
重亚硫酸氢盐直接测序技术的优缺点
优点:测序法以CpG岛两侧不含CpG点的一段序 优点:测序法以CpG岛两侧不含CpG点的一段序 列为引物配对区,能够同时扩增出甲基化和非甲 基化靶序列。 缺点:它的不足是耗费时间和耗资过多,至少要 测序10个以上的克隆才能获得可靠数据,需要大 测序10个以上的克隆才能获得可靠数据,需要大 量的克隆及质粒提取测序,过程较为繁琐、昂贵。 在甲基化变异细胞占少数的混杂的样品中,由于 所用链特异性PCR不是特异扩增变异靶序列,故 所用链特异性PCR不是特异扩增变异靶序列,故 灵敏度较MSP差。 灵敏度较MSP差。
