美国FDA药物审批PPT
fda培训资料ppt课件

行政审批
FDA会对通过技术评审的申请进行行政审 批,审批周期一般需要几个月左右。
技术评审
FDA会对申请资料进行技术评审,评审周 期根据产品类别和风险等级而有所不同, 一般需要几个月到一年不等。
医疗器械不良事件监测与报告
报告义务
医疗器械生产企业有义务向FDA 报告医疗器械不良事件,包括产
品缺陷、故障、质量问题等。
企业应建立专门的法规合规部门,负 责跟踪和研究FDA的法规更新,并及 时向相关部门传达。
提升员工素质
企业应定期对员工进行FDA法规培训 ,提升员工的法规意识和操作技能。
合理规划生产和质量控制
企业应根据FDA的监管要求,合理规 划生产和质量控制环节,确保产品符 合要求。
与FDA保持良好沟通
企业应与FDA保持良好沟通,及时反 馈产品在市场上的表现,以及遇到的 问题和挑战。
FDA建立了一套完善的监测 机制,以收集和整理生物制 品使用过程中出现的不良事 件。这些信息来源于多个渠 道,包括医生报告、患者投 诉、生产商报告等。
根据法规要求,生产商必须 在获知不良事件后的一段时 间内向FDA提交报告。这些 报告必须包含详细的事件描 述、可能的原因分析以及采 取的措施等内容。同时, FDA也会对不良事件进行调 查和分析,以评估事件的真 实性和因果关系。
食品不良反应监测与报告
不良反应监测
FDA对进口和在美销售的食品进行不良反应监测,包括食品中毒、过敏反应、化学物质超标等。
报告义务
FDA要求企业、消费者和医疗专业人士报告疑似食品不良反应事件,以便及时展开调查和采取措施。
06
FDA对生物制品的监管
生物制品注册与审批流程
申请与受理
申请人需提交完整的申请材料,包括生物制品的名称、活性成分、剂型、适应症等信息, 并缴纳相应的费用。FDA对申请材料进行审核,并对申请进行分类,将符合要求的申请转 至评审部门。
美国FDA批准上市的药物(2019年)
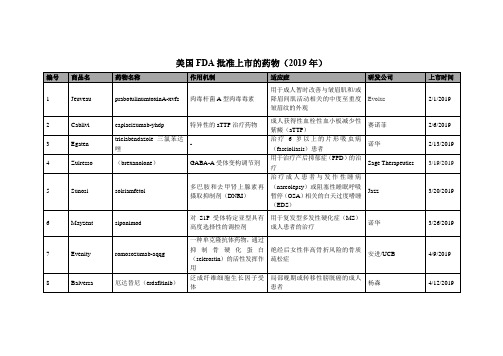
用于眼科手术
Dutch Ophthalmic, USA
12/20/2019
45
Caplyta
lumateperone tosylate
多巴胺受体磷酸蛋白调节剂(DPPM),在D2受体上充当突触前部分激动剂和突触后拮抗剂。
精神分裂症
Kah-PLY’-tah
Intra-Cellular Therapies, Inc.
-
用于治疗成人由于人工型或遗传性转甲状腺素卵白介导的淀粉样变性引起的心肌病(ATTR-CM)
辉瑞
5/3/2019
11
Piqray
Alpelisib
PIK3抑制剂
治疗绝经后女性及男性特定晚期或转移性乳腺癌患者
诺华
5/24/2019
12
Polivy
polatuzumab vedotin-piiq
CD79b
全球结核病药物开发联盟(TB Alliance)
8/14/2019
20
Wakix
pitolisant
用于治疗成年发作性睡病(narcolepsy)患者的白日过度嗜睡(EDS)
Bioprojet
8/14/2019
21
Rozlytrek
entrectini恩曲替尼
选择性酪氨酸激酶抑制剂
用于ROS1阳性转移非小细胞肺癌和所有NTRK融合实体瘤(12岁以上)
12/20/2019
46
Dayvigo
lemborexant
食欲素受体拮抗剂
失眠症
卫材公司
12/20/2019
47
Enhertu
fam-trastuzumab deruxtecan-nxki
HER2靶点的抗体偶联药物
FDA新药审批流程简述

FDA新药审批流程简述FDA(美国食品药品监督管理局)负责监管并审批新药的上市。
下面将对FDA新药审批流程进行简述。
1.阶段Ⅰ临床试验:新药首先在健康志愿者身上进行,评估药物的安全性和耐受性,并确定药物的剂量范围。
2.阶段Ⅱ临床试验:新药在患者身上进行,评估药物的疗效和副作用。
试验时间较长,研究人员需要收集更多的数据,以确定新药的安全性和效力。
3.阶段Ⅲ临床试验:新药在大规模患者群体身上进行,以证明其疗效和安全性是否持久有效,并与现有的治疗方法进行比较。
4.新药申请:药企将试验结果提交给FDA,并申请新药上市批准。
包括药物的数据和试验结果,使用方法等。
FDA会评估申请材料。
5.NDA审批:NDA(新药申请)包括对药物研究的细节、试验结果等的描述。
FDA对NDA进行评估,确定药物是否符合上市标准。
此过程可能需要数月或数年。
6.审查:FDA将药物进行详细审查,并与药企进行沟通,以充分了解药物的性质和潜在的风险。
7.审查会议:FDA可能会召开药物审查会议,邀请专家、学者和公众就药物的疗效和风险发表意见。
8.确认上市:如果FDA认为新药符合上市标准,将发出批准通知,允许药企将新药投入市场销售。
以上是FDA新药审批流程的简要概述。
在流程中,FDA扮演着保障公众健康和安全的角色,确保新上市的药物是安全有效的。
FDA New Drug Approval Process OverviewThe FDA (U.S. Food and Drug Administration) is responsible for regulating and approving new drugs for market. The following is an overview of the FDA's new drug approval process.1. Phase I Clinical Trials: The new drug is first tested on healthy volunteers to assess its safety and tolerability and determine the dosage range.5. NDA Approval: The NDA (New Drug Application) includes a detailed description of the drug's research, trial results, etc. The FDA evaluates the NDA to determine if the drug meets the approval standards. This process can take months or years.7. Review Meetings: The FDA may hold drug review meetings where experts, scholars, and the public are invited to provide opinions on the drug's efficacy and risks.9. Post-Market Surveillance: The FDA continues to monitor the drug's safety and effectiveness, collects feedback from the market, and takes necessary actions, including further research and updating warning labels.The above is a brief overview of the FDA's new drug approval process. Throughout the process, the FDA plays a crucial role insafeguarding public health and safety, ensuring that newly marketed drugs are safe and effective.。
FDA新药审批流程简述

FDA新药审批流程简述FDA(美国食品药品监督管理局)是负责监督和管理美国食品和药品安全的联邦机构。
它负责确保市场上的药品是安全有效的,并且符合严格的审批标准。
新药审批是FDA的主要职责之一,它是一个复杂且漫长的过程,通常包括以下几个步骤:1.提交新药申请(NDA)首先,药物制造商需要通过NDA向FDA提交有关新药的完整资料。
这些资料通常包括药物的化学成分、制造工艺、药理学研究、临床试验数据以及用于治疗的适应症等信息。
此外,还需要提供药物的质量、安全和有效性的证据。
2.评估申请文件一旦FDA收到NDA,会对申请文件进行评估。
这个过程通常包括对文件的完整性和合规性的审查,例如核实所有必需的资料是否齐全。
如果缺少必要的信息,FDA可能会要求制造商提供补充材料。
3.优先审批对于一些药物,FDA可能会给予优先审批待遇。
例如,对于治疗一些严重疾病的新药,FDA可能会加快审批速度,以符合患者的迫切需求。
4.临床试验阶段一旦FDA确认NDA文件完整无误,药物制造商可以开展临床试验。
临床试验是评估药物疗效和安全性的关键步骤,通常分为三个阶段(I、II、III)。
这些试验需要遵守严格的方案和伦理规定,以确保患者的安全和药物的有效性。
5.申请审核委员会的审查在临床试验结束后,药物制造商将向FDA提交试验结果,并要求FDA审核审查委员会对其进行审查。
审查委员会是由FDA专家组成的独立机构,他们会仔细评估试验结果以及相关数据和文献,并发表意见。
这些意见对于FDA的最终决策具有重要影响。
6.申请批准在经过临床试验和审查后,FDA将根据收集到的数据和顾问委员会的意见,决定是否批准新药上市。
如果FDA认为药物的风险和益处之间的平衡是积极的,它将批准新药,并颁发批准证书。
7.监督上市后安全性一旦新药获得批准,FDA对其进行监督,以确保其安全性和真实性。
制造商需要持续向FDA提供有关药物的安全性和有效性的信息。
此外,FDA还通过药物安全盛会进行监测,并与制造商和医疗专业人员合作,收集和分析有关药物的副作用和其他安全问题的信息。
中英文-美国FDA 药品监管

Conduct Inspections, monitor relevant events 执行检查,监控相关事件
16
Approval of a Drug Application Cont. 药品申请的批准 续
GMP inspection GMP检查 Domestic firms: district inspectors 国内企业:区域检查官 Foreign firms: international inspector cadres 国外企业:国际检查官骨干
Increase collaboration and coordination of product safety with relevant US Govt agencies 与相关美国政府机关一起加强产品安全性方面的协调与合作
5
Jurisdiction 管辖权力
What products do we regulate? 哪些产品属于我们的监管范围?
Chapter I: Short Title 21 USC 301 简称
Chapter II: Definitions 21 USC 321 定义
Chapter III: Prohibited Acts and Penalties 21 USC 331-337 禁止的行为和处罚
Chapter IV: Food 21 USC 341-350 食品
外来动物(进口啮齿类动物、龟等) Combination products 组合产品
美国FDA批准上市的药物
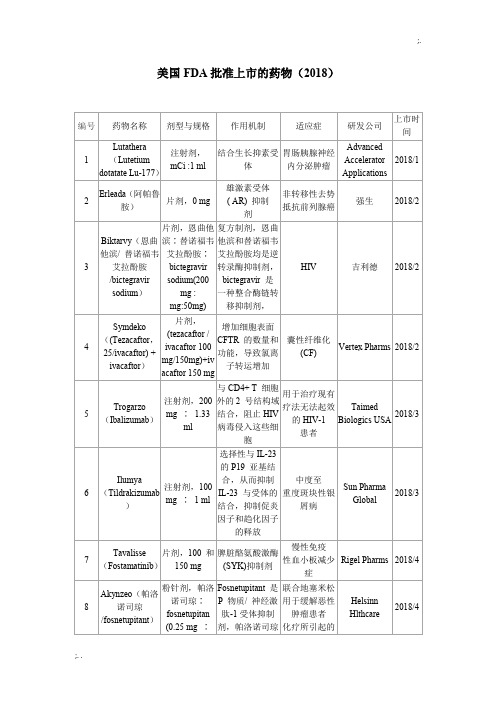
Siga Technologies
2018/7
23
Krintafel(Tafenoquine)
片剂,150 mg
-
疟疾
葛兰素史克
2018/7
24
Orilissa(Elagolix sodium)
片剂,150和200 mg
促性腺激素释放激素(GnRH)受体拮抗剂
治疗子宫内膜异位引起的中度至重度疼痛
基因泰克
2018/10
47
Tegsedi(Inotersen)
皮下注射,284 mg∶1.5 ml
是一种反义寡核苷酸,通过与TTRmRNA结合导致突变体和野生型TTR mRNA的降
解,从而使组织血清TTR蛋白和TTR蛋白沉积物减少
成人遗传性转甲状腺素介导
的淀粉样变性多发性神经病
Akcea Theraps公
口服悬浮液,每包5 g和每包10 g
本品是一种不被吸收的锆硅酸盐,可以捕获钾离子并进行氢、钠的交换,通过结合胃肠道中游离的钾离子,促进钾离子的排放
成人高钾血症
阿斯利康
2018/5
12
Doptelet(Avatrombopag maleate)
片剂,20 mg
血小板生成素(TPO)受体激动剂
计划接受手术的慢性肝病患者的血小板减少症
艾伯维
2018/7
25
Omegaven(Fish oil triglycerides)
注射剂(乳液),5 g∶50 ml和
10 g∶100 ml
脂肪酸补充剂
治疗患有肠外营养相关胆汁淤积(PNAC)的儿童患者
Fresenius Kabi USA
2018/7
26
Mulpleta(鲁索曲波帕)
美国FDA药物分析程序及方法验证指导原则(中文版)

药品及生物制品的分析方法和方法验证指导原则目录1.介绍...................... (1)2.背景..................... .. (2)3.分析方法开发. ..................... . (3)4.分析程序内容.............................................. ......... ..................................... .. 3A.原则/范围 (4)B.仪器/设备............................................. . (4)C.操作参数.............................................. .. (4)D.试剂/标准............................................. . (4)E.样品制备.............................................. .. (4)F.标准对照品溶液的制备............................................ .. (5)G.步骤......... ....................................... (5)H.系统适应性..... (5)I.计算 (5)J.数据报告 (5)5.参考标准和教材............................................ (6)6分析方法验证用于新药,仿制药,生物制品和DMF (6)A.非药典分析方法............................................. (6)B.验证特征 (7)C.药典分析方法............................................. .. (8)7.统计分析和模型 (8)A.统计 (8)B.模型 (8)8.生命周期管理分析程序 (9)A.重新验证 (9)B.分析方法的可比性研究............................................ . (10)1.另一种分析方法............................................... .. (10)2.分析方法转移的研究 (11)C.报告上市后变更已批准的新药,仿制药,或生物制品 (11)9.美国FDA方法验证............................................... . (12)10.参考文献前言本指导原则草案,定稿后,将代表美国食品和药物管理局(FDA)目前关于这个话题目前的想法。
DMF文件简介.ppt

2
背景
根据美国的“食品、药品和化妆品法”,药品(制剂)在上市之前,必需要向FDA 提出新药注册申请,提供拟上市新药及其成分在“安全性、有效性和质量”三方 面的全部信息,FDA做出全面评价认为满足要求后,才能给与批准上市。
3
分类
在FDA发布的《DMF指南》中,DMF分为以下五个类型: (官方网址:/Drugs/GuidanceComplianceRegulator yInformation/Guidances/ucm122886.htm) I型,生产地点、厂房设施、操作步骤和人员;(2000年7月12日已取消) II型,原料药、原料药中间体、生产前述物质使用的原材料,或药品; III型,包装物料; IV型,赋形剂、着色剂、香料、香精,或生产这些物质的原材料; V型,FDA接受的其它信息
(原料药生产企业向FБайду номын сангаасA申报的DMF文件属于II型。)
4
分类
其它:
● 欧 盟: 仅有一种DMF,即 EDMF
● 加拿大: 有四种类型的DMF 第一类:药品物质 第二类:包装材料 第三类:赋形剂 第四类:剂型
5
各类DMF的差别
在美国,整个DMF文件均被视为机密保存. 该产品的部分DMF摘要资料 也许会提供给客户,此部分的DMF资料称为“技术资料档”. 在欧盟的EDMF及加拿大的DMF分为公开及保密管制两个部分.
6
DMF注册流程
7
注释:
CDER:Center for drug evaluation and research 美国FDA药物评价及研究中心
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
•
病例报告
– 包含第二期、第三期临床试验的每一个病人的病例报告 – 每一个已死亡和因不良反应退出临床试验对象的病例报告
Squire, Sanders & Dempsey L.L.P.
新药申请
•
其他
– Right of Reference or Use:引述或使用已经提交FDA的信息的 权利,如果该信息不是新药申请人所提交的,必须获得书面授 权
Squire, Sanders & Dempsey L.L.P.
FDA药物申请的基本组织结构
• IRB
– 功能:确保临床试验的安全性与临床试验对象的权 益 • 利益必须基于临床试验对象本身的直接利益
– 不能基于对社会的利益
– 不能是远期利益 – 组成:至少5人,必须有一位非科学背景的成员(一 般是律师或商业人员、必须有一位具科学训练的成 员) – 职责:审批并持续审查每一项临床试验(功能与职责 相当于FDA,但立场必须独立与专业) – 利益冲突 • 临床试验人员不能成为IRB成员
Squire, Sanders & Dempsey L.L.P.
修改临床试验蓝本
临床试验申请
•
–
FDA终止令
试验对象受伤害的风险太高,IND误导性或错误, 或者不完备,试验方法、设备及药物制造设备等 不能实验对象的安全,试验偏离IND,没有及时报 告负面试验经历/结果,药物被商业性买卖,IND 在非活动状态达五年以上,无令人信服的证据证 明药物安全…… 申请方必须在30天内就上述缺失提出说明、解释 如果FDA不接受该说明,申请方可以在10天内提 出听证要求
– 如果是抗感染类药物,总述相关微生物信息
– 临床试验数据及分析 – 儿童使用试验
Squire, Sander药申请
•
样品及标签
– 四份下列各样品:药物,药品,试验空白样品 – 药品包装 – 存档用副本必须包括
• 三份在药物的制造化学、制造方法、及分析控制手段部分 的分析方法和分析
Squire, Sanders & Dempsey L.L.P.
新药申请
• 新药申请(New Drug Application) (NDA)
– 总述(Summary):NDA各种数据(有效性、安全性、药理、 毒理、代谢数据等等)及信息
• 标签,包括用药指南 • 药理类别,包括药理、用途和药物的医疗作用
•
专利信息
– 所有包涵药物、药物形态、药品组成、以及药物使用的专利信 息 – 专利报告要求(FDA Forms 3542和3542a): • 新药申请号、申请方、商品名、活性成分、药性强度、剂 型、美国专利号、批准日和过期日、专利拥有人的联系信 息等等 • 在新药申请批准后30天内必须提出专利报告 • 新的相关专利必须在批准后30天之内报告FDA
Squire, Sanders & Dempsey L.L.P.
新药申请
• 专利证言(Patent Certification)
– 药物专利、药品专利、药物使用专利 • 专利信息未提交FDA (Paragraph I Certification) • 专利已过期 (Paragraph II Certification)
临床试验申请 – 临床试验蓝本(Protocols) -- 每项临床试验必须有一个蓝本, 包含 • • 该临床试验的目的和目标 每一个试验人员及其资质(含简历),试验场所及设施, IRB每一个成员的姓名地址
•
• • •
试验病人的选择标准及大略人数
临床试验研究设计,包括控制组设计以及对源于试验对 象、试验人员、以及试验分析人员的偏差的控制 决定剂量的方法、最大剂量以及试验对象的用药期 描述临床试验程序、实验测试、以及其他该药药效及控 制试验危险的方式
Squire, Sanders & Dempsey L.L.P.
FDA药物申请的基本组织结构
(1) FDA (2) 内部审查委员会(Institutional Review Board) (IRB) (3) 药物申请方(Sponsor) (4) 药物临床试验研究人员(Investigator) (5) 药物临床试验对象(subject) (1) 需要保护的对象
Squire, Sanders & Dempsey L.L.P.
新药申请
• 技术部分 – 该药物的制造化学、制造方法、及分析控制手段 • 药物的化学、物理、生物特性,制造商及制造过程,分析质控 及生效性控制方法, • 药物的化学、物理、生物特性,制造商及制造过程,分析质控 及生效性控制方法 – 包含用来试验生效性和生体等同性的batch record及总制 造记录 • 环境影响分析 – 非临床试验药理及毒理试验结果 – 该药物的人体药理动力学和生效性(bioavailability)
Squire, Sanders & Dempsey L.L.P.
FDA药物申请的基本种类
• • •
– – – –
研究性药物申请 (Investigational Drug Application) 新药申请(New Drug Application) 生物药物许可申请
DNA类药物(virus plasmid, etc) 血清制品 毒素(toxin)和毒素抗体(antibody) 饱含或少于40个氨基酸的合成多肽类药物
美国FDA药物审批
主讲人:李兆阳(Zhaoyang Li) 化学博士、律师 美国翰宇国际律师事务所 Squire, Sanders & Dempsey LLP zli@ 001-415-393-9885
FDA药物审批的基本法律
• •
食品、药物及美容物品法(Food, Drug, and Cosmetic Act)第5章第505分章 联邦政府法规(Code of Federal Register)第21章第 312、第314和第514分章
Squire, Sanders & Dempsey L.L.P.
临床试验
• 控制试验的方法
– 安慰剂对照试验(placebo concurrent control) – 剂量对照试验(dose-comparison concurrent control) – 非治疗对照试验(no-treatment concurrent control) – 积极治疗对照实验(active-treatment concurrent control) – 病史对照试验(historical control)
Squire, Sanders & Dempsey L.L.P.
新药申请
• 市场独占要求
– 对新化合物(NCE, new chemical entity)新药,自新药申请 批准后3年内,FDA不接受就该药物提出的generic新药申 请(505(b)(2)申请或者简捷新药申请(abbreviated new drug application -- ANDA),如果一项ANDA新药申请含
• 国外上市的历史
• 该药物的制造化学、制造方法、及分析控制手段(称 CMC) • 该药物的非临床试验药理及毒理试验
• 该药物的人体药理动力学和生效性(bioavailability)
• 如果是抗感染类药物,总述相关微生物信息 • 临床试验数据及分析 • 结论,包含benefit/risk,及提出附加试验和上市后监 测手段
• 专利将在某日过期 (Paragraph III Certification)
• 该专利无效、不可执行、或者不会被本新药申请的新药 制造、销售和使用行为侵权(Paragraph IV Certification) – 无相关专利 – 未按时提交的专利信息对后叙generic新药申请的影响 • 如果专利信息在专利颁布后30天后提交FDA,之前提交 的generic新药申请可以不修正它自己的专利信息,之 后提交的generic新药申请必须按上述规定提交有关该 专利的专利信息
– –
•
–
IND非活动状态
试验活动暂停一年或一年以上
–
两年没有试验对象进行临床试验
Squire, Sanders & Dempsey L.L.P.
临床试验申请
•
–
FDA/申请方的第二期临床试验结束会议
讨论第三期临床实验
•
– – – –
药物上市前期会议(Pre-NDA Meeting)
讨论临床试验未解决的问题 确定有关药物有效性的研究 确定还需要进行的研究以确定该药物对孩童的有效性 讨论药物上市申请
•
–
关键是临床试验(Clinical Trials)
试验对象的风险大
Squire, Sanders & Dempsey L.L.P.
临床试验
• 第一期临床试验(Phase 1 clinical trial)
– 确定人体代谢机制和药学行为(20-80个对象),了解 增加药剂量的副作用,以及(如果可能)有效性 • 为后面的临床试验作准备
Squire, Sanders & Dempsey L.L.P.
FDA药物申请的基本组织结构
• 临床试验对象
– 临床试验对象必须同意(Informed consent) • 解释药效 • 解释风险 – 紧急情况下可以免除同意 • 有立即死亡风险 • 同意无法获得 – 比如病人昏迷等
Squire, Sanders & Dempsey L.L.P.
• 有关安慰剂组成、制造以及控制的简单描述
• 标签 • 环境影响评估或者声明环境影响甚微
Squire, Sanders & Dempsey L.L.P.
临床试验申请
– 药理和毒理信息 – 已有的经历 – 其他信息 • 药物依赖性及可能的滥用 • 孩童使用的有效性与安全性 • 其他
