3-动力学概论
河流动力学概论(清华版)习题

河流动力学概论(清华版)习题第二章1. 等容粒径、筛分粒径、沉降粒径的定义各是什么?为什么筛析法得到的泥沙颗粒粒径接近于它的等容粒径? 答:(1)等容粒径为与泥沙颗粒体积相同的球体直径。
如果泥沙颗粒的重量W 和容重γs (或体积V )可以测定,则其等容粒径可按下式计算:113366n s V W D ππγ⎛⎫⎛⎫==⎪ ⎪⎝⎭⎝⎭(2)如果泥沙颗粒较细,不能用称重或体积法确定等容粒径时,一般可以采用筛析法确定其筛分粒径。
设颗粒最后停留在孔径为D 1的筛网上,此前通过了孔径为D 2的筛网,则可以确定颗粒的粒径范围为D 1<D <D 2。
(3)对于粒径小于0.1 mm 的细砂,由于各种原因难以用筛析法确定其粒径,而必须用水析法测量颗粒在静水中的沉速,然后按照球体粒径与沉速的关系式,求出与泥沙颗粒密谋相同、沉速相等的球体直径,作为泥沙颗粒的沉降粒径。
(4)对形状不规则的泥沙颗粒,可以量测出其互相垂直的长、中、短三轴,以a ,b ,c 表示。
可以设想颗粒是以通过中轴筛孔的,因此筛析所得到的颗粒的中轴长度b 。
对粒径较粗的天然泥沙的几何形状作统计分析,结果可以表达如下式:()13b abc =即中轴长度接近(实测结果为略大于)三轴的几何平均值。
如果把颗粒视为椭球体,则其体积为6V abc π=等容粒径为()11336n V D abc π⎛⎫== ⎪⎝⎭因此,如果上述各假设成立,则筛析法所得到的泥沙颗粒粒径(颗粒恰好通过的孔径)接近于它的等到容粒径。
2. 100号筛的孔径是多少毫米?当泥沙粒径小于多少毫米时就必须用水析法做粒径分析? 答:查表2-2知100号筛的孔径是0.149 mm ,当泥沙粒径小于0.1 mm 时就必须用水析法做粒径分析。
3. 什么是颗粒的形状系数?答:有时采用形状系数(shape factor )来综合表示颗粒形状特点,定义如下:SF =4. 密度、容重、干容重在概念上有什么区别? 答:颗粒的密度ρs 即颗粒单位体积内所含的质量,国际单位制单位为kg/m 3或g/cm 3,工程中常用t/m 3。
能源与动力工程概论教学大纲

能源与动力工程概论教学大纲一、课程概述二、课程目标1.了解能源与动力工程的基本概念和发展历史;2.熟悉能源与动力工程领域的各种能源和动力系统;3.掌握能源与动力工程的基础原理和技术;4.培养对能源问题的关注和创新意识。
三、教学内容1.能源与动力工程概论的定义、范围和重要性;2.能源与动力工程的发展历程;3.能源与环境的关系;4.化石能源与可再生能源;5.热能与电能的基础原理;6.燃烧原理和燃烧工程;7.能源与动力系统的设计和运行;8.能源的储存和转换技术;9.能源与动力工程现代化技术;10.能源与动力工程的应用与发展趋势。
四、教学方法1.课堂讲授:通过系统讲解和示例分析,引导学生了解能源与动力工程的基础知识和技术。
2.实践操作:组织学生进行实验室实践,培养学生的实践能力和动手能力。
3.论文讨论:引导学生阅读相关论文,并组织讨论,提高学生的综合素养和科研能力。
4.小组项目:分组进行课程设计或实际案例分析,培养学生的团队合作和解决问题的能力。
五、教材与参考书目主教材:《能源与动力工程概论》(第三版);参考书目:1.《能源工程导论》;2.《动力工程导论》;3.《可持续能源技术导论》;4.《热能工程基础》;5.《动力学及其应用》。
六、考核方式1.平时成绩:包括出勤情况、课堂表现等;2.课程设计或实验报告:根据课程要求完成设计或实验,并提交报告;3.期中考试:测试学生对于课程重点知识的掌握程度;4.期末考试:综合测试学生对于整个课程内容的掌握情况。
七、教学进度安排1.第一周:课程介绍和概述;2.第二周:能源与动力工程的定义和范围;3.第三周:能源与动力工程的发展历程;4.第四周:能源与环境的关系;5.第五周:化石能源与可再生能源;6.第六周:热能与电能的基础原理;7.第七周:燃烧原理和燃烧工程;8.第八周:能源与动力系统的设计和运行;9.第九周:能源的储存和转换技术;10.第十周:能源与动力工程现代化技术;11.第十一周:能源与动力工程的应用与发展趋势;12.第十二周:课程总结和复习;13.第十三周:期末考试。
2021年2、西安理工大学硕士研究生入学考试专业课参考书目(整理)

高等教育出版社
谢处方
834
水化学
《工科现代水化学》
陕西科学出版社
姚秉华
835
信号与线性系统
《信号与系统》(2005.9修订版)
哈尔滨工业大学出版社
王宝祥
836
微机原理及应用
《微型计算机原理》第四版
西安电子科技大学出版社
姚燕南
837
印刷色彩学
《印刷色彩学》2005版
国防工业出版社
胡寿松
818
电力电子技术
《电力电子技术》2000年
机械工业出版社
王兆安
黄俊
819
电路
《电路》(第四版)
高等教育出版社
邱关源
820
信号与系统
《信号与线性系统分析》(第三版)
高等教育出版社
吴大正
821
模拟电子技术基础
《模拟电子技术基础》(模电部分)
高等教育出版社
康华光
823
材料力学B
《材料力学》
829
语言学概论
1、《新编简明英语语言学教程》
上海外语教育出版社
戴炜栋
2、《语言学教程》
北京大学出版社
胡壮麟
830
电动力学
《电动力学》
高等教育出版社
郭硕鸿
831
自动控制理论
《自动控制原理》
中广电大出版社
孙虎章
832
激光原理
《激光原理》
国防工业出版社
周炳琨
科目
代码
考 试 科 目
参 考 书
出 版 社
作 者
高等教育出版社
杨可桢
程光蕴
科目
代码
边坡失稳动力学概论

边坡失稳动力学是研究边坡在外力作用下的失稳行为的学科。
边坡是指自然或人工形成的斜坡地表,而失稳则是指边坡在一定外力作用下发生倾覆、滑动或坍塌等现象。
这个领域的研究涉及到土力学、岩土工程、地质工程等多个学科。
以下是关于边坡失稳动力学的一般概论:
外力作用:边坡失稳通常是由外部因素引起的,比如降雨、地震、人为开挖等。
这些外部因素会改变边坡的平衡状态,导致失稳。
土体特性:土体的物理力学性质对于边坡的稳定性至关重要。
土体的颗粒结构、含水量、孔隙水压等因素都会影响边坡的稳定性。
地质和地形因素:地质条件和地形地貌也是影响边坡稳定性的重要因素。
例如,不同的地质层、地层倾角、岩土层的分布等都对边坡的稳定性产生影响。
动力学因素:地震是可能导致边坡失稳的动力学因素之一。
地震能够引起地面振动,使得边坡的土体发生重新分布,从而影响边坡的稳定性。
数值模拟与监测:现代研究方法包括数值模拟和实时监测技术。
数值模拟可以通过计算机模型模拟不同外部因素对边坡的影响,而实时监测技术则可以用来实地监测边坡的变形、应力状态等参数。
防治与治理:边坡失稳动力学的研究不仅局限于理论分析,还包括防治与治理措施的研究。
通过工程手段、植被的恢复、减灾措施等方式来提高边坡的稳定性。
总体而言,边坡失稳动力学是一个综合性的学科,涉及多个交叉学科的知识。
在工程实践中,对边坡失稳动力学的深入研究有助于更好地理解和预测边坡的失稳行为,从而采取有效的防治和治理措施。
《系统动力学概论》解读

SR 发货率
图 产量PR的形成结构流图
方程式: R PR.KL=WF.K*PROD.K
例如2:
POL 污染 POLA 污染净化率
POLAT 污 染净化 时间
方程式: R POLA.KL=POL.K/POLAT.K
(5)EFFECT.K+NORM.K 方程式: R RATE.KL=NORM.K+ EFFECT.K 式中: RATE——速率; NORM——额定速率; EFFECT——某些因素的影响作用。 例如1:
例如:人口、企业雇员数、库存、生产能力、血 清胆固醇、银行结存、文化传统、人的习惯、人 的感受等。
当设想把时间暂停的时候,这些量也不会消失。
(2)是否把一个量定义为状态变量,要看它的 变化速度与模型的时间坐标比较是快还是慢而定: 变化速度慢的量可定义为常数,变化速度快的量 可定义为辅助变量,一般情况则视为状态变量。
RT 速率
LEV 状态
CONST 比例常数
GL 目标值
DISC 偏差
方程式: L LEV.K=LEV.J+DT*RT.JK N LEV=0 R RT.KL=CONST*DISC.K C CONST=0.1 A DISC.K=GL-LEV.K C GL=100 式中: LEV——状态(单位) RT——速率(单位/时间) CONST——常数(1/时间) DISC——偏差(单位) GL——目标值(单位)
其中,AQR(平均离退率,即为额定 雇佣率)相当于标准公式中的额定速率 NORM,企业就是按AQR雇佣新雇员以代 替正常的离退人员,以保持雇员的总数。 (WFS.K-WF.K)/WFAT相当于标准公式中 的某些因素的影响作用EFFECT。
第三章 细胞反应动力学

四、胞内代谢反应
根据功能分为: 供能反应 生物合成反应 多聚反应 组装反应 根据过程分为: 初级代谢 次级代谢
五、胞内代谢调控
实质 把细胞内所有酶组织起来,通过活化某些酶、抑 制另一些酶,甚至出现一些新酶,去掉某些原有的酶, 以使整个代谢过程适应细胞生理活动的需要
两个重要机制 酶活性调控 酶合成调控
cS cS max exp( ) K S cS K SI cS cS ) exp( )] Teissier等: max [exp( K SI KS
三、有抑制的细胞反应动力学
产物抑制 对产物竞争性抑制:
max cS
cP cS K S (1 ) K PI
三、有抑制的细胞反应动力学
底物抑制 对底物非竞争性抑制:
d max, 0 dcS
* cS KSI KS
*
max
1 2 K S / K SI
三、有抑制的细胞反应动力学
底物抑制 对底物竞争性抑制:
经验方程 Aiba等:
max cS
cS cS K S (1 ) K SI
cS 为限制性底物的质量浓度,g/L K S 为饱和常数,g/L
二、无抑制的细胞反应动力学
Monod模型方程
cS
二、无抑制的细胞反应动力学
Monod模型方程
不同K S值的Monod曲线
二、无抑制的细胞反应动力学
Monod模型方程 max 和 c S 为一级动力学关系 cS , K S时, 当 cS KS 提高限制性底物浓度可以提高比生长速率
13401370436生物反应工程第三章细胞反应动力学概述研究对象以细胞微生物催化剂的反应过程动力学研究内容在细胞水平上通过对细胞的生长速率代谢产物的生成速率和底物的消耗速率等动力学特性的描述反映出细胞反应过程的本征动力学特性研究目的细胞反应过程动力学是进行细胞反应过程优化和生物反应器设计的重要理论依据主要内容第四节底物消耗和产物生成动力学第一节细胞反应概论一基本概念细胞细胞是一切生物体进行生长遗传和进化等生命活动的基本单位也是决定生物体形态结构和功能的基本单位代谢产物排泄进入胞外非生物相二细胞的基本特征组成chon四种元素约占细胞质量的90spnacakclmgfe含量其次以上12种元素约占细胞质量的99细胞的化学组成二细胞的基本特征组成活细胞的主要成分是水占总量8095干物质中90是由蛋白质核酸糖类和脂类等四类大分子物质所组成细胞的元素和化学组成将直接影响细胞大规模培养时的培养基设计二细胞的基本特征组成蛋白质
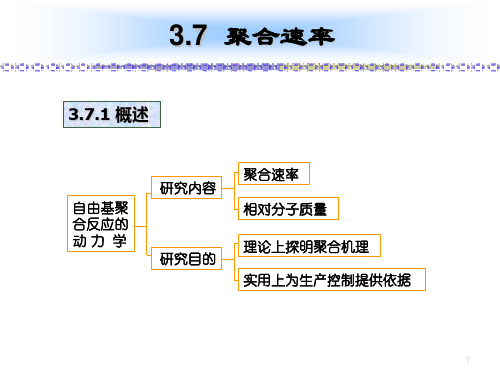
第三章自由基聚合(第7周)动力学概论
直径约1mm 长500mm
4
3.7 聚合速率
膨胀计法:
测定原理:利用聚合过程的体积收缩与转化率的线性关系。
随聚合反应发生,分子间形成了键。反应时,从π键变为σ键, 键长有所增加,但低分子间力转变成链节间的共价键,比未成键 前单体分子间距离要短得多:
22
-d[M]/dt
可用C ~t 曲线表示聚合过程中速率的变化
通常呈S 型。据此,
率自
-
时 间 关 系
由 基 聚 合
曲反
线应
图转
化
转
化 率
中 期
诱
导 期
初 期
S型
后 期
t
聚合过程
诱 初中 后
导
期期 期
期 ︵
零 速
︵︵ ︵ 匀加 减 速速 速
期
期期 期
︶ ︶︶ ︶
诱导期:初级自由基为阻聚杂质所终止,无聚合物形成,聚合速率为零。 初期:单体开始正常聚合,转化率在5%~10%以下(研究聚合时)或10%~20%(工
由于副反应和诱导分解,初级自由基或分解的引
发剂并不全部参加引发反应,故须引入引发剂效 率f。
引发速率(Ri)方程为:
Ri =2fkd[ I ]
B 链增长
单体自由基连续加上大量单体分子的反应
RM M RM2 M RM3 M
kp1
kp 2
kp 3
RMx
∲ 根据等活性理论,链自由基的活性与链长基本无关, 即各步速率常数相等。这是处理自由基动力学的 第一个假定。(低转化率5%-10%)
上述公式一般只适用于聚合初期 (低转化率5%~10%), 为什么?
3.7 聚合速率
7、动力学-动量定理和动量矩定理概论

11
质点动力学两类问题: 第一类问题:已知质点的运动,求作用在质点上的力(微分 问题)。解题步骤和要点: ① 正确选择研究对象 一般选择联系已知量和待求量的质点。 ② 正确进行受力分析,画出受力图 应在一般位置上进行分析。 ③ 正确进行运动分析 分析质点运动的特征量 。 ④ 选择并列出适当形式的质点运动微分方程 建立坐标系 。 ⑤ 求解未知量。
大小与r的大小成正比,称之为向心力。
16
第二类问题:已知作用在质点上的力,求质点的运动(积 分问题)。
已知的作用力可能是常力,也可能是变力。变力可能是时 间、位置、速度或者同时是上述几种变量的函数。 解题步骤如下: ① 正确选择研究对象。 ② 正确进行受力分析,画出受力图。判断力是什么性质的力
(应放在一般位置上进行分析,对变力建立力的表达式)。 ③ 正确进行运动分析。(除应分析质点的运动特征外,还要确
一部分由加速度引起,称为附加动拉力。全部拉力称为动拉力。
14
[例2] 已知质量为m的质点M在坐标平面 Oxy 内运动,如
图所示。其运动方程为 x a cost,y bsint ,其中
a、b、 是常数。求作用于质点上的力F。
解:将质点运动方程消去时间t,得
x2 y2 1
a2 b2
可见,质点的运动轨迹是以
四.动力学的基本问题:大体上可分为两类: 第一类:已知物体的运动情况,求作用力; 第二类:已知物体的受力情况,求物体的运动。
综合性问题:已知部分力,部分运动求另一部分力、部分运动。
已知主动力,求运动,再由运动求约1 质点动力学的基本方程 14.2 动量定理 14.3 动量矩定理
ma
F ,
G d v G sin
g dt
1
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
二、速率方程
1、基元反应的速率方程
质量作用定律:基元反应的速率与反应物浓度(含有相应指 数)的乘积成正比,其中指数为反应式中各反应物的计量系 数,这就是质量作用定律。
物理化学选论
第三章 化学动力学
2020/11/10
§3.1 化学动力学的任务和目的
一、化学热力学的研究对象和局限性
研究化学变化的方向、能达到的最大限度以及外界条件 对平衡的影响。
例如:N2 (g)+3H2 (g)=2NH3(g) 最rG大m转化0 率 26% (300atm,500oC)
热力学能判断这个反应能正向自发进行 但这只是预测反应发生的可能性,至于反应能否发生?反应的 速率如何?反应的机理反应进度随时间的变化率称为“转化速率”,即:
r d
dt
1
dn(R t) dt
1
dn(P t) dt
1
B
dnB (t) dt
式中νB为化学反应式中物质B的计量系数,对反应物取负 值,对产物取正值。
d 1 dnB (t) dt B dt
三、通常所讲的反应速率r的表示方式
§3.2 化学反应速率的表示法
反应速率可以用反应物浓度随时间的 不断降低来表示,也可以用生成物(产物) 浓度随时间的不断升高来表示。但是, 由于在反应式中产物和反应物的计量系 数不尽一致,所以用反应物或产物的浓 度变化率来表示反应速率时,其数值未 必一致。如果采用反应进度随时间的变 化率来表示反应速率,则不会产生这种 矛盾。
r 1 d
V dt
1 1 dnB (t)
V B dt
如反应在恒容条件下进行,则V为常数
所以:r
1
d
n(BV t)
1
dcB
B
dt
B dt
1 d[B]
B dt
r 1 dcB 1 d[B]
B dt B dt
推广:对任意恒 容反应: eE fF gG hH
r 1 d[E] 1 d[F] 1 d[G] 1 d[H] e dt f dt g dt h dt
【思考题】:用不同的反应物或产物表示下列恒容反应的反应速率r
N2 +3H2 =2NH3
答案:r d[N2 ] 1 d[H2 ] 1 d[NH3]
dt
3 dt 2 dt
四、几类反应的速率表达式
1、液相反应(均相)
rc
1
B
dcB dt
(可认为恒容)
2、气相反应(恒容)
rc
1
B
dcB dt
rp
积分式:
ln
C0 C
k1t
浓度参数 Ci 时间 (t) 关系式。 (由微分式积分得到,故叫积分式)
一、基元反应和非基元反应
1、基元反应:
常见的气相反应:H2 + Cl2 2HCl由下边几步构成: 1) Cl2 M 2Cl M 2) Cl H2 HCl H 3) H Cl2 HCl Cl 4) 2Cl M Cl2 M
(1) Cl H2 HCl H (2) H2 2I 2HI
r k1[Cl][H2 ] r k2[H2 ][I]2
式中 k1, k2均称为速率常数
注意: 1)质量作用定律只能适用于“基元反应”。 2)有的非基元反应的速率表达式也符合质量作用定律,
那只是巧合,不能以此推断该反应为基元反应。
➢发展阶段: 2) 20世纪前叶:宏观反应动力学向微观 反应动力学的过渡阶段 3) 20世
纪50年代后:微观反应动力学阶段
➢ 1) 19世纪中叶起:宏观反应动力学 ①质量作用定律; ② Arrhenius 经验式; ③活化能概念
➢ 2) 20世纪前叶:宏观向微观过渡 ①碰撞理论; ②过渡态理论
➢ 3) 20世纪50年代后:微观反应动力学 从分子水平上研究化学反应动力学。由于一些新的实验手段 的利用(如:激光、交叉分子束、计算机等),使得化学动 力学取得了新的进展。
一、 反应进度()的定义
对于反应: R = P (、为计量系数)
t=0 nR(0) t=t nR(t)
nP(0) nP(t)
某一时刻 t 时: (t) n(R t) n(R 0) n(P t) n(P 0)
二、反应的转化速率(r)
(t) n(R t) n(R 0) n(P t) n(P 0)
2、非基元反应的速率方程:
对于非基元反应(总包反应),不能用质量作用定律直接
得到速率方程。需要通过实验手段,确定反应速率方程。所以
动力学研究确实是一门实验科学
例如:H2 + Cl2 2HCl 是非基元反应
➢热力学研究: 最 rG大m转化0 率 26% (300atm,500oC) ➢动力学研究:
可能性√
在此条件下,其反应速率0
采用合适的催化剂(常用Fe),反应速率大大加快
(通过改变反应历程而实现)
可能性
现实性
三、化学反应动力学的发展历程
(相对于热力学)发展较晚,不系统。 1) 19世纪中叶起:宏观反应动力学阶段
1
B
dpB dt
1 dcB RT
B dt
(理想气体)
rc RT
§3.3 化学反应的速率方程
速率方程又称动力学方程。它表明了反应速率与浓度等参 数之间的关系或浓度等参数与时间的关系。速率方程可表示 为微分式或积分式。
微分式: r dx / dt
反应速度 r浓度参数ci关系式 (r 由浓度对时间微分得到,故叫微分式)
二、化学动力学的研究任务 1、了解反应的速率,了解各种因素(如分子结构、温度、 压力、浓度、介质、催化剂等对反应速率的影响,从而给人 们提供选择反应条件,掌握控制反应进行的主动权,使化学 反应按我们所希望的速率进行。 2、研究反应历程。
把热力学的反应可能性变为现实性。
例如:N2 (g)+3H2 (g)=2NH3(g)
上述反应历程中的每一步反应,都是参加反应的粒子在碰撞 中相互作用,一步就直接转化为生成物,这样的反应叫”基元反 应”。
2、非基元反应:
常见的气相反应:H2 + Cl2 2HCl由下边几步构成: 1) Cl2 M 2Cl M 2) Cl H2 HCl H 3) H Cl2 HCl Cl 4) 2Cl M Cl2 M
