高考化学二轮复习课件【12】常见非金属元素
第11讲 常见非金属及其重要化合物(课件)-2023届高考化学二轮复习(全国通用)

化学
2023
二轮精准复习45讲
第11讲
常见非金属及其重要化合物
有关非金属元素单质及其化合物的性质和用途的思维途径
1.硅及其化合物
(1)硅及其化合物的“价类二维”转化。
理清知识主线:
-
H4
-
H4
+
O
+
+
O2
+
O2(H2 O3)
(2)重要反应的方程式。
ClO-+Cl-+2H+═Cl2↑+H2O
⑦将SO2和Cl2混合,漂白性减弱的原因(用离子方程式表示)。
SO2+Cl2+2H2O
+
4H +S +2Cl
(3)扫除易忘知识盲点。
①液氯密封在钢瓶中,而氯水、次氯酸应保存在棕色试剂瓶中。
②酸性KMnO4溶液应用硫酸酸化。
酸化KMnO4溶液不能用盐酸,也不能用硝酸
③ClO-不论在酸性环境中还是在碱性环境中均能体现强氧化性,如ClO-与
-、Fe2+均不能大量共存。
、I
SO23
④当Fe与Cl2在加热条件下反应时,不论Fe过量还是不足,由于Cl2的强氧化
性,产物一定是FeCl3。
⑤“84”消毒液的有效成分为NaClO,漂粉精的有效成分为Ca(ClO)2。“84”消
3S↓+3H2O
④书写下列反应的化学方程式。
a.将 SO2 通入 H2S 溶液中。
2H2S+SO2
3S↓+2H2O
b.Cu 与浓硫酸混合加热。
Cu+2H2SO4(浓)
2014届高考化学二轮专题复习专题10:常见非金属元素及其重要化合物

自查· 自悟· 自建
考点· 方法· 技能
实验· 思想· 建模
续表 氧化物 SO2、SO3、NO、NO2、CO、CO2、SiO2等
对环境 质量的 影响
SO2、NO、NO2、CO是大气污染物 SO2→ 酸雨 NO、NO2→ 光化学烟雾 CO2→ 温室效应
自查· 自悟· 自建
考点· 方法· 技能
实验· 思想· 建模
物理性质
类型
自查· 自悟· 自建考点· Nhomakorabea法· 技能
实验· 思想· 建模
续表
氧化物 与水反 应 与碱反 应 化 学 性 质 SO2、SO3、NO、NO2、CO、CO2、SiO2等 SO2、SO3、NO2、CO2 能 与水反应
-
SO2、SO3、CO2、SiO2与OH 反应生成酸式盐或正盐, - - 如SiO2+2OH ===SiO2 3 +H2O SO2能氧化H2S 氧化性 NO2能使湿润的淀粉 KI 试纸变蓝 SiO2、CO2能被C高温下还原 - + + SO2具有较强的还原性,能被MnO4 (H )、Fe3 、 - HNO3、Cl2、Br2、I2、O3等氧化为SO2 4 还原性 2NO+O2===2NO2 CO是重要的还原剂(能还原CuO、Fe2O3、H2O等) SO2具有漂白性 CO、NO与血红蛋白结合,SiO 与氢氟酸反应: 特性 SiO +4HF===SiF ↑+2H O 2 2 4 2 NO2能自相结合生成N2O4
自查· 自悟· 自建 考点· 方法· 技能 实验· 思想· 建模
续表
非金属单质 氧化性与 还原性 Cl2、Br2、I2、O2、O3、N2、H2、S、C、Si Cl2、O2、Br2具有强氧化性;I2、N2、S有氧化性; C、Si、H2主要表现还原性
高考第二轮复习——无机非金属元素及其化合物(学案含答案)

年级高三学科化学版本苏教版内容标题无机非金属元素及其化合物【本讲教化信息】一. 教学内容:无机非金属元素及其化合物二. 教学目标驾驭氯、氧、硫、氮、磷、碳、硅所在主族元素性质的相像性、递变规律和特别性;重点驾驭几种常见典型物质的物理性质和化学性质;驾驭硫酸、硝酸的化学性质;驾驭氯气、二氧化硫、一氧化氮、二氧化氮、二氧化碳、氨气、氢气的试验室制法和气体的收集与尾气的汲取。
三. 教学重点、难点常见非金属元素的性质及相互关系四. 教学过程:元素化合物是中学化学的主体,这部分内容与基本概念、基本理论相互渗透,与化学试验、化学计算联系紧密。
复习元素化合物,要运用规律、把握关键、抓住重点、联系实际、编织元素化合物的科学体系。
元素化合物学问复习中要留意相像、相近内容的总结归纳。
如SO2、CO2、SO3、P2O5、SiO2等都是酸性氧化物,它们的性质有相像之处也有相异点。
高考命题时常会把这种关系编入试题中。
近几年的高考试题中这种趋向比较明显,值得大家重视。
说明:1. 氯元素的学问网络2. 次氯酸、漂白粉的性质HClO分子的结构式为H-O-Cl(氧处于中心),所以电子式为。
次氯酸、次氯酸钙等有多方面的性质,常常用到以下几方面性质:(1)HClO是一种弱酸,与碳酸比较电离实力有如下关系:H2CO3>HClO>HCO3-,请分析下列反应:少量二氧化碳通入NaClO溶液中:NaClO + CO2+H2O=NaHCO3+HClO氯气通入碳酸氢钠溶液中:Cl2+NaHCO3=NaCl+CO2↑+HClO(2)ClO-是一种弱酸的酸根离子,能发生水解反应:ClO-+H2O HClO+OH-,所以次氯酸钙溶液显碱性。
若遇到铁盐、铝盐易发生双水解:3ClO-+Fe3++3H2O=Fe(OH)3↓+3HClO(3)HClO和ClO-都具有强氧化性,无论酸性、碱性条件下都可以跟亚铁盐、碘化物、硫化物等发生氧化还原反应,但不能使品红溶液褪色。
高考化学总复习非金属元素及其化合物

第四讲、非金属元素及其化合物【知识要点】一、元素非金属性的强弱规律1.常见非金属元素的非金属性由强到弱的顺序: F、O、Cl、N、Br、I、S、P、C、Si 、H:2.元素的非金属性与非金属单质活泼性是并不完全一致的:如元素的非金属性O>Cl, N >Br;而单质的活泼性:O2< Cl2,N2<Br2。
3.比较非金属性强弱的依据(1)元素在周期表中的相对位置(2)非金属单质与氢气化合的越容易,非金属性越强。
如F2、Cl2、Br2、I2与H2化合由易到难,所以,非金属性F>Cl>Br>I。
(3)气态氢化物的越稳定,非金属性越强,如稳定性HF>H2O>HCl>NH3>HBr>HI>H2S >PH3,所以非金属性F>O>Cl>N>Br>I>S>P。
(4)最高价氧化物对应的水化物的酸性越强,非金属性越强,如酸性HClO4>H2SO4>H3PO4>H2CO3>H4SiO4,则非金属性Cl>S>P>C>Si。
(5)非金属性强的元素的单质能置换出非金属性弱的元素的单质。
如2F2+2H2O=4HF+O2↑;O2+4HCl=2H2O+2Cl2(地康法制Cl2);Cl2+2NaBr=2NaCl+Br2;3Cl2+2NH3=N2+6HCl;Cl2+H2S=S+2HCl。
(6)非金属单质对应阴离子的还原性越强,该非金属元素的非金属性越弱。
常见阴离子的还原性由强到弱的顺序是S2->I->Br->Cl->F-,则非金属性S<I<Br<Cl<F。
(7)与变价金属反应时,金属所呈价态越高,非金属性越强,如Cu+Cl2CuCl2;2Cu+S Cu2S,说明非金属性Cl>S。
二、非金属元素的化学性质(注意反应条件、现象、生成物的聚集状态)三、常见非全属单质的制取方法1.电解法①电解水溶液:如2NaCl +2H 2O 电解2NaOH +Cl 2↑+H 2↑②电解熔融物:如2KHF 2 电解F 2↑+H 2↑+2KF2.分解法:如2KClO 3 MnO 22KCl +3O 2↑ CH 4C +2H 2 2H 2O 2MnO 22H 2O +O 2↑ 3.置换法:如Cl 2+2NaBr =2NaCl +Br 2 2H 2S +O 2(不足) 点燃2H 2O +2S4.氧化法:如MnO 2+4HCl MnCl 2+Cl 2↑+2H 2O4NaBr +3H 2SO 4+MnO 2=2Na 2SO 4+MnSO 4+2Br 2+3H 2O5.还原法:C +H 2O CO +H 2,Zn +2HCl =ZnCl 2+H 2↑ 2C + SiO 2Si +2CO ↑【例题分析】[例题1]氯化碘(ICl )的化学性质跟氯气相似,预计它跟水反应的最初生成物是 ( )A 、HI 和HClOB 、HCl 和HIOC、HClO3和HIOD、HClO和HIO【拓展】从某些方面看,NH3和H2O相当,NH4+和H3O+(简写为H+)相当,NH2-和OH-相当,NH2-(有时还包括N3-)和O2-相当(1) 已知在液氨中下列2个反应能发生,完成并配平方程式:NH4Cl + KNH2→ , NH4I + PbNH →(2) 已知M为正二价金属,完成下列反应式:M+NH3→,MO+NH4Cl →M(NH2)2→[例题2]可以验证硫元素的非金属性比氯元素弱的事实是()①硫和氢气在加热条件下能形成H2S、H2S受热300℃左右分解。
高考化学专题复习——非金属元素
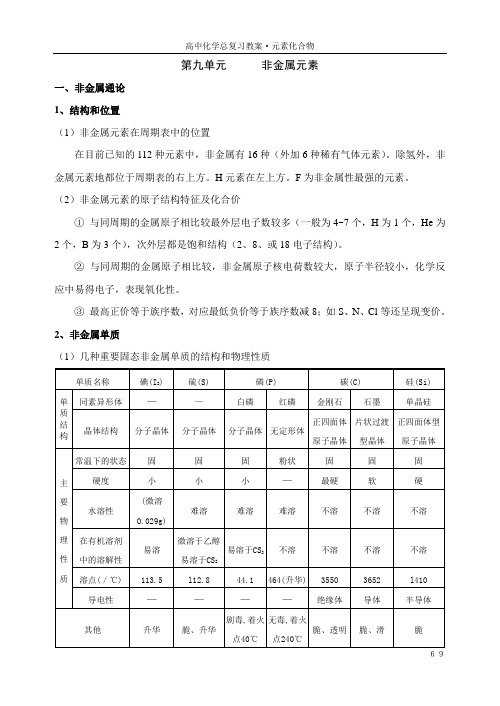
第九单元非金属元素一、非金属通论1、结构和位置(1)非金属元素在周期表中的位置在目前已知的112种元素中,非金属有16种(外加6种稀有气体元素)。
除氢外,非金属元素地都位于周期表的右上方。
H元素在左上方。
F为非金属性最强的元素。
(2)非金属元素的原子结构特征及化合价①与同周期的金属原子相比较最外层电子数较多(一般为4~7个,H为1个,He为2个,B为3个),次外层都是饱和结构(2、8、或18电子结构)。
②与同周期的金属原子相比较,非金属原子核电荷数较大,原子半径较小,化学反应中易得电子,表现氧化性。
③最高正价等于族序数,对应最低负价等于族序数减8;如S、N、Cl等还呈现变价。
2、非金属单质(1)几种重要固态非金属单质的结构和物理性质(2)重要气、液态非金属单质的结构和物理性质(3)结构与单质的化学性质3、非金属单质的制备(1)原理:化合态的非金属有正价态或负价态。
0R R nen−−→−-++,0R R nen−−→−---(2)方法: ① 氧化剂法,如: MnO 2+4HCl (浓)==MnCl 2+Cl 2↑+2H 2O222Br BrCl −→−-,22)(Cl g HCl O−→−(地康法制氯气) ② 还原剂法,如:Si SiO C −→−2,242H SO H Zn−→−③ 热分解法,如:23O KClO−−→−加热,24H C CH+−−→−高温④ 电解法,如:电解水制H 2、O 2,氯碱工业制Cl 2等。
⑤ 物理法,如:工业上分离液态空气得N 2(先)、O 2(后)4、非金属气态氢化物 (1)分子构型与物理性质ⅣA ——RH 4 正四面体结构,非极性分子; ⅤA ——RH 3 三角锥形,极性分子;ⅥA ——H 2R 角型(或“V “型)分子,极性分子; ⅦA ——HR 直线型,极性分子。
固态时均为分子晶体,熔沸点较低,常温下H 2O 是液体,其余都是气体。
(2)化学性质① 稳定性及水溶液的酸碱性非金属元素原子跟氢原子通过共价键形成气态氢化物,一般元素的非金属性越强,跟氢化合能力越强,生成的气态氢化物越稳定,因此气态氢化物的稳定性是非金属性强弱的重要标志之一。
2023届高三化学高考备考二轮复习:元素及其化合物性质及其应用课件

K5=K1·K2/(K32·K4)= 107> 105
(4)向NaClO溶液中通入少量或过量CO2的离子方程式。 。
(5)向NaClO溶液中通入过量SO2的离子方程式。
ClO- + H2O + SO2 ═ SO42- + 2H+ + Cl-
。
(6)向FeBr2溶液中通入等物质的量Cl2的离子方程式。
2Fe2++2Br-+2Cl2===2Fe3++B①r②2+HH2CC4OOC33- l-
。 HCO3- +H+
CO32- +H+
③HClO
ClO- +H+
(7)S将OS2+O2C和l2C+l22混H合2O,==漂=4白H+性+减S弱O24的⑤-④ ⑤+原CH=a2①2CC因COO+33l(+(-②用sC) a-2离+③+2子CC×OlO2方32-。--=(④aC程qa)C+式OC3a表↓2++(2a示Hq)C)lO。
Na2CO3+Ca(OH)2===CaCO3↓+2NaOH 。
(3)向NaOH、Na2CO3、NaHCO3溶液中逐滴滴入少量盐酸,写出发生反应的离子方 程式。
O_H__-_+__H_+_=_=_=__H_2_O_;__C_O__23_-_+__H_+_=_=_=_H__C_O_- 3_;__H_C_O__-3_+__H_+_=_=_=__H_2_O_+__C_O__2_↑____ 。
Fe(OH)2制备常用方法:
方法一:有机覆盖层法将吸有NaOH溶液的胶头滴管 插到液面以下,并在液面上覆盖一层苯或煤油(不能 用CCl4),以防止空气与Fe(OH)2接触发生反应,如图 1所示。
高考化学复习步步高高考化学二轮复习(浙江专用)专题突破配套文档:专题十二常见非金属元素(含答案解析)

[考纲要求 ] 1.了解常见非金属元素单质及其重要化合物的主要性质及应用。
2.了解常见非金属元素单质及其重要化合物对环境质量的影响。
考点一碳、硅及其重要化合物1.理清知识主线-40+2+4CH4C ―→ CO―→ CO2-40+4+4SiH 4Si ―→ SiO2(H 2S i O3)2.注意网络构建3.扫除知识盲点(1)工业上制备粗硅,是用过量的 C 和 SiO 2高温下反应,由于 C 过量,生成的是 CO 而不是CO2,该反应必须在隔绝空气的条件下进行。
(2)氢氟酸不能用玻璃容器盛放;NaOH 溶液能用玻璃试剂瓶,但不能用玻璃塞。
(3)酸性氧化物一般能与水反应生成酸,但SiO2不溶于水;酸性氧化物一般不与酸作用,但SiO 2能与 HF 反应。
(4)硅酸盐大多难溶于水,常见可溶性硅酸盐是硅酸钠,其水溶液称为泡花碱或水玻璃,但却是盐溶液。
(5)H 2CO3的酸性大于H 2SiO3的,所以有Na2SiO 3+ CO2(少量 )+ H2O===H2SiO3↓+ Na2CO3,高温但高温下Na2CO3+ SiO2=====Na2 SiO3+ CO2↑也能发生,原因可以从两方面解释:①硅酸盐比碳酸盐稳定;②从化学平衡角度,由高沸点难挥发固体SiO2制得低沸点易挥发的CO2。
(6)SiO 2不导电,是制作光导纤维的材料;Si 是半导体,是制作光电池的材料。
(7)水泥、玻璃与陶瓷是三大传统无机非金属材料;碳化硅、氮化硅等是新型无机非金属材料。
题组一重要反应必练1.按要求书写反应方程式。
(1)制水煤气高温C+H 2O(g)=====CO+ H2。
(2)制备粗硅高温2C+ SiO2=====2CO↑+ Si。
(3)Mg 在 CO2中燃烧点燃2Mg +CO2=====2MgO +C。
(4)“水滴石穿”的反应原理(用离子方程式表示)CaCO3+CO2+ H2O===Ca2++ 2HCO -3。
(5)“钟乳石”的形成过程(用化学方程式表示)CaCO3+CO2+ H2O===Ca(HCO 3)2,△Ca(HCO 3) 2=====CaCO3↓+ CO2↑+ H 2O。
高考化学第二轮复习 非金属元素概论

目夺市安危阳光实验学校包集中学高考化学第二轮复习教案:非金属元素概论教学目标知识技能:了解元素核外电子排布的周期性与元素性质递变关系,掌握典型非金属在周期表中的位置及其性质的关系。
了解常见非金属元素(Cl、Br、I、F、H、O、S、N、P、C、Si)的单质及其化合物。
能力培养:通过对本节内容的分析讨论,使学生在掌握元素化合物知识的基础上培养学生对知识进行分析综合、归纳演绎的逻辑思维能力和直觉思维能力以及灵活运用所学知识解决问题的能力。
科学思想:培养学生建立“一切客观事物本来是互相联系和具有内部规律的”辩证唯物主义的观点。
科学品质:认识本质,进行知识整理、综合、提高与拓展的方法培养。
科学方法:培养学生科学抽象、概括整理、归纳总结、准确系统地掌握知识规律的方法。
重点、难点非金属元素的结构、性质及应用。
元素化合物知识的综合应用及物质推断。
教学过程设计教师活动【引入】一、元素化合物的复习方法落实存在、性质、制备、用途四要点。
学生活动体会“位、构、性”三者关系。
【举例】(1)从位置出发,以Cs为例。
位置:第六周期,IA族。
→结构特点:最外层只有一个电子,原子半径大。
→比Na、K更活泼的金属元素,具强的金属性。
→应隔绝空气保存;与水反应剧烈,可能发生爆炸;与氧气迅速反应,主要产物肯定不是Cs2O。
(2)从结构出发:已知某元素原子有六个电子层,最外层2个电子→最外层电子数少,电子层数多,应是活泼金属,金属性大于钙→与水剧烈反应;氢氧化物是可溶性强碱;碳酸盐、硫酸盐均不溶于水。
与教师共同分析。
(3)从性质出发:某单质能从水中置换出O2。
→非金属性大于氧,应为最活泼的非金属元素F→在周期表的右上角,第二周期ⅦA族→可与绝大多数金属、非金属甚至某些稀有气体直接反应;化合价只有-1价;几乎无法用氧化剂将F-氧化成F2。
分析:归纳:【投影】例1 BGO是我国研制的一种闪烁晶体材料,曾用于诺贝尔奖获得者丁肇中的著名实验,它是锗酸铋的简称,若知:①在BGO中,锗处于其最高价态。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(
√ ×
)
(
)
(
×
×
)
(7)玻璃容器可长期盛放各种酸
(2014· 海南,9A)
(
)
(8)Si和SiO2都用于制造光导纤维 (2014· 海南,10D) (9)石英只能用于生产光导纤维 (2013· 福建理综,6A)
(
×)
×
)
(
(10)高温下用焦炭还原SiO2制取粗硅
(2013· 广东理综,11C)
高温
。
(3)Mg在CO2中燃烧
2Mg+CO2=====2MgO+C 。
点燃
(4)“水滴石穿”的反应原理(用离子方程式表示) + - CaCO3+CO2+H2O===Ca2 +2HCO3 。 (5)“钟乳石”的形成过程(用化学方程式表示) CaCO3+CO2+H2O===Ca(HCO3)2 , △ Ca(HCO3)2=====CaCO3↓+CO2↑+H2O 。 (6)向饱和Na2CO3溶液中通入过量CO2的离子方程式
(6)SiO2不导电,是制作光导纤维的材料;Si是半导体,是制作光
电池的材料。
(7)水泥、玻璃与陶瓷是三大传统无机非金属材料;碳化硅、氮
化硅等是新型无机非金属材料。
题组集训
题组一 重要反应必练
1.按要求书写反应方程式。 (1)制水煤气 (2)制备粗硅
2C+SiO2=====2CO↑+Si 。
高温
C+H2O(g)=====CO+H2
相关信息如下:
a.四氯化硅遇水极易水解;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯
化物;
c.有关物质的物理常数见下表:
物质 沸点பைடு நூலகம்℃
熔点/℃ 升华温度/℃
SiCl4 57.7
-70.0 -
BCl3 12.8
-107.2 -
AlCl3 -
- 180
FeCl3 315
- 300
PCl5 -
- SiO2+2OH-===SiO2 3 +H2O 。
(11)向Na2SiO3溶液中通入过量CO2的离子方程式
- - SiO2 + 2CO + 2H O===H SiO ↓+ 2HCO 3 2 2 2 3 3 。
题组二 准确判断物质性质 2.正误判断,正确的划“√”,错误的划“×” (1)NH4F水溶液中含有HF,因此NH4F溶液不能存放于玻璃试剂
- 162
请回答下列问题: (1)写出装置A中发生反应的离子方程式: _________________ ____________________________________________________。 (2) 装 置 A 中 g 管 的 作 用 是 ____________ ; 装 置 C 中 的 试 剂 是 __________;装置E中的h瓶需要冷却的理由是______________ ______________________________________________________ 。 (3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到 高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有
+4 +4
C H4←C → C O→ C O2
SiH4←Si →SiO2(H2S i O3)
2.注意网络构建
3.扫除知识盲点 (1)工业上制备粗硅,是用过量的C和SiO2高温下反应,由于C过
量,生成的是 CO而不是 CO2 ,该反应必须在隔绝空气的条件下
进行。
(2)氢氟酸不能用玻璃容器盛放;NaOH溶液能用玻璃试剂瓶,但
的杂质元素是________(填写元素符号)。
(4)为了分析残留物中铁元素的含量,先将残留物预处理,使铁元
素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原
+ 3++Mn2++ 滴定,反应的离子方程式5Fe2++MnO- 4 +8H ===5Fe
4H2O。 ①滴定前是否要滴加指示剂? ________( 填 “ 是 ” 或 “ 否 ”) ,请 说明理由:_________________________________________。 ②某同学称取 5.000 g残留物,经预处理后在容量瓶中配制成 100 mL 溶 液 , 移 取 25.00 mL 试 样 溶 液 , 用 1.000×10 - 2 mol· L - 1 则残留物中铁元素的质量分数是________。
专题十二 常见非金属元素
[考纲要求]
1.掌握常见非金属元素 ( 如H、 C、 N、O、 Si 、 S、 Cl等 ) 单 质及其重要化合物的主要性质,了解其应用。 2.了解常见非金属元素单质及其重要化合物对环境质量的
影响。
考点一
知识精讲 1.理清知识主线
-4 -4
碳、硅及其重要化合物
0 0
+2 +4
不能用玻璃塞。
(3) 酸性氧化物一般能与水反应生成酸,但 SiO2 不溶于水;酸性
氧化物一般不与酸作用,但SiO2能与HF反应。 (4)硅酸盐大多难溶于水,常见可溶性硅酸盐是硅酸钠,其水溶 液称为泡花碱或水玻璃,但却是盐溶液。
(5)H2CO3 的酸性大于 H2SiO3 的,所以有 Na2SiO3 + CO2( 少量 ) + 高温 H2O===H2SiO3↓+Na2CO3,但高温下Na2CO3+SiO2 ===== Na2SiO3 + CO2↑ 也能发生,原因可以从两方面解释:①硅酸盐 比碳酸盐稳定;②从化学平衡角度,由高沸点难挥发固体SiO2制 得低沸点易挥发的CO2。
(
√ ×
)
(11)二氧化硅不与强酸反应,可用石英器皿盛放氢氟酸 (
(2013· 江苏,4B)
)
题组三 重要实验探究
3.单晶硅是信息产业中重要的基础材料。通常用碳在高温下还原
二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应
生成四氯化硅(反应温度450~500 ℃),四氯化硅经提纯后用氢气
还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。
2Na +CO2 3 +CO2+H2O===2NaHCO3↓ 。
+ -
(7)Si和氢氟酸的反应的化学方程式 Si+4HF===SiF4↑+2H2↑ 。
(8)Si和NaOH溶液反应的离子方程式
Si+2OH +H2O===SiO2 3 +2H2↑ 。
- -
(9)SiO2和氢氟酸的反应的化学方程式 SiO2+4HF===SiF4↑+2H2O 。 (10)SiO2和NaOH溶液反应的离子方程式
瓶中
(2014· 天津理综,3B)
( (
√ √ ×
) ) )
(2)氢氟酸刻蚀玻璃涉及化学变化
(2014· 重庆理综,1C)
(3)Ca(HCO3)2溶液与过量NaOH溶液反应可得到Ca(OH)2 (
(2014· 重庆理综,3C)
(4)硅胶可作袋装食品的干燥剂 (2014· 四川理综,1B) (5)晶体硅熔点高、硬度大,可用于制作半导体材料 (2014· 江苏,4A) (6)浓硫酸可刻蚀石英制艺术品 (2014· 海南,1C)
