郑州大学2006年攻读硕士学位研究生入学试题无机化学 B卷答案
无机化学B卷及答案

北京科技大学成人教育学院2007—2008学年第二学期《无机化学》试题B卷一、填空题:(每空1分,共30分)1、频率越高,活化分子数,反应。
2、H2(g)+I2(g)=2HI(g),Kθ=50.3(713k).某状态下,p氢气=p碘=5.379×105pa,p碘化氢=62.59×105pa.则自发进行的方向是______________,原因是________________。
2、2NH3(g)=N2(g)+3H2(g).298k,△rHθm=+92.22kj·mol-1,△rSθm=+198.53j·mol-1·k-1,则标准状态下,NH3(g)自发分解的温度是_________________。
3、系统命名[CoCl(NH3)3(H2O)2]Cl2为,三羟基.水.乙二胺合铬(Ⅲ)的化学式为。
4、已知基元反应2NO2=2NO+O2,则其速率方式为v= ,反应级数为。
5、当J<Kθsp时,沉淀从溶液中;当J>Kθsp时,平衡移动,沉淀无析出;J=Kθsp时,为饱和溶液,溶液中的离子和沉淀处于状态。
6、自然界中硬度最大的单质是_______________;熔点最高的金属元素是____________.7、往KI和足量KCIO3组成的混合溶液中逐滴加入稀H2SO4,可观察到的现象是_____________。
8、根据"碰撞理论”,反应速率取决于以下3个因素:、_和。
9、在水溶液中,HCIO4与HNO3的酸强度比较,是________,水被称为__________; 在液体CH3COOH中,HCIO4与HNO3的酸强度比较,是_________,,故液态CH3COOH被称为。
10、已知反应1)Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)2)3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)3)Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)则反应feo(s)+co(g)=fe(s)+co2(g)的恒压反应热计算公式是=____________,其值=___________。
郑州大学2008年攻读硕士学位研究生入学试题有机化学A卷
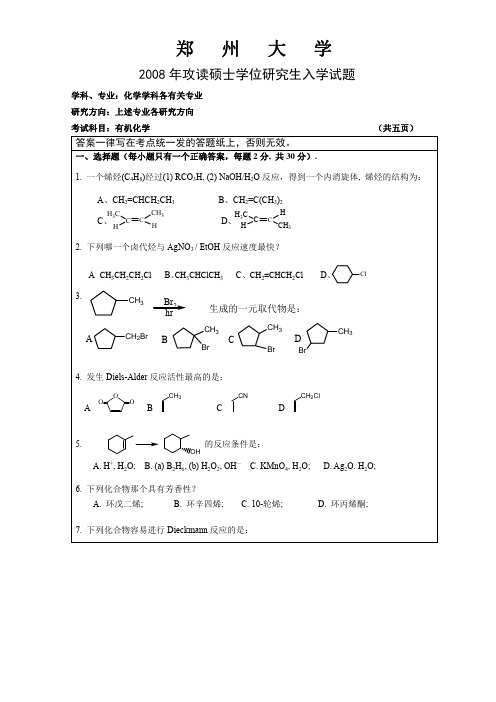
13. (1R,2S)-1-苯基-2-甲氨基-1-丙醇的 Fischer 投影式是:
CH3 H NHCH3 A. H OH C6H5 CH3 CH3 CH3NH H CH3NH H B. H OH C. HO H C6H5 C6H5 CH3 H NHCH3 H D. HO C6H5
14. 将季铵盐 CH3CH2CHCH3 加热,得到的产物主要是: HO- +NMe3 A. CH3CH2CH=CH2 B. CH3CH=CHCH3 C. CH3CH2CHCH3 OH 15. 喹啉用 KMnO4 氧化生成: A.邻苯二甲酸 B. 2,3-吡啶二甲酸 C. 苯甲酸
CH 3
NaNH2 NH 3(l)
CH3
H
H Br
H
NaOEt EtOH
CH 3
7. ClCH=CHCH2Cl + CH3CO2Na 8.
CrO 3, HOAc
25 ℃
OCH2CH=CHCH3 200。 C
9.
O + NH3
H2 Ni
10.
11.
CHO + CH3 CHO
NaOH (CH3)2CuLi
H3C H C
C
B、CH2=C(CH3)2
3 D、 H C
CH3 H
HC
C
H CH3
2. 下列哪一个卤代烃与 AgNO3 / EtOH 反应速度最快? A CH3CH2CH2Cl 3.
CH3
B、 CH3CHClCH3
C、CH2=CHCH2Cl
D、
Cl
Br2
hr
生成的一元取代物是:
CH3 Br CH3
1. H C C 3
OH OH H O C CH3 C6 H5 C 6 H5
郑州大学676无机化学05-20年真题缺20年

19、电极电势不随溶液酸度变化的电点对是
A、O2/OH- B、Cl2/Cl- C、H2O2/H2O D、MnO2/Mn2+
20、将氢原子核外电子激发到 2s 或 2p 所需的能量大小是
A、E2s>E2p B、E2p>E2s C、E2s=E2p
D、不能确定
() () ()
二、 填空题(每题 3 分,30 分)
C、P 区所有元素并非都是非金属元素; D、P 区元素的最高共价数并非都与族数相等。
15、化学式为 A+B-的离子化合物,当 A 的配位数为 4 时,最有可能的半径比(r+/r-)为 ( )
A、0.225 与 0.414 之间 B、0.614 与 0.932 之间 C、0.732 与 1 之间 D、大于 1
× Eo Zn2+/Zn
=
-
0.76V , K稳
Zn(NH3)42+/Zn
=
1
107 。
第1页
郑州大学
2005 年攻读硕士学位研究生入学试题
学科、专业:
研究方向:
ห้องสมุดไป่ตู้
考试科目:
(共 页)
答案一律写在考点统一发的答题纸上,否则无效。
一、 选择题(1-10 每题 1 分,11-20 每题 2 分,30 分)
3、(10 分)在 17°C 时,人体血液的渗透压为 780kPa,现需配置与之相应的食盐、葡萄糖水溶液, 供静脉注射,已知 1L 该溶液中含食盐 5.85g,问其中应含葡萄糖多少克?
(M 葡萄糖=180)
4、(10 分)锌能否从[Ag(NH3)2]+溶液中,置换银? × 已知 , EoAg+/Ag= 0.80V K稳 Ag(NH3)2+/Ag = 1 107,
2006硕士入学试题

五、如图所示的Cu-Sn二元相图中, 在水平线I、II、VI、V、X上各发生什么三相平衡反应
写出相应的反应式 (5分)
:
四相平衡包共晶反应区应是什么形状? 它的上下方分别与几个三相区相在四相区的上方和下方是否还与两相区或单相区相连? 为什么?
三元相图中的四相平衡共晶反应区和包晶反应区都是三角形, 请说出这两种四相平衡反从液相成分点和相邻相区的情况作比较).
在下图所示的三元相图投影图中会发生什么样的四相平衡反应? 写出反应式
组成这个三元系的三个二元系中分别发生什么样的三相平衡反应?
III点代表的成分在室温下的平衡组织.(15分)
九、假定某面心立方晶体(点阵常数为a)中的活动滑移系为]011)[111(,
、给出引起滑移的单位位错的柏氏矢量,加以说明;
、若引起此滑移的为刃型位错,指明位错线方向及其移动方向;
、若引起此滑移的为螺型位错,指明位错线方向及其移动方向。
(10分)十、铜是工业上常用的一种金属材料,具有导电率高和耐腐蚀性好等优点,但是纯铜的强度较低,经常难以满足要求,根据你所学的知识,提出几种强化铜合金的方法,并说明其强化十一、将经过大量冷塑性变形(例如为70%)的纯铜长棒的一端浸入冰水中,另一端加热至接近熔点的高温(例如0.9T m ),过程持续进行一小时,然后试样完全冷却,试作沿棒长度的硬度分布曲线(示意图),并作简要说明。
(8分)
]101[a 能否与肖克莱不全位错]211[a 相结合形成弗兰克不全位错,若能,写。
郑州大学2010年攻读硕士学位研究生入学试题化工原理试题B卷

6.
在重力场中,微小颗粒的沉降速度与下列哪一项无关?(
第1页
(a)粒子的几何形状 (c)流体与粒子的密度 7.
(b)粒子的尺寸大小 (d)流体的速度 )
为了提高蒸发器强度,可采取下述哪种方式?( (a)采用多效蒸发 (c)加大加热蒸汽侧对流给热系数
(b)增加换热面积 (d)提高沸腾侧对流给热系数
8.
1. 选用下列哪种介质有利于热量以热传导方式进行传热 (即导热系数 值最大) ? ( ) (a)空气 2. (b)水泥 ) (c)自来水 (d)钢材
层流和湍流的本质区别是( (a)湍流流速大于层流流速
(b)流动阻力大的为湍流,流动阻力小的为层流 (c)层流的雷诺数小于湍流的雷诺数 (d)层流无径向脉动,而湍流有径向脉动 3. 当不可压缩理想流体在水平放置的变径管路中做稳定的连续流动时,在管子直 径缩小的地方,其静压力( (a)不变 4. ) (c)减小 (d)不确定 )
四.计算题(60 分,每题 15 分)
1. 若在热交换器里的一根钢管,管内径是 25 mm,管壁厚 3.25 mm,管长 5.00 m, 管内壁温度是 373 K,管外壁温度是 371 K,已知钢的导热系数 = 49 W/m·K,分 别按圆筒壁稳定热传导公式和平面壁稳定热传导公式计算这根钢管传递热量。 2. 环己酮(A)- 环己醇(B)混合液(可视为理想溶液)在真空度 88.73 kPa、 温度 90 ℃下达到相平衡状态。求气液两相的组成、相对挥发度及气相中 A、B 两 组分的摩尔数之比。 注:环己酮和环己醇的安托因方程为:
9.
则该物体的黑度为 (13) 若一表面温度为 20℃的物体的辐射能力为 398W/m2, 。 (黑体的辐射系数c0 值为 5.67 [W/m2·K4]) 。
郑州大学2005至2006学年第一学期化工原理I期末考试试题B

郑州大学2005至2006学年第一学期化工原理I期末考试试题B 2005-2006学年第一学期化工原理(I)课程试题(B卷)题号一二三四五六七总分分数合分人:复查人:分数评卷人一、填空题:(每空 1分,共23分)1、因次分析法的依据是。
2、右图示为某塔设备的液封装置,进塔气体压力为80mmHg(表压),为保证正常操作,水封高度h= 。
3、某流体在直管中作层流流动,在流速不变的情况下,管长、管径同时增加一倍,其阻力损失为原来的倍。
4、当喉径与孔径相同时,文丘里流量计的孔流系数C v比孔板流量计的孔流系数C o,文丘里流量计的能量损失比孔板流量计的(大、小)。
5、离心泵的工作点是曲线与曲线的交点。
6、为除去液体中混杂的固体颗粒,在化工生产中可以采用、、等方法(列举三种方法)。
7、间歇过滤机的生产能力可写为Q=V/∑t,∑t表示一个操作循环所需的,∑t等于一个操作循环中,、和项之和。
8、大容积的饱和沸腾传热可分为、和三个阶段,而工业生产中常在阶段操作。
9、管内湍流传热,流体内温度梯度最大的部分是在,原因是。
10、采用多效蒸发器所获得的高的蒸汽经济性是以为代价,因为、。
分数评卷人二、选择题:(每题 2分,共 16 分)1、在完全湍流(阻力平方区)时,粗糙管的摩擦系数λ数值()。
A 与光滑管一样B 只取决于ReC 只取决于相对粗糙度D 与粗糙度无关2、一敞口容器,底部有一进水管(如图示)。
容器内水面保持恒定,管内水流动的速度头为0.5 m水柱。
水由水管进入容器,则2点的表压p2=()水柱。
A 2.0mB 1.5mC 1.0mD 0.75m3、离心泵的调节阀开大时,则()。
A吸入管路的阻力损失不变B泵出口的压强减小C泵入口处真空度减小D泵工作点的扬程升高4、床层的平均空隙率与床层的平均自由截面积在以下条件下相等()。
A颗粒粒度均匀B沿整个横截面上自由截面均匀C沿整个床层高度各截面的自由截面均匀D颗粒的比表面积均匀5、提高回转真空过滤机的转速,其他条件都保持不变时,过滤机的生产能力()。
2006年硕士学位研究生入学考试试题

2006年硕士学位研究生入学考试试题共2页第1页考试科目:微生物学(食品)A一、名词解释(30分)1、菌落2、生长因子3、质粒4、拮抗5、半抗原6、ELISA7、BOD58、Ames试验9、巴斯德效应10、营养缺陷型二、图解题(20分)1、烈性噬菌体与温和性噬菌体的生活史2、营养物质进入细胞的四种运输方式3、暗修复4、大肠杆菌在含有葡萄糖和乳糖的肉汤培养液中的生长曲线三、填空题(20分,答案写在答题纸上)1、影响革兰氏染色结果的因素有、、,革兰氏阳性菌的颜色是色。
2、培养基中大量元素的一般功能为、、、。
3、化能异养微生物在以有机物为基质的生物氧化中,以为最终电子受体时称为无氧呼吸;以为最终电子受体时称为发酵。
共2页第2页4、影响微生物生长的延滞期的因素有、、、。
5、影响微生物耐热力的因素有、、、。
6、平板菌落计数的cfu意指,有效数字有位。
四、是非题(以“+”、“-”表示,共15分,答案写在答题纸上)()1、水中所含的大肠菌群数,等于所含的大肠杆菌数和产气肠细菌数之和。
()2、同一原料的两种样品含菌量分别为10的8次方cfu/ml与10的10次方cfu/ml,在相同温度杀菌所需杀菌时间相同。
()3、饱和氯化钠溶液中不可能有微生物存在。
()4、葡萄糖可作为所有微生物的碳源。
()5、乳酸链球菌素(Nisin)可以抑制革兰氏阴性菌的生长。
五、问答题(75分)1、下述微生物的生态环境如何?设想如何分离它们?(15分)嗜热菌,嗜盐菌,高渗酵母菌,芽孢菌,光合细菌,金黄色葡萄球菌。
2、在食品添加剂和酶制剂中,有相当一部分是来源于微生物的代谢产物,如何使微生物合成比自身需求量更多的产物?举例说明。
(15分)3、检测食品中的大肠菌群指标的意义是什么?通常采用什么方法?现有一种采用革兰氏阳性厌氧菌制成的益生菌活菌产品,该菌可发酵乳糖产酸产气,且能耐受高浓度的胆汁盐,试设计一种检测该产品中的大肠菌群数的方法。
(15分)4、在防止食品腐败变质中,是否可以使用抗生素?为什么?如果使用,所使用的抗生素应具有什么特性?(15分)5、什么是D值?什么是Z值?试以公式说明Z值和D值的关系,并证明该式。
郑州大学2010年攻读硕士学位研究生入学试题化工原理试题A卷答案

二.填空题(30 分,每空 2 分)
(1)难溶 (4)滤饼过滤 (7)71 (10)9.84 (13)138 (2)不变 (5)聚式流化 (8)271 (11)6.0 (14)755 (3)增大 (6)分子扩散 (9)1.14 (12)108 (15)45
三. 简答题(30 分)
1. 简述以雷诺数(Re)作为判据对流体流型的三种分类类型。 (6 分) 答: (1)当 Re < 2000 时,必定出现层流,此为层流区; (2 分)
W = F – D = 100 – 40 = 60 kmol/h 100 0.35 40 0.8 60 xW xW 0.05
(2) V V (1 q ) F V F ( R 1) D F (4 1) 40 100 100 kmol / h
郑
院系名称:化学系 专业名称:工业催化 考试科目:化工原理(一)
州
大
学
二 0 一 0 年研究生考试答案专用纸(A 卷)
科目代码:926
(共 5 页)
一. 单项选择题(30 分,每题 2 分)
1. (d) ;2. (a) ;3. (a) ;4. (a) ;5. (b) ; 6. (d) ;7. (a) ;8. (a) ;9. (d) ;10.(a) 。
气体出干燥器的状态为 t2 = 85 ℃,I2 = I1 = 145 kg/kg 干气
第4页
出口气体的湿度为
H2 I 2 1.01t 2 1.88t 2 2500 145 1.01 85 0.02224 kg / kg 干气 1.88 85 2500
所以空气用量为
4. 简述结晶操作的特点。 (6 分) 答: (1)能从杂质含量较多的混合液体中分离出高纯度的晶体。 (2 分) (2)高熔点混合物、相对挥发度小的物系、共沸物。热敏性物质等难分离 物系,可考虑采用结晶操作加以分离。 (2 分) (2 分)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
二、选择题(30 分 每题 2 分)
1、 下列元素中,第一电离能最大的是 (A) A、氟 B、氧 C、氮 D、氯 2、某元素+3 价阳离子和氟的-1 价阴离子电子结构相同的是 (D) + D、Al3+ A、Ca2+ B、 Fe2+ C、La3 3、在磷的含氧酸中,属于一元酸的是 (C) A、H3PO4 B、H3PO3 C、H3PO2 D、H4P2O7 4、原子核外电子,激发到 2s 或 2p 能级时,所需能量大小是 (C) A、激发到 2s 的能量大于到 2p 能量 B、激发到 2p 能量比 2s 能量高 C、激发到 2s 能量与到 2p 能量相同 D、不确定 5、下列元素中,第一电子亲合能最大的是 (A) A、氯 B、硫 C、氧 D、氟 第1页
2、在某一溶液中分别含有 Zn2+、Pb2+离子分别为 0.2mol·dm3,在室温下通入 H2S 气体,使之
饱和,然后加入盐酸,控制离子浓度,问 pH 调到何值时,才能有 PbS 沉淀而 Zn2+离子不会成 为 ZnS 沉淀?Ksp,PbS = 4.01026,Ksp,ZnS = 1.01020 解: 已知[Zn2+] = [Pb2+] = 0.2mol·dm3 ∴[S2]≥2.01025 mol·dm3 要使 PbS 沉淀,则[S2]≥K sp / [Pb2+] 要使 ZnS 不沉淀,则[S2]≤K sp / [Zn2+] 以 [S2 ] = 5.01020 mol·dm3 ∴[S2]≤5.01020 mol·dm3
≤
1.1 10 22 2.0 10
25
3 23.45 mol·dm ,
再浓的盐酸达不到此浓度,所以溶解 PbS 沉淀必须加氧化性的酸,使之氧化溶解。 3、有一原电池:(一) Pt H2 (p0) HA (0.5 mol·dm3) NaCl (1.0 mol·dm3) AgCl(s) Ag (+),若该电 池电动势为+0.568V,求此一元酸 HA 的电离常数 Ka。已知:E0(Ag+/Ag)=0.799V
第4页
∴ [H+] = 1.27106
∴ Ka =
[H + ]2
(1.27 10 6 ) 2
6
3.23 10 12
答案一律写在考点统一发的答题纸上,否则无效。
解: Hg(NO3)2
m
Tf Kf
0.588 1.86
0.0300(m)
而
(3.24/324)mol 1kg Tf Kf
C、无论在酸、碱介质中都发生
15、氢可以与那个区的元素形成金属型氢化物 (D) A、s 区与 d 区 B、p 区与 d 区 C、d 区与 ds 区 D、d 区,ds 区及 f 区
三、填空题(50 分,每空 2 分)
1、 写出下列物质的化学式:金红石: TiO2 ;莫尔盐:(NH4)2·SO4FeSO4· 6H2O; 硼砂:Na2B4O7·10H2O;保险粉:Na2S2O4·2H2O。 2、K[Pt(C2H4)Cl3]和Ni(CO)4 的系统命名分别是:乙烯基·三氯合铂(II)酸钾 ; 四羰基合镍(0) ;其中心离子(或原子)的轨道杂化类型分别是:dsp2 和 sp3 ,其空间构 型分别是: 平面四边形 和 正四面体。 3、按照价层电子对互斥(VSEPR)理论,下列分子或离子的空间构型为: CO32- 平面三角形 ,XeOF4 四方锥形 ,AsF5 三角双锥 。 4、154 号元素可能的电子结构是:[Rn]7s2 5f146d107p68s25g186f147d2 ,在周期表中的位置为: IVB族金属元素。 第2页
答案一律写在考点统一发的答题纸上,否则无效。
5、 卤素含氧酸的酸性强度变化规律是: 同一卤素不同氧化数的含氧酸的酸性随 氧化数升高 酸 性增强,同类型的卤素含氧酸按 原子序数的增加 顺序酸性减弱。 6、常用的甘汞电极为:Pt, Hg-Hg2Cl2 其电极反应为: Hg2Cl2 + 2e = 2Hg + 2Cl-。 7、硫酸表现出来的沸点高和不易挥发是因为:硫酸分子间可以形成氢键 。 8、高空大气层中臭氧对生物界的保护作用是因为:臭氧可以吸收紫外线 。 ,它属于 缺电子 化合物,B的杂 9、最简单的硼氢化合物是: B2H6 ,其结构式为: 3 化方式为:sp 。 10、已知: MnO4
H
+
/ H2
0.0592 lg([H ] / p )
∴
H
+
/ H2
= 0.00 + 0.0592 lg[H+] = 0.0592 lg[H+]
ε = φ+ φ = +0.219 0.0591lg[H+] = 0.568(V)
[HA] 0.5 1.27 10 4、3.24g Hg(NO3)2 和 10.14g 分别溶解在 1000g 水中,溶液的凝固点分别为 0.0558℃ 和 0.0744℃ ,通过计算回答,问哪种盐在水中以离子状态存在? (已知:Kf = 1.86,M[Hg(NO3)2]= 324; M[HgCl2]=271)
0.01(m)
∴Hg(NO3)2 在水中以离子状态存在
HgCl2: m
0.0744 1.86
0.0400 (m)
而
(10.84/271)mol 1kg
0.041(m) ∴HgCl2 基本上以分子形式存在
郑
学科、专业:化学 研究方向:相关学科 考试科目:无机化学(一) (B 卷)
州
大
学
2006 年攻读硕士学位研究生入学试题
(共 3 页)
答案一律写在考点统一发的答题纸上,否则无效。
一、判断题(15 分 每题 1 分)
1、 在 H2O,NH3,CH4 分子中,中心原子都是采取 sp3 杂化的。 2、 氧分子中没有单电子,所以显逆磁性。× 3、 在相同的浓度下,亚硫酸的氧化性小于硫酸的氧化性。× 4、 在富勒烯是由 60 个碳原子组成的五边形所构成的。× 5、 已知 Ksp(AgCl)= 1.56×10-10, Ksp(Ag2CrO4)=9.0×10-12, 故 Ag2CrO4 的溶解度小于 AgCl。× 6、 Fe(H2O)63+的颜色为黄色。× 7、 对于化学反应∆G 的数值愈小,其反应速率愈大。× 8、 50 年代发现的水俣病是由汞中毒引起的。 9、 大气中的酸雨现象主要是由于工业生产所产生的 SO2 废气所致。× 10、p 轨道的角度分布图为纺锤形,这表明 p 电子是沿“8”轨道运动的。× 11、在配合物中,中心离子的配位数等于中心离子所拥有的配体的数目。× 12、铝是活泼金属, 氯是活泼非金属单质, 因此两者能够反应形成离子键,固态为离子晶体。× 13、单质的∆fGm0,∆fHm0 均为零。× 14、磷的化学性质比氮活泼,所以其电负性比氮高。× 15、C-Cl 键是极性键,所以 CCl4 是极性分子。×
解:
AgCl / Ag Ag H
+
+
/ Ag
0.0592 lg[Ag ] Ag
10 1/2 H2
+
/ Ag
0.0592 lg K sp,AgCl
∵ pH 为标准大气压
2
0.799 0.0592 lg(1.6 10
/ H2
) 0.219(V)
答案一律写在考点统一发的答题纸上,否则无效。
6、下列分子中,键角最大的是 (C) B、H2O C、CCl4 D、NH3 A、H2S 7、下列哪种晶体,直接加热脱水可以得到无水盐 (D) A、BeCl2·4H2O B、AlCl3·6H2O C、MgCl2·6H2O D、以上都不能 ,不能被吸收的是 (C) 8、将 CO2,NO2,NO,SO2 分别通过 NaOH 溶液, B、NO2 C、NO D、SO2 A、CO2 9、锡疫是由于什么原因 (B) A、锡被氧化 B、晶格转变 C、腐蚀 D、蒸发 10、在水溶液中,稳定性最大的配离子是 (A) + - B、CuCl42 C、Cu(NH3)42+ D、Cu(H2O)42+ A、Cu(en)22 11、平衡体系 CO(g) + 2H2(g) =CH3OH(g) ∆rHm0 <0,为了增加甲醇的产量,工业上应采取的措施 (B) A、高温、高压 B、适宜温度,高压、催化剂 C、低温、低压 D、适宜温度、低压、催化剂 12、下列氧化物中,氧化性最强的是 (B) A、CO2 B、PbO2 C、GeO2 D、SiO2 13、碘的苯溶液为 ( A ) A、 紫色 B、无色 C、棕色 D、黑色 14、 、已知 酸性介质O2 0.67v H2O2 1.77v H2O 说明 H2O2 的歧化反应 A、 只在酸性介质中发生 B、只在碱性介质中发生 D、无论在酸碱介质中都不发生 碱性介质O2 –0.08v H2O2 0.87v H2O (C )
- 0.558
-1.185 MnO42- 2.24 MnO2 0.907 Mn3+ 1.541 Mn2+ Mn
在酸性溶液中不能稳定存在的离子有: MnO42- Mn3+ 。
四、简答题(35 分,每题 5 分)
1、 具有惰性电子对的元素有哪几个?它们最显著的性质是什么,举例说明。 TI Pb Bi 它们显著的性质是高价化合物具有强氧化性; 例如:PbO2 + MnO4- + H+ = Mn2+ + Pb2+ + H2O 2、C 和 O 的电负性差较大,但是 CO 分子的偶极矩却很小,请说明原因。 C-O 之间存在反馈键,C=O 3、电器设备起火,为什么不能用泡沫灭火器?应该如何应对? 因为泡沫灭火器主要成分是:Al2(SO4)3 和 NaHCO3 混合溶液,不能灭火。若电器失火,应该先 拉开电闸,再用 CCl4 或 CO2 灭火器来灭火。 4、对于下面给出的氢化物和氟化物的键角做出解释: PH3:94º; PF3: 104º NH3:107º; NF3:102º; 5、1836 年,英国人丹尼尔将铜片和锌片分别放入相应的电解质溶液中,组成原电池,写出该 原电池的电池符号,电极反应以及电池反应。 (-) Zn │ZnSO4(c1)║CuSO4(c2)│Cu (+) 正极反应:Cu2+ + 2e = Cu; 负极反应:Zn – 2e = Zn2+ 电池反应: Zn + Cu2+ = Cu +Zn2+ 6、镧系元素中,原子半径的变化出现了双峰现象,解释现象,并指出是哪两个元素。 63号Eu,和70号Yb的半径较前面的元素半径和后面的原子半径都大的现象;原因是: 电子构型处于半满时,屏蔽作用大。 7、为什么多元弱电解质的电离常数 K1 >> K2 >> K3 ?
