芳香性、离域π键和休克尔规则50页PPT
合集下载
芳香性的判断
苯既具有平面的离域体系,电子数也符合4n+2规则; 萘、蒽、菲等也满足休克尔规则,因此都具有芳香性。
专题一
芳香性与休克尔规则
二、非苯型芳香烃
一些不含苯环的环烯,因符合休克尔规则,故也具有 芳香性,此类烃叫做非苯芳香烃。
(一)轮烯
[10]轮烯
[14]轮烯 [18]轮烯
专题一
芳香性与休克尔规则
二、非苯型芳香烃
专题一
芳香性与休克尔规则
三、休克尔规则的修正
1954年伯朗特(Platt)提出了周边修正法,认为可以 忽略中间的桥键而直接计算外围的电子数,对Hückel规则 进行了完善和补充。
两个前提:
使尽量多的双键处在外周上; 处在外周内外的双键写成其共振的正负电荷形式;
专题一
芳香性与休克尔规则
三、休克尔规则的修正
(二)芳香离子
环丙烯 正离子
环戊二烯 负离子
环庚三烯 正离子
专题一
芳香性与休克尔规则
二、非苯型芳香烃
(三)稠合环系
薁(蓝烃),为青蓝色片状物,符合休克尔规则具有芳香性
薁能发生典型的亲电取Βιβλιοθήκη 反应,取代基主要进入1位专题一
芳香性与休克尔规则
判断下列是否芳香性?
16个电子
12个电子
8个电子
都具有芳香性!
专题一
芳香性与休克尔规则
芳香性与休克尔规则
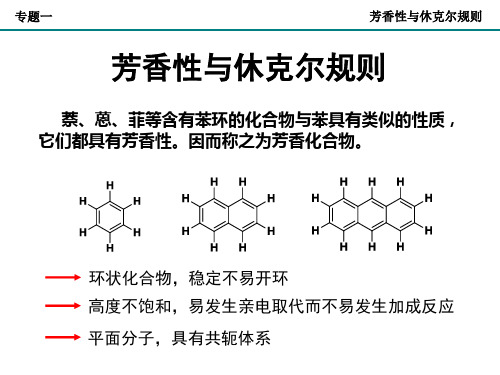
萘、蒽、菲等含有苯环的化合物与苯具有类似的性质, 它们都具有芳香性。因而称之为芳香化合物。
环状化合物,稳定不易开环 高度不饱和,易发生亲电取代而不易发生加成反应
平面分子,具有共轭体系
专题一
芳香性与休克尔规则
一、休克尔规则
成环原子处于同一平面,形成一个闭合的环状π电子 离域体系,且π电子数为4n+2(n = 0,1,2…)时,化合物 具有芳香性。
芳香性、离域π键和休克尔规则共52页

39、没有不老的誓言,没有不变的承 诺,踏 上旅途 ,义无 反顾。 40、对时间的价值没有没有深切认识 的人, 决不会 坚韧勤 勉。
6、最大的骄傲于最大的自卑都表示心灵的最软弱无力。——斯宾诺莎 7、自知之明是最难得的知识。——西班牙 8、勇气通往天堂,怯懦通往地狱。——塞内加 9、有时候读书是一种巧妙地避开思考的方法。——赫尔普斯 10、阅读一切好书如同和过去最杰出的人谈话。——笛卡儿
Thank you
芳香性ቤተ መጻሕፍቲ ባይዱ离域π键和休克尔规则
36、“不可能”这个字(法语是一个字 ),只 在愚人 的字典 中找得 到。--拿 破仑。 37、不要生气要争气,不要看破要突 破,不 要嫉妒 要欣赏 ,不要 托延要 积极, 不要心 动要行 动。 38、勤奋,机会,乐观是成功的三要 素。(注 意:传 统观念 认为勤 奋和机 会是成 功的要 素,但 是经过 统计学 和成功 人士的 分析得 出,乐 观是成 功的第 三要素 。
6、最大的骄傲于最大的自卑都表示心灵的最软弱无力。——斯宾诺莎 7、自知之明是最难得的知识。——西班牙 8、勇气通往天堂,怯懦通往地狱。——塞内加 9、有时候读书是一种巧妙地避开思考的方法。——赫尔普斯 10、阅读一切好书如同和过去最杰出的人谈话。——笛卡儿
Thank you
芳香性ቤተ መጻሕፍቲ ባይዱ离域π键和休克尔规则
36、“不可能”这个字(法语是一个字 ),只 在愚人 的字典 中找得 到。--拿 破仑。 37、不要生气要争气,不要看破要突 破,不 要嫉妒 要欣赏 ,不要 托延要 积极, 不要心 动要行 动。 38、勤奋,机会,乐观是成功的三要 素。(注 意:传 统观念 认为勤 奋和机 会是成 功的要 素,但 是经过 统计学 和成功 人士的 分析得 出,乐 观是成 功的第 三要素 。
有机化学第7章,ppt课件

7.4.1 反应类型及反应机理
1. 亲电取代反应概述
+
+ E
HEsp3杂E化sp2杂化
+
E
+
+ -H
+H+
亲电试剂 π络合物 σ络合物 取代苯
+H E H E+
讨论:1.当过渡态 + 比 + 稳定时,中间体 σ
络合物较难形成,一旦形成后很快转化成产物。
+H E
H E+
2.当过渡态 + 比 + 能量相近时,
ψ3
无节面
ψ1 苯的π 电子分子轨道重叠情况
7.3 单环芳香烃的物理性质
物理性质 苯和其同系物的芳烃一般都溶剂,如 乙醚、CCl4 、石油醚等非极性溶剂。具有一定 的毒性,吸入过量苯蒸气,急性中毒引起神经性 头昏,并可发生再生障碍性贫血,急性白血病; 慢性中毒造成肝损伤。
4. 6电子体系有中性分子、碳正离子和碳负离子。 —
苯
环 戊 二 烯 负 离 子
3. 10 π电子体系( n=2)
环辛四烯双负离子
126°46 ' 0.1334nm2K, THF
K
=
= 2K+
0.1462nm
K
成环C不在同一平面 无
π 电子=8
芳
不能形成环状共轭体系 性
成环C在同一平面 有芳 π 电子=10 n=2 性
三苯甲烷
萘
7.1.2 按4n+2规则的n分类
1. 2 π电子体系( n=0)
2.
具两个电子的环状结构是稳定的,有芳香
Ph性。
Ph
Ph Ph
+
芳香性 离域π键和休克尔规则

(6)[18]轮烯
[18]轮烯具有芳香性。这个环大到足以使环内
氢不再互相排斥,环也没有角张力。X-射线衍射测
定这个环是平面的,键长0.138至0.142nm,不是交
替键长。核磁共振谱显示有反磁环流,分子的化学
性质也属芳香性类型。
更大的轮烯如[20]轮烯、[22]轮烯、 [24]轮烯均已合成。核磁共振显示只有 [22]轮烯是芳香性的,而[20]轮烯、 [24]轮烯均无芳香性,说明休克尔规则 普遍适用于这些轮烯。
例析离域π键
NO
3
CO
2 3
SO3
H2C=CH-CH=CH2
例析离域π键
6 4
BF3
4 3
SO2
4 3
O3
6 6
C6H6
2个
4 3
CO2
HN3 sp sp sp2
例析离域π键
4 3
5 3
2个
4 3
6 5
NO
2
ClO2 OCN-
N2O3
例析离域π键
CC
26 26
CH
3个 6 6
C+
18 19
环状多烯烃类。它们有的很稳定,有的不稳定。有
的在自然界存在,有的是实验室间接证明的东西。
命名或书写时通常是把成环碳原子数置于词前并 定在方括弧内,例如苯可以看作是[6]轮烯,环辛 四烯是[8]轮烯,但一般是把较大的环称作轮烯。
这类化合物如果是在一个平面上并含有4n+2π 电子的应具有芳香性。
(1)环丁二烯
H
H
H
H
+
+
H
H
(2) 环丁二烯双正离子
按照Hückel规则,环丁二烯双正离子 应具有芳香性。如下列化合物
芳香性与休克尔规则PPT课件

C60的体积与病毒活性中心的孔穴大小相匹配,有可能 堵住洞口,切断病毒的营养供给。研究表明:富勒烯 类化 合物在抗爱滋病毒,酶活性抑制、切割DNA、光动力学治 疗等方面具有独特的功效。富勒烯化合物在生化、医学、 药物学等领域具有良好的应用前景。
.
15
它无芳香性。
.
12
作业
P67 作业本 3(单数) 、4、6、9、 10(写出相关方程式)
自己做 3(双数)、 5、7、8、12
.
13
.
14
三维球形芳香分子——富勒烯 C60
C60是由60个碳原子组成的球型分 子,包含12个五元环和20个六元环。其 分子中的杂化轨道界于石墨的sp2和金 刚石sp3杂化之间,σ键沿球面方向, 而键则垂直分布在球的内外表面,形成 3维球状芳香分子。
第4.3节 芳香性与休克尔规则 ( aromatic and Hückel Ruቤተ መጻሕፍቲ ባይዱe)
主要内容 休克尔(Hückel)规则 重要的非苯型芳香烃
.
1
学习要求
1.理解和掌握非苯芳烃的休克尔 (E.Hückel)规则。
2.掌握几种具有芳香性环多烯
.
2
一 休克尔规则
例如:
6个π 电子 n=1
10个π 电子 n=2
环戊二烯负离子和环 庚三烯正离子稠合
78 6
54
1 2
3
天 蓝 色 片 状 固 体 , 熔 点 90° 含 10个 π电 子 , 成 环 C都 在 同 一 平 面 是 闭 环 共 轭 体 系 , 有 芳 性
抗菌和镇痛等作用。
.
11
只有环戊二烯负离子、环庚三烯正离子和环辛
四烯二负离子满足HÜ ckel规则,具有芳香性,其
芳香性、离域π键和休克尔规则 ppt课件

CH
3个 6 6
PPT课件
C+
18 19 33
休克尔规则
规则表明,对完全共轭的、单环的、平面多烯 来说,具有(4n+2)个 π电子(这里n是大于或等 于零的整数)的分子,可能具有特殊芳香稳定性。
每个C原子以SP2杂化,分别与两个
C及一个H原子成3个 键,剩余
一个p轨道,与杂化轨道垂直,N 原子SP2杂化,成三个单键,剩余
芳香性和同芳香性
PPT课件
1
一、 Hückel 4n+2规则
1931年,Hückel从分子轨道理论研究入手, 提出含有4n+2个π电子的平面共轭单环化合 物应具芳香性,这就是Hückel规则。
根据休克尔规则,非苯芳香化合物可以分成以 下几类
1.芳香离子
2.轮烯
3.并联环系化合物
H
CH3
H
CH33。-CCC++H3 即
H H
C
C+
CH HH
CH
H
9个 H 超 共 轭
H
CH3-CCHH+3 即 2。C+
H H
C
C+
H H CH
H
6个 H 超 共 轭
H
H
CH3-C+H2 即 H C C+
1。C+
H
H
H +CH3 即 H C+
H
3个H超共轭
∴ C+稳定性:3°>2°>1°>CH3+
PPT课件
17
(5)[14]轮烯
[14]轮烯在1960年就有人报道过。分子并 不很稳定。核磁共振显示有一定的反磁环流。
离域π键演示教学

离域π键
例析离域π键
NO
3
CO
2 3
SO3
H2C=CH-CH=CH2
例析离域π键
6 4
BF3
4 3
SO2
4 3
O3
பைடு நூலகம்
6 6
C6H6
2个
4 3
CO2
HN3 sp sp sp2
例析离域π键
4 3
5 3
2个
4 3
6 5
N
O
2
ClO2 OCN-
N2O3
例析离域π键
CC
26 26
CH
3个 6 6
许多教科书上把H3PO4的结构式表示为:
HO HO P O
HO
HO 或 HO P O
HO
(2) d-p π键的应用
(a) 可以解释共价分子几何构型
(SiH3)3N与(CH3)3N有不同的几何构型,前者为平 面三角形,后者为三角锥型。这是由于在(SiH3)3N中N 原子可以采取sp2杂化,未杂化的2p轨道(有一对孤对 电子对)可以“肩并肩”地与Si原子的3d空轨道重叠 而形成d-pπ键,使平面三角形结构得以稳定。 (CH3)3N中的C原子不存在d价轨道,所以N原子必须采 取sp3杂化,留给孤对电子对以合适的空间。
(b) 可以解释键角的变化
对于NH3与NF3,∠HNH>∠FNF, 而对于PH3与PF3,∠HPH<∠FPF。
两者是反序的,这是因为后者是由于F原子上 的孤对电子对占有P原子上的3d空轨道,增强了P原 子上的电子云密度,使成键电子对之间的排斥力增 大,所以键角变大。
此课件下载可自行编辑修改,仅供参考! 感谢您的支持,我们努力做得更好!谢谢
个单电子与OH基团形成三个σ键,第四个sp3杂化轨
例析离域π键
NO
3
CO
2 3
SO3
H2C=CH-CH=CH2
例析离域π键
6 4
BF3
4 3
SO2
4 3
O3
பைடு நூலகம்
6 6
C6H6
2个
4 3
CO2
HN3 sp sp sp2
例析离域π键
4 3
5 3
2个
4 3
6 5
N
O
2
ClO2 OCN-
N2O3
例析离域π键
CC
26 26
CH
3个 6 6
许多教科书上把H3PO4的结构式表示为:
HO HO P O
HO
HO 或 HO P O
HO
(2) d-p π键的应用
(a) 可以解释共价分子几何构型
(SiH3)3N与(CH3)3N有不同的几何构型,前者为平 面三角形,后者为三角锥型。这是由于在(SiH3)3N中N 原子可以采取sp2杂化,未杂化的2p轨道(有一对孤对 电子对)可以“肩并肩”地与Si原子的3d空轨道重叠 而形成d-pπ键,使平面三角形结构得以稳定。 (CH3)3N中的C原子不存在d价轨道,所以N原子必须采 取sp3杂化,留给孤对电子对以合适的空间。
(b) 可以解释键角的变化
对于NH3与NF3,∠HNH>∠FNF, 而对于PH3与PF3,∠HPH<∠FPF。
两者是反序的,这是因为后者是由于F原子上 的孤对电子对占有P原子上的3d空轨道,增强了P原 子上的电子云密度,使成键电子对之间的排斥力增 大,所以键角变大。
此课件下载可自行编辑修改,仅供参考! 感谢您的支持,我们努力做得更好!谢谢
个单电子与OH基团形成三个σ键,第四个sp3杂化轨
离域大派键ppt课件

2-5共轭大π键
π键:原子轨道垂直核间联线并相互平行
进行同号重叠(肩并肩)。
1
1、苯分子中的p-p大π键
H
H
C
H
C
C
C
C
H
C
H
H
苯的结构式里的碳-碳键有单键和双键之分,这
种结构满足了碳的四价,可是事实上苯分子的单键 和双键的键长和键能并没有区别,苯的结构式并不 能反映这个事实。用形成p-p大键的概念可以解决 这个矛盾。
2、丁二烯中p-p大π键
3、CO2分子里的大π键
CO2的碳原子取sp杂化轨道,它的两个未参加杂 化的p轨道在空间的取向是跟sp杂化轨道的轴相 互垂直。CO2分子里有两套3原子4电子符号为 34的p-p大键。
OCO OCO O C O
4、杂C化碳O形3酸2–式离根,子离碳中子原的属子大于上πAY键有3型一分个子垂,直中于心分碳子原平子面取的spp2 轨道;端位的3个氧原子也各有1个垂直于分子平 面的p轨道;分子的总价电子数等于24,3个C- Os键有6个电子,每个氧原子上有2个不与分子平 面垂直的孤对电子对,因此4个平行p轨道中共有 2道4-66电-3子×p4-=p6大个电键子,,符所号以为CO4362。–离子中有1个4轨
O
C OO
O
C OO
5、O3分子里的大π键
O3分子的中心O原子采取sp2杂化,和两 个端位O原子形成两个s键,另外中心O原 子和配位O原子都有p轨道,共有4个电子, 小于轨道数的两倍6,满足上述条件即可形 成离域Π34键。
O OO
O OO
6、石墨分子结构是层形结构,每层是由无限 个碳 六元环所形成的平面,其中的碳原子取sp2杂化, 与苯的结构类似,每个碳原子尚余一个未参与杂化 的p轨道,垂直于分子平面而相互平行。平行的n个 p轨道形成了一个p-p大键。n个电子弥散在整个 层键的中n可个以碳自原由子移形动成,的所大以石键墨里能,导电电子。在这个大pnn
π键:原子轨道垂直核间联线并相互平行
进行同号重叠(肩并肩)。
1
1、苯分子中的p-p大π键
H
H
C
H
C
C
C
C
H
C
H
H
苯的结构式里的碳-碳键有单键和双键之分,这
种结构满足了碳的四价,可是事实上苯分子的单键 和双键的键长和键能并没有区别,苯的结构式并不 能反映这个事实。用形成p-p大键的概念可以解决 这个矛盾。
2、丁二烯中p-p大π键
3、CO2分子里的大π键
CO2的碳原子取sp杂化轨道,它的两个未参加杂 化的p轨道在空间的取向是跟sp杂化轨道的轴相 互垂直。CO2分子里有两套3原子4电子符号为 34的p-p大键。
OCO OCO O C O
4、杂C化碳O形3酸2–式离根,子离碳中子原的属子大于上πAY键有3型一分个子垂,直中于心分碳子原平子面取的spp2 轨道;端位的3个氧原子也各有1个垂直于分子平 面的p轨道;分子的总价电子数等于24,3个C- Os键有6个电子,每个氧原子上有2个不与分子平 面垂直的孤对电子对,因此4个平行p轨道中共有 2道4-66电-3子×p4-=p6大个电键子,,符所号以为CO4362。–离子中有1个4轨
O
C OO
O
C OO
5、O3分子里的大π键
O3分子的中心O原子采取sp2杂化,和两 个端位O原子形成两个s键,另外中心O原 子和配位O原子都有p轨道,共有4个电子, 小于轨道数的两倍6,满足上述条件即可形 成离域Π34键。
O OO
O OO
6、石墨分子结构是层形结构,每层是由无限 个碳 六元环所形成的平面,其中的碳原子取sp2杂化, 与苯的结构类似,每个碳原子尚余一个未参与杂化 的p轨道,垂直于分子平面而相互平行。平行的n个 p轨道形成了一个p-p大键。n个电子弥散在整个 层键的中n可个以碳自原由子移形动成,的所大以石键墨里能,导电电子。在这个大pnn
