化学-必修二-元素周期律
化学必修二_元素周期表课件

§1
元素周期表
C
K、Ca、P
Na Cl
(一)元素周期表的历史
1.第一张元素周期表 (1)时间: 1869年 (2)绘制者: 俄国化学家——门捷列夫 (3)排序依据:将元素按照相对原子质量由小到大依次排列 (4)结构特点:将化学性质相似的元素放在一个纵行
[思考与交流](观察元素周期表 )
稀有气体元 素
ⅠA
0
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
主族序数=最外层电子数
总结:
短周期
第 1周期
第 2周期 第 3周期 第 4周期
—— 2 种 —— 8 种 —— 8 种
周期
(7个) 长周期 不完全 周期 主族
—— 18 种
—— 18 种
第 5周期 第 6周期 第 7周期
—— 32 种
—— 26 种
• 我们按照元素在周期表中的顺序给元素编号, 得到原子序数。
1-18号元素原子结构示意图
原子序数=核电荷数=质子数=核外电子数
周 期
1
2
3
周期数=电子层数
(2)族(纵行)
1) 主族: 由短周期元素和长周期元素共同构成的族。
七主七副八和0
表示方法:在罗马数字表示的族序数后面标“A” 字。 Ⅰ A、ⅢA、… 2) A、Ⅱ 副族: 完全由长周期元素构成的族。 表示方法:在族序数后标“B”字。如ⅠB、ⅡB、 ⅢB、… 3) 第VⅢ族: (“八、九、十” 三个纵行) 4) 0族:
( D)
6 14 31 32
7
练习:
1.已知碳元素、镁元素和溴等主族元素的原子 结构示意图:
它们分别位于周期表的什么位置?
高中化学必修二物质结构元素周期律知识点总结_

高中化学必修二物质结构元素周期律知识点总
结_
三、元素周期律
1.元素周期律:元素的性质(核外电子排布、原子半径、主要化合价、金属性、非金属性)随着核电荷数的递增而呈周期性变化的规律。
元素性质的周期性变化实质是元素原子核外电子排布的周期性变化的必然结果。
2.同周期元素性质递变规律
第ⅠA族碱金属元素:Li Na K Rb Cs Fr (Fr是金属性最强的元素,位于周期表左下方)
第ⅦA族卤族元素:F Cl Br I At (F是非金属性最强的元素,位于周期表右上方)
★判断元素金属性和非金属性强弱的方法:
(1)金属性强(弱)①单质与水或酸反应生成氢气容易(难);②氢氧化物碱性强(弱);③相互置换反应(强制弱)Fe+CuSO4=FeSO4+Cu。
(2)非金属性强(弱)①单质与氢气易(难)反应;②生成的氢化物稳定(不稳定);③最高价氧化物的水化物(含
氧酸)酸性强(弱);④相互置换反应(强制弱)2NaBr+Cl2=2NaCl+Br2。
(Ⅰ)同周期比较:
比较粒子(包括原子、离子)半径的方法:(1)先比较电子层数,电子层数多的半径大。
(2)电子层数相同时,再比较核电荷数,核电荷数多的半径反而小。
四、化学键
化学键是相邻两个或多个原子间强烈的相互作用。
1.离子键与共价键的比较
活泼金属与活泼非金属元素之间(特殊:NH4Cl、NH4NO3等铵盐只由非金属元素组成,但含有离子键)
非金属元素之间
离子化合物:由离子键构成的化合物叫做离子化合物。
(一定有离子键,可能有共价键)
共价化合物:原子间通过共用电子对形成分子的化合物叫做共价化合物。
(只有共价键)。
高中化学必修二易错知识点总结附答案

考前不言苦与累,易错知识必须背《必修2 》第一章 物质结构 元素周期律一、元素周期表与元素周期律1.元素周期表的结构⑴周期:元素周期表共有7个横行,每一横行称为一个周期,故元素周期表共有 7 个周期。
⑵族:元素周期表共有 18 个纵行,除了 8、9、10 三个纵行称为Ⅷ外,其余的每一个纵行称为一个 族 ,故元素周期表共有 16 个族。
族的序号一般用罗马数字表示。
2.质量数定义:将核内所有质子和中子的相对原子质量取近似整数值相加,所得的数值叫做质量数。
质量数与质子数和中子数间的关系为: 质量数=质子数+中子数3.核素表示方法:在化学上,我们为了方便地表示某一原子。
在元素符号的左下角表出其质子数,左上角标出质量数AZ X 。
符号A Z X 表示1个 质子数 为Z , 质量数 为A 的原子,其中子数为 A -Z 。
4.同位素⑴ 质子数 相同而 中子数 不同的同一元素的不同原子互称为同位素,如氢元素的三种不同核素11H 、2 1H 、3 1H 互为同位素。
⑵同位素的特点:①各同位素原子的化学性质相同,物理性质不同②天然存在的各同位素原子,他们所占的原子百分数保持不变5.元素金属性强弱判断依据:①根据金属单质与水或与酸反应 置换出氢的 难易程度。
置换出氢 越容易,则金属性越强。
【例】已知金属A 可与冷水反应,金属B 和热水才能反应,金属C 和水不能反应,判断金属A 、B 、C 金属性强弱 A>B>C②根据金属元素最高价氧化物对应水化物碱性强弱。
碱性越强,则原金属元素的金属性越强。
【例】已知NaOH为强碱、Mg(OH)2为中强碱、Al(OH)3为两性氢氧化物,则Na、Mg、Al的金属性强弱Na>Mg>Al③可以根据对应阳离子的氧化性强弱判断。
金属阳离子氧化性越弱,则元素金属性越强。
【例】氧化性Al3+﹥Mg2+﹥Na+,则元素金属性顺序为Na>Mg>Al6.元素非金属性强弱判断依据:①根据非金属单质与氢气反应的难易程度或氢化物的稳定性强弱判断,越容易与氢气反应或氢化物的稳定性越强,则非金属性越强。
高中化学必修二元素周期表规律总结

主要先认清主族与副族相应的金属性和非金属性就会了随着原子序数的增加,元素的性质呈周期性的递变规律:在同一周期中,元素的金属性从左到右递减,非金属性从左到右递增,在同一族中,元素的金属性从上到下递增,非金属性从上到下递减;同一周期中,元素的最高正氧化数从左到右递增(没有正价的除外),最低负氧化数从左到右逐渐增高;同一族的元素性质相近。
主族元素同一周期中,原子半径随着原子序数的增加而减小。
同一族中,原子半径随着原子序数的增加而增大。
如果粒子的电子构型相同,则阴离子的半径比阳离子大,且半径随着电荷数的增加而减小化合价一价氢氯钾钠银,二价氧钙钡镁锌。
三铝四硅五价磷,二三铁二四碳,莫丢二三四五氮,铜汞二价最常见,单质零价记心间。
常见原子团化合价口决负一硝酸氢氧根(硝酸根NO3- ,氢氧根OH-),负二硫酸碳酸根(硫酸根【SO4】2-碳酸根【CO3】2-),还有负三磷酸根(【PO4】3-),只有铵根(NH4+)是正一记金属活动性顺序表可以按照下面的口诀来记:钾钙钠镁铝、锌铁锡铅氢、铜汞银铂金。
周期表分行列,7行18列,行为周期列为族。
周期有七,三短(1,2,3)三长(4,5,6)一不全(7),2 8 8 18 18 32 32满6、7镧锕各15。
族分7主7副1Ⅷ零,长短为主,长为副。
1到8重复现,2、3分主副,先主后副。
Ⅷ特8、9、10,Ⅷ、副全金为过渡。
==================================================== =============结合元素周期表,元素周期律可以表述为:元素的性质随着原子序数的递增而呈周期性的递变规律。
元素周期律的本质:元素核外电子排布的周期性决定了元素性质的周期性。
元素周期律的内容:原子半径变化示意图一、原子半径同一周期(稀有气体除外),从左到右,随着原子序数的递增,元素原子的半径递减;同一族中,从上到下,随着原子序数的递增,元素原子半径递增。
必修二第一章物质结构元素周期律知识点总结
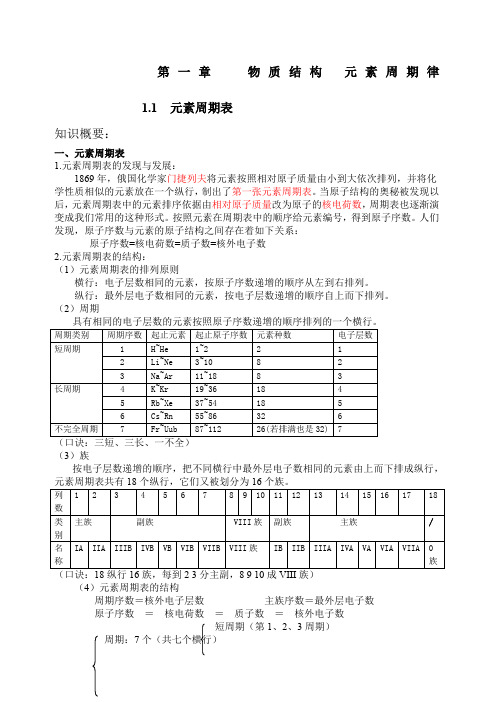
第一章物质结构元素周期律1.1 元素周期表知识概要:一、元素周期表1.元素周期表的发现与发展:1869年,俄国化学家门捷列夫将元素按照相对原子质量由小到大依次排列,并将化学性质相似的元素放在一个纵行,制出了第一张元素周期表。
当原子结构的奥秘被发现以后,元素周期表中的元素排序依据由相对原子质量改为原子的核电荷数,周期表也逐渐演变成我们常用的这种形式。
按照元素在周期表中的顺序给元素编号,得到原子序数。
人们发现,原子序数与元素的原子结构之间存在着如下关系:原子序数=核电荷数=质子数=核外电子数2.元素周期表的结构:(1)元素周期表的排列原则横行:电子层数相同的元素,按原子序数递增的顺序从左到右排列。
纵行:最外层电子数相同的元素,按电子层数递增的顺序自上而下排列。
(2)周期(3)族按电子层数递增的顺序,把不同横行中最外层电子数相同的元素由上而下排成纵行,(4)元素周期表的结构周期序数=核外电子层数主族序数=最外层电子数原子序数=核电荷数=质子数=核外电子数短周期(第1、2、3周期)周期:7个(共七个横行)周期表长周期(第4、5、6、7周期)主族7个:ⅠA-ⅦA族:16个(共18个纵行)副族7个:IB-ⅦB第Ⅷ族1个(3个纵行)零族(1个)稀有气体元素(5)认识周期表中元素相关信息随堂检测(一)1.已知某主族元素的原子结构示意图如下,判断其位于第几周期?第几族?2.主族元素在周期表中的位置取决于该元素的()A.相对原子质量和核外电子数B.电子层数和最外层电子数C.相对原子质量和最外层电子数D.电子层数和次外层电子数3.下列各表为周期表的一部分(表中为原子序数),其中正确的是()A.B.C.D.4.,同一周期ⅡA、ⅢA的两种元素的原子序数差可能为几?5.已知元素的原子序数,可以推断元素原子的()①质子数②核电荷数③核外电子数④离子所带电荷数A.①③B.②③C.①②③D.②③④6.由长周期元素和短周期元素共同构成的族是()①0族②主族③副族④第Ⅷ族A.①②B.①③C.②③D.③④7.下列说法中正确的是()A.现行元素周期表是按相对原子质量逐渐增大的顺序从左到右排列的B.最外层电子数相同的元素一定属于同一族C.非金属元素的最外层电子数都≥4D.同周期元素的电子层数相同二、元素的性质与原子结构1.碱金属元素:从原子结构上看:相同点:最外层都只有一个电子。
人教版高中化学必修二《元素周期律》课件

2.化合价指的是一定数目的一种元素的原子与一定 数目的其他元素的原子化合的性质,元素化合价的数值与 原子的电子层结构,特别是最外层电子数有关。例如,稀 有气体原子核外电子排布已达稳定结构,既不易得到电子 也不易失去电子,所以稀有气体元素的常见化合价为0。 镁原子最外层只有2个电子,容易失去这两个电子而达到 稳定结构,因此镁元素在化合物中通常显+2价;氯原子 最外层有7个电子,只需得到1个电子便可达到稳定结构, 因此氯元素在化合物中可显-1价。
原子的核外电子排布,特别是最外层电子数决定着元 素的主要化学性质。从初中所学知识我们知道,金属元素 的原子最外层电子数一般少于4个,在化学反应中比较容 易失去电子,达到相对稳定结构;而非金属元素的最外层 一般多于4个电子,在化学反应中易得到电子而达到8个电 子的相对稳定结构。原子得到或失去电子后的阴、阳离子 也可用结构示意图来表示。
层,弧形上的数字表示该层的电子数。
二、元素性质与原子核外电子排布的关系 1.最外层电子数排满8个(He为2个)形成稳定结构, 不易得失电子,化学性质稳定。
最外层电子较少的(<4)易失去电子,达到稳定结构, 表现出金属性;最外层电子较多的(>4)易得电子或形成共 用电子对,从而形成稳定结构,表现出非金属性。通常, 我们把最外层8个电子(只有K层时为2个电子)的结构,称 为相对稳定结构,一般不与其他物质发生化学反应。当元 素原子的最外层电子数小于8(K层小于2)时,是不稳定结 构。在化学反应中,具有不稳定结构的原子,总是“想方 设法”通过各种方式使自己的结构趋向于稳定结构。
3.画出下列微粒的结构示意图 C________ O________ Al3+________ Si________ Cl-________ Ar________ K________ Ca________
人教版化学必修二元素周期律优秀ppt

人教版化学必修二1.2元素周期律_课 件(共42 张PPT)
●折线左面是金属元素,右面是非金属元素 ●左下金属性最强元素,右上非金属性最强元素 ●金属非金属元素无严格界限 ●分界限附近元素既能表现某些金属性,也能表
现某些非金属性
人教版化学必修二1.2元素周期律_课 件(共42 张PPT)
人教版化学必修二1.2元素周期律_课 件(共42 张PPT)
原子序数越大,半径越小(稀有气体除外)
如: r( Na)>r(Mg)>r(Al)>r(Si)>r(P)>r(S)>r(Cl)
③电子层结构相同的不同粒子半径: 核电荷数越大,半径越小
如: Ar型结构: S2-、Cl-、K+、Ca2+
r( S2-)>r(Cl-)>r(K+)>r(Ca2+)
练习
1、下列微粒半径之比大于1的是: BC
光照或点 燃,HCl 十分稳定
最高价氧 SiO2
P2O5
SO3
Cl2O7
化化物物及的水酸最高H价4Si氧O4 化物H的3PO水4 化物酸H2S性O4 增强 HClO4
性
弱酸
中强酸
强酸
最强酸
4.元素金属性和非金属性的周期性变化
金属性:从左到右逐渐减弱 非金属性:从左到右逐渐增强
三.比较粒子半径大小的规律
(2)核外电子排布与元素性质的关系
元素的原子半径由__质__子_数__、__电__子__层_数__决定 元素的化学性质主要由___最__外__层__电_子__数____决定 元素的化合价主要由_____最_外__层__电__子__数___决定 金属元素的原子最外层电子数一般少于4,易失电子
高中化学必修二 第一章 物质结构 元素周期律知识点(超全面)

第一章 物质结构 元素周期律第一节 元素周期表一、原子结构....1. 原子核得构成原子 A Z X核电荷数(Z) = 核内质子数 = 核外电子数 = 原子序数2、质量数将原子核内所有得质子与中子得相对质量取近似整数值加起来,所得得数值,叫质量数。
XA Z ——元素符号质量数——核电荷数——(核内质子数)表示原子组成的一种方法a ——代表质量数;b ——代表质子数既核电荷数;c ——代表离子的所带电荷数;d ——代表化合价e ——代表原子个数请看下列表示a b+dXc+e质量数(A)= 质子数(Z)+ 中子数(N)阳离子 a W m+ :核电荷数=质子数>核外电子数,核外电子数=a -m阴离子 b Y n -:核电荷数=质子数<核外电子数,核外电子数=b +n补充:1、原子就是化学变化中得最小粒子;2、分子就是保持物质得化学性质中得最小粒子;3、元素就是具有相同核电荷数即核内质子数得一类原子得总称二、核素、同位素......1、定义:核素:人们把具有一定数目质子与一定数目中子得一种原子称为核素。
同位素:质子数相同而中子数不同得同一元素得不同核素(原子)互为同位素。
2、同位素得特点 ①化学性质几乎完全相同原子核核外电子 Z 个中子 (A -Z)个质子 Z 个②天然存在得某种元素,不论就是游离态还就是化合态,其各种同位素所占得原子个数百分比(即丰度)一般就是不变得。
练习:1、法国里昂得科学家最近发现一种只由四个中子构成得粒子,这种粒子称为“四中子”,也有人称之为“零号元素”。
下列有关“四中子”粒子得说法不正确得就是( )A.该粒子不显电性B.该粒子质量数为4C.与氢元素得质子数相同D.该粒子质量比氢原子大2、已知A2-、B-、C+、D2+、E3+五种简单离子得核外电子数相等,与它们对应得原子得核电荷数由大到小得顺序就是___________ 。
3、现有b X n-与aY m+两种离子,它们得电子数相同,则 a 与下列式子有相等关系得就是( )(A)b-m-n (B) b+m+n(C)b-m+n (D) b+m-n4、某元素得阳离子R n+,核外共用x个电子,原子得质量数为A,则该元素原子里得中子数为( )(A)A-x-n (B)A-x+n (C)A+x-n (D)A+x+n三、元素周期表得结构........1、编排原则:①按原子序数递增得顺序从左到右排列②将电子层数相同......得各元素从左到右排成一横行..。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第一章物质结构元素周期律单元检测试题一、单项选择题(本题包括12小题,每小题只有一个选项符合题意,每小题3分,共36分)( )1.元素周期表里金属元素和非金属元素分界线附近能找到A.新制农药元素 B.制催化剂元素C.制半导体元素D.制耐高温合金元素( )2.YBa2Cu8O x(Y为元素钇)是磁悬浮列车中的重要超导材料,关于8939Y的说法不正确的是A.钇元素属于金属B.质子数与中子数之差为50C.原子的核外电子数是39 D.8939Y和9039Y是两种不同的核素()3.下列说法正确的是A.形成离子键的阴阳离子间只存在静电吸引力B.HF、HCL、HBr、HI的热稳定性和还原性从左到右依次减弱C.第三周期非金属元素含氧酸的酸性从左到右依次增强D.元素周期律是元素原子核外电子排布周期性变化的结果( )4.下列说法正确的是A.第ⅠA族元素的金属性比第ⅡA族元素的金属性强B.第ⅥA族元素的氢化物中,稳定性最好的其沸点也最高C.同周期非金属氧化物对应的水化物的酸性从左到右依次增强D.第三周期元素的离子半径从左到右逐渐减小()5.(2012届惠州市第一次调研)X、Y、Z是三种短周期的主族元素,在周期表的位置如图,X原子的最外层电子数是其次外层电子数的3倍,下列说法正确的是A.原子半径:Y >Z >XB.气态氢化物的热稳定性:X<ZC.Y和Z的最高价氧化物对应水化物均为强酸D.若Z的最高正价为+m,则X的最高正价也一定为+m( )6.X、Y、Z三种非金属元素具有相同的电子层数,它们的气态氢化物的稳定性强弱顺序是XH3<H2Y<HZ,下列说法中正确的是A.原子序数X>Y>Z B.原子得电子能力X<Y<ZC.原子半径X<Y<Z D.离子还原性X3-<Y2-<Z-()7.(2010揭阳市第二次高考模拟考试)元素X、Y、Z原子序数之和为37,X、Y在同一周期,X+与Z-具有相同的核外电子层结构。
下列推测不正确...的是A.同周期元素中X的金属性最强B.原子半径X>Y,离子半径X+>Z-C.同族元素中Z的氢化物稳定性最高D.同周期元素中Y的最高价含氧酸的酸性最强()8.(2010届广东六校12月联考)下列说法中正确的是A.ⅠA、ⅡA族元素的原子,其半径越大,越难失去电子B.元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素C.原子及其离子的核外电子层数等于该元素所在的周期数D.所有主族元素的原子,都能形成单原子离子( )9.X、Y、Z是3种短周期元素,其中X、Y位于同一族,Y、Z处于同一周期。
X原子的最外层电子数是其电子层数的3倍。
Z原子的核外电子数比Y原子的少1。
下列说法正确的是A.元素非金属性由弱到强的顺序为Z<Y<XB.Y元素最高价氧化物对应水化物的化学式可表示为H3YO4C.3种元素的气态氢化物中,Z的气态氢化物最稳定D.原子半径由大到小的顺序为Y>Z>X()10.(2010年深圳一模)短周期元素A、B、C的原子序数依次递增,三者原子最外层电子数之和为14,A原子的次外层电子数等于B原子的最外层电子数,A与C同主族。
则下列叙述正确的是A.原子半径:A<B<C B.氢化物稳定性:A<CC.B与A的化合物比B与C的化合物熔点低 D.A与C的化合物属于大气污染物()11.(执信中学2010届期中考试)元素周期表的第7周期称为不完全周期,若将来发现的元素把第7周期全排满,则下列推论错误..的可能性最大的是A .该周期有32种元素B .该周期的元素,原子序数最大为118C .该周期的ⅦA 族元素是金属元素D .该周期的ⅢA 族元素的氢氧化物具有两性 ( )12A .M 与T 形成的化合物具有两性B .单质与稀盐酸反应的速率为L<QC .氢化物的热稳定性为H 2T<H 2RD .氢化物的沸点为H 2T<H 2R二、双项选择题(本题包括6小题,每小题只有一个选项符合题意,每小题4分,共24分) ( )13.(2011届高三第一次六校联考)如右图为元素F 、S 、Cl 在周期表中的位置,关于F 、S 、Cl 的说法正确的是 A .非金属性:F > S > Cl B .原子半径:Cl > S > FC .稳定性:HF > HCl > H 2SD .酸性:HClO 4 > H 2SO 4( )14.(2011年广州天河一模)下列判断错误..的是 A .稳定性:HF >H 2O > H 2S B .沸点:Cl 2> Br 2> I 2 C .酸性:42434HClO H SO H PO >> D .原子半径:F>Na>Si( )15.(2010茂名一模)X 、Y 和Z 是短周期元素组成的三种单质,X 的组成元素是第三周期原子半径最大的元素;Y 和Z 均由元素R 组成,Y 由两个原子组成,R 最外层电子数是内层电子数的3倍,下列推断正确的是A . Y 和Z 互为同位素B . X 和Y 能化合成两种化合物C . X 和Y 化合的产物中一定不含有共价键D .X 离子比R的离子半径小 ( )16.(佛山一中2011届10月月考)短周期元素A 、B 、C 原子序数依次递增,它们的原子的最外层电子数之和为10。
A 与C 在周期表中同主族,B 原子最外层电子数等于A 原子次外层电子数。
下列叙述正确的是A .原子半径B >C >A B .氧化物的熔点B >A C .A 与C 能形成离子化合物D .氢化物的稳定性C >A ( )17.(2010广雅中学高三期中)短周期元素A 、B 、C 、D 的原子序数依次递增,它们的核电荷数之和为32,原子最外层电子数之和为10。
A 与C 同主族,B 与D 同主族,A 、C 原子的最外层电子数之和等于B 原子的次外层电子数。
则下列叙述正确的是 A .D 元素处于元素周期表中第3周期第IV 族 B .四种元素的原子半径:A<B<D<CC .B 、D 的最高价氧化物中,B 、D 与氧原子之间均为双键D .一定条件下,B 单质能置换出D 单质,C 单质能置换出A 单质( )18.(执信中学2010届高三期中考试) 短周期元素的离子a W 2+、b X +、c Y 2-、d Z -具有相同的电子层结构,下列推断正确的是A .热稳定性:H 2Y<HZB . 原子半径:W >X >Z >YC .离子半径:W 2+>Y2-D .碱性:XOH >W(OH)2 三、非选择题(本题包括4小题,共40分)(1)B在元素周期表的位置:_________;B气态氢化物的电子式________________(2)C的最高价氧化物分别与强酸、强碱反应的离子方程式为;。
(3)D的单质与A的一种氢化物反应生成具有漂白性的物质的化学方程式为__________________________ 20.已知A、B、C、D、E是短周期元素,原子序数依次增大。
其中A、E的单质在常温下呈气态,B的原子最外层电子数是其电子层数的2倍,C在同周期主族元素中原子半径最大,D的合金是日常生活中常用的金属材料。
下列说法正确的是(1)E在元素周期表的位置:______;B的最高价氧化物电子式________________ (2)C、D的最高价氧化物对应的水化物之间发生化学方程式为(3)化合物AE含有______________键,CE含有____________键。
(1)⑤和⑩的元素符号是______和_______;写出⑤的氧化物的一种用途。
(2)表中最活泼的金属是______,非金属性最强的元素是______;(填写元素符号);(3)表中能形成两性氢氧化物的元素是_________,分别写出该元素的氢氧化物与⑥、⑨的最高价氧化物对应水化物反应的离子方程式:____________________________________________________________,__________________________________________;22.(汕头金山中学2011届高三上学期期末考)下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题:(1)④⑤⑥的原子半径由小到大的顺序为(用元素符号表示)。
②③⑦的最高价含氧酸的酸性由弱到强的顺序是(用化学式表示)___________ 。
(2)写出由以上①④⑤元素构成的化合物的电子式______________________;该化合物含有的化学键类型有__________________ 。
19:(1)第二周期V A族(2)Al2O3+6H+=2Al3++3H2O Al2O3+2OH-=2AlO2-+H2O(3)Cl2+H2O=HCl+HClO Cl2+H2O2=2HCl+O220(1)第三周期VIIA族(2)Al(OH)3+NaOH= NaAlO2+2H2O。
(3)共价离子21:(1)Si;Br;生产光导纤维(制坩埚、玻璃、陶瓷等)。
(2)K;F;(3)Al;2Al(OH)3+6H+ = 2Al3++6H2O;Al(OH)3+OH-= AlO2-+2H2O。
22:(1)O<Al<Na(2分) H2SiO3 <H2CO3 <HNO3(2分)(2)Na+[ O H]- (2分)、离子键、共价键(或极性共价键)(2分)。
