化学反应工程基本概念
化学反应工程及其在化工生产中的应用

化学反应工程及其在化工生产中的应用化学反应工程是化学工程的重要分支之一,它主要研究化学反应的物质平衡、能量平衡和动力学规律等方面,以设计、优化和控制化工生产过程。
在化工生产中,化学反应工程发挥着重要作用,为化工产品的制备提供了基础支撑。
一、化学反应工程的基本概念及分类1.基本概念化学反应是指物质在特定条件下发生物化学变化。
化学反应工程就是将这种变化转化为实际工业产品的过程。
化学反应工程涉及到反应的化学性质、反应条件、反应器的设计及控制等方面,需要多学科知识交叉的综合运用。
最终的目标是在合适的反应条件下获得适宜的反应产物。
2.分类化学反应工程按照反应相的不同,可以分为气-液相反应、液-液相反应、气-固相反应和液-固相反应等几种。
其中,液-液相反应是最常见的反应形式之一。
化学反应工程还可以根据反应器类型进行分类,例如批量反应、连续反应和半连续反应等。
二、化学反应工程在化工生产中的应用化学反应工程在化工生产中广泛应用。
以下列举几个典型案例:1.甲醇合成反应甲醇合成反应是化学反应工程中的一大典型反应,它广泛应用于各种工业领域。
该反应是一种四反应组合,其中利用吸热和排放热来维持反应过程的温度和动力学平衡。
由于该反应的揭示机制非常复杂,因此需要多个化学工程师和研究人员共同合作研究来优化反应条件和提高反应效率。
2.碳酸氢盐合成碳酸氢盐合成反应是化学反应工程中一个较为简单的反应,它的化学式为NaHCO3 + HCl → NaCl + CO2 + H2O。
该反应可以大量应用于制药、化妆品制造、清洁剂生产等行业。
它的主要优势是反应条件简单,操作便捷,可大批量生产。
3.烟酸合成烟酸的合成是化学反应工程中较为复杂的一种反应。
它涉及到多个组分的反应和催化反应。
由于烟酸对人体有很好的保健作用,因此其制造是十分有价值的。
烟酸的合成反应需要很长时间的优化,以确定最佳的反应条件和反应器参数,达到最好的反应效果。
4.甘油合成甘油合成反应是一种经济实惠的生产反应,经常应用于生物燃料和化妆品工业。
化学反应工程课件

3、简化模型的要求:
(1)不失真; (2)能满足应用的要求;
(3)能适应当前实验条件,以便进行模型鉴别和参数估值; (4)能适应现有计算机的能力;
4 、基础数学模型
1)化学动力学模型:排除传递过程因素后描述化学反应速
率、物料温度和浓度的数学关系。传统上是物理化学的 研究领域,侧重于研究反应机理;化学反应工程侧 重于 表达三者的数学关系,而直接加以应用。
(3)反应过程的优化:投资少、效率高、生产强度大、产 品质量好。 设计最佳化——反应器体积最小,投资少。 操作最佳化——管理、控制最佳化,最佳操作参数。
(4)反应器的工程放大: 对现成的生产工艺,进行生产规模放大; 新产品研发:小试——中试——扩大试验;
反应过程开发放大方法
• 逐级经验放大法
• 相似放大法
1 、化学工程发展史及化学反应工程学科的形成
• 化学工程学科体系的基本内容:
化学工程共同的现象,可概括为“三传一反”,即动 量传递、热量传递、质量传递及化学反应,其学科形成了 以传递过程及化学反应工程为核心的学科体系(包括化工 热力学、化工单元过程、分离工程、化工系统工程等)
过程工程
• 过程工程(process engineering)的概念是对“化学工程” 概念的拓展。化学工程学在发展过程中不断向科技新领域 渗透拓展,应用对象已经涵盖了所有与物质的物理、化学 加工过程相联系的工业部门,这个部门称为“过程工业” (process industry),包括石油炼制、化学工业、能源 工业、航空、军事、冶金、环保工业、建材、印染、生物 技术、医药、食品、造纸等工业部门。
2 、化学反应器
在这类设备中发生了化学反应,通过化学反应改变了物 料的化学性质。 化工生产过程是由物理过程和化学反应过程组成的。化 工设备分为“物理型”和化学反应器两大类。在化学反应器 中发生化学反应,由原料转换成产物,是化工生产的核心设 备。
化学反应工程知识点梳理
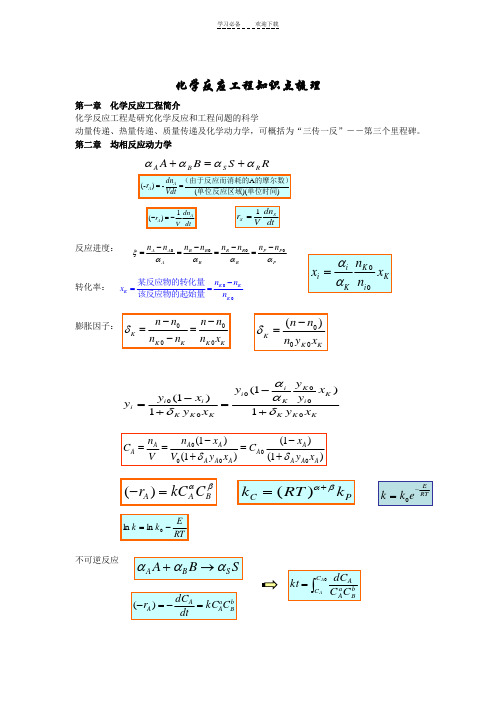
化学反应工程知识点梳理第一章化学反应工程简介化学反应工程是研究化学反应和工程问题的科学动量传递、热量传递、质量传递及化学动力学,可概括为“三传一反”--第三个里程碑。
第二章均相反应动力学反应进度:转化率:膨胀因子:不可逆反应A(-)-()()AAdnrVdt==(由于反应而消耗的的摩尔数)单位反应区域单位时间RSBARSBAαααα+=+1()AAdnrV dt-=-dtdnVr SS1=PPPRRRBBBAAAnnnnnnnnααααξ0-=-=-=-=K KKKn nxn-==某反应物的转化量该反应物的起始量KiKKiixnnxαα=0000KK K K Kn n n nn n n xδ--==-00()KK Kn nn y xδ-=KKKKiKKiiKKKiii xyxyyyxyxyy1)1(1)1(δααδ+-=+-=000(1)(1)(1)(1)A AA AA AA A A A A An xn xC CV V y x y xδδ--===++()A A Br kC Cαβ-=()C Pk RT kαβ+=ERTk k e-=RTEkk-=lnlnSBASBAααα→+bBaAAACkCdtdCr=-=-)(⎰=0AACC bBaAACCdCkt均相催化反应 CC 为催化剂浓度自催化反应A + C → 2C + R …串联反应总收率瞬时收率得率yield总选择性 目的产物P 所生成的摩尔数与副产物S 生成的摩尔数之比,用S0表示:平行反应串联反应()()AA C A dC r kC C dt-=-=CA A A C kCdt dCr =-=-)(A + B P R+S 00PP P A A n n n n -Φ=-/()/p P P A A A r dC dt dC P A r dC dt dC φ====---单位时间内生成的摩尔数单位时间内消耗的摩尔数00/)(A P P P n n n X -=000PP S S n n S n n -=-αA2A αS S (副)αA1A αP P (主),11A A r k C -=(),22A A r k C -=(),1,212()()AA A A A dC r r r k k C dt-=-+-=+=()()A A P A A p P P C k r dt dC r 11,1,1,)(αααα-=--==AA S S S C k dt dC r 22,αα-==tk k A A eC C )(021+-=A P S (均为一级反应)k 1k 2P A P P C k C k dt dC r 21-==PSS C k dt dC r 2==第三章 理想均相反应器 间歇反应器(BSTR)反应时间实际操作时间(operating time)= 反应时间(t) + 辅助时间auxiliary time (t') 反应体积V 是指反应物料在反应器中所占的体积 V = v0 (t + t')为装料系数(the volume charge coefficient),通常在0.4~0.85平推流反应器PFR 空时全混流反应器(CSTR)绝热操作恒容间歇反应器的设计式为:变温平推流反应器⎰⎰--=-=A A A C C A Ax A A A r dC r dx C t 0)()(00等容过程,液相反应 VV ϕ=实际实际的反应器体积为:0V v τ==反应器的容积进料的体积流量0R V dV t v ==⎰反应器中物料反应期的容积的体积流量000()()A A A AA A C C C x V v r r τ-===--0()A A A x V F r =-005000024R R R F v C M ==⨯00000000()(1)A A A A A A x x x A AA A A A E nx x x n n A ART A A dx dx dx t C C C r kC k e C x -===--⎰⎰⎰1001()A A x A A n xA t I x dx k C -=⎰20()()4A A A P A F dx r dV r D dl π=-=-20()4A A A dx D r dl F π-=00000()A x A A A A A dx V V F r v C C τ===-⎰化学反应工程研究的目的是实现工业化学反应过程的优化 全混流平推流多级CSTR 串联的优化对于一级不可逆反应应有PFR: 同间歇釜CSTR:全混流反应器的热衡算方程第四章 非理想流动 停留时间分布()⎰-==A x AAA B A B r dx C t F V 000BR : ()⎰-==Ax A AA P A P r dxCF V 000τPF R: ()000m m A A A A V x F C r τ-==-CST R: 112100010200...(1)(1)(1)Am Am A A A R A A A A A A Am x x x x x V v C kC x kC x kC x -⎛⎫---=+++ ⎪---⎝⎭0121110(1,2,.....1)(1)1Ai RAi Ai Ai v x V i m x k x x -+⎡⎤-∂=-==-⎢⎥∂--⎣⎦11111Ai Ai Ai Ai Ai Ai x xx x x x -++--=--221max 1max 02()k k k P P A C k X C k -==max max 1202211[(/)1]P P A C X C k k ==+1212ln(/)opt k k k k τ=-121opt k k τ=)()1())((0000Pm P P r A c v UAT T c v UA T c v H r V ρρρ+-+=∆--)()1(000P m P r c v UAT T c v UAT Q ρρ+-+= (){}E t P t residence time t t ∆=<<+停留时间分布函数 (){}=<F t P residence time t方差PFRCSTR最大层流流动 轴向扩散模型 0()()d t F t E t t=⎰22222()()()()()()t t t E t dtt t E t dt t E t dt tE t dtσ∞∞∞∞-==-=-⎰⎰⎰⎰0 t t () t t 0 t t E t <⎧⎪=∞=⎨⎪>⎩2220()()()0t t t E t dt t t σ∞=-=-=⎰0 t t () 1 t tF t <⎧=⎨≥⎩()11()t tt tF t e E t et---=-=222 1.0ttθσσ==22()()[2()]r r F t R R =-222/222()2()(1)212()(1)Z t uL E z z Pe tE Ee uL uL e Pe Peθσσ--==--=--。
化学反应工程

化学反应工程的范畴和任务
• 学反应工程学是一门研究化学反应的工程 问题的科学。既以化学反应作为 对象,就 必然要事握这些化学反应的特性;它又以 工程问题为其对象,-那就必须熟悉装置的 特性,并把这两者结合起来形成学科体系。
反应工程与其它学科的关系
化工热力学 计量化学 反应工程 反应动力学 化学工艺 催化剂 工程控制 传递过程
• ②中型实验
数学模型验证
大设备的设计
• ③数学模型的应用
• 放大的依据:相似论(相似准数Re、Pr、 Nu、Pe、Sc等)
•
综上所述,可见目前化学反应工程处理 问题的方法是实验研究和理论分析并举。 在解决新过程的开发问题时,可先建立 动力学和传递过程模型,然后再综合成 整个过程的初步的数学模型,根据数学 模型所作的估计来制定试验,特别是中 间试验方案,然后用试验结果来修正和 验证模型。
二级反应的速率方程式
如果有两反应物,而且初始浓度相等,并在反应过程 消耗的物质的量也相等. rA=kcA2或rA=kcA,02(1-xA)2
1 dnA rA V dt
kcA2=
dc A rA dt
dc A dt
双分子二级反应
分离变量: Kdt= -dcA/cA2 初始条件t=0, cB,0=cA,0,进行积分
反应过程和传递过程
实验只能测得NH3的主体浓度c0,当NH3浓度很小时: r0=k0c0 r=k0c0=kscs, k0c0=ks c0/ (ks/kga+1) k0=ks / (ks/kga+1) k0=1 / (1/kga+1/ks ) …………….……..p17:7-50式 此式表明实验测得的表面反应速率常数k0是化学反应 过程1/ks和扩散过程1/kga共同作用的结果.
化学反应工程的基本原理和应用

化学反应工程的基本原理和应用化学反应工程是一门研究化学反应过程、反应器设计和反应条件优化的学科。
其基本原理涉及到热力学、动力学、传热学和质量传递等多个方面。
在化学工业、制药工业、食品加工、环境保护等领域中,化学反应工程都得到了广泛的应用。
本文将介绍化学反应工程的基本原理和应用。
一、化学反应工程的基本原理1. 热力学基础热力学是研究物质热性质和能量转换的学科。
化学反应的方向、速率和平衡状态均与热力学有关。
在化学反应过程中,反应物和生成物的热力学性质会决定反应物和反应产物的物态和量。
在热力学中,常用的量有物态函数、能量、熵、焓和自由能等。
物态函数是指与温度、压力和物质量有关的函数。
比如,摩尔焓表示单位物质的能量和摩尔基本热容表示温度变化单位物质的热容。
熵表示物质分子的运动状态的无序程度,是一个复杂的物理量。
自由能是描述热力学过程能量变化的重要物理量。
2. 动力学基础动力学研究物质在时间上的变化。
化学反应的速率、动力学模型、反应路径等都与动力学有关。
在化学反应中,反应速率对于工艺过程的影响非常重要,主要受反应物浓度、反应温度、反应物质分子的能量等影响。
化学反应的速率常被表述为反应物消失和产物生成的速率。
反应速率与反应物质分子间的碰撞次数和碰撞的方式有关,速率常数是用来描述反应速率大小的参数。
通过测量反应物的消失和产物的生成速率,可以推导出化学反应的动力学模型和反应路径。
3. 传热学基础传热学是研究热量的传递过程和方法的学科,其研究内容包括传热传质的机理、传热传质的基本定律和传热传质的数学模型等。
在化学反应工程中,传热是一个非常重要的环节。
化学反应需要吸热或放热,传热的效率和传热方式会直接影响反应的温度和速率。
常见的传热方式包括传导、对流和辐射等。
传热系数是描述传热的重要参数,其大小受传热的方式、材料特性和流体性质等多个因素的影响。
4. 质量传递基础质量传递是气体、液体和固体之间物质的传递。
化学反应中会涉及到多种物质的质量传递,比如,反应物的输送、反应产物的分离和纯化等。
化学反应工程的定义

化学反应工程的定义
化学反应工程是一门研究化学反应过程的学科,它涉及到化学反应的设计、优化和控制,以及相关的反应器的设计和操作。
化学反应工程的目标是通过科学的方法和工程技术,实现化学反应的高效、安全和可持续发展。
化学反应工程主要包括以下几个方面的内容:
1. 反应过程的设计和优化:研究如何选择合适的反应条件(温度、压力、反应物浓度等)和催化剂,以提高反应的转化率、选择性和产率,同时降低能耗和废物产生。
2. 反应器的设计和操作:研究如何设计和选择合适的反应器类型(如批式反应器、连续流动反应器、固定床反应器等),以及反应器的尺寸、形状和内部结构,以实现理想的反应条件和反应效果。
3. 反应工艺的控制:研究如何实现反应过程的自动化和精确控制,包括反应温度、反应物添加速率、反应物浓度等参数的控制,以确保反应的稳定性和一致性。
4. 安全与环保:研究如何评估和管理化学反应过程中的安全风险,设计和实施安全措施,以保障工作人员的安全和环境的保护。
通过化学反应工程的研究和应用,可以优化化学反应过程,提高产品质量和产量,降低生产成本和能耗,减少环境污染和废物排放,为化学工业的可持续发展提供科学的支持和指导。
化学反应工程原理 第二版 华东理工大学出版社

AoC 2121t an n p n n A Ao Po P )()(--=-βAf Ao Pf C C C -=βAoPf C C =ϕ1 基本概念 1.1 优化:在一定的范围内,选择一组优惠的决策变量,使系统对于确定的评价标准达到最佳的状态。
1.2 反应速率:反应系统中某一物质在单位时间、单位反应区内的反应量。
1.3 反应转化率:反应物中某一组分转化掉的量(摩尔)与其初始量(摩尔)的比值。
常用x 表示。
1.4 选择率:对于复杂反应过程,同一反应原料可以生成几种不同的产物和无用的副产物。
此时,不同产物之间的分配比例对该反应过程的经济效益是一个非常重要的指标。
产物之间的这种分配比例可以用反应选择率 表示。
定义为已经转化掉的反应物量(摩尔)中,转化为目的产物的摩尔分率。
例:(主反应) (副反应)或又称为平均选择率。
瞬时选择率 β1.5 反应收率:得到的产物的量与投入反应系统的原料的量的比值φ。
该指标综合了选择率和反应速率两个指标的特点。
可采用摩尔收率和质量收率来表示。
以摩尔收率为例:总收率1.6 单耗:产品的原料消耗若以每份产品所需的反应原料份数来表示,就称为原料单耗,也可以用摩尔分率或质量分率来表示。
单耗与收率互成倒数。
1.7 返混:使早先进入的存在于反应器内的物料有机会与刚进入的反应物料相混合,这种混合现象称为返混现象。
1.8 排除了一切物理传递过程的影响,得到的化学反应动力学称为微观动力学或本征动力学。
在包含物理过程影响的条件下所测得的反应动力学称为宏观动力学(或称为表观反应动力学)。
1.9 基元反应和非基元反应:如果一个化学反应,反应物分子在碰撞中相互作用直接转化为生成物分子,这种化学反应称为基元反应(elementary reaction),否则就是非基元反应。
1.10 反应机理或反应历程:复杂反应要经过若干个基元反应才能完成,这些基元反应代表了反应所经过的途径,动力学上就称为反应机理或反应历程。
《化学反应工程》课件

部分模化法
将反应器的一部分进行放大或缩小, 以研究其放大效应或缩小效应。
相似放大法
通过相似理论来预测大试实验结果, 需要保证相似条件得到满足。
04
流动与混合
流动模型与流型
1 2
层流模型
适用于低雷诺数的流体,流速较低,流体呈层状 流动。
湍流模型
适用于高雷诺数的流体,流速较高,流体呈湍流 状态。
3
过渡流模型
化学反应影响流动特性
化学反应释放的热量和产生的压力变化会影响流体的流动状 态。
流动与混合实验技术
实验设备
包括管式反应器、搅拌釜式反应器、喷射式反应器等。
实验方法
通过测量流体的流速、压力、温度等参数,分析流动与混合对化学反应的影响 。
05
传递过程与反应器的热力学基础
传递过程基础
传递过程定义
物质和能量的传递是自然界和工程领域中普遍存在的现象,传递 过程是研究物质和能量传递规律的科学。
通过调节进料浓度来控制反应物浓度,保证反应的稳定性和效率。
催化剂选择与优化
选择合适的催化剂并优化其用量,提高反应效率和选择性。
反应器放大与缩小
经验放大法
根据小试实验数据和经验公式,通过 比例放大来预测大试实验结果。
数学模拟放大法
通过建立数学模型来模拟反应过程, 并利用计算机技术进行放大和缩小实 验。
管式反应器
适用于连续操作和大量生产,传热效果好, 适用于高粘度液体和悬浮液。
流化床反应器
适用于固体颗粒的反应,传热效果好,适用 于大规模生产。
反应器设计基础
反应动力学
研究反应速率和反应机理,为反应器设计提 供基础数据。
热力学
研究反应过程中的能量变化和物质平衡,为 反应器设计提供热力学依据。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第一章1. 化学反应工程是一门研究 (化学反应个工程问题)的科学。
2. 所谓数学模型是指 (用数学方法表达各变量间的关系)。
3. 化学反应器的数学模型包括 (动力学方程式、 物料横算式子、 热量衡算式、 动量衡算式 和 参数计算式)4. 所谓控制体积是指 (能把反应速率视作定值的最大空间范围)。
5. 模型参数随空间而变化的数学模型称为 ( 分布参数模型)。
6. 模型参数随时间而变化的数学模型称为 (非定态模型)。
7. 建立物料、热量和动量衡算方程的一般式为 (累积量=输入量-输出量)。
第二章1. 均相反应是指 (在均一的液相或气相中进行的反应)。
2. 对于反应aA + bB → pP + sS ,则r P =( p/a )r A 。
3.着眼反应物A 的转化率的定义式为(转化率Xa=转化了的物料A 的量/反应开始的物料A 的量)。
4. 产物P 的收率ΦP 与得率ХP 和转化率x A 间的关系为( Xp/Xa )。
5. 化学反应速率式为r A =k C C A αC B β,用浓度表示的速率常数为k C ,假定符合理想气体状态方程,如用压力表示的速率常数k P ,则k C =[ (RT)的a+B 次方]k P 。
6.对反应aA + bB → pP + sS 的膨胀因子的定义式为 (P+S )-(A+B))/A 。
7.膨胀率的物理意义为 (反应物A 全部转化后系统的体积变化率)。
8. 活化能的大小直接反映了 (反应速率) 对温度变化的敏感程度。
9. 反应级数的大小直接反映了(反应速率) 对浓度变化的敏感程度。
10.对复合反应,生成主产物的反应称为 (主反应),其它的均为(副反应)。
11. 平行反应A → P 、A → S 均为一级不可逆反应,若E 1>E 2,选择性S p 与 (A 的浓度)无关,仅是 (A 的浓度) 的函数。
12. 如果平行反应A → P 、A → S 均为一级不可逆反应,若E 1>E 2,提高选择性S P 应(提到温度)。
13. 一级连串反应A → P → S 在平推流反应器中,为提高目的产物P 的收率,应(降低)k 2/k 1。
14. 产物P 的收率的定义式为 (生成的全部P 的物质的量/反应掉的全部A 的物质的量)15. 产物P 的瞬时收率φP 的定义式为(生成的物质的量/反应的A 的物质的量)16. 产物P 的选择性S P 的定义式为(单位时间内产物P 的物质的量/单位时间内生成产物S的物质的量)17. 由A 和B 进行均相二级不可逆反应αA A+αB B = αS S ,速率方程为:r A =-dC A /dt=kC A C b 。
求: (1)当C A0/C B0=αA /αB 时的积分式(2)当C A0/C B0=λ≠αA /αB 时的积分式18. 反应A → B 为n 级不可逆反应。
已知在300K 时要使A 的转化率达到20%需,而在340K 时达到同样的转化率仅需,求该反应的活化能E 。
第三章1. 理想反应器是指(理想混合反应器 平推流反应器)。
2. 全混流反应器的空时τ是 (反应器容积) 与(进料的体积流量)之比。
3. 全混流反应器的放热速率Q G ={ 00()A A Hr Ft y x ∆ }。
4. 全混流反应器的移热速率Q r ={ 012()pm Ft C T T - }5. 全混流反应器的定常态操作点的判据为{ G r Q Q = }。
6. 全混流反应器处于热稳定的定常态操作点的判据为{ G r Q Q = G r dQ dQ dT dT> }。
7. 全混流反应器的返混 (无限大)。
8. 平推流反应器的返混为 (为零)。
9. 平推流是指 (反应物料以一致的方向向前移动)。
10. 全混流是指 (刚进入反应器的新鲜物料与已存在的反应器中的物料能达到瞬间的完全混合)。
11. 平推流的特征为 (所有物料颗粒在反应器中的停留时间相同不存在反混)。
12. 全混流的特征为 (反应器中各处浓度温度相等 且都与出口处一致 反混无限大)。
13. 如果将反应器出口的产物部分的返回到入口处与原始物料混合,这类反应器为 (循环反应器)。
14. 对循环反应器,当循环比β→0时为 (平推流) 反应器,而当β→∞时则相当于(全混釜)反应器。
15. 对于反应级数n <0的反应,为降低反应器容积,应选用 (全混流) 反应器为宜。
16. 对于反应级数n >0的反应,为降低反应器容积,应选用 (平推流) 反应器为宜。
17. 对于可逆放热反应如何选择操作温度答:对于放热反应要使反应速率尽可能保持最大必须随转化率的提高,按最优温度曲线相应降低温度,这是由于可逆放热反应,由于逆反应速率也随反应温度的提高而提高,净反应速率出现一极大值;而温度的进一步提高将导致正逆反应速率相等而达到化学平衡。
18. 对于反应,r R =k 1C A 2,E 1;r S =k 2C A ,E 2,当E 1>E 2时如何选择操作温度可以提高产物的收率答:对于平行反应ART E E A RT E RTE S R R C e k k C e k e k r r S 12212010/20/10---===,所以,当1E >2E 时应尽可能提高反应温度,方可提高R 的选择性,提高R 的收率。
19. 在间歇釜中一级不可逆反应,液相反应A → 2R ,r A =kC A kmol/m 3·hk=×109exp[T] h -1C A 0= kmol/m 3,M R =60,C R 0=0,若转化率x A =,装置的生产能力为50000 kg 产物R/天。
求50℃等温操作所需反应器的有效容积(用于非生产性操作时间t 0= h )解:)/(22.3230m kmol x C C A A R == A x A A x AA A x k x dx k kC dx C t A A-=-==⎰⎰11ln 111000 92.0502734.7448ex p 1052.99=⎥⎦⎤⎢⎣⎡+-⨯=k )(31.17.011ln 92.01h t =-=24500000=+t t M VC R R )(2.226022.32406.2500003m V =⨯⨯⨯=20. 应用两个按最优容积比串联的全混流釜进行不可逆的一级液相反应,假定各釜的容积和操作温度都相同,已知此时的速率常数k=,原料液的进料速度v 0=10m 3/h ,要求最终转化率x A =,试求V 1、V 2和总容积V 。
解:对于一级不可逆反应应有21010111)1(1)1(1)1(A A A A A A A x kC x kC x x r -=⎥⎦⎤⎢⎣⎡-∂∂=∂-∂ 代入⎥⎥⎦⎤⎢⎢⎣⎡----=∂-∂+-i A i A i A iA i A i A r r x x x r ,1,1,,,,111)1( 得 ⎥⎦⎤⎢⎣⎡----=-)1(1)1(11)1(1102001210A A A A A A A A x kC x kC x x x kC整理得 022121=+-A A A x x x∵9.02=A x , ∴6838.01=A x ∴)(35.2)6838.01(92.06838.0)1(111h x k x A A =-=-=τ)(5.233101m v V ==τ)(35.2)9.01(92.06838.09.0)1(2122h x k x x A A A =--=--=τ)(5.233202m v V ==τ总容积)(47321m V V V =+=21. 用两串联全混流反应器进行一个二级不可逆等温反应,已知在操作温度下k=0.92m 3/(),C A 0=m 3,v 0=10m 3/h ,要求出口x A =,计算该操作最优容积比V 1/V 2和总容积V 。
解:31202120111)1(2])1(1[)1(A A A A A A A x kC x kC x x r -=-∂∂=∂-∂代入]11[1)1(1,2,0,1,1,1,A A A A A A r r x x x r ----=∂-∂])1(1)1(1[1)1(221,2021,201,31,20A A A A A A A x kC x kC x x kC ---=-741.0099.001.33112131==-+-A A A A x x x x∴ h x kC x x A A A A 22.5)741.01(3.292.1741.0)1(2210011=-⨯⨯=--=τh x kC x x A A A A 51.7)9.01(3.292.0741.09.0)1(2220122=-⨯⨯-=--=τ 695.051.722.52121===ττV V总容积021v V V V ⨯=+=τ ∴ 33.127)22.551.7(10m V =+⨯=22.在平推流反应器中进行等温一级反应,出口转化率可达。
现将反应转移至一个等体积的全混流反应器中进行,操作条件完全不变,试问出口转化率将为多少解 : 00110000102121111ln()(1)1(1)11ln()(1)10.850.655xA xA A A A A A A A A A A A A A A A A A A dx dx V C C v KC KC x K x C C x KC K x x K x K x x x ττττ====---==-==--==⎰⎰23. 等温间歇反应器反应时间与反应物浓度的关系在间歇反应器中进行等温二级反应A → B,r A =,当C A0为1mol/l 时,求反应至C A =l 所需时间。
解: 00.0102010.01111()99000.010.011A A A x C A A A A C A A A dx dC dC C r r C s τ==-=---=-=⎰⎰⎰24. 液相反应A →R 在一全混釜中进行,C A0=1mol/l ,反应速率常数k =1l/(),求:1) 平均停留时间为1s 时该反应器的x A ;2) 若v 0=1l/s ,x A =,求反应器的体积。
第四章1. 停留时间分布的密度函数在t <0时,E (t )=(0)。
2. 停留时间分布的密度函数在t ≥0时,E (t )(>0)。
3. 当t=0时,停留时间分布函数F (t )=(0)。
4. 当t=∞时,停留时间分布函数F (t )=(1)。
5. 停留时间分布的密度函数E (θ)={ t }E (t )。
6. 表示停留时间分布的分散程度的量σθ2=[ 1/(t*t) ]σt 2。
7. 根据示踪剂的输入方式不同,测定停留时间分布的方法主要分为(脉冲示踪法)和(阶跃示踪法)。
