无机及分析化学b教学(丁明玉)chapter5-2-31页精选文档
无机及分析化学课程教学大纲

《无机及分析化学B》课程教学大纲课程名称(中文):无机及分析化学B课程名称(英文):Inorganic and Analytical Chemistry课程编码:1103108开课学期:第 1 学期学时数、学分数:48学时,3.0学分适用专业:农业科技类(中药学、生物科学)、动物科学、园艺、植保、旅游管理、木工、生物技术、梁希班先修课程:后续课程:有机化学一、教学目的与任务《无机及分析化学》是阐述化学基本知识、基本原理的一门基础性学科,是农科类、理科类、食品科学与工程类及生物类等各专业本科生的必修基础课程。
本课程全面、系统地介绍化学的基础知识和基本理论,为学生进一步学习相关专业基础课和专业课打下基础,同时训练学生掌握分析测量的基本要求。
本课程教学以提高人才素质为核心,以培养学生创新能力为目的,密切联系现代科技前沿和农业科技实践,注重培养学生的科学思维方法和树立辩证唯物主义世界观,提高学生分析问题和解决问题的能力。
二、教学内容与基本要求通过本课程的学习,使学生了解化学科学的发展历程,了解化学与工农业及人类生活的关系,了解化学学科的前沿知识,了解某些重要生命元素的性质,了解某些现代测试手段;重点掌握平衡的原理、溶液中的各种化学平衡及其在分析化学中的应用,使学生建立准确的“量”的概念和掌握各种化学分析方法;掌握化学热力学、化学反应速率、物质结构、分散体系等方面的基本理论和基本知识;会运用基本理论和基本知识解释化学现象,会运用基本分析方法和测试手段进行一般的化学分析,能够运用所学知识解决生产生活中的实际问题,能将化学知识与专业实际相结合。
(一)理论知识方面Ⅰ.结构化学部分一、微观粒子的运动特性1.了解电子等微观粒子运动特性:物理量量子化、波粒二象性2.了解测不准原理,了解量子力学的基本假设二、波函数1.了解波函数的物理意义和量子数的物理意义2.掌握量子数的取值规则3.了解原子轨道轮廓图、等值线图和电子云图三、原子的核外电子结构1.单电子原子:了解单电子原子内轨道能级2.多电子原子:了解屏蔽作用对轨道能级的影响,了解有效核电荷概念,了解能级组的划分,了解能量最低原理、不相容原理、洪特规则,掌握原子核外电子的排布规律四、元素周期律1.了解元素原子核外电子结构周期性变化规律与周期表结构的关系2.了解主、副族元素原子的结构特点3.了解电子结构、原子半径、有效核电荷与主、副族元素性质(电离能、电子亲合能、电负性)变化基本规律的关系五、化学键1.了解离子键理论要点2.了解离子晶体晶格能概念及其对离子晶体重要物理性质的影响3.了解共价键价键理论,分子轨道理论要点,σ键和π键4.了解轨道杂化理论、了解杂化轨道与分子空间构型及分子极性的关系5.了解分子间力、氢键及其对物质重要性质的影响6.了解配合物结构的价键理论Ⅱ.化学基础理论部分预备知识:1.掌握“物质的量”概念2.掌握“化学计量数”概念3.掌握“化学反应进度”概念一、化学热力学1.热力学第一定律:理解状态函数、功、热、热力学能、焓等概念,理解热力学第一定律数学表达式,理解定压热与焓变、定容热与热力学能变有关系,掌握热容概念2.热化学:理解并掌握化学反应热概念,掌握化学反应的(标准)摩尔焓概念,理解并熟练应用盖斯定律,掌握并熟练应用标准摩尔生成焓概念,能应用基尔霍夫公式3.了解自发过程的特点,了解可逆过程4.了解熵增原理,了解熵的统计意义5.了解吉布斯自由能和吉布斯自由能判据6.掌握热力学基本公式7.理解化学势概念,理解化学反应摩尔吉布斯自由能概念和标准摩尔生成吉布斯自由能概念8.了解理解气体和非电解质理想溶液中各组分的化学势,了解非理想气体和非想溶液中各组分的化学势,了解逸度、活度概念9.掌握吉布斯——亥姆霍兹方程和化学反应等温式的应用二、化学平衡1.理解化学平衡状态的热力学意义:化学势与化学平衡2.掌握标准平衡常数概念和化学平衡计算及多重平衡原理3.掌握各种因素对化学平衡的影响4.了解经验平衡常数三、化学动力学1.掌握化学动力学基本概念:基元反应、简单反应、复杂反应、反应分子数、化学反应速率、反应级数、速率方程、速率常数,掌握简单级数反应的特点和有关计算2.掌握浓度、温度对反应速率的影响,阿累尼乌斯公式及其应用3.了解复合反应及其近似处理4.了解反应速率理论,了解活化能概念5.了解催化作用和催化剂四、电解质溶液1.掌握离子电迁移、电导、是导率等概念及其简装应用2.掌握离子的化学势、活度和活度系数等概念,了解强电解质溶液理论Ⅲ.溶液中的离子反应一、酸碱反应1.掌握质子酸碱概念、了解路易斯酸碱概念2.理解酸碱强度与结构的关系3.掌握弱酸碱的离解平衡、酸碱水溶液酸度和有关离子浓度的近似计算4.掌握影响酸碱离解平衡移动的各种因素,掌握介质酸度对弱酸碱存在形体的影响5.掌握缓冲溶液的性质、组成、酸度的近似计算及缓冲溶液的配置二、沉淀——溶解反应1.掌握溶度积原理2.掌握分步沉淀作用3.掌握同离子效应、酸度、配位反应、氧化还原反应对沉淀——溶解反应的影响、沉淀转化4.了解沉淀反应在离子分离和定性分析中的应用三、配位反应1.掌握配离子稳定常数概念和配位平衡的近似计算2.理解酸碱反应、沉淀反应和氧化还原反应对配位平衡的影响,并能做简单近似计算3.了解配位反应的重要应用四、氧化还原反应1.掌握有关基本概念,掌握氧化还原反应式的配平方法2.掌握原电池、电极、电池电动势、电极电势等重要概念3.掌握可逆电池热力学,掌握Nernst方程及其应用、氧化还原反应的标准平衡常数4.了解pH——电势图Ⅳ.分析化学部分一、掌握分析化学的基本概念:化学分析与仪器分析、定量分析的一般程序、准确度与精密度、提高测定准确度的措施二、初步掌握有效数据的统计处理:t—检验、F—检验三、掌握滴定分析基本概念和原理,了解反应完全程度对终点误差的影响,掌握各类指示剂的变色原理和选择四、各类滴定分析方法酸碱滴定:掌握强酸(碱)、弱酸(碱)及简单的混合酸碱的滴定分析方法及重要应用;沉淀滴定:掌握莫尔法、佛尔哈德法原理和重要应用配位滴定:理解条件稳定常数概念、酸效应对条件稳定常数的影响,单一离子的滴定条件,掌握配位滴定的重要应用氧化还原滴定:理解条件电极电势、氧化还原反应的条件平衡常数,掌握高锰酸钾法、重铬酸钾法和碘量法原理及重要应用三、课程的重点与难点第1章溶液(2学时)本章教学目的要求:1.掌握溶液中物质的量浓度、质量摩尔浓度、物质的量分数、质量分数的计算及相互间的换算。
无机及分析化学最新版

第18页/共41页
【例】在50 ml 0.2mol·L-1 MgCl2溶液中加入 等体积的0.2mol·L-1的氨水,有无Mg(OH)2↓生 成?[Mg(OH)2 的KspӨ =1.8×10-10,氨水的KbӨ =1.77×10-5]
解: c(Mg2+) = 0.2/2 = 0.1 (mol·L-1) c(NH3.H2O) = 0.2/2 = 0.1 (mol·L-1)
S=4
K
θ sp
27
4. A3D2型 如Ca3(PO4)2 、 Mg3(PO4)2 (自推)
第5页/共41页
【例】已知AgCl在298K时溶解了1.92×10-3 g·L-1,计算其KspӨ。
解: AgCl的摩尔质量= 143.4 g ·mol-1 S = 1.92×10-3/143.4 = 1.34 ×10-5 (mol·L-1) KspӨ = S2 = 1.8×10-10
2+
]r
=
4.0 ×10-53 1.0 ×10-19
= 4.0×10-34
[H2S]r [Hg 2+ ]r [H+ ]r2
= 4.0×10-34
[H+ ]r
0.12 4.0 ×10-34
= 5.0×1015
HgS不能溶于盐酸。
第31页/共41页
2. 发生氧化还原反应而溶解
CuS(s)
Cu2+ + S2-
NH3.H2O 平衡 0.1-x
NH4+ + OH-
x
x
第19页/共41页
[OH- ]r = 0.1×1.77×10-5 = 1.33×10-3 Qc = cr(Mg2+) cr2(OH-) = 0.1×(1.33×10-3 )2
《无机及分析化学》课程教学大纲

《无机及分析化学》课程教学大纲课程名称:无机及分析化学课程类别:必修课适用专业:生态学考核方式:考试总学时、学分:48学时 3学分其中实验学时:0 学时一、教学目的本课程的目的是要求学生掌握元素周期律、物质结构理论基本知识、化学热力学、化学反应速率、化学平衡、酸碱平衡、沉淀平衡、配位平衡、氧化还原反应等基本理论。
并在上述理论的指导下,理解掌握溶液中四大平衡的相互关系和有关计算。
重点掌握平衡的原理、溶液中的各种化学平衡及其在分析化学中的应用,使学生建立准确的“量”的概念和掌握鉴定物质的化学结构和化学成分以及测定有关成分含量的化学分析方法及方法的原理。
通过分析化学理论和实验学习,培养学生实事求是的科学态度和严谨、细致的工作作风,为后继课程的学习和将来参加社会实践打下良好基础。
在完成该课程的学习之后,要求学生在掌握了无机分析化学基本原理的前提下,可以根据样品性质、分析对象,正确设计分析方案,精确测定组分含量,准确报告分析结果,培养学生分析问题和解决问题的能力,具备初步的实验技能。
能够运用所学知识解决生产生活中的实际问题,能将化学知识与专业实际相结合。
二、教学要求1、注意讲清本课程中的基本概念和基本理论,在保持课程的科学性及系统性的基础上,应突出重点、难点,并努力反映本学科的新成就。
2、因学时有限,内容较多,有一部分内容要求学生自学。
采用由教师提示,学生课后自学并提出问题,老师课后解答的方式。
3、必要时对重点章节,可在讲授基础上,引导学生查阅资料,并进行课后学习兴趣小组讨论,写出读书报告,以培养学生综合分析问题的能力。
4、教学过程中要充分利用微视频、直观教具、录像和计算机辅助教学软件、多媒体教学辅助设备。
三、课程高中化学四、教学重、难点课程教学重点是化学热力学基本概念及其应用,化学平衡原理,化学反应速率,酸碱平衡,氧化还原反应,原子结构,分子结构,配合物的组成、结构及价键理论,酸碱滴定分析法、氧化还原滴定分析法、配位滴定法、比色法和分光光度法。
无机及分析化学课件

(4)sp3 不等性杂化 (sp3 Uneven Hybridization) ) 不等性杂化 NH3, H2O 基态 N:1s22s22p3 7 2s22px12py12pz1 杂化 1个2s+3个2p → 4个sp3杂化轨道 1 2s+3 2p 4 sp
不等性杂化的定义:因含孤对电子而造成杂化轨 不等性杂化的定义:因含孤对电子而造成杂化轨 孤对 道成分略有差异的现象称不等性杂化。 道成分略有差异的现象称不等性杂化。(ⅤA和ⅥA) 和 )
轨道重叠: 9F 1s22s22p5 F 1s22s22p5 9 F 1s22s22p5 9 B 原子的 3 个 sp2 杂化轨道与 3 个F原 子的2p 轨道重叠形成 3 个 sp2-p轨道构成的σ 键。 空间构型: 空间构型:平面三角形 键 角:120° °
(3)sp3 等性杂化(sp3 Even Hybridization) ) 等性杂化 CCl4、CH4分子就属于此类型杂化。 基 态 C :1s22s22p2 6
举例 H2:1s1 + 1s1 —— s-s Cl2:1s22s22p63s23p5 1s22s22p63s23p5 3py23pz23px1 3py23pz23px1
3px1+3px1 —— px-px HCl: s-px
(2) π键 ) 键
定义: 定义:两原子轨道垂直于两核间联线并相互 平行而进行同号重叠所形成的共价键 叫π键。 范畴: 范畴: pz-pz 重叠 py-py 重叠
最大重叠原理 (2)原子轨道最大重叠原理 )原子轨道最大重叠
成键原子轨道重叠越多,两核间电 成键 子云密度越大,形成的共价键 共价键越稳定。 共价键
(3)对称性匹配原理 )
两原子轨道重叠时,必须考虑原 子轨道“+”、“-”号,同号重叠才是有 效重叠。
无机及分析化学b教学丁明玉
E(N-N)=159 E(P-P)=209
高卤酸强。
E(O-O)=142 E(S-S)=264
E(F-F)=158 E(Cl-Cl)=244
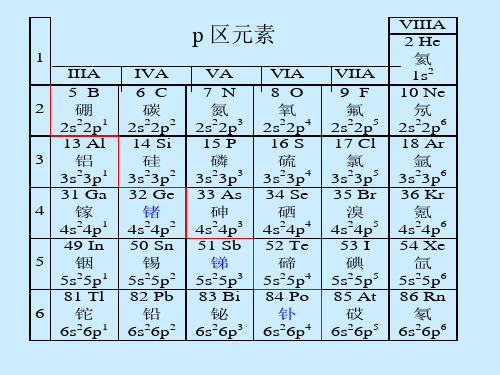
中间排元素异样性 (d区插入):溴酸、高溴酸氧化性比其它卤酸、 每族最后三个元素性质缓慢地递变(镧系收缩) 2.同一元素多种氧化态:价电子构型:ns2np1-5 3.电负性大,多种共价结构
5.氢的化合物 离子型氢化物(盐型) —与IA、 IIA 族活泼金属生成离子晶体 共价型氢化物(分子型) —与P 区非金属元素生成分子晶体
金属型氢化物
—与过渡金属元素生成固熔体,氢存储与提纯 M + x/2H2 MHx
LaNi5H6 PdH0.8
储氢材料
10.1.2 稀有气体(Noble Gases或Rare gases)
氧化物:XeO3, XeO4 氟氧化物:XeOF2,XeOF4 大量氟化物的衍生物 (氧化剂) (氟化剂) 含氧酸盐:M(I)HXeO4, M(I)4XeO6
空间构型:
应用价层电子对互斥理论 VSEPR
如:XeF4
BP=4,LP=2,VP = 4 + 2 = 6
电子对空间分布:正八面体;分子几何构型:平面正方形
零族元素(He、Ne、Ar、Kr、Xe、Rn),价电子构型:ns2np6
原称“惰性气体”(Inert Gases),常温常压下为气态;
在地壳中含量稀少, 1. 稀有气体的发现 十九世纪科学四大发现之一;“第三位小数的胜利”。
1890年,Rayleigh 和 Ramsay实验发现:
化学法制得N2的密度:1.2502g•L-1 空气分馏制得氮气的密度:1.2572 g•L-1 卤素概述
卤素:F,Cl,Br,I,At 电子结构:ns2np5 , 第七主族元素; 有强烈得电子形成阴离子的趋势;
无机及分析化学

绪论0.1 化学是21世纪的中心学科波义耳把化学确立为科学,明确提出“化学的对象和任务就是寻找和认识物质的组成和性质”;1777年,拉瓦锡提出燃烧的氧化学说;1811年,阿伏伽德罗提出分子假说;1807年,道尔顿建立原子论,合理地解释定组成定律和倍比定律,为化学新理论的诞生奠定基础;1869年,门捷列夫提出元素周期律,形成较为完整的化学体系;1913年,丹麦科学家玻尔把量子概念引入原子结构理论,量子力学的建立开辟了现代原子结构理论发展的新历程。
0.2 化学与化学的分支学科化学可分为四大分支学科:无机化学、有机化学、物理化学和分析化学。
无机化学是化学学科中发展最早的一个分支学科;有机化学是最大的化学分支学科。
0.4学习无机及分析化学的预备知识0.4.1 分压定律科学上常用理想气体状态方程式描述气体的行为:PV=nRT式中:R为摩尔气体常量,R=8.314J?mol-1?K-1一定温度下,某组分气体占据与混合气体相同体积时所具有的压力称为该组分气体的分压。
混合气体总压力是由各组分共同产生的。
P(总)= P(A)+ P(B)+ P(C)+…式中:P(总)为混合气体的总压;P(A)、P(B)、P(C)分别为混和气体中A、B、C 组分气体的分压。
该式就是道尔顿分压定律的数学表达式。
它表明“一定温度、一定体积条件下,混合气体的总压等于各组分气体分压之和”。
)()总()()总()(B x n B n P B p == 式中:X(B)为B 组分气体的摩尔分数,则P(B)=P(总) ?x(B)定温条件下,某组分气体的分压与混合理想气体总压相同时,其单独占据的体积称为该组分气体的分体积。
混合气体的总体积是各组分气体分体积的加和,称为分体积定律。
V(总)=V(A)+V(B)+V(C)+… V(总)=RT P n )总( V(B)=RT PB n )(=X(B) ?V(总) V(B)=X(B) ?V(总)0.4.2 有效数字对数数值的有效数字位数只取决于小数部分的位数,整数部分代表该数为10的多少次方,起定位作用。
无机及分析化学课件
E=hv P=h/λ h=6.626 ×10-34 J·s
任何运动物体都有波动性,宏观物体只是由 于质量太大而导致波长太短无法显示出来 !
h h λ= = p mu
证实: 证实:电子衍射实验
1927年,Davisson和Germer实验: 年 实验: 和 实验 微粒波的强度反 映了粒子在该处出 现概率密度的大小
415nm 435nm 487nm
电子束
电子束
660nm
1 1 n = R( 2 ) 2 n1 n2 式中, 为常数 为常数, 必须是正整数且n 式中,R为常数,n1、n2必须是正整数且 1<n2
氢原子光谱示意图
氢原子光谱特征: 氢原子光谱特征 不连续的,线状的(可见区:4条)
线状光谱(连续) 带状光谱(连续) 线状光谱(连续)、带状光谱(连续)
(1)假设 )
核外电子不能沿任意轨道运动,而只能在确 定半径和能量的轨道上运动; 正常情况下,原子中电子尽可能处在离核最 近的轨道上运动,此时能量最低 — 原子处 于基态(最低能级n1=1)。当原子受到辐射 获得能量后,电子可跃迁到离核较远的轨道 上 — 原子处于激发态(较高能级n2); 电子在定轨道运动时既不吸收能量,也不辐 射能量 不同轨道的能量是不相同的,且不连续
重点
量子数的取值原则 波函数及电子云的空间图形 原子核外电子排布规律 能级组的概念 价键理论和杂化理论 简单分子的空间构型 Nhomakorabea难点
波函数概念、能级概念 原子轨道及电子云空间图形 杂化轨道理论及分子空间构型判断
§5.1 原子核外电子的运动状态
氢原子光谱和Bohr理论 一、氢原子光谱和 理论
氢放 电管 狭缝 棱镜
l=0, 1, 2… l≥︱m︱
第一章 分散体系
无机及分析化学
第一章
分散体系
1.0.4 分压定律的应用
21 上一页 下一页 本章目录 总目录
无机及分析化学
第一章
分散体系
【例】: 可以用亚硝酸铵受热分解的方法制取 纯氮气。反应如下: NH4NO2(s) 2H2O(g) + N2(g) 如果在19℃、97.8kPa下,以排水集气法在 水面上收集到的氮气体积为4.16L,计算消耗 掉的亚硝酸铵的质量。 解: T =(273+19)K = 292K p=97.8kPa V=4.16L
上一页 下一页 本章目录
14 总目录
无机及分析化学
第一章
分散体系
3.气体密度的计算
mRT M pV
RT M p
=m/V
pM RT
上一页 下一页 本章目录
15 总目录
无机及分析化学
第一章
分散体系
1.0.3 分压定律
组分气体: 理想气体混合物中每一种气体叫做组 分气体。 分压:组分气体B在相同温度下占有与混 合气体相同体积时所产生的压力,叫做组 分气体B的分压。
1
1
R=8.314 kPaLK-1mol-1
上一页 下一页 本章目录
13 总目录
无机及分析化学
第一章
分散体系
1.0.2 理想气体状态方程式的应用
1. 计算p,V,T,n 四个物理量之一。 pV = nRT 用于温度不太低,压力不太高的真实气体。 2.气体摩尔质量的计算 pV nRT m m pV RT n M M mRT M = Mr gmol-1 M pV
理想气体状态方程式:
R---- 摩尔气体常量 在STP下,p =101.325kPa, T=273.15K n=1.0 mol时, Vm=22.414L=22.414×10-3m3
电子教案与课件:无机及分析化学配套课件 5-3
影响指示剂变色范围的因素
1. 指示剂加入量多少影响变色敏锐程度(过多 或过少都不好);指示剂应适当少量。
2. 不同酸碱指示剂其变色范围和理论变色点 不同。
3. 指示剂的变色范围受温度、溶剂性质影响。 4. 为辨于颜色的观察,通常使指示剂的颜色
由无色变有色,由浅色变深色。
混合指示剂
▪ 混合指示剂的原理:利用颜色的互补作用使颜色变化敏锐, 易观察,变色范围较窄。
HIn
H+ + In-
• 酚酞 • 甲基橙 • 甲基红
• 甲基橙:偶氮类结构,变色范围3.1~4.4, 红色变黄色。
• 酚酞: 三苯甲烷类,无色变红色
指示剂的变色范围
HIn
H+ + In-
K HIn
=
H+ In-
HIn
HIn
pH = pKHIn - lg In-
•
酸式色时:[HIn]/[In-]≥10,pH≤ pKHIn-1
实验测得的变色范围。一般小于2个pH单位。
•
指示剂的理论变色点: pH = pKHIn 。
常用的酸碱指示剂
指示剂 百里酚蓝(第一次变色) 甲基黄 甲基橙 溴酚蓝 溴甲酚绿 甲基红 中性红 酚酞 百里酚蓝(第二次变色)
pH变色范围 1.2~2.8 2.9~4.0 3.1~4.4 3.0~4.6 3.8~5.4 4.4~6.2 6.8~8.0 8.0~9.6 8.0~9.6
二、滴定突越和指示剂的选择
• 选择合适的指示剂,能减小酸碱滴定过程中 的滴定误差,而指示剂的变色与溶液的pH有 关,因此有必要研究滴定过程中溶液pH的变 化,特别是化学计量点附近溶液pH的改变, 从而选择一个刚好能在化学计量点附近变色 的指示剂。以酸碱加入的体积(或被滴定的 百分数)为横坐标,溶液的pH为纵坐标,描 绘滴定过程中溶液pH值的变化情况的曲线, 称为酸碱滴定的曲线。
电子教案与课件:无机及分析化学配套课件 5-4
● 掌握原电池的 知识
● 掌握能斯特方 程
● 能用电极电 位来判断物质 的氧化性和还 原性
●能测定常见的 氧化性或还原 性物质
• 一、氧化 还原反应
• (一)氧化值 • 在氧化还原反应中,
由于发生了电子转移, 导致某些元素带电状 态发生变化。为了描 述元素原子带电状态 的不同,人们提出了 氧化值的概念。氧化 值也叫做氧化数。
0.05 %的水溶液 0.1 %的水溶液 0.1 % Na2CO3的溶液 0.025 mol·L-1的水溶液 0.025 mol·L-1的水溶液
• 常用的氧化还原滴定法 有
• 高锰酸钾法
• 重铬酸钾法 • 碘量法
• 高锰酸钾作为标准溶液不 能直接配制需要先粗略配 制再标定
• 具体见实验 部分
• 重铬酸钾可以直接配制标 准溶液
• 《无机及分析化学》配套课件 • 项目五 试样测定
任务一滴定分析的化学反应
任务二 电解质溶液和离子平衡 任务三 酸碱性样品的测定 任务四 氧化还原性物质的测定 • 任务五 配位滴定法测定金属离子含量 • 任务六 沉淀滴定法测定非金属离子含量
• 学习任务
●理解氧化值的概 念
●学习离子电子法 配平
• 思考题 • 1.离子电子配平法有什么好处?
• 2.原电池由哪些部分组成? • 3.标准电极电位高低与物质氧化性和还原性有怎样的关系?
• 4.由能斯特方程可看出电极电位与哪些因素有关系? • 5.电极电位有哪些应用?
• 6.什么是元素的电势图?有何用处? • 7.氧化还原滴定与其他滴定有何不同? • 8.氧化还原滴定有哪些类型的指示剂? • 9.高锰酸钾标准溶液为何要提前一周配制然后标定?
•
银电极的标准电极电位:+0.799 V。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
在氧化还原反应中,总是较强的氧化剂与较强的还原剂发 生反应,生成较弱的氧化剂和较弱的还原剂。
用标准电动势E判断时考虑到浓度的影响: E > 0.2 V 反应正向自发进行
E<-0.2V 反应逆向自发进行
-0.2V <E< 0.2V 反应方向受浓度的影响。
Cl2 2e
2 Cl
Eθ 1.36V
Eθ Eθ MnO2 / Mn 2 Eθ Cl2 / Cl
1.23V 1.36V 0.13V 0
所以,该反应在标准态下不能向右进行。
2浓HCl中,c H c Cl 12mol L1
2
= -0.403V + 0.0592V lg 0.10
2
= -0.433V
E (Sn4+ / Sn2+) = E (Sn4+ / Sn2+) +
0.0592V 2
lg
cSn 4 cSn 2
= 0.154V + 0.0592V lg 0.10 = 0.213 V
2
0.0010
E (Sn4+ / Sn2+) >E (Cd2+ /Cd)
2H O2 2e
H 2O2
Eθ (O 2 /H 2 O 2) 0.682V
H 2O2 2H 2e
Fe3 e
Fe 2
2H 2O Eθ (H 2 O 2 /H 2 O) 1.77V Eθ (Fe3 / Fe2 ) 0.771V
Fe2 2e Fe s
所以, Sn4+ / Sn2+为正极, Cd2+/Cd为负极
原电池电动势: E=E(正极)-E(负极)
=0.213V-(-0.433V)=0.646V
正极发生还原反应: Sn4+ + 2e- Sn2+
负极发生氧化反应: Cd - 2e- Cd2+
电池反应为:
Sn4+ + Cd
Sn2+ + Cd2+
5.4.2 判断氧化还原反应进行的方向
Eθ (Fe2 /Fe) 0.44V
解: Fe2 2e
Fe s
2H O2 2e
Fe3 e
Fe 2
H 2O2
Eθ 0.44V Eθ 0.682V Eθ 0.771V
H 2O2 2H 2e
2H2O Eθ 1.77V
Sn4+(0.10mol/L), Sn2+(0.0010mol/L)︱Pt
解:Cd2+ + 2eSn4+ + 2e-
Cd
E (Cd2+ /Cd)=-0.403V
Sn 2+ E (Sn4+ / Sn2+)=0.154V
E (Cd2+ /Cd) = E (Cd2+ /Cd) +
0.0592V lg cC d 2
E (Cd2+ /Cd)=-0.403V
Sn4+ + 2e-
Sn2+ E (#43; Cd
Sn2+ + Cd2+
例:判断在酸性溶液中H2O2与Fe2+混合时,能否发 生氧化还原反应?若能反应,写出反应方程式。
解: H2O2与Fe2+既是氧化剂,又是还原剂。
1.36V
0.0592V 2
lg
1 122
1.30V
E E MnO2/Mn2 E Cl2/Cl 0.06V 0
对角线规则:
在标准电极电势表中,电势表左下方的物质(相对 较强的氧化剂)能与右上方的物质(相对较强的还 原剂)发生反应。
Cd2+ + 2e- Cd
解:
I 2 /I
E θ /V 0.535
Br2 /Br 1.065
Cl2 /Cl 1.36
Fe3 /Fe2
MnO
4
/Mn
2
E θ / V 0.771
1.51
即 E θ I2 /I E θ Fe3 /Fe2 E θ Br2 /Br
E θ Cl2/Cl
5.4.1 计算原电池的电动势
应用标准电极电势E和Nernst方程,可算出原电 池的电动势。
E = E (+) -E (-) E = E (+) -E (-)
例:计算下列原电池在298K时的电动势,并判断正 负极,写出电池反应式。(p110例5-9)
Cd︱Cd2+(0.10mol/L )‖
例:(1) 试判断反应
MnO2 s 4HClaq
MnCl2 aq Cl2 g 2H2Ol
在 25Ο C时的标准态下能否向右进行?
(2) 实验室中为什么能用浓HCl 制取Cl2 g?
解:(1)
MnO2 4H 2e
Mn 2 2H 2O Eθ 1.23V
E MnO2/Mn2
Eθ MnO2/Mn 2
0.0592V 2
lg
c4 H c Mn 2
=1.23
0.0592V
124 lg
1.36V
2
1
E Cl2/Cl
Eθ
Cl2/Cl
0.0592V 2
lg
pCl2 / pθ
c2 Cl
H
2
O
与
2
Fe
2
发生的反应:
H 2O 2 2Fe2 2H 2Fe3 2H 2O
Eθ Eθ H 2O 2 / H 2O Eθ Fe3 / Fe2
1.77V 0.771V
1.00V 0.2V
5.4.3 选择氧化剂和还原剂
例:现有含Cl-、Br-、I-的混合溶液,欲将I氧化成I2 ,而Br-、Cl-不被氧化,在常用 的氧化剂Fe2(SO4)3和KMnO4中选择哪一 个能符合上述要求?
Eθ
MnO
无机及分析化学
第五章 氧化还原反应
5.1 氧化还原反应的基本概念 5.2 氧化还原方程式配平(略) 5.3 电极电势
5.4 电极电势的应用 5.5 元素电势图及其应用
5.4 电极电势的应用
5.4.1 计算原电池的电动势 5.4.2 判断氧化还原反应的方向 5.4.3 选择氧化剂和还原剂 5.4.4 判断氧化还原反应进行的次序 5.4.5 判断氧化还原反应进行的程度 5.4.6 求相关化学平衡常数
