非苯芳烃讲解
合集下载
有机化学A:第七章 芳烃及非苯芳烃

煤焦油中含有大量的芳香族化合物,分馏煤焦油可以得到各种 馏分。
苯及其同系物主要存在于低沸点馏分中,即轻油中,此外,由 于在煤干馏时,苯和甲苯等一部分轻油馏分未能立即冷凝成液 体,而仍以气体状态被煤气带走,因此要用重油洗涤煤气,这 样可以吸收其中的苯和甲苯等。再蒸馏此重油,就可以从中又 取得苯和甲苯。
Organic Chem
University of Science and Technology of China
芳香烃分子中去掉1个氢原子后所剩下的原子团称为芳 基(aryl group),常用“Ar”来表示。通常将苯分子去 掉1个氢原子后所剩下的原子团称为苯基,以C6H5-,也用 Ph-(phenyl)或Φ-表示。
但无法解释2和3异常现象芳香性归因于环状交替单双键结构1911年willstatter合成了使br褪色kmno非芳香性产生芳香性的真正原因universitychinaorganicchem苯的结构苯的结构平面型分子平面型分子cccc完全相等完全相等140pm108pm120chinaorganicchembrbrbrbr表达的是同一分子表达的是同一分子2二溴代产物只有一个二溴代产物只有一个chinaorganicchem三个成键轨道电子云叠加的总形象
磺化反应可逆性在合成上的应用
例:
H3C
Cl H3C
• 直接氯代
1)环烷烃催化脱氢
2)烷烃脱氢环化和再脱氢
3)环烷烃异构化和脱氢
Organic Chem
University of Science and Technology of China
§7.4、单环芳烃的物理性质
一般为具有特殊的气味的液体。苯蒸气可通过呼吸道对人体产生损害, 高 浓度的苯蒸气主要作用于中枢神经,引起急性中毒,低浓度的苯蒸气长期接
chem-7多环芳烃和非苯芳烃

αα
β
β
Br
β
β
αα
β-溴萘
Br
α-溴萘
-NH2 ,-OH ,-CHO, -SO3H, -COOH OH
SO3H
βቤተ መጻሕፍቲ ባይዱ萘磺酸
α-萘酚
2.二取代物
8 7
6 5
1 2
3 4
C2H5
C2H5 1,6-二乙基萘
CH3
SO3H
4-甲基-1-萘磺酸
OH SO3H
C2H5 5-乙基-2-萘磺酸
NO2 4-硝基-1-萘酚
(三)萘的化学性质
1.亲电取代反应
α
α β
E+
β
EH
EH
+
+ 其它不稳定共振结构
+
+E H + 其它不稳定共振结构
⑴卤化
Cl
+ Cl2
I2 苯
Br
+ Br2 CCl4
⑵硝化
HNO3/H2SO4
N O2
⑶磺化(可逆反应)
< 80℃
浓 H2SO4
165℃
SO3H
96%
SO3H
165℃ / H2SO4
斥力较大
H SO3H
85%
H
SO3H
H
斥力较小
⑷付氏酰基化反应
AlCl3 + CH3COCl
CS2 或 C2H2Cl4 -15℃
硝基苯 200℃
COCH3 93%
COCH3 90%
⑸一取代萘的定位效应
由于邻对位定位基的致活作用,取代发生在同环,并且第 二个基团进入这个定位基的邻对位中的α位。
CH3
β
β
Br
β
β
αα
β-溴萘
Br
α-溴萘
-NH2 ,-OH ,-CHO, -SO3H, -COOH OH
SO3H
βቤተ መጻሕፍቲ ባይዱ萘磺酸
α-萘酚
2.二取代物
8 7
6 5
1 2
3 4
C2H5
C2H5 1,6-二乙基萘
CH3
SO3H
4-甲基-1-萘磺酸
OH SO3H
C2H5 5-乙基-2-萘磺酸
NO2 4-硝基-1-萘酚
(三)萘的化学性质
1.亲电取代反应
α
α β
E+
β
EH
EH
+
+ 其它不稳定共振结构
+
+E H + 其它不稳定共振结构
⑴卤化
Cl
+ Cl2
I2 苯
Br
+ Br2 CCl4
⑵硝化
HNO3/H2SO4
N O2
⑶磺化(可逆反应)
< 80℃
浓 H2SO4
165℃
SO3H
96%
SO3H
165℃ / H2SO4
斥力较大
H SO3H
85%
H
SO3H
H
斥力较小
⑷付氏酰基化反应
AlCl3 + CH3COCl
CS2 或 C2H2Cl4 -15℃
硝基苯 200℃
COCH3 93%
COCH3 90%
⑸一取代萘的定位效应
由于邻对位定位基的致活作用,取代发生在同环,并且第 二个基团进入这个定位基的邻对位中的α位。
CH3
稠合芳烃与非苯芳烃
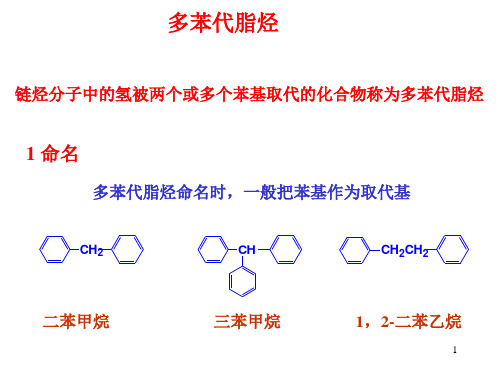
SO3H
85%
23
稠环化合物:萘
(1) 磺化反应的热力学控制和动力学控制:
E 反应进程
因萘的α-位电子云
较高,反应所需的活 化能ΔEα较低,在 较低的反应温度下即
可完成,反应是受动力学控制的。但因磺酸基的体积较大, 与8-位上的氢原子之间的距离小于H 与 SO3H 的半径之和,
故α-萘磺酸的稳定性较差。
O 80oC
O
O AlCl3 C6H5NO2 ,
CO2H
O
CH3
OH H2SO4 HNO3
OH NO2
NO2
NO2
32
休克尔规则和非苯芳香体系 一 非苯芳香体系
苯系以外的芳香体系统称为非苯芳香体系。
二 休克尔规则
判别单环化合物是否有芳香性的规则
含有 4n + 2 ( n = 0, 1, 2…..)个电子的 单环的、平面的、封闭共轭多烯具有芳香性。
α 萘乙酸 简称:NAA
26
稠环化合物:萘
NAA是一种植物生长激素,能促使植物生根、开花、 早熟、高产,对人畜无害。
(3)F-C酰基化反应:
+
+
+
+
COCClOCCCOl COCAOCllCCl l3lAl +
CAl3lAClAlC3llC3 l3
CO COCCOOCO
α 苯α 甲α苯酰α甲α萘苯酰苯甲苯萘甲酰甲酰萘酰萘萘
1968年测出了二 聚体的实际结构
Zn 2Ph3CCl CO2气流保护下进行
Ph3C•的苯溶液
<O>
振荡
(黄色)
苯
六苯乙烷
二聚体(油状物) 蒸发
Ph3C-O-O-CPh3
85%
23
稠环化合物:萘
(1) 磺化反应的热力学控制和动力学控制:
E 反应进程
因萘的α-位电子云
较高,反应所需的活 化能ΔEα较低,在 较低的反应温度下即
可完成,反应是受动力学控制的。但因磺酸基的体积较大, 与8-位上的氢原子之间的距离小于H 与 SO3H 的半径之和,
故α-萘磺酸的稳定性较差。
O 80oC
O
O AlCl3 C6H5NO2 ,
CO2H
O
CH3
OH H2SO4 HNO3
OH NO2
NO2
NO2
32
休克尔规则和非苯芳香体系 一 非苯芳香体系
苯系以外的芳香体系统称为非苯芳香体系。
二 休克尔规则
判别单环化合物是否有芳香性的规则
含有 4n + 2 ( n = 0, 1, 2…..)个电子的 单环的、平面的、封闭共轭多烯具有芳香性。
α 萘乙酸 简称:NAA
26
稠环化合物:萘
NAA是一种植物生长激素,能促使植物生根、开花、 早熟、高产,对人畜无害。
(3)F-C酰基化反应:
+
+
+
+
COCClOCCCOl COCAOCllCCl l3lAl +
CAl3lAClAlC3llC3 l3
CO COCCOOCO
α 苯α 甲α苯酰α甲α萘苯酰苯甲苯萘甲酰甲酰萘酰萘萘
1968年测出了二 聚体的实际结构
Zn 2Ph3CCl CO2气流保护下进行
Ph3C•的苯溶液
<O>
振荡
(黄色)
苯
六苯乙烷
二聚体(油状物) 蒸发
Ph3C-O-O-CPh3
第07章 多环芳烃和非苯芳烃

AlCl3 CS2 -15oC
O + CH 3CCl
AlCl3 C6H5NO2 250oC
75%
COCH3
90%
13
⑶ 萘的硝化和卤代
Br Br2 CH3COOH Cl2 I2 C6H6 Cl
72-75%
HNO3,H2SO4 50oC NO2
92%
4-5% +
NO2
92%
14
三、 萘的定位规律:
SO3H Na2CO3 SO3Na
NaOH 。 300 C
O Na
H
+
OH
12
⑵ F-C反应:
● 烷基化实际意义不大,但在萘的α-位引入羧甲基则有实际意义。
CH2COOH + ClCH2COOH
FeCl3 , KBr 。 200 ~ 218 C
α
萘乙酸 简称:NAA
COCH3
植物生长激素,能 促使植物生根、开 花、早熟、高产, 对人畜无害。
8
γ
α
3 9 2β 3 7 6 5 4 3 8 10 1 6 2 5 4 2 1 10 8 9
9
1
10
或
7
4
5
10
4
萘
蒽
注意萘、蒽和菲的编号, 没有H的一般没有取代基, 也不编号。
菲
0.142 0.136 α β 0.140
一、萘的结构:
0.139
苯的共轭能:150 kj· -1; mol 萘的共轭能:225 kj· -1。 mol 芳香性:苯 > 萘 > 菲 > 蒽。
μ = 3.335 + 10-30 C m
4. 富烯类:
μ = 3.669 + 10-30 C m
《芳烃及非苯芳烃》课件

详细描述
非苯芳烃可以根据其取代基和官能团的不同进行分类,如烯基、烷基、卤素、硝基等。这些不同的取代基和官能 团可以影响非苯芳烃的物理和化学性质。
非苯芳烃的合成方法
总结词
非苯芳烃可以通过多种合成方法获得。
详细描述
非苯芳烃可以通过多种化学反应合成,如烷基化反应、酰化反应、氧化反应等。这些合成方法可以根 据需要选择,以获得具有特定结构和性质的产物。
化工原料
01
02
芳烃是化工原料的重要组成部分,用于生产多种化学品,如苯酚、苯 胺、乙酸酐等。
非苯芳烃同样也是重要的化工原料,可用于生产农药、染料、香料等 精细化学品。
高分子材料合成
芳烃是合成高分子材料的重要 单体,如聚酯、聚酰胺和聚氨
酯等。
02
01
非苯芳烃也可以用于合成高分子 材料,如聚乙烯吡啶、聚苯乙烯
《芳烃及非苯芳烃》课件
目录
• 芳烃简介 • 芳烃的性质 • 非苯芳烃介绍 • 非苯芳烃的性质 • 芳烃与非苯芳烃的应用 • 芳烃与非苯芳烃的发展趋势与展望Fra bibliotek1芳烃简介
定义与特性
01
02
定义
特性
芳烃是一类具有芳香族特性的烃类化合物,通常具有闭合的环状结构 。
芳烃具有特殊的芳香族气味,化学性质稳定,不易发生氧化、水解等 反应。
04
非苯芳烃的性质
物理性质
熔点
非苯芳烃的熔点通常较高,因为它们具有较大的 分子量和较高的共轭程度。
沸点
由于非苯芳烃的分子间作用力较强,其沸点也较 高。
溶解性
非苯芳烃的溶解性取决于其分子结构,有些非苯 芳烃可以溶于有机溶剂,而有些则不易溶。
化学性质
加成反应
非苯芳烃可以发生加成反应,例如与氢、卤素等发生加成反应。
非苯芳烃可以根据其取代基和官能团的不同进行分类,如烯基、烷基、卤素、硝基等。这些不同的取代基和官能 团可以影响非苯芳烃的物理和化学性质。
非苯芳烃的合成方法
总结词
非苯芳烃可以通过多种合成方法获得。
详细描述
非苯芳烃可以通过多种化学反应合成,如烷基化反应、酰化反应、氧化反应等。这些合成方法可以根 据需要选择,以获得具有特定结构和性质的产物。
化工原料
01
02
芳烃是化工原料的重要组成部分,用于生产多种化学品,如苯酚、苯 胺、乙酸酐等。
非苯芳烃同样也是重要的化工原料,可用于生产农药、染料、香料等 精细化学品。
高分子材料合成
芳烃是合成高分子材料的重要 单体,如聚酯、聚酰胺和聚氨
酯等。
02
01
非苯芳烃也可以用于合成高分子 材料,如聚乙烯吡啶、聚苯乙烯
《芳烃及非苯芳烃》课件
目录
• 芳烃简介 • 芳烃的性质 • 非苯芳烃介绍 • 非苯芳烃的性质 • 芳烃与非苯芳烃的应用 • 芳烃与非苯芳烃的发展趋势与展望Fra bibliotek1芳烃简介
定义与特性
01
02
定义
特性
芳烃是一类具有芳香族特性的烃类化合物,通常具有闭合的环状结构 。
芳烃具有特殊的芳香族气味,化学性质稳定,不易发生氧化、水解等 反应。
04
非苯芳烃的性质
物理性质
熔点
非苯芳烃的熔点通常较高,因为它们具有较大的 分子量和较高的共轭程度。
沸点
由于非苯芳烃的分子间作用力较强,其沸点也较 高。
溶解性
非苯芳烃的溶解性取决于其分子结构,有些非苯 芳烃可以溶于有机溶剂,而有些则不易溶。
化学性质
加成反应
非苯芳烃可以发生加成反应,例如与氢、卤素等发生加成反应。
4-3非苯芳香烃

第四章芳香烃【学习要求】:
1、掌握芳香烃的命名及化学性质。
2、了解苯环上亲电取代反应历程,熟悉取代苯的定位基规则。
3、掌握休克尔规则。
【教学重点】:
取代苯的定位基定位规则
【教学难点】:
1、取代苯的定位基定位规则
2、芳香性及休克尔规则
【教学过程】:
苯的大π键分子轨道示意图
+ 119.6KJ/mol
+ 207.4KJ/mol
多为无色液体,不溶于水,易溶于有机溶剂,如乙醚、CCl
对位异构体的熔点一般比邻位和间位异构体的高(可能是由于对位
具有一定的毒性,吸入过量苯蒸气,急性中毒引起神经性头昏,并可发生再生障碍性贫血,急性白血病;慢性中毒造成肝损伤。
3
NO2 2
)
安徽科技学院理学院《有机化学》教案第四章
11。
第三节非苯芳烃

Π18
18
§4-3 非苯芳烃
一、休克尔规则 凯库勒发表了苯环的结构以后,就有人企图合成比 苯少一个或多一个双键的共轭环状化合物,看它们是否 与苯有相似的性质。如:
环丁二烯
环辛四烯
一、休克尔规则
环丁二烯的纯品一直不能制得,因为一旦形成便立 即分解或聚合了。没有芳香性。
环辛四烯己于1911年制得,它的性质与苯毫无共同 之处,而是与相应的链状烯烃(1,3,5,7-辛四烯)差不 多,也没有芳香性。
二、非苯芳烃
现已经合成了一些稳定的含取代基环丙烯正离子的 化合物。如: Cl Cl C6H5 C6H5
2.环戊二烯负离子
C6H5
(
Cl
+ (CH3)3COK
H H
)
-
Π5
6
H
二、非苯芳烃
3.环庚三烯正离子
H H⊕Βιβλιοθήκη + (C6H5)3C
+
4.轮烯 通常将十个碳原子以上的单环多烯烃CnHn(n≧10) 叫做轮烯。如: 〔18〕-轮烯
一、休克尔规则
休克尔规则:(4n+2)π电子规则 单环共轭多烯 环上所有的原子共处同一平面或 接近于平面 离域的 电子数为4n + 2 则该化合物具有芳香性
二、非苯芳烃
1.环丙烯正离子
H
–HH H
H
(
+
)
H
H
经测定环丙烯正离子的碳碳键长均为0.140nm,这说 明两个π 电子完全离域,平均分布在三个碳原子上。
第7章 芳烃及非苯芳烃

氨基
羟基
磺酸基
醛基
羧基
OH O NH2 OH O S O C H O C
OH
苯胺
苯酚
苯磺酸
苯甲醛
苯甲酸
多取代基时,作母体命名的官能团的优先规则: -X,-NO2,-OR,-R,-NH2,-OH,-COR,-CHO, -CN,-CONH2(酰胺),-COX(酰卤),-COOR (酯),-SO3H,-CO2H,-N+R3(季铵盐)
+
NO2
38%
58%
CH3 HNO3 + H2SO4
100oC
TNT黄色炸药
O2N
NO2NBiblioteka 23.磺化反应◆苯与浓硫酸的反应速度很慢:
SO 3H + H2SO 4 + H2O
◆苯与发烟硫酸则在室温下即生成苯磺酸:
SO 3H + H2SO 4 • SO 3 + H2SO 4
◆苯磺酸在更高温度下继续磺化,可生成间苯二 磺酸:
7.3.2 石油的芳构化
石油
分馏
20世纪40年代起
60-150oC
oC 500 C5-C7组份 芳香化合物 加压重整
铂重整:将轻汽油中含6~8个碳原子的烃类,在 催化剂铂或钯等存在下,于450~500℃进行脱氢、环 化和异构化等一系列复杂反应转变为芳烃的过程。 1.环烷烃催化脱氢
CH 3 CH 3
+
H Cl
该反应在苯环上引入一个氯磺酸基(-SO2Cl),即 为氯磺化反应。 苯的磺化反应是可逆的。 利用磺化的可逆性可保护苯环上的某些位置。
OH
H2SO4
OH
2molBr2
OH Br Br
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
单环轮烯p电子数,只计周边
两点注意: 1. 不仅看p电子数,有时可能因键角张力太大 或基团拥挤而无法共平面可能导致无芳香性。
H H A B C
A, B因角张力太大 不能共平面—无芳香性 C因环内质子拥挤,非键 斥力太大—不能存在,
2. 芳香稳定性——是相对于它们相应的定域键化合物 而言,并非都如苯一样稳定,事实上,有些在常温 下也是不稳定的。
2
m = 3,5,7……,奇数个p电子,总有一个未成对(自由基) m = 4,8,12……(4n),m/2-1个成键轨道,还有两个p电子在 非键轨道上,各占一个轨道。自旋平行,→ 双自由 基—极不稳定,电子的离域不但没有使分子稳定化, 反而大大提高能量→“反芳香性” m = 6,10…… 4n+2, 正好填满m/2个成键轨道,能量最低— —”芳香性”。
NMR证明其存在, 正电荷分散到苯环上
3). 五元环六电子—芳香性
酸性,Ka = 10-15 H (CH3)3COH + (CH3)3CONa H Ka = 10-45 H H Na+
Ph Ph Ph
Ph 原因 Ph Ph
Ph Ph Ph
Ph Ph Ph
μ= 6.3D出乎意料的大 烃类极性本应很小
两个环都满足 芳香性要求。
4). 七元环六电子—芳香性:
H Br2 H H Br H - HBr H H Br
Br-
产物不溶于乙醇, 而溶于水;+ AgAgBr 以正离子稳定存在
5). 八元环,十电子—芳香性
+ 2Na
2Na+
U4+
2.大环芳香化合物
轮烯 组成碳环的原子共平面 含4n+2个p电子 14, 18, 22, 26…… 芳香性
下列轮烯已合成,键平均化 NMR证明其具有抗磁环流——芳香性
[14]- 轮烯
[18]- 轮烯
Dewar等经计算预言:轮烯芳香性将消失于22-26之间 因为环增大—共平面难。 实际上:有三个26,一个30轮烯已合成,具有芳香性。
Hückel 规则不仅适用于碳环,也适用于杂环。
O S N H N
不计在内 有芳香性
二、 Hückel 规则
假定分子共平面,每个C 通式为CmHm的环多烯 原子各有一个p原子轨道 线性组成m个分子轨道 用简化的分子轨道法计算这些轨道的能量, 可近似地用内接于半径为2β的圆,顶角朝下 的正多边形顶点表示:
-1 0.618 2 -2 -1.618 2 -2 -1 1 2 -1.802 -0.445 1.24 2 -2 -1.414 1.414 2
非苯芳烃
一、芳香性:
高度不饱和,却不易发生加成,而发生取代; 不易氧化、降解,有特殊的稳定性。 定义含糊,无明确界线
由环状闭合大π键产生的“电子环流”, 电子离域产生稳定。 “抗磁环流”可以用NMR测定 单靠电子离域不一定产生芳香性(如 ) 组成环状共轭大π键的p电子数必须为4n+2(Hü ckel 规则),由结构式直接可判定芳香环,2电子-芳香性
Cl + SbCl5 Cl H O 2 Cl O SbCl6O-
从张力看,应生成偕二醇, 实际生成酮(因为可极化 成环丙稀正离子—芳香性。
2). 四元环,二价离子—芳香性
Ph Ph Br Ph Ph SbF5 Ph SO2 Ph Br Ph Ph Ph Ph Ph Ph
