7章稠环芳烃和非苯芳烃
合集下载
有机化学第七章(多)
CH3 CH3 CH3
4 3 2 1
1
α-甲基萘 β-甲基萘 1-甲基萘 2-甲基萘
SO3H
5 4 NO2
SO3H 2 3
4 3 2 1 OH
CH3 5
4-甲基-1-萘磺酸 5-硝基-2-萘磺酸
5-甲基-1质: (1)性状:无色片状晶体,mp:80.2℃,bp:218 ℃,有特殊气味。 性状: 有特殊气味。 性状 无色片状晶体, ℃ 有特殊气味 (2)易升华,蒸气有杀菌作用。用于做卫生球,用于杀菌防虫。 易升华, 易升华 蒸气有杀菌作用。用于做卫生球,用于杀菌防虫。 萘的化学性质与苯相似,但由于离域的不太好, 萘的化学性质与苯相似,但由于离域的不太好,π电子云不是均匀 分布,所以反应活性与苯相比,不仅比苯易进行亲电取代反应, 分布,所以反应活性与苯相比,不仅比苯易进行亲电取代反应, 而且也较易进行加成和氧化反应。 而且也较易进行加成和氧化反应。 1.亲电取代反应 亲电取代反应 萘环上的π电子云不是均匀分布,据测定,它的α 萘环上的π电子云不是均匀分布,据测定,它的α位上电子云密度 最高, 位次之, 位最低, 最高,β位次之,γ位最低,所以萘的亲电取代反应一般发生在 特殊情况下也能在β位反应。 α位。特殊情况下也能在β位反应。
CH3
(2)原来取代基为第二类定位基时,则钝化芳环,主要发生异环α 原来取代基为第二类定位基时,则钝化芳环,主要发生异环α 原来取代基为第二类定位基时 位取代。 -位取代。如: NO
2
NO2
萘亲电取代的定位规律
但是,萘的亲电取代反应有的不遵循定位规律, 但是,萘的亲电取代反应有的不遵循定位规律,如:
H2 SO4 H2O
9,10-蒽醌和它的衍生物是蒽醌类染料的主要原料。 -蒽醌和它的衍生物是蒽醌类染料的主要原料。
4 3 2 1
1
α-甲基萘 β-甲基萘 1-甲基萘 2-甲基萘
SO3H
5 4 NO2
SO3H 2 3
4 3 2 1 OH
CH3 5
4-甲基-1-萘磺酸 5-硝基-2-萘磺酸
5-甲基-1质: (1)性状:无色片状晶体,mp:80.2℃,bp:218 ℃,有特殊气味。 性状: 有特殊气味。 性状 无色片状晶体, ℃ 有特殊气味 (2)易升华,蒸气有杀菌作用。用于做卫生球,用于杀菌防虫。 易升华, 易升华 蒸气有杀菌作用。用于做卫生球,用于杀菌防虫。 萘的化学性质与苯相似,但由于离域的不太好, 萘的化学性质与苯相似,但由于离域的不太好,π电子云不是均匀 分布,所以反应活性与苯相比,不仅比苯易进行亲电取代反应, 分布,所以反应活性与苯相比,不仅比苯易进行亲电取代反应, 而且也较易进行加成和氧化反应。 而且也较易进行加成和氧化反应。 1.亲电取代反应 亲电取代反应 萘环上的π电子云不是均匀分布,据测定,它的α 萘环上的π电子云不是均匀分布,据测定,它的α位上电子云密度 最高, 位次之, 位最低, 最高,β位次之,γ位最低,所以萘的亲电取代反应一般发生在 特殊情况下也能在β位反应。 α位。特殊情况下也能在β位反应。
CH3
(2)原来取代基为第二类定位基时,则钝化芳环,主要发生异环α 原来取代基为第二类定位基时,则钝化芳环,主要发生异环α 原来取代基为第二类定位基时 位取代。 -位取代。如: NO
2
NO2
萘亲电取代的定位规律
但是,萘的亲电取代反应有的不遵循定位规律, 但是,萘的亲电取代反应有的不遵循定位规律,如:
H2 SO4 H2O
9,10-蒽醌和它的衍生物是蒽醌类染料的主要原料。 -蒽醌和它的衍生物是蒽醌类染料的主要原料。
ch7_多环芳烃和非苯芳烃

CrO3, HOAc 25 C O O O2 , V 2 O5 400--500 C O O
NO2 [O]
NO2 COOH COOH
NH2 [O] HOOC HOOC
电子云密度高 的环易被氧化
4 萘环的取代规律 p149
主
G(o,p)
次
热 热
G(o,p)
次 主
从动力学考虑 活化基团使反应在同 环发生。钝化基团使 反应在异环发生。 -位优于-位。
H H
HH HH
H H HH
H
H HH H
H
10-轮烯因环内 氢的相互作用, 使C不能同处 在同一平面内, 无芳香性。
14-轮烯 有芳香性 环内氢 0 ppm 环外氢7.6 ppm
16-轮烯 无芳香性
18-轮烯 有芳香性
1,1,4-三甲基-5-乙基环庚烷
1-甲基-3-异丙基-1-环己烯
3,7,7-三甲基双环[4.1.0] 庚烷
即
3 2
蒽
菲
环戊烷多氢菲本身不存在于自 然界中,但它的衍生物(胆固 醇、胆酸、维生素D、性激素 等)广泛分布在动植物体内, 它被称为甾族化合物骨架。
环戊烷多氢菲
蒽的伯齐还原
Na/NH3(液) C2H5OH Na/NH3(液) C2H5OH Na/NH3(液) C2H5OH
菲的氧化
KMnO4
COOH COOH
5 6 7
C2H5
CH3
1,3-二甲基萘
H3C 1 8 2-甲基-6-乙基萘
化学反应
亲电取代反应最易在萘的位 1.亲电取代反应 (p146) 萘的卤代、硝化主要发生在位上,磺化反应根据温 度不同,反应产物可为-萘磺酸或-萘磺酸。
有机化学第7章,ppt课件

7.4.1 反应类型及反应机理
1. 亲电取代反应概述
+
+ E
HEsp3杂E化sp2杂化
+
E
+
+ -H
+H+
亲电试剂 π络合物 σ络合物 取代苯
+H E H E+
讨论:1.当过渡态 + 比 + 稳定时,中间体 σ
络合物较难形成,一旦形成后很快转化成产物。
+H E
H E+
2.当过渡态 + 比 + 能量相近时,
ψ3
无节面
ψ1 苯的π 电子分子轨道重叠情况
7.3 单环芳香烃的物理性质
物理性质 苯和其同系物的芳烃一般都溶剂,如 乙醚、CCl4 、石油醚等非极性溶剂。具有一定 的毒性,吸入过量苯蒸气,急性中毒引起神经性 头昏,并可发生再生障碍性贫血,急性白血病; 慢性中毒造成肝损伤。
4. 6电子体系有中性分子、碳正离子和碳负离子。 —
苯
环 戊 二 烯 负 离 子
3. 10 π电子体系( n=2)
环辛四烯双负离子
126°46 ' 0.1334nm2K, THF
K
=
= 2K+
0.1462nm
K
成环C不在同一平面 无
π 电子=8
芳
不能形成环状共轭体系 性
成环C在同一平面 有芳 π 电子=10 n=2 性
三苯甲烷
萘
7.1.2 按4n+2规则的n分类
1. 2 π电子体系( n=0)
2.
具两个电子的环状结构是稳定的,有芳香
Ph性。
Ph
Ph Ph
+
有机化学第七章 芳烃

H
H
H
H
H
H
可以解释:为什么苯分子特别稳定? 为什么苯分子中碳碳键长完全等同? 为什么邻位二取代物只有一种?
(b)分子轨道理论 分子轨道理论认为:苯分子形成σ键后,苯的
六个碳原子上的六个P 轨道经线性组合可以形成六 个分子轨道,其中ψ1 、ψ2 和ψ3 是成键轨道,ψ4、 ψ5和 ψ6是反键轨道。当苯分子处于基态时六个电 子填满三个成键轨道,反键轨道则是空的。
-络合物
(b)硝化反应
2 H2SO4 HNO3
NO2
HNO3 H2SO4,45℃
CH3
HNO3 H2SO4,30℃
NO2
CH3 NO2
CH3
NO2
HNO3 H2SO4,95℃
NO2
NO2
NO2
H3O 2 HSO4
反应比苯容易 反应比苯困难
硝化反应机理
硝化反应中进攻试剂是NO2+,浓硫酸的作 用促进NO2+的生成:
苯环的特殊稳定性可以从它具有较低的氢化热 得到证明:
环己三烯氢化热=360kj/mol(假想值) 苯环氢化热=208kj/mol 相差152kj/mol
氢化热简图:
环己三烯+3H2
环己二烯+2H2
苯+3H2
环己烯+H2
231kj/mol
120kj/mol
208kj/mol
360kj/mol
环己烷
苯分子的近代概念
ቤተ መጻሕፍቲ ባይዱ
(1)煤的干馏
煤隔绝空气加热至1000~1300℃时分解所得到的 液态产物——煤焦油,其中含有大量芳烃化合物。 再经分馏得到各类芳烃。
馏分名称 轻油 酚油 萘油 洗油 蒽油
第七章芳香烃资料.

§7.1 芳香族化合物的分类
芳烃
单环 芳烃
分子中含一个苯环
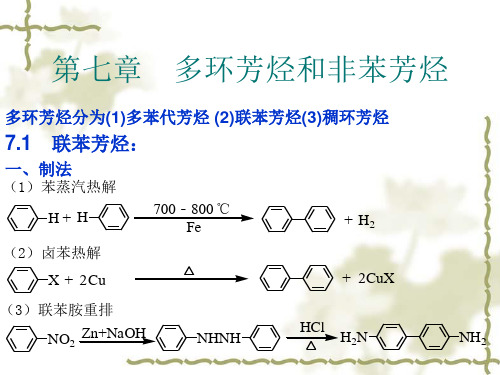
联苯 苯环各以环上 一个碳原子直 接相连。
CH3
联苯 mp.70.5
多环 芳烃
多苯代 脂肪烃
CH2
二苯甲烷 mp.27
芴 CmHp2.116
苯环共用相 稠环芳烃 邻两个以上
碳原子稠合 而成。
萘 mp.80.2
蒽 mp.218
单环芳烃
§7.2 苯的结构
道
E
节面
反键轨道
节面
成键轨道
苯的分子轨道模型
▪ 由于苯的大体系结构是封闭成环的,所以其电子 具有完全的离域性,分子内能进一步降低,因此具 有特殊的稳定性,即所谓的“芳香性”。
§7.3 单环芳烃的异构现象及命名
单环芳烃可看作是苯环上的氢原子被烃基取 代所得的衍生物,分为一烃基苯、二烃基苯、三烃 基苯等等。
一、一烃基苯
例:
只有一种,而无异 构体。命名时,以 苯环作母体,烃基 作取代基,称为某 烃(基)苯。
CH3
甲苯 methylbenzene
Bp. 111
CH2CH3
乙苯 ethylbenzene Bp. 136.2
二、二烃基苯
二烃基苯有三种异构体, 用数字或邻、间、对 (o-, m-, p-)表示取代基位置。 例如:
CH3 CH3
CH3
CH3
1,2-二甲苯 邻-二甲苯
o-二甲苯
CH3
1,3-二甲苯 间-二甲苯
m-二甲苯
CH3
1,4-二甲苯
对-二甲苯
p-二甲苯
o– orther
m– meta
p- para
三、三烃基苯 若三个相同烃基的三烃基苯也有三种异构体,例如:
《有机化学》第7章 芳香烃

若把反应步骤颠倒一下,先氧化,后硝化,那么所得的产物是单一的间硝基苯甲酸。
所以如果希望获得所需的产物,使用正确的反应步骤是重要的。
2023/6/13
18
第三节 稠环芳烃
一、 萘
萘,分子式C10H8,光亮的片状结构,熔点80.2 ℃,沸点218 ℃,有特殊气味,易 升华,不溶于水,易溶于乙醇、乙醚、苯等有机溶剂。其化学性质与苯相似。
2023/6/13
11
⑷ 傅-克(Friedel-Crafts)反应 ① 烷基化反应 凡在有机化合物分子中引入烷基的反应,称为烷基化反应。反
应中提供烷基的试剂叫烷基化剂,它可以是卤代烷、烯烃和醇。
当烷基化剂含有三个或三个以上直链碳原子时,产物发生碳链异构。
② 酰基化反应 凡在有机化合物分子中引入酰基(
①若原有两个取代基不是同一类的,则第三个取代基进入的位置一般受邻、对 位定位基的支配,因为邻、对位基反应的速率大于间位基。
②若原有两个取代基是同一类的,则第三个取代基进入的位置主要受强的定位基 的支配。
2023/6/13
17
⑵ 选择适当的合成路线
例如:由甲苯制备对硝基苯甲酸。
比较这两个结构,反应步骤必须是先硝化,后侧链氧化。
1.取代反应
在萘环上,p电子的离域并不像苯环那样完全平均化,而是在α-碳原子上的电子 云密度较高,β-碳原子上次之,中间共用的两个碳原子上更小,因此亲电取代反应 一般发生在α位。
⑴ 卤化反应
在Fe或FeCl3存在下,将Cl2 通入萘的苯溶液中,主要得到α-氯萘。α-氯萘为无 色液体,沸点259 ℃,可做高沸点溶剂和增塑剂。
2023/6/13
6
苯分子去掉一个氢原子后的基团(C6H5―)叫做苯基,也可以用Ph―代 表。芳烃分子的芳环上去掉一个氢原子后的基团叫做芳基,可用Ar―代表。甲 苯分子中苯环上去掉一个氢原子后所得的基团CH3C6H5―称甲苯基;如果甲苯 的甲基上去掉一个氢原子,C6H5CH2―称苯甲基,又称苄基。
所以如果希望获得所需的产物,使用正确的反应步骤是重要的。
2023/6/13
18
第三节 稠环芳烃
一、 萘
萘,分子式C10H8,光亮的片状结构,熔点80.2 ℃,沸点218 ℃,有特殊气味,易 升华,不溶于水,易溶于乙醇、乙醚、苯等有机溶剂。其化学性质与苯相似。
2023/6/13
11
⑷ 傅-克(Friedel-Crafts)反应 ① 烷基化反应 凡在有机化合物分子中引入烷基的反应,称为烷基化反应。反
应中提供烷基的试剂叫烷基化剂,它可以是卤代烷、烯烃和醇。
当烷基化剂含有三个或三个以上直链碳原子时,产物发生碳链异构。
② 酰基化反应 凡在有机化合物分子中引入酰基(
①若原有两个取代基不是同一类的,则第三个取代基进入的位置一般受邻、对 位定位基的支配,因为邻、对位基反应的速率大于间位基。
②若原有两个取代基是同一类的,则第三个取代基进入的位置主要受强的定位基 的支配。
2023/6/13
17
⑵ 选择适当的合成路线
例如:由甲苯制备对硝基苯甲酸。
比较这两个结构,反应步骤必须是先硝化,后侧链氧化。
1.取代反应
在萘环上,p电子的离域并不像苯环那样完全平均化,而是在α-碳原子上的电子 云密度较高,β-碳原子上次之,中间共用的两个碳原子上更小,因此亲电取代反应 一般发生在α位。
⑴ 卤化反应
在Fe或FeCl3存在下,将Cl2 通入萘的苯溶液中,主要得到α-氯萘。α-氯萘为无 色液体,沸点259 ℃,可做高沸点溶剂和增塑剂。
2023/6/13
6
苯分子去掉一个氢原子后的基团(C6H5―)叫做苯基,也可以用Ph―代 表。芳烃分子的芳环上去掉一个氢原子后的基团叫做芳基,可用Ar―代表。甲 苯分子中苯环上去掉一个氢原子后所得的基团CH3C6H5―称甲苯基;如果甲苯 的甲基上去掉一个氢原子,C6H5CH2―称苯甲基,又称苄基。
有机化学第七章 芳烃
1
一、教学目的和要求 通过对本章的学习,掌握芳烃的定义、分类、苯的结构、 闭合共轭体系、芳香性及苯的同系物的命名,掌握苯环上 的亲电取代反应及定位规则,侧链卤代和氧化反应,掌握 萘的结构及命名,萘的亲电取代反应、氧化反应;熟悉休 克尔规则及非苯芳烃的芳香性判断;了解联苯、蒽、菲的 结构及命名以及苯及其同系物的主要物理性质(易燃性)。 二、教学重点内容 芳烃的结构、闭合共轭体系、命名、亲电取代反应及其定 位规律、侧链氧化、萘的结构、命名及亲电取代反应、非 苯芳烃芳香性的判断是本章的重点。
CH3 CH3 CH3
(1)单环芳烃
苯 甲苯 间二甲苯
(2)多环芳烃
连 苯 三
C H 苯 甲
烷
(3)稠环芳烃
萘 蒽 菲
4
5.1
芳烃的构造异构和命名
5.1.1 构造异构
苯及其同系物的通式为:CnH2n-6。 例如苯有六个碳和六个氢,其六个碳和六个氢是等同的; 结构异构: 一元取代:只有一种
CH3 CH CH2 H3C CH CH3
(a)
(b) (c) (d) (e)
卤化
硝化 磺化 Friedel-Crafts反应 氯甲基化
17
(1)亲电取代反应
(a) 卤化
苯环上和卤代反应较困难,常用FeX3(Lewis酸)作催化剂。
+ Cl2
FeCl3,25oC 90%
Cl + HCl
控制苯过量,不要太激烈,避免二卤代。 因是亲电反应,所以苯的同系物(甲苯)比苯更易反应。 Cl 卤代活性: F2>Cl2>Br2>ICH CH3 CH3 CH3 2。 3
14
5.3
单环芳烃的物理性质
第七章 芳香烃(2)
定位效应包括两方面:(1)基团所进入的位置; (2)反应的速度快慢。
42
CH3
H2SO4+ HNO3
30 ℃
CH3 NO2
( O + P = 96.5 %)
56.5 %
CH3
NO2
40 %
NO2
H2SO4+ HNO3
90~100 ℃
(O + P = 6.7%)
NO2
NO2
93.2%
NO2 NO2
6.4%
结构特点:与苯环直接相连的原子多数含有未共用 电子对。
44
2. 间位定位基—第二类定位基(钝化 苯环)
强致钝基:-N+R3, -NO2, -CX3 中等致钝基: -CN, -SO3H, -COR(H), -CO2H, -CCl3 弱致钝基:-COOR,-CONHCH3, -CONH2, -NH3, etc.
H
O
X
CR
卤代反应 NO2
SO3H
R 酰基化 反应
硝化反应
20
磺化反应 烷基化反应
反应机理: 亲电取代反应
sp2 + E+
E+ 慢
sp3
H -H+
+
E
sp2 E
亲电试剂 络合物
络合物
产物
用极限式表示中间体 络合物 :
H
H
E
E
+
+
21
+H E
1.卤代反应
卤 素:Cl2 、Br2 催化剂:FeX3 AlCl3 ZnCl2或 Fe
具有三个相同烃基的取代苯也有三种异构体。如:
CH3 CH3
07多环芳烃和稠环芳烃
I + Cu
+
CuI
HNO3 H2SO4 O2N
HNO3 H2SO4 O2N NO2
NO2
Zn NaOH
N N H H
HCl
H2N
NH2
二 二氢 氢氢
联氢 联
7.2 稠环芳烃
7.2.1 萘及其衍生物
主要来源:煤焦油(约6%)。
8 1
(1) 结构、异构、命名 结构、异构、
它的结构与苯类似: 环状共轭体系。 共平面 电子离域 但键长不完全等长。 常用右式表示。 异构、命名(略)。
–
+
[14]轮烯
[16]轮烯
[18]轮烯
*芳香性阴离子及芳香性阳离子
¨ H
+ H
富勒烯
C60
球体表面π 球体表面 电子离域, 电子离域, 形成球状大 π键。 键
关于芳香性的含义小结: 关于芳香性的含义小结:
环的平面结构,单双键交替, 1、环的平面结构,单双键交替,形成环状大 π -键 。 2、存在离域能。环结构的化学安定性和环氢 存在离域能。 的活泼性。 的活泼性。 3、符合 4n+2 规则。 规则。 4、环电流和环外质子的去屏效应(详见核磁共
第七章 绸环芳烃
目 录
稠环芳烃的分类 7.1 联苯及其衍生物 7.2 稠环芳烃 7.3 非苯芳烃及休克尔规则 芳香性的含义
第七章 多环芳烃和非苯芳烃
分类: 分类:一般是按苯环的联结情况进行分类 1、联苯和联多苯 联苯、对联三苯、 如:联苯、对联三苯、联四苯等 2、多苯代脂肪烃类 二苯甲烷、三苯甲烷、 如:二苯甲烷、三苯甲烷、1,2-二苯乙烯 二苯乙烯 3、稠环芳烃 如:萘、蒽、菲等 其中,在多环芳烃中以稠环芳烃比较重要。 其中,在多环芳烃中以稠环芳烃比较重要。
第七章芳香烃
7.1.2 按苯环数目和结合方式分类
按苯环数目分类:单环芳烃、 多环芳烃 、非苯芳烃
CH(CH3)2
CH3
苯
间甲基异丙苯
萘
菲
蒽
芘
苯并芘 (强效致癌物质)
3
联苯 三苯基甲烷
反-二苯乙烯
[18]-轮烯 富勒烯 (非苯芳烃)
4
7.2 苯的结构 7.2.1 苯的结构研究历史
1825年,Faraday从路灯照明燃气凝结液中 分离出来,测定实验式CH。 1833年,确定分子式C6H6,有下列反应。
OCH3 CH3
主要产物
COOH NO2
主要产物
CH3 CI
混合物
36
(3)苯环上原有两个取代基对引入第三个取代基的定 位作用不一致,两个取代基属不同类定位基时,这时 第三个取代基进入苯环的位置主要由第一类定位基定 位:
NHCOCH3 COOH O2N CH3
在考虑第三个取代基进入苯环的位置时,除考虑 原有两个取代基的定位作用外,还应该考虑空间位 阻,如 3-乙酰氨基苯甲酸的 2 位取代产物很少。
Ⅰa
CH3
+
H E
+
CH3
Ⅰc
Ⅰb
+
H E
CH3
CH3 或 H E
+
进攻对位:
CH3
+
CH3 H E
Ⅱc
+
H E
Ⅱ
H E
Ⅱb
Ⅱa
CH3
CH3
+
CH3
+
进攻间位:
+ H或 E
CH3 H +E
Ⅲc
H
E
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
③还原反应
Na, lig.NH3 ROH
Birch还原1,4-二源自萘2.蒽和菲 (C14H10)
8 7 6 5 10 4 9 1 2 3 6 7 8 9 4 5
3 2 1 10
环闭共轭体系(大键); 离域能:苯>萘>菲>蒽 9,10位化学活性较大。
O HNO3
O
Na ROH
O + O O O O O
+
CH3COCl
AlCl3
COCH3
phNO2
(90%)
一取代萘的定位效应
G(act.) G(act.) G(deact.) G(deact.)
CH3 ClSO3H CCl4 ,OoC
CH3
SO3H
NO2 HNO3 H2SO4,0 C NO2
o
NO2 +
NO2
NO2
②氧化反应
NO2(deact.) [O] NO2 COOH COOH NH2(act.) COOH [O] COOH
第七章
稠环芳烃和非苯芳烃
一、稠环芳烃
1. 萘 (C10H8) 1)结构
142.1
环闭共轭体系(大键);
136.3pm
142.3
C-C键长不完全等同;
电子云不完全平均化;
离域能 ~255kJ/mol。
141.8
2) 化学性质
① 亲电取代 (反应条件较温和,取代主要发生在α 位。)
H E
+
H
E 其它贡献较小的共振式
• 芳香化合物的共性 2. 休克尔(Hü ckel)规则 环闭的共轭体系,共轭体系中成环的原子处于同一平面,其
电子数为4n+2时(n=0,1,2,3...整数),具有芳香性。
电子数
n
6 1
10 2
14 3
14 3
3. 非苯芳香化合物 1)芳香离子
_ 2K
环戊二烯负离子
_ _ _
环辛四烯双负离子 判断下列离子有无芳香性?
3.致癌芳烃
8 7 6 5 10 4 9 1 2 3
6 5 1 2
CH3
CH3
5,10-二甲基-1,2-苯并蒽
5 4 3 9 1 10 6 7
1,2,5,6-二苯并蒽
3 4
2
8
1
2
2,3-苯并芘
1,2,3,4-二苯并菲
二、非苯芳烃
1.芳香性
H 5.77ppm H 7.27ppm H H H 6.95ppm H 7.21ppm -0.5 ppm
COCH3
神奇的全碳分子——富勒烯
C60
C70
H
+
+
E
其它贡献较小的共振式
Br 卤化 + Br2
CH3COOH (75%)
NO2 硝化 + HNO3
H2SO4 (95%)
[磺化] 可逆。低温有利α 位取代,高温有利β 位取代。
SO3H 动力学控制
H2SO4 H2SO4 ~1600C
SO3H 热力学控制
[酰化] 定位与溶剂及温度有关
CS2
COCH3 (93%)
+ ++ -+
有
有
有
有
2)轮烯 单环共轭多烯亦称轮烯。 例如:环丁二烯、环辛四烯、环癸五烯、环十八碳九烯等
[4]轮烯
[8]轮烯
[10]轮烯
[18]轮烯
共平面的(4n+2)轮烯具有芳香性
H H HH H H H H
无
无
有
( 非平面性)
茚和薁(yù )
茚
Na _
无
有
+ _ + _
薁
O CH3CCl AlCl3
