植物细胞融合(实验)
植物体细胞杂交技术

法规限制
1
法规限制:植物体细胞杂交技术涉及基因编辑,可能受到相关法规的限制
2
伦理问题:植物体细胞杂交技术可能引发伦理问题,如基因编辑后的植物是否具有生命权等
3
技术难度:植物体细胞杂交技术难度较大,需要较高的技术水平和设备支持
4
安全性问题:植物体细胞杂交技术可能存在安全隐患,如基因编辑后的植物可能对环境造成影响
4
植物体细胞杂交技术的未来发展
技术优化
提高杂交效率:通过优化培养条件、选择合适的细胞融合方法等提高杂交效率
提高稳定性:通过优化培养条件、选择合适的细胞融合方法等提高杂交稳定性
提高产量:通过优化培养条件、选择合适的细胞融合方法等提高产量
降低成本:通过优化培养条件、选择合适的细胞融合方法等降低成本
法规完善
法规制定:制定植物体细胞杂交技术的相关法规,明确技术应用范围和限制
01
法规执行:加强法规执行,确保技术应用符合法规要求
02
法规修订:根据技术发展和社会需求,适时修订法规,适应新技术的发展
03
法规宣传:加强法规宣传,提高公众对植物体细胞杂交技术的认识和了解
04
谢谢
杂种植株经过筛选和鉴定,获得具有优良性状的新品种
技术应用
植物育种:提高作物产量和品质
生物制药:生产药用植物成分
环境保护:修复污染土壤和生态修复
生物技术研究:探索植物基因功能和调控机制
技术发展历程
01
19世纪末,植物体细胞杂交技术开始出现
02
20世纪初,植物体细胞杂交技术逐渐成熟
03
20世纪中叶,植物体细胞杂交技术广泛应用于农业生产
04
21世纪初,植物体细胞杂交技术在生物制药、环境保护等领域得到广泛应用
植物细胞融合共50页PPT

不存在杂合型,进行RAPD遗传分析时,与共显性标记具
有同样的遗传行为,是天然的优良作图材料。现在已进行
原生质体融合方法
• 原生质体融合采用PEG融合法,按Ryschka的 方法进行,略作修改,步骤如下:按1:1的比例混 合供体、受体的原生质体,混合均匀。在直径为 5cm的无菌塑料培养皿中滴加7滴混合原生质体溶 液,每滴40μl,静止放置10min使原生质体沉积在 培养皿底部。然后在每滴两侧加60μl 40%的PEG 溶液。5min后,稍微倾斜培养皿去掉培养皿中的 混合液。随后,小心加入13%的PEG溶液2mL, 5min后去掉。再小心加入6.7%的PEG溶液 2mL,5min后去掉。用1/2培养基洗涤培养皿两次, 最后,加入1/2培养基2mL用于原生质体培养。
植物细胞融合
1、 舟 遥 遥 以 轻飏, 风飘飘 而吹衣 。 2、 秋 菊 有 佳 色,裛 露掇其 英。 3、 日 月 掷 人 去,有 志不获 骋。 4、 未 言 心 相 醉,不 再接杯 酒。 5、 黄 发 垂 髫 ,并怡 然自乐 。
植物细胞融合技术(补充)
周有文
无性杂交(asexual hybridization):使两个亲本的原生质体融合成为一个 具双亲遗传物质的杂种细胞,并在人工培养下使之形成杂种果树的杂 交方法。无性杂交不受亲缘关系限制,特别是某些不能有性杂交的果 树,可以采用无性杂交方法育种,培育新的果树类型。其选择杂交亲 本的范围比有性杂交更广泛,遗传基础更复杂。
• 遗传图谱构建的问题
•
RAPD是一种显性标记,符合孟德尔遗传定律,不能
区分杂合型和纯合型,因此在遗传分析及遗传图谱的构建
等一些方面受到限制。目前,在实践中,主要利用了以下
2种方法。
•
植物细胞融合(实验)

准备仪器
准备适当的显微镜、离心 机、摇床、培养皿等实验 仪器。
分离原生质体
表面消毒
将实验材料表面消毒,以避免污染。
酶解
用适当的酶溶液处理实验材料,使细胞壁分解,释放 出原生质体。
分离
将酶解后的组织用离心机或过滤法分离出生质体。鉴定通过形态学观察、分子生 物学技术或免疫学技术等 方法对融合细胞进行鉴定。
培养与繁殖
将筛选和鉴定合格的融合 细胞进行培养和繁殖,以 备后续实验或应用。
03
植物细胞融合实验结果分 析
融合细胞的筛选结果
1 2
筛选方法
采用抗性筛选和荧光激活细胞分选(FACS)等 方法,从融合细胞群体中筛选出具有稳定融合特 征的细胞。
筛选和培育融合细胞
在融合后的细胞中筛选具有双亲遗传 特征的融合细胞,并进行进一步的培 育和筛选。
克隆和繁殖
对筛选出的融合细胞进行克隆和繁殖, 获得具有特定性状的植物个体。
02
植物细胞融合实验步骤
准备实验材料
01
02
03
选择实验材料
选择健康、无病虫害的植 物组织作为实验材料,如 根、茎、叶等。
准备试剂
植物细胞融合(实验)
目录
• 植物细胞融合实验简介 • 植物细胞融合实验步骤 • 植物细胞融合实验结果分析 • 植物细胞融合实验的应用与展望 • 结论
01
植物细胞融合实验简介
植物细胞融合的定义
01
植物细胞融合是指将来自不同植 物的细胞通过物理或化学方法诱 导融合,形成一个具有双亲遗传 特征的融合细胞的过程。
植物细胞融合技术可以用于新品种的培育和遗传改良,未来可以开展 相关研究,为育种工作提供新的工具和方法。
植物体细胞杂交技术的流程

植物体细胞杂交技术的流程下载温馨提示:该文档是我店铺精心编制而成,希望大家下载以后,能够帮助大家解决实际的问题。
文档下载后可定制随意修改,请根据实际需要进行相应的调整和使用,谢谢!并且,本店铺为大家提供各种各样类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,如想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by theeditor. I hope that after you download them,they can help yousolve practical problems. The document can be customized andmodified after downloading,please adjust and use it according toactual needs, thank you!In addition, our shop provides you with various types ofpractical materials,such as educational essays, diaryappreciation,sentence excerpts,ancient poems,classic articles,topic composition,work summary,word parsing,copy excerpts,other materials and so on,want to know different data formats andwriting methods,please pay attention!植物体细胞杂交技术的流程一、准备工作阶段。
在开展植物体细胞杂交技术之前,要进行充分的准备。
植物组织培养第七章植物原生质体培养及细胞融合

202X
CIICK HERE TO ADD A TITLE
单击添加副标题
第 七 章 植物原生质体培养及细胞融合
陈传红 制作 2007 / 5
202X
本章内容提要: 原生质体培养的发展与意义 原生质体的分离 原生质体的培养 植物细胞的融合 体细胞杂种鉴定方法
1975年柑桔原生质体培养成功;
2
现有:苹果、猕猴桃、柿、枇杷、马铃薯、番茄、矮牵牛等作物的原生质体培养成功;木本植物中柑桔最为成功。
3
陈传红 制作 2007 / 5
番茄+马铃薯?
陈传红 制作 2007 / 5
3、融合方法
01
02
1、机械分离(Machanical isolation)
Cut plasmolyzed tissue and subsequent deplasmolysis results in expansion and release of the protoplasts from the cut ends of the cell.
高度液泡化的细胞
陈传红 制作 2007 / 5
2、 酶解分离(Enzymatic isolation)
双子叶外植体/培养细胞
单子叶植物胚性细胞
2.1 材料 应选择生长旺盛的植物体幼嫩部分。叶肉细胞分离原生质体,来源方便,有明显的叶绿体,便于在融合中认识。 但禾本科叶肉原生质体往往不能分裂,因此常采用悬浮细胞作为分离原生质体的材料,最适宜的细胞是处于对数生长早期的细胞。
单击添加副标题
清新立春时节
什么是原生质体(Protoplast)?
1880, Hanstein:质壁分离时,能够与细胞壁分开的那部分细胞物质 含义:去掉细胞壁的由质膜包裹、具有生活力的裸露细胞。
植物细胞融合

结果与分析
活力很低, 活力很低,取 该条件下作为 一个融合亲本
取该条件下作为 一个融合亲本
融合原生质体细胞的分裂
初始培养的1 初始培养的1-2 天, 异核体较易识别。 异核体较易识别。
绿色的霸王原生质体 与红色的草木樨状黄 芪原生质体粘连。 芪原生质体粘连。
UV照射3 UV照射3分钟的霸王原生质体 照射 与经R 6G处理的草木樨状黄 与经R-6G处理的草木樨状黄 芪原生质体融合产物
优点: 优点:可以收集到数量 较大的纯净原生质体, 较大的纯净原生质体, 同时避免收集过程中 原生质体因相互挤压 而破碎。 而破碎。
活力检测
酚藏花红染色法: 酚藏花红染色法: 0.1%酚藏 0.1%酚藏 花红能使有活力的 原生质体染成红色, 原生质体染成红色, 无活力的原生质体 不着色。 不着色。
返回
亲本原生质体的预处理
预 处 理
的 原生质体 的 原生质体
处理
·
处理的
处理
处理
处理的
处理
返回
原生质体诱导融合
融合比例:大约1:1 融合比例:大约1:1 诱导剂:聚乙二醇(polyethyleneglycol诱导剂:聚乙二醇(polyethyleneglycol(polyethyleneglycol PEG)融合诱导液 PEG)融合诱导液 最终状态: 最终状态:形成杂种小愈伤组织
具体步骤
1.亲本原生质体的分离、收集纯化及活力检测 亲本原生质体的分离、 亲本原生质体的分离 2.亲本原生质体的预处理 2.亲本原生质体的预处理 3.原生质体诱导融合 3.原生质体诱导融合 4.杂种融合细胞的鉴别和筛选 4.杂种融合细胞的鉴别和筛选 5.杂种融合细胞的培养和杂种愈伤组织的形成及分化 5.杂种融合细胞的培养和杂种愈伤组织的形成及分化 6.杂种愈伤组织的RAPD分析和线粒体CAPS分析 杂种愈伤组织的RAPD分析和线粒体CAPS 6.杂种愈伤组织的RAPD分析和线粒体CAPS分析 7.杂种愈伤组织对渗透胁迫的抗性分析 7.杂种愈伤组织对渗透胁迫的抗性分析 8.PEG PEG胁迫下杂种愈伤组织的游离脯氨酸含 8.PEG胁迫下杂种愈伤组织的游离脯氨酸含
植物细胞融合(实验)
Potato plants growing in a test tube
Phenotype of intraspecific diploids of S. tuberosum
US-W9310.3 Somatic hybrid US-W9545.99
在原生质体细胞膜与膜紧密接触的部 位,膜内蛋白质颗粒易位并凝聚。接着可 能是相邻的剥去蛋白质的细胞膜间的类脂 质与类脂质反应。继之,类脂质分子的扰 动和重排导致接触的细胞膜局部发生融合, 形成很小的细胞质桥,之后它逐渐扩大, 两个原生质体最终融合。
使用化学促融剂时,Ca2+是必需的。 关于Ca2+的作用机理,有的认为是Ca2+和 PO43-形成不溶于水的配合物,成为细胞间 的钙桥,由此引起融合。也有解释为Ca2+ 结合到带负电磷脂的电离基上,使磷脂分 子在膜上相互分离,由此引起融合。
Putative somatic hybrid plants
A fertile somatic hybrid
Phenotype of somatic hybrids clearly shows characteristics of both parents
S. brevidens somatic hybrid S. tuberosum
电融合法原生质体的融合结果
原生质体成串(40×)
原生质体融合(图1)
电融合法原生质体的融合结果
原生质体融合(图2) 原生质体融合(图3)
简述植物细胞融合过程

简述植物细胞融合过程植物细胞融合是指两个或多个植物细胞融合成一个细胞的过程。
这种细胞融合过程在植物中具有重要的生物学意义,可以产生新的基因组合,促进遗传变异和进化。
下面将以标题“植物细胞融合过程”为线索,简述植物细胞融合的过程。
植物细胞融合过程主要分为两类:有性融合和无性融合。
有性融合是指两个植物细胞通过生殖细胞的融合来形成新的细胞。
无性融合则是指两个植物细胞通过非生殖细胞的融合来形成新的细胞。
在有性融合中,花粉管是植物细胞融合的重要组成部分。
花粉管是花粉萌发后形成的管状结构,它通过花粉管的生长,将花粉颗粒中的两个生殖细胞输送到雌蕊内。
当花粉管生长到胚珠位置时,花粉管会穿过胚珠表皮,进入胚珠内部。
然后,花粉管会与胚珠中的一个特殊细胞——卵细胞融合,形成受精卵。
受精卵是植物细胞融合过程中的一个重要步骤,它具有两个细胞核,一个是雄性核,来自花粉管,另一个是雌性核,来自卵细胞。
无性融合是植物细胞融合过程中的另一种方式,它包括多种形式,如质体融合、细胞融合等。
在质体融合中,两个植物细胞的质体会融合成一个新的质体。
质体是细胞内的一种特殊结构,具有自主繁殖的能力。
质体融合可以促进基因的重新组合和遗传变异,对植物的进化起到重要作用。
细胞融合则是指两个植物细胞的细胞质融合成一个新的细胞质。
细胞融合在植物繁殖和生长过程中起到重要的作用,可以增加植物的遗传多样性。
植物细胞融合过程中,融合的细胞通常需要通过某种方式接触和识别对方细胞。
这通常涉及到一系列的信号传递和识别机制。
例如,在花粉管与卵细胞融合的过程中,花粉管会释放一种化学物质,称为花粉管引导物质,它能够吸引和诱导花粉管的生长方向,使其朝向卵细胞。
同时,卵细胞也会释放化学物质,称为卵细胞诱导物质,它能够识别花粉管的到来,并与之融合。
植物细胞融合过程中,细胞融合的结果通常是形成一个新的细胞,这个细胞具有两个或多个细胞核。
这种细胞被称为合子细胞。
合子细胞具有两个或多个不同的基因组合,因此具有较高的遗传多样性。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
植物细胞融合(实验)
一、细胞融合的目的和意义
细胞融合能实现远缘杂交。其意义在 于打破了仅仅依赖有性杂交重组基因创造 新种的界限,有可能形成有性杂交方法无 法获得的新型杂种植物,广泛组合各种基 因型,扩大了遗传物质的重组范围。
植物细胞融合(实验)
二、细胞融合(cell fusion)概念
在外力(诱导剂或促融合剂)作用下,两个或两 个以上的异源细胞或原生质体相互接触,从而发生 膜融合、胞质融合和核融合并形成杂种细胞的现象。
通过细胞培养技术,这个细胞有可能发育成完 整的生物个体,这个杂种后代有可能兼有两个上代 的一些优良性状。
植物细胞融合(实验)
细胞在融合过程中发生的主要变化:
呈致密状态的体细胞在促融合剂的作用 下,细胞膜的性质发生变化。 首先出现 细胞凝集现象;然后部分凝集细胞之间的 膜发生粘连;继而融合形成多核细胞;在 培养过程中多核细胞又进行核的融合而成 为单核的杂种细胞,而那些不能形成单核 的融合细胞在培养过程中逐渐死亡。
电处理融合法是20世纪80年代发展起 来的细胞融合技术,使融合率大为提高。
植物细胞融合(实验)
Model ECM830 from BTX
植物细胞融合(实验) Electroporator 2510 from Brinkmann
电融合过程的分子机制: 是以电降解及双向电泳的联合作用为
基础。通过电泳,两细胞膜紧密接触,且 膜表面的蛋白质分子分离,产生了无蛋白 的类脂区。
植物细胞融合(实验)
电脉冲作用时引起膜结构局部扰乱, 出现小孔洞。而相对的脂双层间分子在范 德华力作用下,形成脂分子桥。由于连接 处的细胞膜表面曲率大,处于高张力状态, 在热力学上是不稳定的,所以最终导致两 细胞逐渐融合成一个圆形的大球状细胞。
植物细胞融合(实验)
A Alignment:
Cells are brought into close contact by means of dielectrophor esis.
B Fusion pulse: C Heterokaryon
phase:
A squarewave
pulse of a mere The cell
15
membranes are
microseconds
fused
is applied in
complecytoplasm
植物细胞融合(实验)
三、细胞融合技术原理和方法
由于体外培养的细胞很少会发生自发 融合(融合频率大约在10-4~10-6之间), 因此要采用生物、化学或物理的方法人为 地促使细胞融合。
植物细胞融合(实验)
促细胞融合的方法有: (一)病毒促进细胞融合
其中仙台病毒(HVJ)是最早用于动物细胞融 合的融合剂。 (二)化学融合剂促进细胞融合
主要包括盐类融合剂、聚乙二醇(PEG)、 二甲亚砜(DMSO)、甘油-醋酸酯、油酸盐、脂 质、Ca2+配合物等。 (三)电处理融合法
植物细胞融合(实验)
聚乙二醇(polyethylene glycol,PEG)融合 在众多的化学试剂中,PEG应用最为
广泛,因PEG液比病毒更易制备和控制、 活性稳定、使用方便、而且促进细胞融合 的能力更强。PEG是一种多聚化合物。
植物细胞融合(实验)
使用化学促融剂时,Ca2+是必需的。 关于Ca2+的作用机理,有的认为是Ca2+和 PO43-形成不溶于水的配合物,成为细胞间 的钙桥,由此引起融合。也有解释为Ca2+ 结合到带负电磷脂的电离基上,使磷脂分 子在膜上相互分离,由此引起融合。
植物细胞融合(实验)
电融合(electrofusion technique)法:
再用1~5V/cm直流电脉冲/微秒冲击细 胞或原生质体的粘接点,细胞膜降解造成 若干微孔,于是在膜之间形成通道,使细 胞质得以交换;最后导致新的球状细胞的 形成。
植物细胞融合(实验)
电融合法优点(与PEG法比较):
1、融合率高; 2、重复性强;
Electrofusion
3、诱导仅发生在质膜接触部位,对细胞 或原生质
Fusion phases of oat protoplasts (Avena sativa)
植物细胞融合(实验)
实际操作: 先把待融合的细胞或原生质体混合,取
样置于100V/cm的高频交流电场中,在非 均匀交流电场中形成项链状排列;
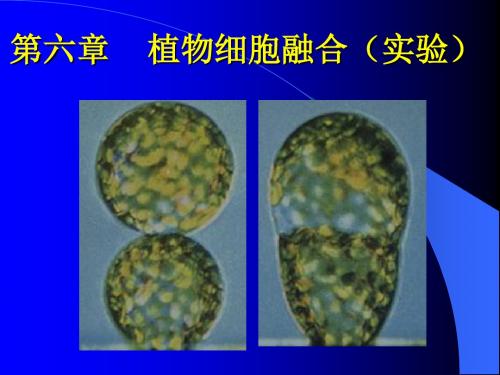
完整烟草原生质体(40×) 原生质体成串(40×) 植物细胞融合(实验)
7 mmol/L 0.7mmol/L 3 mmol/L
甘露醇
0.5 mmol/L
permeate the
has mixed
membrane. The together. Only
membranes
the nuclei
then fuse.
remain separate.
植物细胞融合(实验)
D Entire fusion product:
The nuclei are now fused as well. As a rule, the number of chromosome s is reduced.
植物细胞融合(实验)
PEG诱导原生质体融合的机理: 带有大量负电荷的PEG与水之间的氢
键结合,使溶液中自由水消失,由于高度 脱水引起原生质体凝集,形成大小程度不 同的凝集物。原生质体发生皱缩并大大扭 曲变形,邻近原生质体之间紧密接触。
植物细胞融合(实验)
在原生质体细胞膜与膜紧密接触的部 位,膜内蛋白质颗粒易位并凝聚。接着可 能是相邻的剥去蛋白质的细胞膜间的类脂 质与类脂质反应。继之,类脂质分子的扰 动和重排导致接触的细胞膜局部发生融合, 形成很小的细胞质桥,之后它逐渐扩大, 两个原生质体最终融合。
体伤害小;
4、融合是在同步状态下进行,活细胞数目多;
5、装置精巧,方法简单,可在显微镜下观察或录
像融合过程;
6、免去PEG诱导后的洗涤过程,诱导过程可控制
性强。
植物细胞融合(实验)
四、实验材料、试剂和仪器
1.材料
无菌烟草叶片、洋葱根尖
植物细胞融合(实验)
2.试剂
1)酶混合液
配制分两部进行:
(1)将CaCl2.2H2O NaH2PO4.2H2O MES
