高考化学离子浓度单项练习
2019高考化学水溶液中的离子浓度单元测试题及答案详解

2019高考化学水溶液中的离子浓度单元测试题一、单选题(共15小题)1.下列关于盐酸与醋酸两种稀溶液的说法正确的是()A.相同浓度的两溶液中c(H+)相同B.100 mL 0.1 mol·L-1的两溶液能中和等物质的量的氢氧化钠C.c(H+)=10-3mol·L-1的两溶液稀释100倍,c(H+)都为10-5mol·L-1D.两溶液中分别加入少量对应的钠盐,c(H+)均明显减小2.可溶性钡盐有毒,医院中常用硫酸钡这种钡盐作为内服造影剂。
医院抢救钡离子中毒患者时,除催吐外,还需要向中毒者胃中灌入硫酸钠溶液。
已知:K sp(BaCO3)=5.1×10-9、K sp(BaSO4)=1.1×10-10,下列推断正确的是()A.不用碳酸钡作为内服造影剂,是因为K sp(BaCO3)>K sp(BaSO4)B.抢救钡离子中毒患者时,若没有硫酸钠,可以用碳酸钠溶液代替C.若误饮c(Ba2+)=1.0×10-5mol·L-1的溶液时,会引起钡离子中毒D.可以用0.36 mol·L-1Na2SO4溶液给钡离子中毒患者洗胃3.在AgCl饱和溶液中尚有AgCl固体存在,当向溶液中加入0.1 mol·L-1的盐酸时,下列说法正确的是() A.AgCl沉淀溶解平衡正向移动B.AgCl溶解度增大C.溶液中c(Ag+)增大D.溶液中c(Cl-)增大4.常温下,某溶液中由水电离出的c(H+)与c(OH-)的乘积为10-10,该溶液可能是()A.pH等于5的醋酸溶液B.一定浓度的NaHSO4溶液C.一定浓度的NH4Cl溶液D.0.1 mol·L-1的NaCl溶液5.物质的量浓度相同的下列溶液中,含微粒种类最多的是()A.CaCl2B.CH3COONaC.NH4ClD.Na2S6.用物质的量都是0.1 mol的HCN和NaCN配成1 L溶液,已知其中c(CN-) <c(Na+),则下列判断正确的是()A.c(Na+)>c(CN-)>c(H+)>c(OH-)B.c(Na+)+c(H+)=c(CN-)C.c(CN-)+c(OH-)<0.1 mol·L-1D.c(CN-)+c(HCN)=0.2 mol·L-17.室温下,用0.100 mol﹒L-1NaOH溶液分别滴定20.00 mL 0.100 mol﹒L-1的盐酸和醋酸,下列说法正确的是()A.Ⅰ表示的是滴定盐酸的曲线B.pH=7时,滴定醋酸消耗的V(NaOH)小于20 mLC.V(NaOH)=20 mL时,两份溶液中c(Cl-)=c(CH3COO-)D.V(NaOH)=10 mL时,醋酸溶液中c(Na+)>c(CH3COO-)>c(H+)>c(OH-)8.下列操作会促进H2O的电离,且使溶液pH>7的是()A.将纯水加热到90 ℃B.向水中加少量NaOH溶液C.向水中加少量Na2CO3溶液D.向水中加少量FeCl3溶液9.下列离子方程式中,属于水解反应的是()A.CH 3COOH+H2O CH3COO-+H3O+B.SO 2+H2O+H+C.+OH-+H2OD.+H2O NH3·H2O+H+10.在一定条件下,Na 2CO3溶液中存在水解平衡:+H2O+OH-,下列说法正确的是() A.稀释溶液,上述可逆反应平衡常数不变B.通入CO2,溶液pH增大C.加入NaOH固体,平衡向正反应方向移动D.升高温度,c()/c()不变11.常温下两份等浓度的纯碱溶液,将第二份升高温度,两溶液中c()()A.前者大于后者B.后者大于前者C.二者相等D.无法比较12.常温下,将a L 0.1 mol·L-1的NaOH溶液与b L 0.1 mol·L-1的CH3COOH溶液混合。
高考化学复习高考热点选择题——04离子浓度.docx

高中化学学习材料唐玲出品2007高考热点选择题——04离子浓度1、(97)0.1摩/升NaOH和0.1摩/升NH4Cl溶液等体积混和后,离子浓度大小顺序正确的是A [Na+]>[Cl-]>[OH-]>[H+]B [Na+]=[Cl-]>[OH-]>[H+]C [Na+]=[Cl-]>[H+]>[OH-]D [Cl-]>[Na+]>[OH-]>[H+]2、(98)用水稀释0.1摩/升氨水时,溶液中随着水量的增加而减小的是A BC [H+]和[OH-]的乘积D OH-的物质的量3、(98)等体积等浓度的MOH强碱溶液和HA弱酸溶液混和后,混和液中有关离子的浓度应满足的关系是A [M+]>[OH-]>[A-]>[H+]B [M+]>[A-]>[H+]>[OH-]C [M+]>[A-]>[OH-]>[H+]D [M+]>[H+] =[OH-]+[A-]4、(03单科)在甲烧杯中放入盐酸,乙烧杯中放入醋酸,两种溶液的体积和pH都相等,向两烧杯中同时加入质量不等的锌粒,反应结束后得到等量的氢气。
下列说法正确的是A 甲烧杯中放入锌的质量比乙烧杯中放入锌的质量大B 甲烧杯中的酸过量C 两烧杯中参加反应的锌等量D 反应开始后乙烧杯中的c(H+)始终比甲烧杯中的c(H+)小5、(03单科)将0.2mol·L-1HCN溶液和0.1mol·L-1的NaOH溶液等体积混合后,溶液显碱性,下列关系式中正确的是A c(HCN)<c(CN-)B c(Na+)>c(CN-)C c(HCN)-c(CN-)=c(OH-)D c(HCN)+c(CN-)=0.1mol·L-16、(03理综)将20mL 0.4mol/L硝酸铵溶液跟50mL 0.1mol/L氢氧化钡溶液混合,则混合溶液中各离子浓度的大小顺序是A [NO3-]>[OH-]>[NH4+]>[Ba2+]B [NO3-]>[Ba2+]>[OH-]>[NH4+]C [Ba2+]>[NO3-]>[OH-]>[NH4+]D [NO3-]>[Ba2+]>[NH4+]>[OH-]7、(02理综)常温下,将甲酸和氢氧化钠溶液混合,所得溶液 pH=7,则此溶液中A [HCOO-]>[Na+]B [HCOO-]<[Na+]C [HCOO-]=[Na+]D 无法确定[HCOO-]与[Na+]的关系8、(03上海)在10mL0.1mol·L-NaOH溶液中加入同体积、同浓度的HAc溶液,反应后溶液中各微粒的浓度关系错误的是A C(Na+)>C(Ac-)>C(H+)>C(OH-)B C(Na+)>C(Ac-)>C(OH-)>C(H+)C C(Na+)=C(Ac-)>C(HAc)D C(Na+)+C(H+)=C(Ac-)+C(OH-)9、(2004北京理综)已知0.1mol·L-1的二元酸H2A溶液的PH=4.0,则下列说法中正确的是A 在Na2A、NaHA两溶液中,离子种类不相同B 在溶质物质的量相等的Na2A、NaHA两溶液中,阴离子总数相等C 在NaHA溶液中一定有:[Na+]+[H+]= [HA-]+[OH-] +2[A2-]D 在Na2A溶液中一定有:[Na+]>[A2-]> [H+]> [OH-]10、(2005江苏12)常温下将稀NaOH溶液与稀CH3COOH溶液混合,不可能...出现的结果是A.pH > 7,且c(OH—) >c(Na+) >c(H+) >c(CH3COO—)B.pH > 7,且c(Na+) + c(H+) = c(OH—) + c(CH3COO—)C.pH < 7,且c(CH3COO—) >c(H+) >c(Na+) >c(OH—)D.pH = 7,且c(CH3COO—) >c(Na+) >c(H+) = c(OH—)11、(2005上海14)叠氮酸(HN3)与醋酸酸性相似,下列叙述中错误的是()A.HN3水溶液中微粒浓度大小顺序为:c(HN3)>c(H+)>c(N3¯)>c(OH¯)B.HN3与NH3作用生成的叠氮酸铵是共价化合物C.NaN3水溶液中离子浓度大小顺序为:c(Na+)>c(N3¯) >c(OH¯)>c(H+)D.N3¯与CO2含相等电子数)、c(HCO3¯)都减少,12、(2005上海16)欲使0.1mol/L的NaHCO3溶液中c(H+)、c(CO 23其方法是()A.通入二氧化碳气体B.加入氢氧化钠固体C.通入氯化氢气体D.加入饱和石灰水溶液答案:1B 2B 3C 4AC 5BD 6B 7C 8AC 9C。
高考化学微测试系列专题35离子浓度大小比较(含解析)

专题35 离子浓度大小比较(满分60分时间25分钟)姓名:班级:得分:1.醋酸钡(CH3COO)2Ba·H2O]是一种媒染剂,下列是有关0.1 mol/L醋酸钡溶液中粒子浓度的比较,其中不正确...的是A.c(Ba2+)>c(CH3COO-)>c(OH-)>c(H+)B.c(H+)+2c(Ba2+)=c(CH3COO-)+c(OH-)C.c(H+)=c(OH-)-c(CH3COOH)D.2c(Ba2+)=c(CH3COO-)+c(CH3COOH)【答案】A考点:考查了离子浓度大小的比较;盐类水解的应用的相关知识。
2.一定温度下,下列溶液的离子浓度关系式正确的是()A.pH=5的H2S溶液中,c(H+)= c(HS-)=1×10—5mol·L—1B.pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1C.pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比混合:c(Na+)+ c(H+)=c(OH-)+c( HC2O4-)D.pH相同的①CH3COONa②NaHC O3③NaClO三种溶液的c(Na+):①>②>③【答案】D考点:本题考查离子浓度比较。
3.25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是A.NaHCO3溶液中:c(H+)+c(H2CO3)=c(CO32-)+c(OH-)B.0.1mol/L醋酸钠溶液20ml与0.1mol/L盐酸10ml混合后的溶液中:c(CH3COO-)>c(Cl -)>c(H+)>c(CH3COOH)C.物质的量浓度相等的①NH4Cl、②(NH4)2SO4、③NH4Al(SO4)2三种溶液中,c(NH4+)由大到小的顺序为:③>②>①D.浓度为0.1mol/L的①氨水、②C6H5ONa溶液、③Na2CO3溶液、④NaHCO3溶液,pH的大小顺序:①>④>③>②【答案】A【解析】试题分析:A.NaHCO3溶液中根据质子守恒可知c(H+)+c(H2CO3)=c(CO32-)+c(OH-),A正确;B.0.1mol/L醋酸钠溶液20ml与0.1mol/L盐酸10ml混合后的溶液中存在等浓度的醋酸钠、醋酸和氯化钠,溶液显酸性,则溶液中c(CH3COO-)>c(Cl-) >c(CH3COOH) >c(H+),C 错误;C.铝离子水解抑制铵根水解,则物质的量浓度相等的①NH4Cl、②(NH4)2SO4、③NH4Al(SO4)2三种溶液中,c(NH4+)由大到小的顺序为:②>③>①,C错误;D.酸性是碳酸强于苯酚,苯酚强于碳酸氢钠,酸性越强,相应酸根越容易水解,则浓度为0.1mol/L 的①氨水、②C6H5ONa溶液、③Na2CO3溶液、④NaHCO3溶液,pH的大小顺序为①>③>②>④,D错误,答案选A。
高中化学离子浓度大小比较练习题 附答案

高中化学离子浓度大小比较练习题附答案1. 将0.5mol/L的NaCl溶液和0.3mol/L的CaCl2溶液混合,哪个离子浓度更大?答:Ca2+离子浓度更大。
2. 将0.3mol/L的Na2SO4溶液和0.4mol/L的NaCl溶液混合,哪个离子浓度更大?答:Na+离子浓度相同。
3. 将0.2mol/L的K2SO4溶液和0.1mol/L的MgSO4溶液混合,哪个离子浓度更大?答:SO42-离子浓度相同。
4. 将0.1mol/L的Na3PO4溶液和0.2mol/L的Na2SO4溶液混合,哪个离子浓度更大?答:Na+离子浓度更大。
5. 将0.4mol/L的NaCl溶液和0.2mol/L的KCl溶液混合,哪个离子浓度更大?答:Cl-离子浓度相同。
6. 将0.3mol/L的Ca(NO3)2溶液和0.2mol/L的Na2CO3溶液混合,哪个离子浓度更大?答:Ca2+离子浓度更大。
7. 将0.1mol/L的NaOH溶液和0.2mol/L的HCl溶液混合,哪个离子浓度更大?答:H+离子浓度更大。
8. 将0.2mol/L的K2CO3溶液和0.1mol/L的CaCl2溶液混合,哪个离子浓度更大?答:CO32-离子浓度更大。
9. 将0.3mol/L的NaCl溶液和0.1mol/L的MgCl2溶液混合,哪个离子浓度更大?答:Cl-离子浓度相同。
10. 将0.2mol/L的FeSO4溶液和0.1mol/L的MgSO4溶液混合,哪个离子浓度更大?答:SO42-离子浓度相同。
11. 将0.1mol/L的Na3PO4溶液和0.2mol/L的Ca(NO3)2溶液混合,哪个离子浓度更大?答:Na+离子浓度更大。
12. 将0.3mol/L的KCl溶液和0.1mol/L的CaCl2溶液混合,哪个离子浓度更大?答:Cl-离子浓度相同。
13. 将0.2mol/L的Na2CO3溶液和0.1mol/L的NaOH溶液混合,哪个离子浓度更大?答:Na+离子浓度更大。
高考化学选择题专项训练---离子浓度大小比较和三大守恒式(含答案和解析)
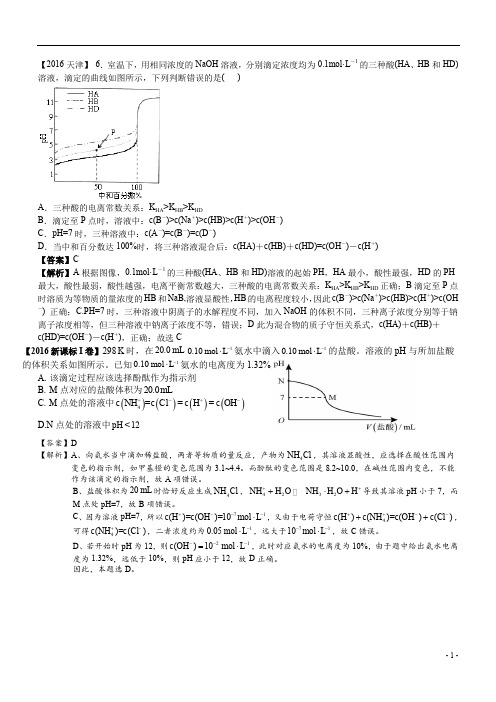
【2016天津】 6.室温下,用相同浓度的NaOH 溶液,分别滴定浓度均为0.1mol·L -1的三种酸(HA 、HB 和HD)溶液,滴定的曲线如图所示,下列判断错误的是( )A .三种酸的电离常数关系:K HA >K HB >K HDB .滴定至P 点时,溶液中:c(B -)>c(Na +)>c(HB)>c(H +)>c(OH -)C .pH=7时,三种溶液中:c(A -)=c(B -)=c(D -)D .当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH -)-c(H +) 【答案】C【解析】A 根据图像,0.1mol·L -1的三种酸(HA 、HB 和HD)溶液的起始PH ,HA 最小,酸性最强,HD 的PH 最大,酸性最弱,酸性越强,电离平衡常数越大,三种酸的电离常数关系:K HA >K HB >K HD 正确;B 滴定至P 点时溶质为等物质的量浓度的HB 和NaB,溶液显酸性,HB 的电离程度较小,因此c(B -)>c(Na +)>c(HB)>c(H +)>c(OH-) 正确;C.PH=7时,三种溶液中阴离子的水解程度不同,加入NaOH 的体积不同,三种离子浓度分别等于钠离子浓度相等,但三种溶液中钠离子浓度不等,错误;D 此为混合物的质子守恒关系式,c(HA)+c(HB)+c(HD)=c(OH -)-c(H +),正确;故选C【2016新课标I 卷】298K 时,在20.0mL 10.10mol L -⋅氨水中滴入10.10mol L -⋅的盐酸。
溶液的pH 与所加盐酸的体积关系如图所示。
已知10.10mol L -⋅氨水的电离度为1.32%,下列有关叙述正确的是A. 该滴定过程应该选择酚酞作为指示剂B. M 点对应的盐酸体积为20.0mLC. M 点处的溶液中()()()()++4NH Cl =H =OH c =c c c --D.N 点处的溶液中pH <12【答案】D【解析】A 、向氨水当中滴加稀盐酸,两者等物质的量反应,产物为4NH Cl ,其溶液显酸性,应选择在酸性范围内变色的指示剂,如甲基橙的变色范围为3.1~4.4。
高考盐类水解离子浓度经典习题(含答案)

盐类水解离子浓度经典习题1、向三份0.1 mol/LCH 3COON溶液中分别加入少量NHNO、NaSO、FeCl3固体(忽略溶液体积变化),则CH3COO浓度的变化依次为()A.减小、增大、减小B.增大、减小、减小C.减小、增大、增大D.增大、减小、增大2、有①NaCO溶液②CHCOON籀液③NaOH^(各25 mL物质的量浓度均为0.1 mol - L \下列说法正确的是() A.3种溶液pH的大小顺序是③下②〉①B.若将3种溶液稀释相同倍数,pH变化最大的是②C.若分别加入25 mL 0.1 mol - L 1盐酸后,pH最大的是①D.若3种溶液的pH均为9,则物质的量浓度的大小顺序是③下①〉② 13、有①NaCO溶椒②CHCOON金披③NaOH§^④CHCOONHt披各25mL物质的量浓度均为0. 1mol • L ,下列说法正确的是()A.四种溶液的pH大小顺序是③ >②>①>④B.若分别加入25mL0.1mol • L-1盐酸充分反应后,pH最大的是①C.若将四种溶液稀释相同倍数,pH变化最大的是④D.升高温度,四种溶液的pH均减小4、25 C时,0.1 mol/L 的HA溶液中c(H +)/c(OH ) = l X 10 6,下列叙述正确的是()A.该溶液中由水电离出的c(H + ) =l X 10 13 mol/LB.由pH=4 的HA与pH= 10 的NaOH§液等体积混合,溶液中c(Na + )>c(A )>c(OH 一)>c(H +)C.浓度均为0.1 mol/L 的HA和NaA溶液等体积混合,若溶液呈酸性,则c(A ) >c(HA) >c(Na+) >c(H+) >c(OHI )D.0.1 mol - L-1 HA溶液与0.05 mol • L—1 NaOH溶液等体积混合后所得溶液中c(H + ) + c(Na+) = c(OH ) + c(A ) 5、下列溶液中有关微粒的物质的量浓度关系正确的是()A.常温下将物质的量浓度相等的醋酸钠、醋酸两溶液等体积混合,混合后的溶液中,已知c (Na+) >c (CHCOOH ,则:c (Ns+) > c (CHCOO > c (OH > c (H)B.NaHSO和NaHCO勺中性混合溶液中(S和C均用R表示):C (Na+) =c (HRO) +2c (RO2-)C.常温下,物质的量浓度和体积都相等的①N K SO②NaSO③NaHSOE种溶液中离子总数:①〈②〈③D.常温下,①pH=3的HCl溶液和pH=11的氨水等体积混合液② pH=3的HCl溶液③pH=11的氨水中由水电离出的c (H):①》③〉②6、下列溶液中有关微粒的物质的量浓度关系正确的是 ()A.NaHSO 和NaHCO 勺中性混合溶液中(S 和C 均用R 表示):c (Na +) =c (HRO) +c (RO 2-) B.常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中: C (Na +) v C (Cl -) v C (CHCOOHC.常温下物质的量浓度相等的①(NH 2CQ ②(NH) 2SQ 、③(NH) 2Fe ( SQ) 2三种溶液中c ( NH +):①〈③〈②D.等体积等物质的量浓度的 NaClO (aq)与NaCl (aq)中离子总数多少:N 前<N 后 7、下列溶液中,微粒的物质的量浓度关系正确的是()A.等体积等物质的量浓度 NaF 溶液与HF 混合:2c (Na) =c ( F -) +c (HF)B.0.1mol ?L -1pH 为 4 的 NaHB 溶液中:c (HB) > c (H 2B) > c (B 2-) C.在 NaHA§液中一定有:c (Na +) +c (H +) =c (HA) +c (OH) +c (A 2-)D.等物质的量浓度的(NH) 2SO 和(NH) 2CO 溶液中的c (NH +):前者〈后者 8、下列溶液中微粒的物质的量浓度关系正确的是A.Na z CO 溶液:C(OH )+ C(H +尸C(HCQ )+2 C(H 2CO)B.0.1 \mol-L^.'初CQ ;溶液:/(二)>c(0H)C .室温下,向0.01羽司, £'A 刃斗那04溶液中滴加.W0H 溶液至中性:W) >> 人NH ;) >D .25 c 时,pH 二4,75、浓度均为°」阴小上"的CH £O0R CH 3C00\a 混合溶液: 幽,)+画-)< c(CH<00H)+时)9、下列各溶液中,微粒物质的量浓度关系正确的是()A .O.lmol 溶液中[0H-] = [HC0.]+[H-]>[C0r]B .2国:施JS04溶液中:[SO ;-]>[NH ;]>[H-]>[OH-] c.g ^NaHCO^溶液中:[>V]>[OH-]>[HCOr]>[HJ D .1-2$溶液中:=半,+ 2晔]+2此§]10、下列各溶液中,微粒物质的量浓度关系正确的是 ()11、下列有关溶液中微粒浓度关系的叙述正确的是()。
2019-2020年高考化学专题复习 离子浓度练习

2019-2020年高考化学专题复习离子浓度练习1.下列溶液中有关离子浓度关系一定正确的是BA.常温下,NaHS溶液中:c(OH-)+2c(S2-)=c(H+)+c(Na+)B.室温下,向0.1mol/LNH4HSO4溶液中滴人等体积等浓度的NaOH溶液c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-)C.常温下,0.1 mol/l.的下列溶液中:①NH4Al(SO4)2②NH4Cl③NH3·H2O④CH3COONH4,c(NH4+)由大到小的顺序是:②>①>④>③D,在0.4 mol/L CH3COONa溶液中加入等体积0.1m01/LHCl溶液后c(Na+)=c(CH3COO-)+c(CH3COOH)+c(Cl-)2.常温下,向25 mL 0.1 mol/L MOH溶液中逐滴加入0.2 mol/L HA溶液,曲线如图所示(体积变化忽略不计)。
下列说法不正确的是: CA 、MOH的电离方程式为 MOH=M++OH-B 、MOH与HA恰好中和时溶液呈碱性C 、D点时,若C(HA)=0.04mol/L 则溶液的PH=3D 、C点溶液中离子浓度的大小关系: A->M+3. 25℃时,下列溶液的pH或微粒的物质的量浓度关系正确的是AA.将0.2 mol/L的某一元酸HA溶液和0.1 mol/L NaOH溶液等体积混合后,混合液pH大于7,则反应后的混合液:2c(OH一)+c(A一)=2c(H+)+c(HA)B.pH均为9的三种溶液:CH3COOH、Na2CO3、NaOH,其物质的量浓度的大小顺序是NaOH 溶液>CH3COOH溶液>Na2CO3溶液C.pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液:c(R2-)+c(HR一)=c(Na+)D.0.2mol/LNaHCO3溶液与0.1mol/LNaOH溶液等体积混合:c(H+)=c(OH—)+c(HCO3—)+2c(H2CO3)4.下列叙述正确的是 CA.25℃时,若0.1 mol/L氨水溶液中=1×10-8,则该溶液pH=9B.25℃时,将0.1 mol/L醋酸溶液加水稀释,保持温度不变,稀释过程中的比值减小C.0.1 mol/L的Na2CO3溶液中:c(OH- ) - c(H+ )=c(HCO3-) + 2c(H2CO3)D.浓度均为0.1 mol/L的氨水溶液和NH4Cl溶液等体积混合后,若溶液呈碱性,则所得溶液中:c(NH4+ )>c(NH3·H2O) >c(Cl-) >c(OH-) >c(H+ )5、下列叙述正确的是DA.c(NH4+)相等的(NH4)2SO4、(NH4)2Fe(SO4)2和NH4Cl溶液中,溶质浓度大小关系是:C((NH4)2SO4)<c((NH4)2Fe(SO4)2)<c(NH4Cl)B.若0.3 mol/L HY溶液与0.3 mol/L NaOH溶液等体积混合后,溶液的pH = 9,则c(OH-)-c(HY)=c(H+)=1×10-5mol/LC.0.2mol·L-1 HCl溶液与等体积0.05 mol·L-1 Ba(OH)2溶液混合后,溶液的pH=1 D.NaHCO3溶液中:c(H+) + c(H2CO3)=c(CO32-) + c(OH-)6.25℃时,向10mL 0.01mol/L KOH溶液中滴加0.01mol/L苯酚溶液,混合溶液中粒子浓度关系正确的是DA.pH>7时,c(C6H5O—)>c(K+)>c(H+)>c(OH—)B.pH<7时,c(K+)>c(C6H5O—)>c(H+)>c(OH—)C.V[C6H5OH(aq)]=10mL时,c(K+)=c(C6H5O—)>c(OH—)=c(H+)D.V[C6H5OH(aq)]=20mL时,c(C6H5O—)+(C6H5OH)=2c(K+)7..下列溶液中微粒的物质的量浓度关系正确的是A.0.1 mol·L-1的NH4Cl溶液与0.05 mol·L-1的NaOH溶液等体积混合后的溶液:c(Cl-)>c(Na+)>c(NH4+)>c(OH-)>c(H+)B.等物质的量的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-)C.pH=2的HA溶液与pH=12的MOH溶液等体积混合:c(M+)=c(A-)>c(OH-)=c(H+)D.某二元弱酸的酸式盐NaHA溶液:c(OH-)+c(H2A)=c(H+)+2c(A2-)8.下列溶液中粒子的物质的量浓度关系正确的是A.0.1mol/LNaHCO3溶液与0.1mol/LNaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)B.20ml0.1mol/LCH3COONa溶液与10ml0.1mol/LHCl溶液混合后呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)C.室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)>c(H+)>c(NH4+)>c(OH-)D.0.1mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH)9.25℃时,下列溶液中微粒的物质的量浓度关系正确的是()A.等物质的量浓度的H2S和NaHS混合溶液中:c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-)B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(Na2CO3)<c(CH3COONa)C.pH =3的一元酸HA与pH=11的NaOH溶液等体积混合后:c(Na+)>c(A-)>c(OH-)>c(H+)D.0.4mol/L NH4Cl和0.2mol/L NaOH两种溶液等体积混合后pH=9:c(NH+4)>c(Cl-)>c(Na+)>c(OH-)>c(H+)10.对于体积相同的①、②)NH4HSO4、③H2SO4溶液,下列说法正确的是A.溶液的pH相同时,3种溶液物质的量浓度大小顺序是③>②>①B.溶液的pH相同时,将3种溶液稀释相同倍数,pH变化最大的是①C.溶液的pH相同时,由水电离出的大小顺序是③>②>①D.若3种溶液的物质的量浓度都相同,则溶液的pH大小顺序是①>②>③11.常温下,对下列四种溶液的叙述正确的是DwB.四种溶液分别加水稀释10倍,pH变化最大的是①和④C.①、②、③中分别加入少量的醋酸铵固体后,三种溶液的pH均减小D.①、④两溶液按一定体积比混合,所得溶液中离子浓度的关系一定有:c(NH4+)+c(H+)=c(Cl-)+c(OH-)12.已知草酸为二元中强酸,具有较强还原性,草酸氢钠(NaHC2O4)水溶液呈酸性,下列说法正确的是( D )A.草酸与氢氧化钠溶液混合呈中性时,溶液中存在:c(Na+) = c(HC2O4-)+ c(C2O42-) B.NaHC2O4与NaClO溶液混合,反应的离子方程式为:HC2O4-+ClO-= HClO+ C2O42-C.草酸铵溶液中:c(NH4+)=2 c(H2C2O4) +2 c(HC2O4-)+2 c(C2O42-)D.草酸使酸性KMnO4溶液褪色,其离子方程式为:5H2C2O4 + 2MnO4-+ 6H+ = 2Mn2+ + 10CO2↑ + 8H2O.。
高三化学专题——离子浓度图象综合提高练习

离子浓度图象题1.四甲基氢氧化铵[(CH3)4NOH]是一元强碱。
常温下,向20mL、浓度均为0.1mol·L-1的四甲基氢氧化铵溶液、氨水中分别滴加0.1mol·L-1盐酸,溶液导电性如图所示(已知:溶液导电性与离子浓度相关)。
下列说法正确的是A.在a、b、c、d、e中,水电离程度最大的点是dB.c点溶液中:c(H+)=c(OH-)+c(NH3·H2O)C.曲线I中c与e之间某点溶液呈中性D.a点溶液pH=122.常温下,向二元弱酸H2Y溶液中滴加KOH溶液,所得混合溶液的pH与离子浓度变化的关系如图所示。
下列有关说法错误的是A.曲线M表示pH与lgc(HY-)/c(H2Y)的变化关系B.K a2(H2Y)=10-4.3C.d点溶液中:c(H+)-c(OH-)=2c(Y2-)+c(HY-)-c(K+)D.交点e的溶液中:c(H2Y)=c(Y2-)>c(HY-)>c(H+)>c(OH-)3.25℃时,向10mLNaOH溶液中逐滴加入0.lmol/L的HR溶液,测得反应混合液中c水(OH-)与V(HR)的变化关系如图所示。
下列说法不正确的是A.V2=10B.HR为弱酸C.当V(HR)=V2时,溶液中存在:c (OH-)-c(H+)=c(HR)D.当V(HR)=V1或V3时,溶液中均有:c(Na+)=c(HR)+c(R-)4.25℃时在10 mL 0.1mol·L—1Na2CO3溶液中逐滴加入0.1 mol·L—1HCl溶液20 mL,溶液中部分含碳微粒的物质的量随溶液pH的变化如图所示。
下列说法正确的是A.0.1 mol·L—1Na2CO3溶液中c(Na+)+c(H+)=c(OH—)+c(CO32—)+c(HCO3—)B.当加入10mL盐酸时,所得混合溶液pH>7C.当pH=8时,c(Na+)=c(CO32—)+c(HCO3—)+c(H2CO3)D.在M点:c(CO32—)=c(HCO3—)>c(Na+)>c(OH—)>c(H+)5.常温下,向25.00mL 0.1mol·L-1 HSCN溶液中滴入0.1 mol·L-1 NaOH溶液,溶液中由水电离出的c(H+)的负对数[-1gc水(H+)]与所加NaOH溶液体积的关系如图所示,下列说法正确的是A.常温下,K a(HSCN)约为1×10-3B.b=25.00C.R、Q两点溶液对应的pH=7D.N点溶液中:c(Na+)<c(SCN-)6.25℃时,向20mL0.1mol·L-1四氯金酸( HAuCl4)溶液中滴加0.1mol·L-1NaOH溶液,滴定曲线如图1,含氯微粒的物质的量分数(δ)随pH变化关系如图2,则下列说法不正确的是A.b点溶液中存在关系:2c(H+)+ c(HAuCl4)=2c(OH-)+ c(AuCl4-)B.X点描述的是滴定曲线中b点含氯微粒的物质的量分数δ与pH的关系C.c点溶液中存在关系:c(Na+)=c(AuCl4-)D.d点时,溶液中微粒浓度的大小关系为c(Na+)>c(AuCl4-)>c(OH-)>c(H+)7.室温下,将0.10 mol·L-1盐酸逐滴滴入20.00 mL 0.10 mol·L-1氨水中,溶液中pH和pOH随加入盐酸体积变化曲线如图所示。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
单项练习(二)
一、水的电离和溶液的pH的简单计算
1、某温度下,0.1 moL/L醋酸溶液的pH = 3。
将该温度下0.2 moL/L醋酸溶液和0.2 mol/L
醋酸钠溶液等体积混合后,混合液的pH = 4.7。
下列说法正确的是:
A.该温度下0.01 mol/L醋酸溶液的Ph = 4
B.该温度下,用PH = 3醋酸和PH = 4醋酸分别完全中和等体积等浓度的NaOH溶液,消耗两醋酸的体积比为< l:10
C.该温度下,0.2 mol/L醋酸溶液和0.4 mol/L醋酸钠溶液等体积混合后,混合液的pH < 4.7
D.该温度下,0.2 mol/L盐酸溶液和0.4 mol/L醋酸钠溶液等体积混合后,混合液的pH = 4.7
2、在0.01mol/L硫酸溶液中,水电离出的H+浓度是:
(A)1×10-12mol/L (B)0.02mol/L (C)1×10-7mol/L (D)5×10-13mol/L 3、重水(D2O)的离子积为1.6×10-15,可以用pH一样的定义来规定pD= -lg[D+],以下
关于pD的叙述正确的是:
(A)中性溶液的pD=7.0
(B)含0.01mol NaOD的D2O溶液1L,其pD=12.0
(C)溶解0.01molDCl的D2O溶液1L,其pD=2.0
(D)在100mL0.25mol/L的DCl重水溶液中,加入50mL0.2mol/LNaOD的重水溶液,其pD=1.0
4、在某未知溶液中加入醋酸钠晶体后测得溶液中c(Na+)与C(CH3COO-)之比等于1:1,
对原来未知溶液的判断正确的是:
A、可能是强酸溶液
B、可能是强碱溶液
C、可能是中性溶液
D、难以确定
5、常温下,有甲、乙两份体积均为1 L,浓度均为0.1 mol·L-1的氨水,其pH为11。
①甲用蒸馏水稀释100倍后,溶液的pH将为a;②乙与等体积、浓度为0.2mol·L-1
的HCl混合,在混合溶液中:n(NH4+)+n(H+)-n(OH—)=b mol 。
a、b正确的答案组合是:
A.9~11之间;0.1 B.9~11之间;0.2
C.12~13之间;0.2 D.13;0.1
二、盐类的水解及离子浓度大小的比较
1、将0.1mol下列物质置于1L水中充分搅拌,溶液中阴离子数最多的是:
(A)KCl (B)Mg(OH)2(C)Na2CO3(D)MgSO4
2、已知NaHSO3显酸性,NaHCO3溶液显碱性,现有浓度为0.1mol/L的NaHSO3和NaHCO3
两种溶液,两种溶液中各粒子的物质的量浓度存在下列关系(R表示S或C),其中正确的一组是:
A.c(Na+)>c(HRO3-)>c(H+)>c(RO32-)>c(OH-)
B.c(Na+)+c(H+)=c(HRO3-)+ c(RO32-)+c(OH-)
C.c(H+)+c(H2RO3)=c(RO32-)+c(OH-)
D.c(Na+)=c(HRO3-)+(H2RO3)+2c(RO32-)
3、已知一种[H+]=1×10-3mol/L的酸和一种[OH—] = 1×10-3mol/ L的碱溶液等体积混合后溶液呈酸性,其原因可能是:
(A)浓的强酸和稀的强碱溶液反应(B)浓的弱酸和稀的强碱溶液反应(C)等浓度的强酸与弱碱溶液反应(D)生成了一种强酸弱碱盐
4、将0.2 mol·L-1HCN溶液和0.1 mol·L-1的NaOH溶液等体积混合后,溶液显碱性,下列
关系中正确的是:
(A)c(HCN)< c(CN-) (B)c(Na+)>c(CN-)
(C)c(HCN)- c(CN-)= c(OH-) (D)c(HCN)+ c(CN-)=0.1mol·L-1
5、将pH=2的盐酸和pH=12的氨水等体积混合后,溶液中浓度关系正确的是:
(A)c(NH4+)>c (Cl-)>c (H+)>c (OH-) (B)c (Cl-)> c(NH4+)>c(OH-)> c(H+) (C)c (NH4+)> c (Cl-)> c (OH-)>c (H+) (D)c (Cl-)>c (NH4+)>c (H+)>c (OH-) 6、下列混合液中,各离子浓度的大小顺序正确的是:
A.10ml.1mol/LNIH4Cl溶液与5mL0.2mol/LNaOH溶液混合,
c(Na+)>c(C1—)>c(OH—)>c(H+)
B.10mL0.1mol/L氨水与10mL0.1mol/L盐酸混合,
c(Cl—)>c(NH4+)>c(OH—)>c(H+)
C.10mL0.1mol/LCH3COOH溶液与5mL0.2moL/LNaOH溶液混合,c(Na+)>c(CH3COO-)>c(OH—)>c(H+)
D.10mL0.5mol/LCH3COONa溶液与6mLlmoL/L盐酸混合,
c(Cl—)>c(Na+)>c(OH—)>c(H+)
7、下列混合液中,各离子浓度的大小顺序正确的是:
A.10ml.1mol/LNIH4Cl溶液与5mL0.2mol/LNaOH溶液混合,
c(Na+)>c(C1—)>c(OH—)>c(H+)
B.10mL0.1mol/L氨水与10mL0.1mol/L盐酸混合,
c(Cl—)>c(NH4+)>c(OH—)>c(H+)
C.10mL0.1mol/LCH3COOH溶液与5mL0.2moL/LNaOH溶液混合,c(Na+)>c(CH3COO-)>c(OH—)>c(H+)
D.10mL0.5mol/LCH3COONa溶液与6mLlmoL/L盐酸混合,
c(Cl—)>c(Na+)>c(OH—)>c(H+)
8、某二元弱酸的酸式盐NaHA溶液,若PH<7,则溶液中各离子的浓度关系不正确
...的是:A.c (Na+) > c (HA—) > c (H+) > c (A2—) > c (OH—)
B.c (Na+) + c (H+) = c (H—) + 2c(A2—) + c (OH—)
C.c (H+) + c (A2—) = c (OH—) + c (H2 A)
D.c (Na+) == c (HA—) + c (H2 A) + 2 c (A2—)
一:1B 2D 3CD 4B 5B
二:1C 2C 3B 4BD 5C 6A 7D 8CD。
