铜族和锌族元素优秀课件
第8章 ds区-1

CuCl42-
OH− (适 ) 量 OH− (过 ,浓 量 ) 2+ Cu →Cu (OH 2 (s) Cu ) → (OH 2− )4
∆ 2[Cu ) 4 ] +C6H12O6 → (OH
2−
Cu2O(s) +C6H12O7 + 2H2O+ 4OH−
氧 银 化 暗 色 末 棕 粉
硫 银 酸 白 晶 色 体 5.40 660, 1085℃ 时 分 为A SO 解 g, 2 和O 2 0.75(18℃ 1.4 ), ( 100℃ , 溶 )易 于NH3 水 不 , 溶 与 类 较 溶 醇 , 易 于 2SO4 中 浓H
三 化 氯 金 深 色 水 固 红 吸 性 体 2.44 196
10
Elemental Chemistry CAI
元素化学教学课件
二、铜族元素的化合物
1. 铜的化合物
铜的常见化合物的氧化值为+1和 铜的常见化合物的氧化值为 和+2
Cu(I): d10构型,不存在 跃迁, 化合物为白色或无色 构型,不存在d-d跃迁 跃迁, Cu(II): d9构型,存在d-d跃迁, 化合物有颜色 构型,存在 跃迁, 跃迁
暗红色
检验糖尿病:红色为有病, 检验糖尿病:红色为有病,蓝色没有病
15
Elemental Chemistry CAI
元素化学教学课件
NH3(适 ) 量 NH3 (过 ) 量 Cu → (OH 2SO4 (s) → (NH3)2+ Cu ) Cu 4
2+
浅蓝
深蓝
Cu2+ + 4Cl− (浓 → Cl2- (黄 ) Cu 4 ) H2O
过度元素之锌与铜PPT(完整版)

铜的一些性质
• 铜(Cu)的原子序数是29,是 一种过渡金属。 铜呈紫红色光
泽的金属,密度克/立方厘米。 熔点1083.4±0.2℃,沸点 2567℃。常见化合价+1和+2。 铜是人类发现最早的金属之一,
也是最好的纯金属之一,稍硬、
极坚韧、耐磨损。还有很好的
延展性,导热和导电性。铜和
人体缺铜可适量增加摄入含铜较高 的食物,如鱼、虾、蟹、玉米、豆制品 等。
锌的基本性质
• 锌化学符号是Zn,它的原子序数是30。 锌是一种蓝白色金属。密度为克/立方 厘米,熔点为419.5℃。在室温下,性 较脆;100~150℃时,变软;超过 200℃后,又变脆。锌的化学性质活泼, 在常温下的空气中,表面生成一层薄而 致密的碱式碳酸锌膜,可阻止进一步氧 化。当温度达到225℃后,锌氧化激烈。 锌在空气中很难燃烧,在氧气中发出强 烈白光。锌易溶于酸,也易从溶液中置 换金、银、铜等。锌是一种常用有色金 属,是古代铜、锡、铅、金、银、汞、 锌等7种有色金属中提炼最晚的一种, 是第四常见的金属,仅次于铁、铝及铜。 锌能与多种有色金属制成合金,其中最 主要的是锌与铜、锡、铅等组成的黄铜 等,还可与铝、镁、铜等组成压铸合金。 锌主要用于钢铁、冶金、机械、电气、 化工、轻工、军事和医药等领域。
锌的一些主要用途
(1)镀锌 锌具有优良的抗大气腐蚀性能,在常温下表
面易生成一层保护膜,因此锌最大的用途是用于镀锌工业。 被主要用于钢材和钢结构件的表面镀层(如镀锌板),广泛 用于汽车、建筑、船舶、轻工等行业。近年来西方国家开 始尝试直接用锌合金板做屋顶覆盖材料,其使用年限可长 达120-140年,而且可回收再用,而用镀锌铁板作屋顶材 料的使用寿命一般为5-10年。近年来,钢带热浸镀锌量有 显著增长。电镀锌也有使用,但该法一般用于较薄的镀层 和不同的表面光洁度。使用含锌粉的涂料是涂层的另一种 方法;对于与水连续接触的物体,如用于船舶、桥梁和近 海油气井架的大的钢构件,只须和大的锌块连接,便可得 到保护,不过锌块要定期更换。
第二十章铜族和锌族元素ds区

第19章 铜族和锌族元素§19-1铜族元素19-1-1铜族元素的通性铜族元素即ⅠB 的Cu 、Ag 、Au 三个元素。
1.价电子层结构(n-1)d 10s 1 最外层均只有1个s 电子,次外层18e 。
2.氧化数铜族元素具有+Ⅰ、+Ⅱ、+Ⅲ三种氧化态,而碱金属则只有+Ⅰ一种,这是因为铜族元素的ns 电子和(n-1)d 电子的能量相关不太大,在反应时容易补偿再被夺去1-2个电子的能量,例如我们比较同属四周期的Cu 和K ,Cu 的I 1=750KJ·mol -1,I 2=1970KJ·mol -1,而K 的I 1=421KJ·mol -1,I 2=3088KJ·mol -1,可见Cu 第二个电子的电离能较K 小得多。
铜族元素的I 1与I 2相相差约为1100-1400KJ·mol -1,而碱金属元素则相差2100KJ·mol -1 —6700KJ·mol -1。
3.金属活泼性同族从上到下按Cu 、Ag 、Au 的顺序金属活泼性减弱,这与所有副族元素一致,而与ⅠA 族等主族元素的金属性递变规律恰好相反。
其原因是因同副族元素从上到下原子半径增加不大,而新增加的次外层(对Au 还包括倒数第三层的f 电子)d 电子的屏蔽作用较小,因而有效核电荷从上到下增大的影响超过原子半径增大的影响所致。
从φ0值可以说明这一顺序:φ0Cu+/Cu =0.522V,φ0Ag+/Ag =0.796V ,φ0Au+/Au =1.68V与同周期碱金属元素相比,铜族元素由于次外层18e 结构, 核电荷又较同周期碱金属元素增加了10个单位,因此Z *增加明显,于是表现出x,I 均较大, 而原子半径和M +离子半径均较小,金属性较弱。
4.由于化合物共价性较明显,18e 结构离子有很强的极化力和变形性, 因此形成化合物时共价性较明显(如AgI )。
这可从它们的电负性值看出,按Pauling 提出的键的离子性百分数计算式键的离子性%=()1001241⨯⎥⎦⎤⎢⎣⎡---B A X X e当x A -x B >1.7键才属离子键。
《无机化学》课件——第19章 铜副族元素和锌副族元素

2 [ Ag(CN)2 ]- + Zn —— [ Zn(CN)4 ]2- + 2 Ag
闪银矿 Ag2S,角银矿 AgCl 的处 理就有所不同,生成 [ Ag(CN)2 ]- 的 反应如下:
Ag2S + 4 NaCN —— 2 Na [ Ag(CN)2 ] + Na2S
固态 CuCl2 具有链状结构。
每个 Cu 处于 4 个 Cl 形成的 平面正方形的中心:
在浓溶液中 CuCl2 是黄色 的,这是由于生成 [ CuCl4 ]2- 配位单元的缘故。
稀溶液中水分子多, CuCl2 变为 [ Cu(H2O)4 ] Cl2,由于水合 显蓝色。
目前这种方法已经被严令禁 止使用。
另一种方法是氰化法提金,用 NaCN 溶液浸取矿粉,将金溶出:
4 Au + 8 CN- + 2 H2O + O2 —— 4 [ Au(CN)2 ]- + 4 OH-
用 Zn 还原 [ Au(CN)2 ]- 得 Au
2 [ Au(CN)2 ]- + Zn —— [ Zn(CN)4 ]2- + 2 Au
4 Cu2++ 8 OH- + N2H4 —— 2 Cu2O + N2 + 6 H2O
Cu2O 呈弱碱性,溶于稀酸,并 立即歧化为 Cu 和 Cu2+:
Cu2O + 2H+ —— Cu + + Cu2+ + H2O
Cu2O 十分稳定,在 1235 ℃ 熔化但不分解。
Cu2O 溶于氨水,生成无色的 络离子:
2. 铜副族元素的提取
铜副族和锌副族优秀课件

前言
铜副族(I B): 原子核外价层电子的构型 :(n-1)d10ns1 常见氧化态:
铜 (+1,+2 ) 银 (+1) 金 (+1,+3)
铜、银、金被称为“货币金属”。 在自然界中,铜、银、金可以以单质状态、也可以以化 合态存在。
铜储量居世界第三位。以三种形式于自然界:
Cu(OH)2 -0.08 CuO2 -0.360 Cu
Ag2O3 0.739 AgO 0.607 Ag2O 0.342 Ag Au(OH)3 1.45 Au
Zn2+ -0.7618 Zn
Cd2+ >-0.6 Cd22+ <-0.2 Cd
-0.4030
Hg2+ 0.92
Hg22+ 0.789 Hg
自然铜:又称游离铜,很少;
硫化物矿:辉铜矿Cu2S、黄铜矿CuFeS2 等; 含氧矿物:赤铜矿Cu2O、黑铜矿CuO、
孔雀石CuCO3·Cu(OH)2、 胆矾CuSO4·5H2O等。
银主要是以硫化物形式存在的,除了较少的闪银矿Ag2S 外,硫化银常与方铅矿共存。
金矿主要是以自然金形式存在,包括散布在岩石中的岩 脉金和存在于沙砾中的冲积金两大类。
而Cu与配位能力较弱的配体作用时,要在氧气存在 下方能进行:
2 Cu + 8 NH3+O2 +2 H2O 2 [Cu(NH3)4]2+ + 4 OH-
铜在生命系统中起着重要作用,人体有30多种含 有铜的蛋白质和酶。血浆中的铜几乎全部结合在 铜蓝蛋白中,铜蓝蛋白具有亚铁氧化酶的功能, 成CuO。在高温下 CuO又分解为Cu2O。
银和金没有铜活泼,高温下在空气中也是稳定的。 与卤素作用,与硫作用,都反映出铜、银、金的活泼 性是逐渐减弱的。 铜与一些强配体作用放出H2,如CN-
第13章过渡元素(一) 铜族和锌族元素
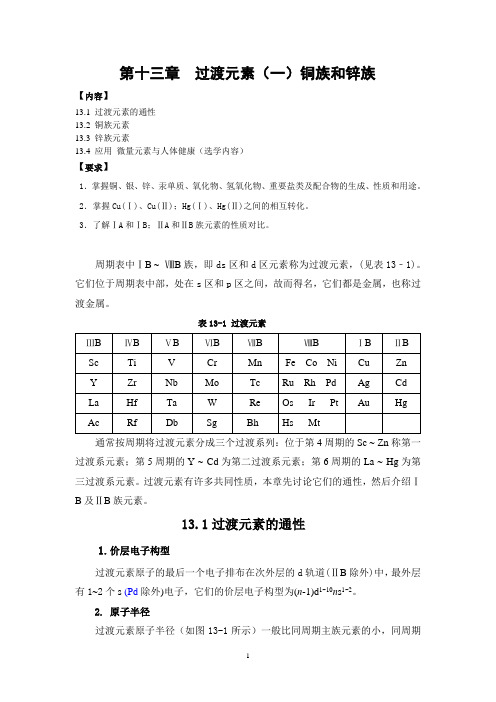
第十三章过渡元素(一)铜族和锌族【内容】13.1 过渡元素的通性13.2 铜族元素13.3 锌族元素13.4 应用微量元素与人体健康(选学内容)【要求】1.掌握铜、银、锌、汞单质、氧化物、氢氧化物、重要盐类及配合物的生成、性质和用途。
2.掌握Cu(Ⅰ)、Cu(Ⅱ);Hg(Ⅰ)、Hg(Ⅱ)之间的相互转化。
3.了解ⅠA和ⅠB;ⅡA和ⅡB族元素的性质对比。
周期表中ⅠB ~ⅧB族,即ds区和d区元素称为过渡元素,(见表13﹣1)。
它们位于周期表中部,处在s区和p区之间,故而得名,它们都是金属,也称过渡金属。
表13-1 过渡元素通常按周期将过渡元素分成三个过渡系列:位于第4周期的Sc ~ Zn称第一过渡系元素;第5周期的Y ~ Cd为第二过渡系元素;第6周期的La ~ Hg为第三过渡系元素。
过渡元素有许多共同性质,本章先讨论它们的通性,然后介绍ⅠB及ⅡB族元素。
13.1过渡元素的通性1.价层电子构型过渡元素原子的最后一个电子排布在次外层的d轨道(ⅡB除外)中,最外层有1~2个s (Pd除外)电子,它们的价层电子构型为(n-1)d1~10n s1~2。
2. 原子半径过渡元素原子半径(如图13-1所示)一般比同周期主族元素的小,同周期元素从左到右原子半径缓慢减小,到铜族前后又稍增大。
同族元素从上往下原子半径增大,但第二、第三过渡系(除ⅢB外)由于镧系收缩使同族元素原子半径十分接近,导致元素性质相似。
图13-1过渡元素原子半径3. 氧化态过渡元素有多种氧化态,因其最外层s电子和次外层部分或全部d电子都可作为价电子参与成键,一般可由+2依次增加到与族数相同的氧化态(Ⅷ族除Ru、Os外,其它元素尚无Ⅷ氧化态),这种氧化态的显著特征以第一过渡系最为典型。
表13-2第一过渡系元素的氧化数(下划线表示常见的氧化态)由13-2表可看出随着原子序数的增加,氧化数先是逐渐升高,后又逐渐降低。
这种变化主要是由于开始时3d轨道中价电子数增加,氧化数逐渐升高,当3d轨道中电子数达到5或超过5时,3d轨道逐渐趋向稳定。
铜族元素锌族元素优秀课件

II B (n-1)d10ns2
Zn Cd Hg 锌族
与主族金属接 近一些,氧化 态以+2为主
同周期,IB---IIB族比较
性质
IB
价电子构型 (n-1)d10ns1
原子半径r/pm
<
金属活泼性
<
II B (n-1)d10ns2
(n-1)d电子未参与 成键,性质与过渡 元素有较大差别
● 与NH3反应
Cu2O + 4NH3 + H2O = 2[Cu(NH3)2]+ + 2OH-
红色
无色
(很快被空气中的氧氧化)
4 [ C u ( N H 3 ) 2 ] + + 8 N H 3 + 2 H 2 O + O 2 4 [ C u ( N H 3 ) 4 ] 2 + + 4 O H -
18.1.3 存在和冶炼
1. 存在 2. 冶炼
单质:Cu,Ag,Au 矿物:孔雀石:Cu2(OH)2CO3
辉银矿:Ag2S 碲金矿Байду номын сангаасAuTe2
氰化法提炼金和银
Ag2S+ 4NaCN= Na[Ag(CN)2] + Na2S 4Ag + 8NaCN + 2H2O + O2 = 4Na[Ag(CN)2] + 4NaOH 4Au+8NaCN+2H2O+O2 = 4Na[Au(CN)2] + 4NaOH 2Na[Ag(CN)2] + Zn = 2Ag + 4Na2[Zn(CN)4]
无色
蓝色
∴ 可用[ Cu(NH3)2 ] + 除去混合气体中的O2
无机化学 第17章铜族和锌族元素

O2
2
不可用铜器盛氨水
7
[Cu(NH3 ) 4 ] (蓝)
4Au O2 8CN 2H 2 O 4[Au(CN)2 ] 4OH
17.3
铜族元素的主要化合物
1 . 氧化物及氢氧化物
加热Cu(OH)2、Cu2(OH)2CO3、Cu(NO3)2都可 以得到CuO:
Cu(OH)2 CuCO3 2CuO H2O CO2 Cu(OH)2 CuO H2O
H 2SO 4 Ag 2S(s, 黑)
21
Ag+的鉴定:
HCl AgCl Ag
NH 3
Ag(NH )
3 2
Br AgBr(s)
S2 O 3 3
-
HNO 3
Ag 2S(s) S Ag(CN)
2-
2
CN AgI(s) I Ag(S O ) 3 2 3 2 I AgI(趋势较小) 2
导热率(Hg=1)
51.3
57.2
39.2
3
熔沸点较低(相对于其他过渡金属): ①原子半径较大、结构不够紧密 ②次外层充满,电子不参与成键,价电 子较少 良好导电导热性和良好的延展性 1gAu可拉3.4km金丝,金也可被压成 0.0001mm厚的金箔 Cu、Ag、Au和许多金属形成合金 Cu-Zn 黄铜 Cu-Sn-Zn 青铜 60-40 80 -15 -5 Cu —— Ni —— Zn 白铜 50~70 - 13~15 - 13~25 4
Au 4HCl(浓) HNO3 (浓) H[AuCl4 ] NO(g) 2H 2 O
6
与沉淀剂、配合剂的作用
4Ag 2H2S O2 2Ag2S 2H2O
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
因此主铜要在氧水化溶液态中的稳定价+态1是,2+2
+1
+1,+3
原子金属半径/pm
127.8
第一电离势(kJ·mol-1) 750
第二电离势(kJ·mol-1) 1970
M+水合热(kJ·mol-1)
-582
M2+离子水合热(kJ·mol-1) -2121
升华热(kJ·mol-1)
340
电负性
1.9
比铜不活泼 mCu2S+nFeS ==Cu2S·nFeS (冰铜)
的金制属粗杂铜质沉:
于阳极泥中
2Cu2S+3O2 === 2Cu2O+2SO比2 铜活泼的金属 2Cu2O+Cu2S === 6Cu+SO杂2↑质溶解于溶液中
电解精炼 阳极(粗铜): Cu=Cu2++2e
Hale Waihona Puke 阴极(纯铜):Cu2++2e=Cu
144.4 735 2083 -486 —— 285 1.93
144.2 895 1987 -644 —— 385 2.54
四、标准电极电势
化学活泼性远小于碱金属; 从上到下,金属活泼性递减;与碱金属的变化规律 相反。
五、性质 变化特点
同周期元素核电荷:碱金属 < 铜族 同周期元素半径: 碱金属 > 铜族
2Cu+8HCl(浓)→2H3[CuCl4]+H2↑
铜在常温下不与干燥空气中的氧化合,加热时能产 生黑色的氧化铜。银、金在加热时也不与空气中的 氧化合。在潮湿的空气中放久后铜的表面会慢慢生 成一层铜绿。
2Cu+O2+H2O+CO2→Cu(OH)→ Cu(OH)2·CuCO3
银、金则不发生这个反应。铜、银能和H2S、S反应:
铜族和锌族元素优秀课件
本章内容
第一节 铜族元素 第二节 锌族元素
本章要求
1.掌握铜、银、锌、汞单质的性质和用途。
2.掌握铜、银、锌、汞的氧化物、氢氧化 物及其重要盐类的性质。
3.掌握Cu(Ⅰ)、Cu(Ⅱ)、Hg(Ⅰ)、Hg(Ⅱ)之 间的相互转化。
4.掌握A和B;A和B族元素的性质对比。
第一节 铜族元素
二、成键特征
可以形成离子键 它们的电离能不是很大,与变形性小电负性大的原 子成键时,可以失去电子形成离子键
CuSO4
AgNO3
AgF
容易形成共价 键和配位键
由于18电子结构的离子具有很强的极化力和明显的 变形性,所以铜族元素一方面易形成共价化合物, 另一方面由于它们离子的d、s、p轨道能量相差不 大,能级较低的空轨道较多,所以铜族元素容易形 成配合物。
还原:2Na[Au(CN)2]+Zn=2Au+Na2[Zn(CN)4] 2Na[Ag(CN)2]+Zn=2Ag+Na2[Zn(CN)4]淘金法
二、单质性质和用途
三种金属的标准电极电势都在氢之下,它们不溶于 稀盐酸及稀硫酸中。但当有空气或配位剂存在时, 铜能溶于稀酸和浓盐酸:
2Cu+2H2SO4+O2→2CuSO4+2H2O
铜族位于周期系的IB族,包括铜、银、金三种元素。
1-1 铜族元素的通性
铜族元素虽能形成与碱金属相同的+1氧化态的化合 物,但它们却很少相似。碱金属在周期表中是最活 泼的金属,尤其是铯、而铜族金属是不活泼的,且 由Cu→Ag→Au活泼性递减。金是很 惰性的金属。
一、电子层结构和元素氧化态
铜族:(n-1)s2 (n-1)p6 (n-1)d10 ns1 碱金属: (n-1)s2 (n-1)p6 ns1
由于上述两种因素, 加上18电子层结构对核的屏蔽效 应比8电子结构小得多,使铜族元素的有效核电荷较 大,对最外层s电子的吸引力比碱金属强。因此,与同 周期的碱金属相比,铜族元素的第一电离势较高;标 准电极电势的数值为正值;单质的熔沸点固体密度及 硬度等均比碱金属的高,所以铜族元素的金属活泼性 远小于碱金属。变化规律是:自上而下活泼性递减。 这与主族元素的变化是不同的。
2.金属冶炼
铜矿石 富集
沸腾炉 焙烧
铜的冶炼
923-1073K
反射炉 制冰铜
1773-1823K
电解精炼 富集用浮选法
转炉 制粗铜
高温吹入空气
有关的冶炼反应
焙烧: 2CuFeS2+O2 === Cu2S+2FeS+SO2
制冰铜: 2FeS+3O2 === 2FeO+2SO2
FeO+SiO2 ===FeSiO3
Cu(NH3)42+
Cu2I2 AgI
AuCl3
三、基本性质
表20-1 铜族元素的基本性质
Cu 虽然原铜子的量第二电离势较大,但63铜.5
同周期元A素g 比较,铜A族u 元素的1原07子.9半径比碱19金7.0
的二价价电离子子水合热的负值更大3d,104s1 属原子4小d1得05多s1。 5d106s1
电解反应
Cu(粗铜)===Cu(纯铜)
湿法冶炼Ag和Au
银 Ag 金Au
有关反应:
矿 物
NaCN溶液 浸取
锌 粉
往浸取液中 加放锌粉还原
浸取:4Au+8NaCN+2H2O+O2=4Na[Au(CN)2]+4NaOH 4Ag+8NaCN+2H2O+O2=4Na[Ag(CN)2]+4NaOH Ag2S+4NaCN=2Na[Ag(CN)2]+Na2S
铜、银、金三个元素,每一个元素都有+1、+2和 +3三种氧化数。最常见的氧化数:铜为+2、银为 +1、金为+3。
Cu2O、CuO、KCuO2(铜酸钾)、AgNO3、AgF2、 AgI[AgO2]等。而碱金属主要氧化态是+1。
原因是IB族的ns电子和次外层(n-1)d电子能量相差 不大,在与其他元素化合时,不仅ns电子能参加反 应,(n-1)d电子也能依反应条件的不同,可以部分 参加反应,即表现出不同的氧化态。
1-2 金属单质 一、存在和冶炼
辉黄闪赤铜矿铜斑铜矿银矿矿
1.存在 铜矿 银矿
硫化物矿:辉铜矿(Cu2S), 黄铜矿孔雀石 (CuFeS2), 斑铜矿(Cu2FeS4) 氧化物矿:赤铜矿(Cu2O), 孔雀石 (CuCO3·Cu(OH)2)。
闪银矿(Ag2S) 黄金
金矿 主要以游态存在,岩脉金矿,冲积金
4Ag+2H2S+O2=2Ag2S+2H2O
金则不能。
铜与银很容易溶解在硝酸或热的浓硫酸中,而金 只能溶于王水中。这时,硝酸作为氧化剂,盐酸 作为配位剂:
Cu+2H2SO4(浓)= CuSO4+SO2+2H2O 3Ag+4HNO3=3AgNO3+NO+2H2O
Au+4HCl+HNO3→HAuCl4+NO+2H2O
