化学反应速率 化学反应速率理论
合集下载
无机及分析化学二章节化学反应速率

eg:C(s)+O2(g)=CO2(s) v=k·C(O2) 稀溶液中溶剂参加的反应,其速率方程中不必 列出溶剂的浓度. v=k 例如: 2Na(s)+2H2O(l)=2Na+(aq)+2OH-(aq) +H2(g)
对气体而言,C可以以p表示,如上例
v=k ·C(O2) 或v=k’·p(O2) k大小由实验测得
v2 = kc2(NO2)
3、应用反应速率方程时应注意的问题
速率方程通式: 对于反应 aA+bB=dD+eE
v=k·CAm·CBn 对于基元反应:v=k·CAa·CBb 对于非基元反应:v=k·CAm·CBn 基元反应的a.b 是方程式中的系数, 非基元反应的m.n是由实验所测数据得出 m.n可能与a.b相同,也可能不同.m=a,n=b不代 表此反应一定是基元反应
对于 H2 :1级
对于:Cl2 0.5级
对于整个反应:1.5级
反应级数与实验条件有关;如蔗糖水解 反应是二级反应,但当水为大量时,可 视为水的浓度不变,即反应对水是零级、 总反应变为一级反应。
复杂反应的反应级数求法:由实验测:
例: 298K, 3I-(aq) + S2O82-(aq)= 2SO42- + I3求k、m、n、m+n
代入 第一组(或其他组)数:
k= 0.65mol-1·min-1·L
浓度如何影响反应速率 ——影响单位体积内活化分子的总数
C(反应物)增大,单位体积内分子数增大、有 效碰撞次数增大、v增大;
活化分子总数增大但活化分子百分数f不变
单位体积内分子数 活化分子数 f
100个
8个
f=8%
浓度增大 1000个
对气体而言,C可以以p表示,如上例
v=k ·C(O2) 或v=k’·p(O2) k大小由实验测得
v2 = kc2(NO2)
3、应用反应速率方程时应注意的问题
速率方程通式: 对于反应 aA+bB=dD+eE
v=k·CAm·CBn 对于基元反应:v=k·CAa·CBb 对于非基元反应:v=k·CAm·CBn 基元反应的a.b 是方程式中的系数, 非基元反应的m.n是由实验所测数据得出 m.n可能与a.b相同,也可能不同.m=a,n=b不代 表此反应一定是基元反应
对于 H2 :1级
对于:Cl2 0.5级
对于整个反应:1.5级
反应级数与实验条件有关;如蔗糖水解 反应是二级反应,但当水为大量时,可 视为水的浓度不变,即反应对水是零级、 总反应变为一级反应。
复杂反应的反应级数求法:由实验测:
例: 298K, 3I-(aq) + S2O82-(aq)= 2SO42- + I3求k、m、n、m+n
代入 第一组(或其他组)数:
k= 0.65mol-1·min-1·L
浓度如何影响反应速率 ——影响单位体积内活化分子的总数
C(反应物)增大,单位体积内分子数增大、有 效碰撞次数增大、v增大;
活化分子总数增大但活化分子百分数f不变
单位体积内分子数 活化分子数 f
100个
8个
f=8%
浓度增大 1000个
大学化学反应速率

压力对反应速率的影响Байду номын сангаас
总结词
压力越大,反应速率越快
详细描述
在一定条件下,压力越大,气体分子 密度越大,分子之间的碰撞频率和碰 撞力度增加,从而提高了反应速率。
催化剂对反应速率的影响
总结词
催化剂可以加快或减慢反应速率
详细描述
催化剂可以改变反应的途径和能量需求,从而影响反应速率。有些催化剂可以降低活化 能,使反应更容易进行,从而提高反应速率;而有些催化剂则可能通过抑制或促进某些
课程目标
01 掌握化学反应速率的基本概念、单位和表 示方法。
02 理解影响化学反应速率的因素,如温度、 浓度、压力等。
03
学习如何通过实验测定化学反应速率,并 掌握相关的实验技能。
04
了解化学反应速率在生产和生活中的应用, 培养解决实际问题的能力。
02
化学反应速率定义
化学反应速率定义
化学反应速率是指在一定条件下,化学反应进行的快慢程度,通常用单位时间内 反应物浓度的减少或生成物浓度的增加来表示。
大学化学反应速率
• 引言 • 化学反应速率定义 • 影响化学反应速率的因素 • 化学反应速率理论 • 化学反应速率的应用 • 结论
01
引言
主题简介
化学反应速率是化学学科中的重要概 念,它描述了化学反应的快慢程度。
化学反应速率的研究有助于理解化学 反应机理、反应条件和反应过程,对 于化学工业、药物合成等领域具有重 要意义。
反应速率是化学反应动力学的重要参数,可以用来描述和比较不同化学反应的进 行速度。
反应速率的表示方法
反应速率常数
在一定温度下,反应速率与反应物的浓度无关,而与催化剂的存在、光、磁场等外部条件有关,这种速率常数称 为反应速率常数。
化学反应速率及其表示方法反应速率理论简介

在复合反应中,速率最慢的步骤决定了总反 应的反应速率,称为复合反应的速率控制步骤。
二、质量作用定律
当其他条件一定时,反应物浓度越大,化学 反应的速率越快。
对有气体参加的化学反应,增大压力,反 应速率也会随之增大。
质量作用定律指出: 在一定温度下,元反应 的反应速率与反应物浓度以其化学计量数的绝 对值为幂指数的乘积成正比。
(3) 温和的催化条件:酶在常温常压下即可发 挥催化作用,温度过高会引起酶变性,失去催化 活性。
(4) 特殊的 pH:酶只能在一定的 pH 范围内发 挥催化作用,如果 pH 偏离这个范围,酶的活性就 会降低,甚至完全丧失。
对于酶的催化作用机理,一般认为是通过生成 某种中间化合物进行的。酶 E 先与底物 S 形成中间 化合物 ES,然后 ES 再进一步分解为产物 P,并释 放出酶 E。此过程可表示为:
E + S 噲垐kk1?1? ES k2 E + P
r Hm rUm=Em,2-Em,1 = (E-Em,1)(E-Em,2)
r H m=Ea-Ea'
第三节 浓度对化学反应速率的影响
一、元反应和复合反应 二、质量作用定律 三、反应级数和反应分子数
一、元反应和复合反应
反应物的微粒间直接碰撞而一步实现的化 学反应,称为元反应。
大多数化学反应要经过若干个元反应才能完 成,这类反应称为复合反应。
反应级数通常是利用实验测定的。
(二)反应分子数
反应分子数是指元反应中参加反应的微粒 的数目。元反应分为单分子反应、双分子反应 和三分子反应。
反应级数与反应分子数是两个不同的概念。 反应级数是指速率方程中浓度项的幂指数之和, 可利用实验测定,它体现了反应物浓度对反应 速率的影响,其数值可能是整数、分数或零, 也可能是负数。反应分子数是对元反应而言的, 它是由反应机理所决定的,其数值只可能是 1、 2、3 。在元反应中,反应级数和反应分子数通 常是一致的。
二、质量作用定律
当其他条件一定时,反应物浓度越大,化学 反应的速率越快。
对有气体参加的化学反应,增大压力,反 应速率也会随之增大。
质量作用定律指出: 在一定温度下,元反应 的反应速率与反应物浓度以其化学计量数的绝 对值为幂指数的乘积成正比。
(3) 温和的催化条件:酶在常温常压下即可发 挥催化作用,温度过高会引起酶变性,失去催化 活性。
(4) 特殊的 pH:酶只能在一定的 pH 范围内发 挥催化作用,如果 pH 偏离这个范围,酶的活性就 会降低,甚至完全丧失。
对于酶的催化作用机理,一般认为是通过生成 某种中间化合物进行的。酶 E 先与底物 S 形成中间 化合物 ES,然后 ES 再进一步分解为产物 P,并释 放出酶 E。此过程可表示为:
E + S 噲垐kk1?1? ES k2 E + P
r Hm rUm=Em,2-Em,1 = (E-Em,1)(E-Em,2)
r H m=Ea-Ea'
第三节 浓度对化学反应速率的影响
一、元反应和复合反应 二、质量作用定律 三、反应级数和反应分子数
一、元反应和复合反应
反应物的微粒间直接碰撞而一步实现的化 学反应,称为元反应。
大多数化学反应要经过若干个元反应才能完 成,这类反应称为复合反应。
反应级数通常是利用实验测定的。
(二)反应分子数
反应分子数是指元反应中参加反应的微粒 的数目。元反应分为单分子反应、双分子反应 和三分子反应。
反应级数与反应分子数是两个不同的概念。 反应级数是指速率方程中浓度项的幂指数之和, 可利用实验测定,它体现了反应物浓度对反应 速率的影响,其数值可能是整数、分数或零, 也可能是负数。反应分子数是对元反应而言的, 它是由反应机理所决定的,其数值只可能是 1、 2、3 。在元反应中,反应级数和反应分子数通 常是一致的。
《有机化学》第二章 化学反应速率

由第一、三次实验数据可得:
1.2×10-2 = k ×(1.0)x ×(1.0)y 4.8 × 10-2 = k ×(1.0)x ×(2.0)y
以上两式相除得: y=2
该反应的速率方程为: kcA cB2
②将任何一组实验数据代入速率方程
1.2102 mol L1 S 1
k cA cB2 (1.0mol L1)(1.0mol L1)2
催化剂通过改变反 应历程,降低反应的 活化能,从而间接增 加活化分子百分数, 加快反应速率。
注:一般反应中,反应级数x、y由实验确定,x、y可以 是整数,分数 或 零。
例: 在 298.15 K 时,发生下列反应:
aA + bB
C
将不同浓度的 A,B 两种溶液混合,得到下列实验数据:
A的初始浓 度/mol·L-1
1.0
2.0 1.0
B的初始浓 度/mol·L-1
1.0
1.0 2.0
初始速率υ/ mol·L-1 ·s-1
[B] t
:物质B的浓度随时间的变化率。
二、瞬时速率
1 lim [B] B t0 t
第二节 影响反应速率的因素
一、 浓度对反应速率的影响 1.速率方程式:
一般反应: mA+nB
pC+qD
kcAx cBy
⑴速率常数k: 只与温度、催化剂有关,与浓度无关。
⑵反应级数
①定义:速率方程式中,反应物浓度的指数x、y分别称为 反应物A和B的反应级数。总反应级数 = x + y
3.质量作用定律:— 只适用于基元反应
质量作用定律:恒温下,基元反应的化学反应 速率与各反应物浓度方次的乘积成正比,反应 物浓度的方次数就等于化学反应式中各相应物 质的计量系数。
1.2×10-2 = k ×(1.0)x ×(1.0)y 4.8 × 10-2 = k ×(1.0)x ×(2.0)y
以上两式相除得: y=2
该反应的速率方程为: kcA cB2
②将任何一组实验数据代入速率方程
1.2102 mol L1 S 1
k cA cB2 (1.0mol L1)(1.0mol L1)2
催化剂通过改变反 应历程,降低反应的 活化能,从而间接增 加活化分子百分数, 加快反应速率。
注:一般反应中,反应级数x、y由实验确定,x、y可以 是整数,分数 或 零。
例: 在 298.15 K 时,发生下列反应:
aA + bB
C
将不同浓度的 A,B 两种溶液混合,得到下列实验数据:
A的初始浓 度/mol·L-1
1.0
2.0 1.0
B的初始浓 度/mol·L-1
1.0
1.0 2.0
初始速率υ/ mol·L-1 ·s-1
[B] t
:物质B的浓度随时间的变化率。
二、瞬时速率
1 lim [B] B t0 t
第二节 影响反应速率的因素
一、 浓度对反应速率的影响 1.速率方程式:
一般反应: mA+nB
pC+qD
kcAx cBy
⑴速率常数k: 只与温度、催化剂有关,与浓度无关。
⑵反应级数
①定义:速率方程式中,反应物浓度的指数x、y分别称为 反应物A和B的反应级数。总反应级数 = x + y
3.质量作用定律:— 只适用于基元反应
质量作用定律:恒温下,基元反应的化学反应 速率与各反应物浓度方次的乘积成正比,反应 物浓度的方次数就等于化学反应式中各相应物 质的计量系数。
化学反应速率理论

化学反应速率理论
反应(1)为硫酸生产中的SO3的合成反应,反应(2)为合成 氨反应,都需要高温高压和催化剂的条件,而酸碱中和反应(3)在 常温常压下就能进行,且反应速率很快。
总之,反应的活化能的大小是决定反应速率的重要因素。碰撞
理论直观明了地说明了反应速率v
Ea的关系,但没有从分
子内部原子重新组合的角度去揭示活化能的物理意义。
化学反应速率理论
一、 有效碰撞理论与活化能
1918年,路易斯(Lewis)在阿仑尼乌斯研究的基础上,利用 气体分子运动论的成果,提出有效碰撞理论:化学反应发生的先决条 件是反应物分子间互相接触发生碰撞,但并不是每次碰撞都能发生化 学反应,大多数碰撞是无效的,只有相碰撞的反应物分子的能量超过 某一数值时,碰撞后才能发生反应。
化学反应速率理论
二、 过渡态理论
随着人们对原子、分子内部结构认识的深入, 1935年,艾林(Eyring)在量子力学和统计力学的 基础上提出了过渡态理论:化学反应不只是通过 反应物分子的简单碰撞就能完成的,在反应物到 生成物的转变过程中,必须经过一个中间过渡状 态,即反应物分子先形成活化络合物,然后再分 解为产物。
无机化学
化学反应速率理论
大气污染已经成为公众日益关注的环境问题,为了减少汽车尾气 的排放,可利用如下反应:
有些反应需要快速完成,而有些反应如橡胶的老化或者金属的腐 蚀,人们又常常希望它慢一些,因此只有在深入研究速率理论的基础 上了解反应机理,才能实现对反应速率和反应途径的控制。
自1889年阿仑尼乌斯提出活化分子、活化能之后,在气体分子 运动论和分子结构知识的基础上,逐渐形成有效碰撞理论和过渡态理 论两种主要的反应速率理论。
化学反应速率理论
活化分子具有较高的能量,以克服相碰撞时电子云之间的斥力, 并导致分子中旧键的断裂和新键的生成。反应速率的大小主要取决于 单位时间内有效碰撞的次数,而有效碰撞的次数不仅与活化分子的能 量、数目有关,也与反应的活化能密切相关。每个反应都有符合其特 征的活化能,在一定的温度下,反应的活化能越大、活化分子所占的 比例越小,单位时间内有效碰撞的次数越少,反应进行的速率就越慢。 反之,反应的活化能越小、活化分子所占的比例越大,反应速率就越 快。不同类型的反应,活化能差别很大,例如:
第三章 化学反应速率
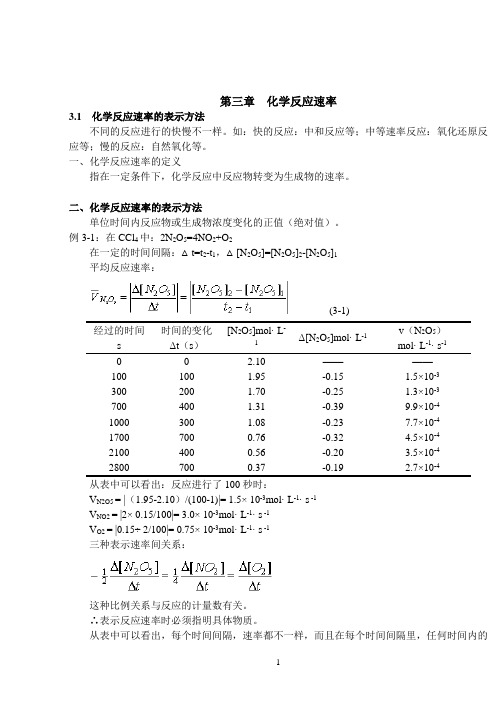
第三章化学反应速率3.1化学反应速率的表示方法不同的反应进行的快慢不一样。
如:快的反应:中和反应等;中等速率反应:氧化还原反应等;慢的反应:自然氧化等。
一、化学反应速率的定义指在一定条件下,化学反应中反应物转变为生成物的速率。
二、化学反应速率的表示方法单位时间内反应物或生成物浓度变化的正值(绝对值)。
例3-1:在CCl4中:2N2O5=4NO2+O2在一定的时间间隔:△t=t2-t1,△[N2O5]=[N2O5]2-[N2O5]1平均反应速率:(3-1)经过的时间s 时间的变化Δt(s)[N2O5]mol· L-1Δ[N2O5]mol· L-1v(N2O5)mol· L-1· s-10 0 2.10 ————100 100 1.95 -0.15 1.5×10-3300 200 1.70 -0.25 1.3×10-3700 400 1.31 -0.39 9.9×10-41000 300 1.08 -0.23 7.7×10-41700 700 0.76 -0.32 4.5×10-42100 400 0.56 -0.20 3.5×10-42800 700 0.37 -0.19 2.7×10-4从表中可以看出:反应进行了100秒时:V N2O5 = |(1.95-2.10)/(100-1)|= 1.5× 10-3mol· L-1· s -1V NO2 = |2× 0.15/100|= 3.0× 10-3mol· L-1· s -1V O2 = |0.15÷ 2/100|= 0.75× 10-3mol· L-1· s -1三种表示速率间关系:这种比例关系与反应的计量数有关。
∴表示反应速率时必须指明具体物质。
化学课件第四章、化学反应速率
规定: 规定:以各个不同的速率项除以各自在反应式中 的计量系数表示反应的反应速率. 的计量系数表示反应的反应速率.
1 1 v = vNH3 = vH2 = vN2 = 0.15mol⋅L−1 ⋅ S−1 2 3
4.1.2 瞬时速率(即时速率) 瞬时速率(即时速率) 瞬时速率: 化学反应进行到某一时刻的速率. 瞬时速率: 化学反应进行到某一时刻的速率.
ν = κ ⋅ c (A)⋅ c (B)
a b
k称为速率常数,其数值为在一定条件(温度、 称为速率常数,其数值为在一定条件(温度、 催化剂) 当各反应物浓度均为1mol· 催化剂)下,当各反应物浓度均为1mol·L-1时的化 学反应速率。 值决定于反应的本性和反应温度, 学反应速率。k值决定于反应的本性和反应温度, 与反应物浓度无关。 值一般都由实验测定。 与反应物浓度无关。k值一般都由实验测定。 (a+b)称为反应总级数 (a+b)称为反应总级数
说明: (1)速率常数 的单位与反应总级数有关: 说明: (1)速率常数k的单位与反应总级数有关: 速率常数k a+b 0 1 2 反应总级数 0级 一级 二级 k的单位 mol·L mol·L-1 · S-1 S -1 L · mol-1 · S-1
(2) a+b称为反应总级数, a为反应物A的级数,b a+b称为反应总级数 a为反应物 的级数,b 称为反应总级数, 为反应物A 为反应物B的级数. 为反应物B的级数.
∆c dc v = ±lim = ± t dt ∆t→ ∆ 0
对任一化学反应: 对任一化学反应:
−ν A ⋅ A−νB ⋅ B = + Y ⋅Y +νΖ ⋅ Z ν 1 dc(A) 1 dc(B) 1 dc(Y) 1 dc(Z) v= = = = ν A dt νB dt νY dt νZ dt
1 1 v = vNH3 = vH2 = vN2 = 0.15mol⋅L−1 ⋅ S−1 2 3
4.1.2 瞬时速率(即时速率) 瞬时速率(即时速率) 瞬时速率: 化学反应进行到某一时刻的速率. 瞬时速率: 化学反应进行到某一时刻的速率.
ν = κ ⋅ c (A)⋅ c (B)
a b
k称为速率常数,其数值为在一定条件(温度、 称为速率常数,其数值为在一定条件(温度、 催化剂) 当各反应物浓度均为1mol· 催化剂)下,当各反应物浓度均为1mol·L-1时的化 学反应速率。 值决定于反应的本性和反应温度, 学反应速率。k值决定于反应的本性和反应温度, 与反应物浓度无关。 值一般都由实验测定。 与反应物浓度无关。k值一般都由实验测定。 (a+b)称为反应总级数 (a+b)称为反应总级数
说明: (1)速率常数 的单位与反应总级数有关: 说明: (1)速率常数k的单位与反应总级数有关: 速率常数k a+b 0 1 2 反应总级数 0级 一级 二级 k的单位 mol·L mol·L-1 · S-1 S -1 L · mol-1 · S-1
(2) a+b称为反应总级数, a为反应物A的级数,b a+b称为反应总级数 a为反应物 的级数,b 称为反应总级数, 为反应物A 为反应物B的级数. 为反应物B的级数.
∆c dc v = ±lim = ± t dt ∆t→ ∆ 0
对任一化学反应: 对任一化学反应:
−ν A ⋅ A−νB ⋅ B = + Y ⋅Y +νΖ ⋅ Z ν 1 dc(A) 1 dc(B) 1 dc(Y) 1 dc(Z) v= = = = ν A dt νB dt νY dt νZ dt
化学反应速率(无机化学核心教程)

化学反应速率
Rate of chemical reaction
作业:PP55 1,3,4,9,13
CO(g) + NO(g) == CO2(g) + 1/2 N2(g) Kθp=1.9×1060 >> 500 (298K)
常温下,此反应基本上不能进行,为什么?
CO(g) + NO(g)
3 2 1
时间变化
反应物浓 度减少
生成物浓 度增加
想一想:化学反应速度与普通物体的移动速度 有些什么相同的地方?
全程平均速度 某一点的瞬时速度
二、化学反应的平均速率和瞬时速度
平均速率 瞬时速率
△c(反应物) =- △t
dc(反应物) = -
dt
IH2O2(aq) === H2O(l) + 1/2O2(g)
E
E1 A+B+C
(1)
(2) [AC]+B
C A+B AB
[AB]+C
练习题
√1、如果催化剂能使正增加三倍,
那么必然也能使逆增加三倍。
×2、加入催化剂能使平衡常数增大。
×3、催化剂能使非自发反应变成自发反应。
三、生物催化剂——酶
酶
底物
产物(脂肪、淀粉)
特点
选择性特别高 须适当的pH、T 催化效率特别高
2.50
0
0
1.00min 2.50-2x 4x
x
c0= 2.50/5.00 = 0.500(mol/L)
lnc = - kt + lnc0
0.5mol/L
1.68x10-2s-1 60 s
N2O5的剩余浓度:c = 0.182(mol/L) ∴ N2O5的剩余量 = 0.182×5.00 = 0.910(mol) ∵ 2.50 - 2x = 0.910 ∴ x = 0.795 (mol)
Rate of chemical reaction
作业:PP55 1,3,4,9,13
CO(g) + NO(g) == CO2(g) + 1/2 N2(g) Kθp=1.9×1060 >> 500 (298K)
常温下,此反应基本上不能进行,为什么?
CO(g) + NO(g)
3 2 1
时间变化
反应物浓 度减少
生成物浓 度增加
想一想:化学反应速度与普通物体的移动速度 有些什么相同的地方?
全程平均速度 某一点的瞬时速度
二、化学反应的平均速率和瞬时速度
平均速率 瞬时速率
△c(反应物) =- △t
dc(反应物) = -
dt
IH2O2(aq) === H2O(l) + 1/2O2(g)
E
E1 A+B+C
(1)
(2) [AC]+B
C A+B AB
[AB]+C
练习题
√1、如果催化剂能使正增加三倍,
那么必然也能使逆增加三倍。
×2、加入催化剂能使平衡常数增大。
×3、催化剂能使非自发反应变成自发反应。
三、生物催化剂——酶
酶
底物
产物(脂肪、淀粉)
特点
选择性特别高 须适当的pH、T 催化效率特别高
2.50
0
0
1.00min 2.50-2x 4x
x
c0= 2.50/5.00 = 0.500(mol/L)
lnc = - kt + lnc0
0.5mol/L
1.68x10-2s-1 60 s
N2O5的剩余浓度:c = 0.182(mol/L) ∴ N2O5的剩余量 = 0.182×5.00 = 0.910(mol) ∵ 2.50 - 2x = 0.910 ∴ x = 0.795 (mol)
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
催化剂对反应活化能的影响
2.多相催化:
催化剂与反应物种不属于同一物相的 催化反应。 汽车尾气(NO和CO)的催化转化:
Pt(Pd, Rh) 2NO g CO g N2 g CO2 g
反应在固相催化剂表面的活性中心上 进行,催化剂分散在陶瓷载体上,其表面 积很大,活性中心足够多,尾气可与催化 剂充分接触。
活化能
(1).活化分子
分子发生有效碰撞所必须具有的最低能量若以Ec表示,则 具有等于或超过Ec能量的分子称为活化分子,能量低于Ec的 分子称为非活化分子或者普通分子。
(2).活化能
活化分子具有的平均能量 E * 与反应物分子的平均能量 之差称为反应的活化能 Ea :
E
Ea E * E
60 80 120 0.040 0.120
0.070 0.050 0.040 0.040 0.060 0.100 0.120 0.120
0.120
NO2
0.100
c /mol•L-1
0.080
0.060
0.040
N2O4
0.020 0.00 0
0
20
40
60
80
100
N2O4-NO2体系平衡的建立
Ea2
a
A+BC r Hmθ
Ea2:逆反应活化能 r Hmθ = Ea1Ea2
b
AB + C
O
反应历程
反应途径的能量变化
EⅠ-反应物(始态)势能
EⅡ-生成物(终态)势能
正反应的活化能 Ea(正) =Eac - E(Ⅰ)
逆反应的活化能 Ea(逆) =Eac - E(Ⅱ) ΔrHm= E(Ⅱ) - E(Ⅰ)= [Eac - Ea(逆)] -[Eac - Ea(正)] ΔrHm= Ea(正) - Ea(逆)
/mol•L-1 •s-1
正
正=逆
逆
t/s
可逆反应的反应速率变化示意图
(3)化学平衡: 正、逆反应速度相等时,体系所处的状态叫 做化学平衡
正 逆 0
化学平衡状态特征: (1)前提:恒温,封闭体系,可逆反应
(2)条件:正、逆反应速率相等
(3)标志:系统的组成不再随时间而变。
3 . 酶催化
酶催化:以酶为催化剂的反应。
特点:①高效
②高选择性
③条件温和
催化剂的重要性
• 从右图来看出,加入催化剂 后,正反应活化能降低的值 与逆反应括化能降低的值是 相等的。这表明,催化剂对 正、逆反应的作用是同等的, 它只加快反应速率,而不影 响化学平衡,不改变反应方 向。 有催化与天催化的反应活 • 催化剂还具有选择性,某一 化能比较 种催化剂往往只对某一种反 应起催化作用,而不能催化 其它反应。
r Gm = r Gmθ + RT lnJ J 称为反应商
如果 P,Q,Y,Z 均为气体
[ p(Y) / p θ ] y [ p( Z) / p θ ]z Jp θ p θ q [ p(P) / p ] [ p(Q) / p ]
能量
Ea无催化 催化活化配合物 Ea催化 反应物 生成物 反应历程 催化剂改变反应 途径示意图
O
例如:反应 2 H2O2(aq) → 2H2O(l) + O2(g) 无催化剂时,反应的活化能为 75. 3 kJmol1; 用 I 做催化剂时,反应的活化能为 56. 5 kJmol1; 若使用过氧化氢酶,更能把反应速率提高到 1023 倍以上。
a. b. c. d.
第二节 反应速率理论
2.2. 反应速率理论 2.2.1分子碰撞理论 只有具有足够能量的反应物分子的碰撞才有可能发 生反应。这种能够发生反应的碰撞叫有效碰撞。 那些具有足够高能量,能发生有效碰撞的分子称 为活化分子,要使普通分子成为活化分子所需最小能量 称为活化能。 发生反应的有效碰撞的分子,还必须沿着特定的 方向碰撞。
平均速率
Example 1
起始浓度/mol· L-1 2s末浓度/mol· L-1
N2 3H 2 2NH 3
2.0 1.8 3.0 2.4 0.0 0.4
c N 2 1.8 2.0 m ol L1 v N 2 0.1m ol L1 s 1 2 0s t
需要注意以下特点 :
催化剂只能通过改变反应途径来改变反应速率, 但不能改变反应的焓变(rHm)、方向和限度 在反应速率方程中,催化剂对反应速率的影响 体现在反应速率常数(k)内。对确定反应来 说,反应温度一定时,采用不同的催化剂一般 有不同的k值。
对同一个可逆反应来说,催化剂等值地降低了 正、逆反应的活化能。
(2)化学平衡的基本特征
有些化学反应逆反应比较显著。例如, 373K时, 将0.100mol无色的N2O4气体放入1L抽空的密 闭容器中,立刻出现红综色。
N2O4
时间 /s 0 20 40 C (N2O4)/(mol· L- 0.100 1) 0.000 C (NO2)/(mol· L-1)
2NO2
P(H2O) = 0.38105Pa。试计算该反应的Kc,Kp。
解: C(s) + H2O(g) CO(g) + H2(g)
4.6 7.6 7.6 平衡浓度/(10-3mol· L- - 1)) 平衡分压 - 0.38 0.63 0.63 /(105Pa) 3 1 2 1.2 10 2 mol L1 c CO c H 7 . 6 10 mol L 2 则 Kc 4.6 10 3 mol L1 c H 2O
PC = [C] RT, PD = [D]RT PY = y[Y] RT, Pz = [Z]RT z y z P Y P Z C Y C Z RT y z cd Kp c c d d P C P D C C C D 令(y + z) (c + d) = n
3.1化学反应速率
3.3.1反应速率与浓度的关系 3.3.1.1反应速率的表示方法
(1) 化学反应速率
a.反应速率定义
1.传统的定义
反应速率 是指在一定条件下单位时间内某化学反应的反应 物转化为生成物的速率,对于均匀体系的恒容反应,习惯用 单位时间内反应物浓度的减少或者产物浓度的增加来表示, 而且习惯取正值。 浓度常用mol.L-1,时间常用s,min,h,d,y. 反应速率又分为平均速率和瞬间速率两种表示方法.
例如:
O C + 生成物 (终态)
O C
O
N
活化络合物 (过渡态)
O
O C
O
O
O
N
O
+ C O O O
C N O+O C O
N
Eac
EII
(正)
Eac
Ea(逆)
EI
(正 )
Ea(
逆)
EI
EII
能量
活化配合物 A· · · B· · · C
c
Ea1
Ea1:正反应活化能
cC(g) + dD(g)
C y Y C z Z Kc c C C C d D
yY(g) + zZ(g)
P y Y P z Z Kp c P C P d D
(物质的量)浓度
n P V RT
cC(g) + dD(g)
yY(g) + zZ(g)
则:
催化剂具有选择性。
3.4 化学平衡
3.4.1可逆反应与化学平衡
1.4.1.1可逆反应与化学平衡(1)可逆反应 在同一条件下,既能向正反应方向又 能向逆反应方向进行的反应。 仅有少数的化学反应其反应物能全部转 变为生成物,亦即反应能进行到底。
Ag + Cl
2KClO3
MnO2
AgCl
2KCl + 3O2
K p Kc RT
n
平衡常数是表明化学反应限度的一种特征值。平衡常数 越大,表示正反应进行得越完全。平衡常数值与温度及反 应式的书写形式有关,但不随浓度、压力而变。
2. 书写平衡常数关系式的规则
如果反应中有固体和纯液体参加,它们 的浓度不应写在平衡关系式中 CaCO3 (s) CaO (s) + CO2 (g) Kc =c (CO2) 稀溶液中进行的反应,如有水参加,水 的浓度也不必写在平衡关系式中 Cr2O72 + H2O 2CrO42 + cCr2O7 2H c 2
p CO p H 2 0.63 10 5 Pa 5 Kp 1 . 0 10 Pa 5 p H 2O 0.38 10 Pa
2
3标准平衡常数
(1)非标准状态下的摩尔吉布斯函数变 rGm(T)
对于一化学反应:pP + qQ = yY + zZ,在恒温恒压、 任意状态下的 rGm 与标准态 rGmθ 有如下关系:
加入催化剂Br2,可以加快H2O2分解,分解 反应的机理是: 第一步 H2O2 (aq) Br2 2H (aq) O2 (g) 2Br (aq) 第二步 H2O2 (aq) 2H (aq) 2Br (aq) 2H2O(l) Br2 总反应: 2H O (aq) O (g) 2H O(l) 2 2 2 2
(4)化学平衡是动态平衡。
3.4.1.2平衡常数
1. 实验平衡常数 2. 书写平衡常数关系式的规则 3. 标准平衡常数
1. 实验平衡常数
化学平衡常数:任何可逆反应,不管反应的始 态如何,在一定温度下达平衡时,各生成物 平衡浓度幂的乘积与反应物平衡浓度幂的乘 积之比值是一个常数。以浓度表示的称为浓 度平衡常数(Kc),以分压表示的称为压力 平衡常数(Kp)。
K c 2 CrO
