高考化学工艺流程题专项训练50题(学生版)
最新 高考备考化学 化学工艺流程综合大题专项 学生版 (2)

硼镁泥是硼镁矿生产硼砂(Na2B4O7·10H2O)时的废渣,其主要成分是MgO,还含有CaO、Al2O3、Fe2O3、FeO、MnO、B2O3、SiO2等杂质。
以硼镁泥为原料制取的七水硫酸镁在印染、造纸和医药等工业上都有广泛的应用。
硼镁泥制取七水硫酸镁的工艺流程如下:(1)滤渣A能溶于氢氟酸,写出其反应的化学方程式:_________________________________。
(2)滤渣B中含有不溶于稀盐酸的黑色固体,则滤渣B含有的成分有____________________,加MgO并煮沸的目的是_______________________。
(3)写出加NaClO过程中发生反应的离子方程式:_______________________________________________。
(4)趁热过滤的目的是_______________________________。
(5)因B2O3溶于硫酸,所以此法制备的七水硫酸镁含有少量硼酸(H3BO3),硼酸与NaOH溶液反应可制得硼砂,写出该反应的化学方程式:_____________________________________。
失去结晶水的硼砂与金属钠、氢气及石英砂一起反应可制备有机化学中的“万能还原剂——NaBH4”和另一种钠盐,写出其反应的化学方程式:________________________________________________________。
【解析】(1)硼镁泥是硼镁矿生产硼砂(Na2B4O7·10H2O)时的废渣,其主要成分是MgO,还含有CaO、Al2O3、Fe2O3、FeO、MnO、B2O3、SiO2等杂质,在硼镁泥中加硫酸,二氧化硅不溶,所以过滤后的滤渣A为二氧化硅,二氧化硅和氢氟酸反应的方程式为SiO2+4HF=SiF4↑+2H2O。
(2)加次氯酸钠的目的是为了将亚铁离子和Mn2+氧化,氧化后加氧化镁是为了调节pH,让铁离子和铝离子转化为氢氧化铁和氢氧化铝的沉淀除去,滤渣B中含有不溶于稀盐酸的黑色固体是二氧化锰,所以滤渣B的成分为:Al(OH)3、Fe(OH)3、MnO2。
高三化学专项训练 工艺流程汇总(含答案)
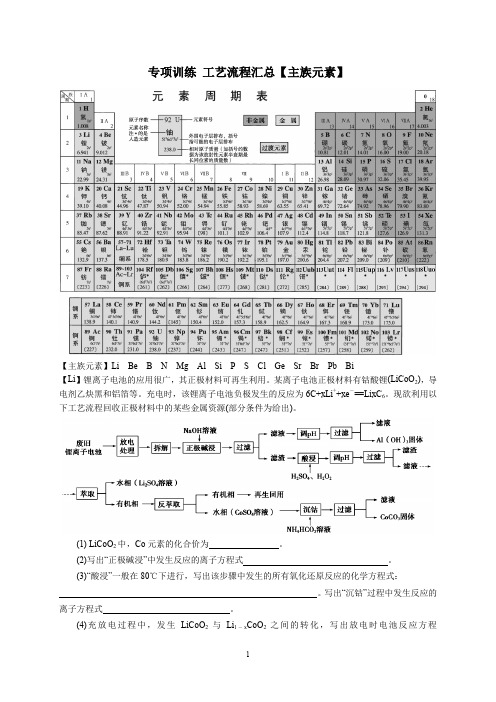
专项训练工艺流程汇总【主族元素】【主族元素】Li Be B N Mg Al Si P S Cl Ge Sr Br Pb Bi【Li】锂离子电池的应用很广,其正极材料可再生利用。
某离子电池正极材料有钴酸锂(LiCoO2),导电剂乙炔黑和铝箔等。
充电时,该锂离子电池负极发生的反应为6C+xLi++xe-=LixC6。
现欲利用以下工艺流程回收正极材料中的某些金属资源(部分条件为给出)。
(1) LiCoO2中,Co元素的化合价为。
(2)写出“正极碱浸”中发生反应的离子方程式。
(3)“酸浸”一般在80℃下进行,写出该步骤中发生的所有氧化还原反应的化学方程式:。
写出“沉钴”过程中发生反应的离子方程式。
(4)充放电过程中,发生LiCoO2与Li1-x CoO2之间的转化,写出放电时电池反应方程式。
(5)在整个回收工艺中,可回收到的金属化合物有(填化学式)。
(6)二甲醚直接燃料电池具有启动快、效率高等优点,若电解质为酸性,二甲醚直接燃料电池的负极反应为。
【Be】铍作为一种新兴材料日益被重视,有“超级金属”、“尖端金属”、“空间金属”之称。
工业上常用绿柱石(主要成分3BeO·Al2O3·6SiO2,还含有铁等杂质)冶炼铍,一种简化的工艺流程如下:按元素周期表的对角线规则,Be和Al性质相似;几种金属阳离子的氢氧化物沉淀时的pH如表。
回答下列问题:(1)步骤②。
(2)步骤③加入H2O2时发生反应的离子方程式为_______________________________,从滤液1中得到沉淀的合理pH为__________(填序号)。
A.3.3~3.7B.3.7~5.0 C.5.0~5.2 D.5.2~6.5(3)步骤④不宜使用NaOH溶液来沉淀Be2+的原因是____________________________。
从溶液中得到(NH4)2BeF4的实验操作是________、过滤、洗涤、干燥。
高考化学工艺流程题目专项练习

高考化学工艺流程题目专项练习1.废旧印刷电路板是一种电子废弃物,其中铜的含量达到矿石中的几十倍。
湿法技术是将粉碎的印刷电路板经溶解、萃取、电解等操作得到纯铜等产品。
某化学小组模拟该方法回收铜和制取胆矾,流程简图如下:流程中有三处实现了试剂的循环使用,已用虚线标出两处,第三处的试剂是________。
循环使用的NH4Cl 在反应Ⅰ中的主要作用是_________________________________________。
【答案】H2SO4防止由于溶液中的c(OH-)过高,生成Cu(OH)2沉淀【解析】操作④得到的H2SO4可以利用到反应Ⅲ中,所以第三处循环的试剂为H2SO4;NH4Cl水解溶液呈酸性,可以中和溶液中的OH―,防止由于溶液中的c(OH-)过高,生成Cu(OH)2沉淀。
2.毒重石的主要成分为BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2·2H2O的流程如下:pH pHCa2+Mg2+Fe3+开始沉淀时的pH 11.9 9.1 1.9完全沉淀时的pH 13.9 11.1 3.2加入NH3·H2O调节pH=8可除去________(填离子符号),滤渣Ⅱ中含________(填化学式)。
加入H2C2O4时应避免过量,原因是_____________________________________________________________。
已知:K sp(BaC2O4)=1.6×10-7,K sp(CaC2O4)=2.3×10-9。
【答案】Fe3+Mg(OH)2、Ca(OH)2H2C2O4过量会导致生成BaC2O4沉淀,产品的产量减少【解析】根据流程图及表格中数据可知,加入NH3·H2O调节pH=8时,只有Fe3+完全沉淀而除去。
加入NaOH,调pH=12.5,对比表格中数据可知,此时Mg2+完全沉淀,Ca2+部分沉淀,所以滤渣Ⅱ中含Mg(OH)2、Ca(OH)2。
高三化学工艺流程题专项练习

化学工艺流程题专项练习一·试题1.绿矾FeSO 4·7H 2O 的一种综合利用工艺如下:1绿矾与NH 4HCO 3在溶液中按物质的量之比1:2反应,有CO 2生成,反应的离子方程式为______________; 2隔绝空气进行“焙烧”,铁元素的转化途径是,实际作还原剂的是CO;写出“焙烧”过程中各步反应的化学方程式____________; 3“除杂”步骤为:向母液中通入含臭氧的空气、调节pH 、过滤,除去的杂质离子是____________;4母液“除杂”后,欲得到NH 42SO 4粗产品,操作步骤依次为真空蒸发浓缩、冷却结晶、____________;浓缩时若温度过高,产品中将混有NH 4HSO 4,运用化学平衡移动原理解释其原因__________________; 5绿矾的另一种综合利用方法是:绿矾脱水后在有氧条件下焙烧,FeSO 4转化为Fe 2O 3和硫的氧化物;分析下表实验数据,为了提高SO 3的含量,可采取的措施是__________________;空气通入量/L ·s-1温度/℃ SO 2含量/%SO 3含量/% 0.02 850 45.4 54.6 0.06 850 30.5 69.5 0.10 850 11.1 88.9 0.10 810 11.1 88.9 0.1089011.288.82.某炼铁废渣中含有大量CuS 及少量的铁和铁的化合物,工业上以该废渣为原料生产 CuCl 2·2H 2O 的流程如下:请回答下列问题:1废渣中的铁在潮湿的空气中发生吸氧腐蚀,其正极反应式为 ; 2高温煅烧时CuS 发生的反应为:FeCO 3 FeO Fe分解 还原绿矾FeCO 3固体母液还原铁粉NH 42SO 4粗产品……废渣CuCl 2·2H 2O……滤液B高温CuS + NaCl + O 2——→ CuCl 2 + Na 2SO 4 , 配平该反应方程式;3调pH 后铁元素生成滤渣的离子方程式为 ; 4试剂A 最好选用下列三种物质中的 填序号:a.NaClOb.Cl 2c.浓硫酸 理由是 ; 5分析右图溶解度曲线回答:①为了获得CuCl 2·2H 2O 晶体,对滤液B 进行的操作是:蒸发浓缩、_________、滤液冷却结晶、过滤得到产品;②“冷却结晶”过程中,析出CuCl 2·2H 2O 晶体的合适温度或温度范围是 ;3.硫铁矿烧渣是一种重要的化学化工产业中间产物, 主要成分是Fe 3O 4、Fe 2O 3、FeO 和二氧化硅等;下面是以硫铁矿烧渣制备高效净水剂聚合硫酸铁Fe 2OH n SO 43-n/2m 流程图:1实验室实现“操作I”所用的玻璃仪器有 、玻璃棒和烧杯等;“操作III ” 系列操作名称依次为: 、 、过滤和洗涤; 2“酸溶”过程中Fe 3O 4溶解的化学反应方程式: ; 3硫铁矿烧渣在“酸溶”前要粉碎的主要目的是;4实验室检验“反应I”已经完全的试剂是 ,现象废铁皮硫铁矿烧酸溶 200~300℃水浸 操作I反应I操作FeSO 4∙7H 2O 稀H 2SO 4Fe 2OH n SO 43-n/2m①稀H 2SO 4/②H 2O 2③水解滤渣操作滤液滤渣是 ;5加入适量H2O2的目的是氧化Fe2+,写出H2O2氧化Fe2+为Fe3+的离子方程式 ;4.铁氧体可用于隐形飞机上吸收雷达波涂料;一种以废旧锌锰电池为原料制备锰锌铁氧体的主要流程如下:1酸浸时,二氧化锰被双氧水还原的化学方程式为___________________________;2活性铁粉除汞时,铁粉的作用是_____填“氧化剂”或“还原剂”或“吸附剂”;3除汞是以氮气为载气吹入滤液带出汞蒸汽经KMnO4溶液进行吸收而实现的;右下图是KMnO4溶液处于不同pH值时对应的Hg去除率变化图,图中物质为Hg与MnO4-在该pH范围内的主要产物;①请根据该图给出pH值对汞去除率影响的变化规律:_______________________;②试猜想在强酸性环境下汞的去除率高的原因:__ ____________;4当x=0.2时,所得到的锰锌铁氧体对雷达波的吸收能力特别强,试用氧化物形式表示该铁氧体组成____________________;5经测定滤液成分后同时加入一定量的MnSO4和铁粉的目的是_____________________;5.已知工业上合成氨的反应为:N2g+3H2g 2NH3g △H<0;在一体积为2L的密闭容积中,加入0.20mol的N2和0.60mol的H2,反应中NH3的物质的量浓度的变化情况如图所示,请回答下列问题:1 写出该反应平衡常数的表达式K=______________________2反应进行到4分钟到达平衡;请计算从反应开始到刚刚平衡,平均反应速率vNH3为;35分钟时,保持其它条件不变,把容器的体积缩小一半,平衡 移动 填“向逆反应方向”、“向正反应方向”或“不” 原因是: ;化学平衡常数将 填“增大”、“减少”或“不变”;4在第5分钟时将容器的体积瞬间缩小一半后,若在第8分钟时达到新的平衡此时NH 3的浓度约为0.25 mol·L—1,请在图中画出第5分钟后NH 3浓度的变化曲线;5N 2和H 2的反应还有其它应用;如:有人设想寻求合适的催化剂和电极材料,分别以N 2、H 2为电极反应物,以HCl —NH 4Cl 溶液为电解质溶液制造新型燃料电池,试写出该电池的正极电极反应式 ;6.高铁酸钾广泛应用于净水、电池工业等领域;工业上以钛白粉生产的副产品FeSO 4制备高铁酸钾的生产流程如下:FeSO 4溶液氧化I过滤NaOH操作IH 2SO 4氧化II试剂AB反应KOHK 2FeO 4滤渣H 2O 2查资料得知K 2FeO 4的一些性质:①在碱性环境中稳定,在中性和酸性条件下不稳定 ②溶解度很大,难溶于无水乙醇等有机溶剂③具有强氧化性,能氧化有机烃、苯胺和80%以下乙醇溶液 回答下列问题:1写出“氧化I ”中,生成Fe 3+的离子反应方程式 ;2氧化Ⅱ中,试剂A 为 填“H 2O 2”或“HNO 3”或“NaClO ”;过滤操作中,得到的滤渣B 中除NaCl 还有3操作I 中包括冷却结晶、过滤、洗涤干燥几个步骤;洗涤干燥的目的是脱碱脱水,进行该操作时最好用 洗涤;4净水时高铁酸钾能逐渐与水反应生成絮状的FeOH 3,请补充并配平该反应方程式K 2FeO 4 + H 2O = FeOH 3↓ + KOH + 5将一定量的K 2FeO 4投入一定浓度的FeCl 3溶液中,测得剩余K 2FeO 4浓度如下图所示,推测产生曲线I 和曲线II 差异的原因是 来源:.shulihua.shulihua高铁酸钾剩余浓度 m g ·L -1时间/t FeCl 3浓度1.5 mg ·L -10 mg ·L -1III7.硫酸工业中废渣的成分为SiO2、Fe2O3、Al2O3、MgO;某探究性学习小组的同学设计以下方案,进行硫酸渣中金属元素的提取实验;硫酸渣过量盐酸固体充分反应固体固体固体溶液溶液溶液溶液ABCDEFGH试剂试剂调调pH=3.7pH=13过量CO2X X已知:阳离子以氢氧化物形式完全沉淀时溶液的pH:沉淀物FeOH3AlOH3MgOH2pH 3.45.212.4一水合氨电离常数K b=1.8×10-5,其饱和溶液中c OH-约为1×10-3mol·L-1;请回答:1写出A与氢氟酸反应的化学方程式:;2上述流程中两次使用试剂X,推测试剂X是填以下字母编号A.水B.氧化铝 C.氨水D.氢氧化钠3溶液D到固体E过程中需要控制溶液pH=13,如果pH过小,可能导致的后果是 ;任写2点4写出F H的反应离子方程式: ;5证明H溶液的主要阴离子Cl-、OH-除外的方法是 ;8.镍电池电极材料由NiOH2、碳粉、氧化铁等涂覆在铝箔上制成;由于电池使用后电极材料对环境有危害,某兴趣小组对该电池电极材料进行资源回收研究,设计实验流程如下:已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+;②已知实验温度时的溶解度:NiC2O4>NiC2O4·H2O>NiC2O4·2H2OMOH n K sp开始沉淀时pH 沉淀完全时的pHAlOH3 1.9×10-23 3.4 4.2FeOH3 3.8×10-38 2.5 2.9NiOH2 1.6×10-147.6 9.81 用NiO调节溶液的pH,依次析出沉淀Ⅰ和沉淀Ⅱ填化学式;2 写出加入Na2C2O4溶液的反应的化学方程式: ;3 写出电解滤液的阴极电极反应式: ;检验电解滤液时阳极产生的气体的方法是: ;4 写出“氧化”反应的离子方程式: ;5 如何检验NiOH3是否洗涤干净 ;9.工业上利用硫铁矿烧渣主要成分为Fe2O3、FeO、SiO2等为原料制备高档颜料铁红Fe2O3 ,具体生产流程如下:试回答下列问题:1滤液X中含有的金属阳离子是填离子符号;2步骤Ⅲ中可选用试剂调节溶液的pH填字母;A.稀硝酸 B.氨水 C.氢氧化钠溶液 D.高锰酸钾溶液3步骤Ⅳ中,FeCO3达到沉淀溶解平衡时,室温下测得溶液的pH为8,cFe2+为1.0×10-5mol·L-1 ;试判断所得FeCO3中是否混有FeOH2填“是”或“否”,请通过简单计算说明理由已知:K sp FeOH2=4.9×10-17;4步骤Ⅳ的反应温度一般需控制在35℃以下,其目的是 ;5在空气中煅烧FeCO3生成产品氧化铁的化学方程式为 ;二·答案1.1Fe2++2HCO3-=FeCO3↓+CO2↑+H2O2FeCO3FeO+CO2↑CO2+C2COFeO+CO Fe+CO23Fe2+4过滤 NH4++H2O NH3·H2O+H+,温度过高NH3挥发使平衡向右移动,溶液酸性增强生成NH4HSO4;5增大空气通入量2.12H2O+O2+4e-=4OH-21 2 2 1 13Fe3++3OH—= FeOH3↓4 a2分 NaClO能将Fe2+氧化为Fe3+,且NaClO溶液显碱性,能增大溶液pH5①趁热过滤②35~40℃3.1漏斗蒸发浓缩冷却结晶2Fe3O4+4H2SO4=FeSO4+Fe2SO43+4H2O3增大烧渣与硫酸的接触面积,加快烧渣的溶解速率4KSCN溶液溶液不呈血红色52Fe2++H2O2+2H+=2Fe3++2H2O4.16分1MnO2+H2O2+H2SO4 = MnSO4 +O2↑+2H2O2还原剂3①随pH值的升高汞的去除率先降低后增加②Mn2+具有催化作用4MnO·4ZnO·5Fe2O35调节滤液离子的成分,符合水热后获得锰锌铁氧化体组成5.120.025mol/(L min)3向正反应方向;原因是:若只把容器的体积缩小一半,各种物质的浓度都加倍,浓度熵Q<K,平衡向正向移动也可答体积缩小一半相当于增大体系的压强.......的方向即正.........,平衡向气体分子数减小反应方向移动不变气体分子数减小.......的方向即正反应方向移动不变4CNH3mol·L-15N2 + 8H++ 6e—==2NH4+6.1 H2O2 +2 H++2Fe2+=2Fe3++2H2O2 NaClO Na2SO43 无水乙醇4 4 10 8 3O2↑5 FeCl3溶液水解显酸性,促进K2FeO4与水反应,从而降低K2FeO4浓度7.1 SiO2+4HF=SiF4↑+2H2O2D3镁离子沉淀不完全或氢氧化铝溶解不完全4AlO2- + CO2 + 2H2O == AlOH3↓+ HCO3-5取1-2 mL H溶液,加入过量..BaCl2CaCl2溶液,没有沉淀产生;再滴加入NaOH溶液,有白色沉淀产生,或再滴加入盐酸,有无色无味气体产生,证明含有HCO3-8.1 FeOH3 AlOH32 NiCl2+Na2C2O4+2H2O===NiC2O4·2H2O↓+2NaCl3 2H+ + 2e- == H2↑ 用湿润的淀粉碘化钾试纸检验4 2NiOH2+2OH-+Cl2===2NiOH3+2Cl-5 用小试管取少量洗涤液,滴加AgNO3溶液,若没有白色沉淀生成,则说明NiOH3已洗涤干净;若有白色沉淀生成,则说明还未洗涤干净;9. 1Fe2+、Fe3+2B3否溶液中c Fe2+·c2OH-=1.0×10-5×1×10-62=1.0×10-17﹤K sp FeOH2,故无FeOH2沉淀生成4防止NH4HCO3分解,减少Fe2+的水解54FeCO3 + O2 2Fe2O3 + 4CO2高温。
高考化学工艺流程练习题

26.(14分)过氧化钙微溶于水,溶于酸,可作分析试剂、医用防腐剂、消毒剂。
学.科网.以下是一种制备过氧化钙的实验方法。
回答下列问题:(一)碳酸钙的制备 (1)步骤①加入氨水的目的是_______。
小火煮沸的作用是使沉淀颗粒长大,有利于____。
(2)右图是某学生的过滤操作示意图,其操作不规范的是______(填标号)。
a .漏斗末端颈尖未紧靠烧杯壁b .玻璃棒用作引流c .将滤纸湿润,使其紧贴漏斗壁d .滤纸边缘高出漏斗e .用玻璃棒在漏斗中轻轻搅动以加快过滤速度(二)过氧化钙的制备(3)步骤②的具体操作为逐滴加入稀盐酸,至溶液中尚存有少量固体,此时溶液呈____性(填“酸”、“碱”或“中”)。
将溶液煮沸,趁热过滤。
将溶液煮沸的作用是___________。
(4)步骤③中反应的化学方程式为________,该反应需要在冰浴下进行,原因是_________。
(5)将过滤得到的白色结晶依次使用蒸馏水、乙醇洗涤,使用乙醇洗涤的目的是_______。
(6)制备过氧化钙的另一种方法是:将石灰石煅烧后,直接加入双氧水反应,过滤后可得石灰石 双氧水和氨水 盐过滤滤CaCO碳酸铵溶液 过滤 白色结晶 稀盐酸、煮沸、过滤 滤液 CaCO 3过滤 氨水和双氧水到过氧化钙产品。
该工艺方法的优点是______,产品的缺点是_______。
28.(14分)以硅藻土为载体的五氧化二钒(V 2O 5)是接触法生成硫酸的催化剂。
从废钒催化剂中回收V 2O 5既避免污染环境又有利于资源综合利用。
废钒催化剂的主要成分为:物质V 2O 5 V 2O 4 K 2SO 4 SiO 2 Fe 2O 3 Al 2O 3 质量分数/% 2.2~2.9 2.8~3.1 22~28 60~65 1~2 <1回答下列问题:(1)“酸浸”时V 2O 5转化为VO 2+,反应的离子方程式为___________,同时V 2O 4转成VO 2+。
工艺流程综合题--2024年高考真题和模拟题化学好题汇编(学生版)

工艺流程综合题考点工艺流程综合题1(2024·浙江6月卷)矿物资源的综合利用有多种方法,如铅锌矿(主要成分为PbS 、ZnS )的利用有火法和电解法等。
已知:①PbCl 2(s )热水冷却PbCl 2(aq )HClH 2PbCl 4 ;②电解前后ZnS 总量不变;③AgF 易溶于水。
请回答:(1)根据富氧煅烧(在空气流中煅烧)和通电电解(如图)的结果,PbS 中硫元素体现的性质是(选填“氧化性”、“还原性”、“酸性”、“热稳定性”之一)。
产物B 中有少量Pb 3O 4,该物质可溶于浓盐酸,Pb 元素转化为PbCl 4 2-,写出该反应的化学方程式;从该反应液中提取PbCl 2的步骤如下:加热条件下,加入(填一种反应试剂),充分反应,趁热过滤,冷却结晶,得到产品。
(2)下列说法正确的是。
A.电解池中发生的总反应是PbS =Pb +S (条件省略)B.产物B 主要是铅氧化物与锌氧化物C.1mol 化合物C 在水溶液中最多可中和2molNaOHD.ClF 的氧化性弱于Cl 2(3)D 的结构为(X =F 或Cl ),设计实验先除去样品D 中的硫元素,再用除去硫元素后的溶液探究X 为何种元素。
①实验方案:取D 的溶液,加入足量NaOH 溶液,加热充分反应,然后;②写出D (用HSO 3X 表示)的溶液与足量NaOH 溶液反应的离子方程式。
2(2024·安徽卷)精炼铜产生的铜阳极泥富含Cu 、Ag 、Au 等多种元素。
研究人员设计了一种从铜阳极泥中分离提收金和银的流程,如下图所示。
回答下列问题:(1)Cu位于元素周期表第周期第族。
(2)“浸出液1”中含有的金属离子主要是。
(3)“浸取2”步骤中,单质金转化为HAuCl4的化学方程式为。
(4)“浸取3”步骤中,“浸渣2”中的(填化学式)转化为Ag S2O323-。
(5)“电沉积”步骤中阴极的电极反应式为。
“电沉积”步骤完成后,阴极区溶液中可循环利用的物质为(填化学式)。
高考化学 化学工艺流程综合训练试题

冠夺市安全阳光实验学校化学工艺流程综合训练1. (2014·化州模拟改编)某科研小组以难溶性钾长石(K2O·Al2O3·6SiO2)为原料,提取Al2O3、K2CO3等物质,工艺流程如下:(1) 煅烧过程中有如下反应发生。
①钾长石中的硅元素在CaCO3作用下转化为CaSiO3,写出SiO2转化为CaSiO3的化学方程式: 。
②钾长石中的钾元素和铝元素在Na2CO3作用下转化为可溶性的NaAlO2和KAlO2,写出Al2O3转化为NaAlO2的化学方程式: 。
(2) 已知NaAlO2和KAlO2易发生如下水解反应:Al-2O+2H2O Al(OH)3+OH-。
“浸取”时应保持溶液呈(填“酸”或“碱”)性。
“浸取”时不断搅拌的目的是。
(3) “转化”时加入NaOH的主要作用是(用离子方程式表示)。
(4) 上述工艺中可以循环利用的主要物质是、和水。
2. (2014·河源期末改编)化工原料红矾钠(重铬酸钠:Na2Cr2O7·2H2O)主要是以铬铁矿(主要成分为FeO·Cr2O3,还含有Al2O3、SiO2等杂质)为主要原料生产,其主要工艺流程如下:步骤①中主要反应的化学方程式如下:4FeO·Cr2O3+8Na2CO3+7O28Na2CrO4+2Fe2O3+8CO2(1) ①中反应是在回转窑中进行的,反应时需不断搅拌,其作用是。
(2) 杂质Al2O3、SiO2在①中转化反应的化学方程式为、。
3) 用化学平衡移动原理说明③中煮沸的作用是(用离子方程式结合文字说明),若调节pH过低产生的影响是。
(4) ⑤中酸化是使Cr2-4O转化为Cr22-7O,写出该反应的离子方程式: 。
(5) 工业上还可用电解法制备重铬酸钠,其装置示意图如右图。
阴极的电极反应式为 ;阳极的电极反应式为。
3. (2014·珠海模拟改编)锰锌铁氧体可用于隐形飞机上吸收雷达波涂料。
2025届高考化学专项小练工艺流程图选择题

工艺流程图选择题1.(广东试验中学2024届高三阶段测试)钒是一种熔点高、硬度大、无磁性的金属,广泛应用于钢铁、航空航天、能源等领域。
工业上利用冶炼铝生成的固体废料——赤泥(主要成分为Fe2O3、Al2O3、V2O5及少量稀土金属氧化物)提取金属钒,其工艺流程图如下:已知:钒有多种价态,其中+5价最稳定。
钒在溶液中主要以和的形式存在,且存在平衡VO2++H2O VO3-+2H+。
下列说法正确的是A.工业生产中,碱浸步骤可选用较为廉价的氨水B.可以推想VO2Cl溶解度大于NH4VO3C.焙烧非磁性产品所得的固体产物加酸溶解时,应加入过量盐酸使其溶解完全D.将磁性产品加入稀硝酸溶解,取上层清液再加入KSCN溶液后未见红色,则磁性产品中肯定不含铁元素【答案】B【解析】赤泥进行碱浸,氧化铝溶解形成偏铝酸盐,再通入二氧化碳得到氢氧化铝沉淀。
滤渣1系列操作得到V2O5,可知滤渣1中含有Fe2O3、V2O5及少量稀土金属氧化物,进行还原、磁选,磁性产品中含有Fe等,非磁性产品含有V元素,在空气中焙烧后用盐酸溶解,钒在溶液中主要以VO2+和VO3﹣的形式存在,再加入氯化铵转化为NH4VO3,焙烧得到V2O5,由溶液中存在平衡VO2++H2O VO3-+2H+,盐酸过量会抑制的生成NH4VO3,盐酸溶解时不宜过量。
氧化铝不溶于弱碱,氨水不能溶解氧化铝,故A错误;B.用盐酸溶液后的溶液中含有VO2+和VO3﹣、Cl﹣,加入氯化铵生成NH4VO3沉淀,反应向生成更难溶的物质进行,可以推想VO2Cl溶解度大于NH4VO3,故B正确;C.溶液中存在平衡VO2++H2O VO3-+2H+,盐酸过量平衡逆向移动,会抑制的生成NH4VO3,所以不能加入过量的盐酸,故C错误;D.磁性产品中有铁的单质存在,若加入的硝酸不足,Fe元素被硝酸氧化可能生成亚铁离子,亚铁离子遇KSCN溶液无明显现象,故D错误;故选B。
2.(湖南省衡阳市第八中学2024届高三月考)用适当浓度的盐酸、NaCl溶液、氨水、铁粉和葡萄糖溶液可依据如图方法从某含有Cu2+、Ag+的溶液中回收Cu和Ag(图中标注的试剂和物质均不同)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高考化学工艺流程题专项训练50题(学生版)1.利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。
某工厂对制革工业污泥中Cr(Ⅲ)的处理工艺流程如下:已知:①硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
②常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:阳离子Fe3+Mg2+Al3+Cr3+沉淀完全时的pH 3.7 11.1 5.4(>8溶解) 9(>9溶解)(1)实验室用18.4 mol·L-1的浓硫酸配制480 mL 2 mol·L-1的硫酸,需量取浓硫酸_______________mL;配制时所用玻璃仪器除量筒、烧杯和玻璃棒外,还需__________________________________________。
(2)H2O2的作用是_____________________________________(用离子方程式表示)。
(3)加入NaOH溶液使溶液呈碱性,既可以除去某些杂质离子,同时又可以将Cr2O72-转化为_______(填微粒的化学式)(4)钠离子交换树脂的反应原理为:M n+ + nNaR = MR n + nNa+,则利用钠离子交换树脂可除去滤液Ⅱ中的金属阳离子有__________________。
(5)写出上述流程中用SO2进行还原时发生反应的离子方程式:____________________。
2.工业以软锰矿(主要成分是MnO2,含有SiO2、Fe2O3等少量杂质)为主要原料制备高性能的磁性材料碳酸锰(MnCO3)。
其工业流程如下:(1)浸锰过程中Fe2O3与SO2反应的离子方程式为Fe2O3+SO2+2H+=2Fe2++SO42-+H2O,该反应是经历以下两步反应实现的。
i.Fe2O3+6H+=2Fe3++3H2O ii.……写出ii的离子方程式:______________________。
(2)过滤Ⅰ所得滤液中主要存在的两种金属阳离子为___________(填离子符号)(3)氧化过程中被MnO2氧化的物质有(写化学式):______________________。
(4)“浸锰”反应中往往有副产物MnS2O6生成,温度对浸锰”反应的影响如图所示:为减少MnS2O6的生成,“浸锰”的适宜温度是___________;向过滤Ⅱ所得的滤液中加入NH4HCO3溶液时温度不宜太高的原因是______________________。
(5)加入NH4HCO3溶液后,生成MnCO3沉淀,同时还有气体生成,写出反应的离子方程式:______________________。
(6)已知:pNi=-lgc(Ni2+),常温下,Ksp(NiCO3)=1.4×10-7,向10mL0.1mol·L-1Ni(NO3)2溶液中滴加0.1mol·L-1Na2S溶液,会产生NiS沉淀,在滴加过程中pNi与Na2S溶液体积的关系如图所示。
则在E、F、G三点中,___________点对应溶液中水电离程度最小,常温下,在NiS和NiCO3的浊液中=______________________。
3.铍铜是广泛应用于制造高级弹性元件的良好合金。
某科研小组从某废旧铍铜元件(主要含BeO、CuS,还含少量FeS和SiO2)中回收铍和铜两种金属的工艺流程如下:已知:i.铍、铝元素化学性质相似;BeCl2熔融时能微弱电离。
ii.常温下:Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Mn(OH)2]=2.1×10-13。
回答下列问题:(1)滤液A的主要成分除NaOH外,还有___________(填化学式);写出反应I中含铍化合物与过量盐酸反应的离子方程式:___________。
(2)滤液C中含NaCl、BeCl2和少量HCl,为得到较纯净的BeCl2溶液,选择下列实验操作最合理步骤的顺序是___________;电解熔融BeCl2制备金属铍时,需要加入NaCl,其作用是___________。
①加入过量的NaOH:②加入过量的氨水;③加入适量的HCl;④过滤;⑤洗涤。
(3)反应Ⅱ中CuS的氧化产物为S单质,该反应的化学方程式为___________。
(4)常温下,若滤液D中c(Cu2+)=2.2mol·L-1、c(Fe3+)=0.008mol·L-1、c(Mn2+)=0.21mol·L-1,向其中逐滴加入稀氨水,生成沉淀F是___________(填化学式);为了尽可能多的回收铜,所得滤液G的pH最大值为___________。
4.黄钠铁钒渣主要含有Na2Fe6(SO4)4(OH)12、BaSO4、NiSO4、MgSO4、CaSO4、Al2(SO4)3等,利用其制备镍锌铁氧体工艺流程如下。
已知:①锌、铝两种元素化学性质相似;②晶体完整度与晶体中Ni、Zn、Fe比例有关;③常温下,相关物质的pK sp单如下表:(1)“焙烧”中无烟煤的作用为___________.(2)“调pH”时,a值可取___________(填标号)。
A.3.2B.4.3C.5.2D.9.1(3)若“净化”后的溶液中c(M2+)=1.0×10-3mol·L-1,则c(Ca2+)=___________ mol·L-1。
(4)“水热合成”发生反应的离子方程式为___________,滤液的主要成分为___________(填化学式) (5)由右图可知,pH=8时“水热合成”所得镍锌铁氧体晶体的完整度最高,其原因是___________。
(6)“焙烧”会生成少量BaS,对该工艺造成的影响是___________。
5.某废旧锂电池材料含有钴酸锂(LiCoO2)、导电剂石墨和铝粉等。
回收废旧锂电池中钴的工艺流程如下:已知:K sp(CoC2O4)=2.5×10-9,K sp(CoCO3)=1.5×10-13回答下列问题:(1)“浸出液”的主要成分是LiHC2O4、Al(HC2O4)3,“浸出渣”的主要成分是CoC2O4。
“浸出”中生成CoC2O4的化学方程式为_______ ,若H2C2O4用量过大,CoC2O4的产率反而会降低,原因是____。
(2)“转化”中加入Na2CO3溶液发生反应的离子方程式为___________,该反应进行的程度较大,试用平衡常数K解释原因_____ 。
(3)“电解”时装置如图所示。
阳极的电极反应式为______,电解后a室中的电解液可返回________工序继续使用。
(4)某废旧锂电池粉末中LiCoO2的质量分数为w,将mkg该废料进行回收利用,电解得到钴nkg,钴的回收率为____。
6.高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色净水消毒剂。
工业上以菱铁矿(主要成分是FeCO3及少量SiO2)为原料制备高铁酸钠生产过程如下:(1)Na2FeO4中铁元素的化合价为___,高铁酸钠用于杀菌消毒时的化学反应类型为____(填“氧化还原反应”、“复分解反应”或“化合反应”)。
(2)按照上述流程,步骤①中碱浸时能否用较便宜的Ca(OH)2替代NaOH_____(填“能”或“不能”),理由是___________。
(3)步骤②中28%的稀硫酸需要用98%的浓硫酸配制,配制时所需玻璃仪器除量筒外,还____(填字母序号)。
步骤③中检验Fe2+全部转化成Fe3+的方法是:__________。
A.容量瓶B.烧杯C.烧瓶D.玻璃棒E.酸式滴定管;(4)步骤④中除生成Na2FeO4外,还有NaCl生成,其离子方程式为_________;己知步骤⑤是向Na2FeO4溶液中继续加入氢氧化钠固体得到悬浊液,则操作a的名称为_____。
(5)理论上,每获得0.5mol的FeO42-消耗NaClO的总质量为_____。
7.金属铼熔点高、耐磨、耐腐蚀,广泛用于航天航空等领域。
工业上用富铼渣(含ReS2)制得铼粉,其工艺流程如下图所示:回答下列问题(1)下图是矿样粒度与浸出率关系图,浸出时应将富铼渣粉碎至___________目;请给出提高铼浸出率的另外两种方法:___________。
浸出反应中ReS2转化为两种强酸,请写出铼浸出反应的离子方程式:______________________。
(2)上图表示萃取液流速与铼吸附率关系。
结合实际工业生产效益,萃取剂流速宜选用的范围是___________BV/h。
(3)已知高铼酸铵不溶于冷水,易溶于热水。
提纯粗高铼酸铵固体的方法是___________。
(4)高铼酸铵热分解得到Re2O7,写出氢气在800℃时还原Re2O7制得铼粉的化学方程式______________________。
(5)整个工艺流程中可循环利用的物质有:H2SO4、___________、___________。
8.硫酸锰是一种重要的化工中间体,是锰行业研究的热点。
一种以高硫锰矿(主要成分为含锰化合物及FeS)为原料制备硫酸锰的工艺流程如下:已知:①“混合焙烧”后烧渣含MnSO4、Fe2O3及少量FeO、Al2O3、MgO。
②金属离子在水溶液中的平衡浓度与pH的关系如图所示(25℃):③此实验条件下Mn2+开始沉淀的pH为7.54;离子浓度≤10-5mol·L-1时,离子沉淀完全。
请回答:(1)传统工艺处理高硫锰矿时,不经“混合焙烧”,而是直接用H2SO4浸出,其缺点为___________。
(2)“氧化”时,发生反应的离子方程式为_________________________________。
若省略“氧化”步骤,造成的后果是_________________________________。
(3)“中和除杂”时,生成沉淀的主要成分为______________________(填化学式)。
(4)“氟化除杂”时,若使溶液中的Mg2+和Ca2+沉淀完全,需维持c(F-)不低于___________。
(已知:K sp(MgF2)=6.4×10-10;K sp(CaF2)=3.6×10-12)(5)“碳化结晶”时,发生反应的离子方程式为______________________。
(6)“系列操作”指___________、过滤、洗涤、干燥(7)用惰性电极电解MnSO4溶液可制备MnO2,电解过程中阳极的电极反应式为___________。
9.氨法溶浸氧化锌烟灰制取高纯锌的工艺流程如图所示。
溶浸后氧化锌烟灰中锌、铜、镉、砷元素分别以Zn(NH3)42+、Cu(NH3)42+、Cd(NH3)42+、AsCl52-的形式存在。
