第4章氧化还原反应
大学化学-第4章-电化学原理及应用
氧化剂与还原剂在反应中的变化规律
氧化剂 得电子 还原剂 失电子
氧化数降低 具有氧化性 使还原剂氧化
本身被还原
氧化数升高 具有还原性 使氧化剂还原
本身被氧化
+1 +2 -1 +3 NaClO + 2FeSO4 + H2SO4 = NaCl + Fe2(SO4)3 + H2O
氧化剂 还原剂 还原产物 氧化产物
第 章 电化学原理及应用
4
4.2 原电池与电极电势
氧化-还原电极 电极
Fe3+(c1), Fe2+(c2) | Pt Cu2+(c1), Cu+(c2) | Pt
电极反应
Fe3+(c1) + e- →Fe2+(c2) Cu2+(c1) + e- →Cu+(c2)
Sn4+(c1), Sn2+(c2) | Pt
第 章 电化学原理及应用
4
4.2 原电池与电极电势
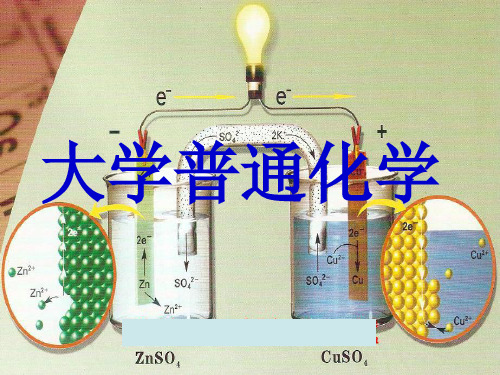
工作原理:Zn比Cu活泼,Zn原子失去电子被氧 化成 Zn2+进入ZnSO4 溶液;电子沿导线流向Cu片,
CuSO4 溶液中的Cu2+ 从 Cu片上获得电子还原成Cu
原子沉积在Cu片上。外电路上电子的定向流动产生 了电流 , 所以指针偏转,原电池对外做了电功。
氧化还原反应 直观的认识(20世纪):氧化数变化 2e如:电子得失: Zn + Cu2+ 电子偏移: 2H2 + O2 氧化数变化: Zn + Cu2+
0 +2 0 0
本质的认识(19世纪):电子得失或偏移
Zn2+ + Cu 2H2O
高中化学:《高中化学》必修二第四章《氧化还原反应》

高中化学:《高中化学》必修二第四章《氧化还原反应》氧化还原反应作为化学中的重要反应之一,具有广泛的应用领域。
在《高中化学》必修二第四章《氧化还原反应》中,学生将通过实验和探究,深入理解氧化和还原的概念,认识氧化还原反应的特征和意义,掌握常见氧化还原反应的平衡方程式以及电子转移过程中的电子数变化等内容,提高科学思维和实验技能。
本章相关知识点:1、氧化和还原的概念、化学符号表示和电子转移过程中的电子数变化。
2、氧化还原反应的特征和意义。
3、氧化剂和还原剂的概念及其判断方法。
4、常见氧化还原反应的平衡方程式和化学实验的探究,提高实验技能和科学思维。
下面是本章的练习题:一、选择题:1、将Na转变成Na+,则它的氧化数由()变成()。
A、0,+1B、0,−1C、+1,02、用Cu2+溶液处理Zn的表面,此时Zn的()。
A、氧化数增加B、氧化数不变C、氧化数减小3、SO2气体遇到KMnO4溶液,能使KMnO4氧化为()。
A、MnO2B、MnO4−C、Mn2+4、下列物质不可以作为还原剂的是()。
A、ZnB、CuC、Al2O35、设化学反应:Fe2O3 + 3H2 → 2Fe + 3H2O,那么Fe2O3的氧化数是()。
A、+2B、+3C、+6二、填空题:1、Zn与Cu2+溶液反应时,Zn被氧化,Cu2+离子被()。
2、NO在HNO3中发生氧化反应,NO的氧化数从()变为()。
三、解答题:1、请给出下列反应的电子转移方程式和氧化还原反应类型:a)Cu + 2HNO3 → Cu(NO3)2 + 2NO2↑ + H2Ob)Na2S2O3 + 2HCl → 2NaCl + SO2↑ + S↓ + H2O2、在化学实验中,如何判断一种物质是还原剂或氧化剂?参考答案:一、选择题:1、B2、A3、B4、C5、B二、填空题:1、还原2、+2,+3三、解答题:1、a)Cu → Cu2+ + 2e−HNO3 + 3e− → NO2↑ + 2H2O氧化还原反应类型:还原反应b)Na2S2O3 → 2Na+ + S2O32−2H+ + 2e− → H2↑氧化还原反应类型:还原反应2、根据化学实验的结果,能够判断一种物质是还原剂或氧化剂。
2012普化-第04章氧化还原-带答案

第4章电化学与金属腐蚀一、判断题:1、一个电极对应着一个氧化还原反应的半反应。
(√)2、电极电势代数值大的电对的氧化能力强。
(×)3、氢标准电极的电极电势的绝对值为零。
(×)4、一个电极对应着一个氧化还原反应的半反应。
(√)5、电极电势值小的电对能被电极电势值大的电对氧化。
(×)二、选择题1、已知下列反应均按正反应方向进行2FeCl3 + SnCl2 = 2FeCl2 + SnCl42KMnO4 + 10FeSO4 + 8H2SO4 = 2MnSO4 + 5Fe2(SO4)3 + K2SO4 + 8H2O在上述物质中,最强的氧化剂是(E),最强的还原剂是(B)。
A、FeCl3B、SnCl2C、FeSO4D、SnCl4E、KMnO42、在电极反应S2O82- + 2e 2SO4 2-中,下列叙述中正确的是(D)A、K2S2O8是正极,SO4 2-是负极;B、K2S2O8被氧化,SO4 2-被还原;C、K2S2O8是氧化剂,SO4 2-是还原剂;D、K2S2O8是氧化型,SO4 2- 是还原型。
3、已知φО (Ni2+/ Ni) = - 0.23V,φО (Zn2+/ Zn) = - 0.76V,则反应Ni2+ + Zn Ni + Zn2+ 在标准状态下应如何进行(B)A、向左B、向右C、平衡状态D、无法确定4、在一个氧化还原反应中,如果两个电对的电极电势值相差越大,则该反应(C)A、反应速率越大B、反应速率越小C、反应自发进行趋势越大D、反应自发进行趋势越小三、填空题1、在原电池中,发生还原反应的电极为正极,发生氧化反应的电极为负极;原电池可将化学能转化为电能。
2、在原电池中,φ值大的电对为正极,φ值小的电对为负极;φ值越大,电对的氧化型物质的氧化能力越强,φ值越小,电对的还原型物质的还原能力越强。
四、问答题1、什么叫金属的电化学腐蚀?金属的电化学腐蚀的主要类型是什么?写出相应的电极反应式。
《普通化学》第4章作业题解(氧化还原反应与电化学)

= 0.15 + 0.0885 = 0.238 V ∴E = (+) - (-) = 0.770 - 0.238 = 0.532 V (4) 使用后: c(Fe3+) ↙, c(Fe2+) ↗, ∴ (+) ↙;
= 31.39
解得:K⊝
2021/1/14
=2.43
×1031
15. 计算下列反应的平衡常数和所组成的原电池 的电动势(设离子浓度均为1.0 mol·dm-3)。 Fe3++I-= Fe2+ + ½ I2 解:⊝+ = ⊝(Fe3+/ Fe2+) = 0.770 V ⊝- = ⊝(I2/I-) = 0.535 V ∴E⊝ = ⊝+ - ⊝- = 0.770 - 0.535 = 0.235 V
(2) ⊝(Fe3+/Fe2+) = +0.770 V ⊝(Cr2O72-/Cr3+ ) = +1.33 V E⊝ = ⊝(Fe3+/Fe2+) - ⊝(Cr2O72-/Cr3+ ) = 0.770 - 1.33 = -0.56 V < 0 即Cr2O72-为氧化剂, Fe2+为还原剂 所以反应逆向进行。
(2) 负极:Ni = Ni2+ + 2e-;正极:Sn4+ + 2e- = Sn2+ ∴原电池符号:
(-) Ni | Ni2+ (c1) || Sn2+(c2) , Sn4+(c3) | Pt (+)
第4章电极电势

Oxidation-Reduction Reaction and Electrode Potential
1
人类一切生产和生命活动:能量供应问题。 煤、石油等燃烧发热
营养物质的消化吸收
体内的生物化学反应
氧化还原过程
生物电现象(心电、脑电)
2
第一节 第二节 第三节 第四节 第五节 第六节
31
标准电极电势的测定
例5 简述测定Pt | Fe3+(1.0), Fe2+(1.0)的标准 电极电势的方法及结果。 解 将Pt | Fe3+(1.0), Fe2+(1.0)与标准氢电 极组成电池。从实验电流的方向确定此待 测电极为正极,标准氢电极为负极。 测得电动势为0.771V,则 EΘ= E+Θ - E- Θ = EΘFe3+ /Fe2+ - EΘH+/H2
34
三、标准电极电势表及其应用
附录:常见的氧化还原电对的标准电极电势
1.标准电极电势与氧化还原反应的关系
(1)判断氧化剂和还原剂 对比两个氧化还原电对的标准电极电 势的大小,便可知道此氧化还原反应在标 准态时谁是氧化剂,谁是还原剂。
35
标准电极电势与氧化还原反应的关系
(2)判断标准态时氧化还原反应自发进行方向: 强Ox + 强Red → 弱Ox + 弱Red
30
4.标准电极电势的测定 电池电动势 EΘ= E+Θ - E-Θ
首先和标准氢电极组成原电池,其次确定被测 电极是正极还是负极。 若为正极,则其标准电极电势
E+Θ =EΘ + EH+/H2Θ =EΘ
第四章氧化还原反应和电化学概要

MnO
4
SO32
Mn2
SO42
(酸性介质)
(1)氧化:
SO
2 3
SO42
还原:MnO4 Mn2 (2)配平原则:
酸性介质中:多氧的一边加H+,少氧的一边加H2O ; 碱性介质中:多氧的一边加H2O,少氧的一边加OH- ; 中性介质中:左边加H2O,右边根据需要加H+或OH-。
SO
3
H 2O
Cu2 | Cu
电对符号
电极符号
30 构成电极的物质,有时须注明状态。如气体分压
液体浓度等。
两个半电池中进行的反应称为半电池反应或者电极反应。
根据正负极的规定,我们可以知道:负极进行的是氧化 反应(失去电子);正极进行的是还原反应(得到电子)。
对于Cu-Zn原电池来说,它的电极反应为:
负极:Zn = Zn2+ + 2e- 正极:Cu2+ + 2e-=Cu
氧化: CrO2 CrO42 CrO2 4OH CrO42 2H2O 3e
还原: H2O2 2e 2OH 整理: 2CrO2 3H2O2 2OH 2CrO42 4H2O
§4.2 原电池与电极电势
(Primary cell and electrode potential)
3) 2I I2 2e
2) MnO4 2H2O 3e MnO2 4OH
——————————————————————————
2MnO4 6I 4H2O 2MnO2 3I2 8OH ★ 特例:H2O2
酸性介质中 氧化:H2O2 O2 2H 2e(作还原剂)
还原:H2O2 2H 2e 2H2O(作氧化剂)
Fe2 Fe3 e
Fe 3 Fe 2
无机化学课件:第四章(应化专业)
电池反应
Cu2+ + Zn →Cu + Zn2+
氧化还原电对:
氧化还原电对表示方法 氧化型物质/还原型物质
如 Cu2+/Cu、Zn2+/Zn、H+/H2、Sn4+/Sn2+
氧化型物质,还原型物质 如 Cu2+,Cu、Zn2+,Zn、H+,H2、Sn4+,Sn2+
(-)Pt, Cl2(p) Cl-(c) Cr2O72-(c1), H+(c2), Cr3+(c3) Pt(+)
原电池的表示方法课堂练习
2H2 + O2 → 2H2O
H2 - 2e- → 2H+ 氧化 O2 + 4H+ + 4e- → 2H2O 还原
(-) Pt, H2(p1) | H+(c1) || H+(c1), H2O | O2(p2), Pt(+)
而伽伐尼的朋友伏打则认为 他可以用任意两个金属和一 种潮湿的物质(食盐水)重 复上述现象,用伏打自己的 话来说:金属是真正的电流 激发者,而神经是被动的。 从而发明了伏打堆。 这一发现引起了极大地震动, 因为这是第一个可以产生持 续电流的装置。
公元1799年,伏打发明伏打電池。
一种利用两种不同的金属夹着盐水湿过的纸张、布片 的多种构造。相当于数个电池串联,故又称为伏打电 堆。
= 0V- 0.7626 V= -0.7626 V
3. 标准电极电势的意义
待测电极处于标准态时
物质皆为纯净物 有关物质的浓度为1mol·L-1 涉及到的气体分压为100kPa 此时测得的电极电势即为标准电极电势
第4章 氧化还原反应与电化学习题
一、思考题1.什么叫原电池?它由哪几部分组成?如何用符号表示一个原电池?答案:电池由两个电极和电极之间的电解质构成,因而电化学的研究内容应包括两个方面:一是电解质的研究,即电解质学,其中包括电解质的导电性质、离子的传输性质、参与反应离子的平衡性质等;另一方面是电极的研究,即电极学,其中包括电极的平衡性质和通电后的极化性质,也就是电极和电解质界面上的电化学行为。
利用化学反应产生电能的装置,也称为化学电池;但不是所有的电池都属于此类化学电池。
构成原电池的条件:电极材料:是由活性物质与导电极板所构成,所谓活性物质是指在电极上可进行氧化还原的物质。
两电极材料活性不同,在负极上发生氧化反应;正极上发生还原反应。
电解液:含电解质的溶液。
构成回路2.原电池和电解池在结构和原理上各有何特点?3.离子-电子法配平氧化还原反应方程式的原则是什么?有什么步骤?答案:两个半反应得失电子数相等。
配平步骤:①用离子式写出主要反应物和产物(气体、纯液体、固体和弱电解质则写分子式)。
②分别写出氧化剂被还原和还原剂被氧化的半反应。
③分别配平两个半反应方程式,等号两边的各种元素的原子总数各自相等且电荷数相等。
④确定两半反应方程式得、失电子数目的最小公倍数。
将两个半反应方程式中各项分别乘以相应的系数,使得、失电子数目相同。
然后,将两者合并,就得到了配平的氧化还原反应的离子方程式。
有时根据需要可将其改为分子方程式。
4.用离子-电子法完成并配平下列方程式(必要时添加反应介质):(1)K2MnO4 + K2SO3 + H2SO4 K2SO4 + MnSO4 + H2O(2)NaBiO3 (s) + MnSO4 + HNO3 HMnO4 + Bi(NO3)3 + Na2SO4 + NaNO3 + H2O(3)Cr2O72—+ H2O2 + H+(4)MnO2 + S + H+Mn2+ + H2SO3 + H2O(5)Zn + NO3-+ H+Zn2+ + NH4+ + H2O(6) Ag + NO 3-+ H +Ag + + NO + H 2O(7) Al + NO 3-+ OH -+ H 2O [Al(OH)4]-+ NH 35. 如何用图示表示原电池? 答案:原电池符号(电池图示):书写原电池符号的规则:①负极“-”在左边,正极“+”在右边,盐桥用“‖”表示。
无机化学第4章 氧化还原反应
∵ E- =E (H+/H2) = 0.000V
∴ E = E+ = E待测
例如:测定Zn2+/Zn电极的标准电极电势 将Zn2+/Zn与SHE组成电池
(-)Pt,H2(100kPa)|H+(1mol· -3)||Zn2+(1mol· -3)|Zn(+) dm dm 298.15K时, E = -0.76V E (Zn2+/Zn) = -0.76V 又如:测定Cu2+/Cu电极的标准电极电势 将Cu2+/Cu与SHE组成电池
1. 标准氢电极(SHE)
电极反应:
2H+(aq) + 2e
电对:H+/H2 电极电势(规定):
H2(g)
H+ 标准氢电极装置图
E (H+/H2)= 0.000V
电极符号:
Pt ,H2(100kPa) | H+ (1.0mol· -3) dm
2. 电极电势的测定
将标准氢电极与待测电极组成电池: ( - )标准氢电极 || 待测电极( + ) E = E+ - E-
Cr2O72- (c1), Cr3+(c3) ,H+(c2) | Pt (+)
例题4-1 将下列氧化还原反应设计成原电池, 并写出它的原电池符号。 Cr2O72- + 6Fe2+ + 14H+ = 2Cr3+ + 6Fe3+ + 7H2O 解: 原电池的正极: Cr2O72- + 14H+ + 6e- = 2Cr3+ + 7H2O 负极: Fe2+ = Fe3+ + e-
天津大学无机化学课件第四章氧化还原反应2
电对 Pb2+/Pb > Sn2+/Sn
E /V -0.126V -0.136V
反应自发向右进行 无机化学
1.氧化还原反应自发进行的判据
E > 0 ;E(氧化剂)>E(还原剂)
(1) 标准态时
只需比较E (氧化剂)和E (还原剂)大小
例1 试判断下列反应:Pb2++ Sn Pb + Sn2+ 在标准态时反应自发进行的方向
1.氧化还原反应自发进行的判据
化学反应自发进行的条件 rGm < 0
rGm= -zFE
rGm < 0 E > 0 或 E(氧化剂)>E(还原剂)
08.08.2020
无机化学
4-3-1 氧化还原反应的方向 1.氧化还原反应自发进行的判据
E > 0 ;E(氧化剂)>E(还原剂)
氧化还原反应的规律:
较强 较强
∨
E (Cu2+/Cu)= 0.340 V
反应向右进行
08.08.2020
无机化学
2.影响氧化还原反应方向的因素
例 判断反应2Ag+ +Cu 2Ag+Cu2+进行方向
(2) 非标准态
c(Ag+)=0.050 molL-1,c(Cu2+)=1.0 molL-1
EE((AAgg++//AAgg))=-E (ACgu+2/+A/Cgu) )+=00..709519912VV-0lg.3[4c0(AVg>+0)./2cV]
08.08.2020
电对 Pb2+/Pb > Sn2+/Sn
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第五章氧化还原反应一、填空题1.原电池通过反应将直接转化为电能。
2.利用氧化还原反应组成原电池,其电动势可判断氧化还原的方向。
若εΘ时,△GΘ,反应将正向自发进行。
若εΘ时,△GΘ,反应将逆向自发进行。
3.将铜片插入盛有0.5mol·L-1CuSO4溶液的烧杯中,银片插入盛有0.5mol·L-1 AgNO3溶液的烧杯中,组成电池,电池反应为,该电池中的负极是。
4.在下列情况下,铜锌原电池的电动势是增大还是减少?(1)向ZnSO4溶液加入一些NaOH 浓溶液;(2)向CuSO4溶液加入一些NH3浓溶液5.已知EΘFe3+/Fe2+=0.77V,EΘMnO4-/Mn2+=1.51V,EΘF2/F-=2.87V。
在标准状态下,上述三个电对中,最强的氧化剂是,最强的还原剂是。
6.将下述反应设计为电池,Ag+(aq)+Fe2+(aq)⇌Ag(s) + Fe3+(aq),其电池符号为。
7.反应3ClO-→ ClO3-+2Cl-是属于氧化还原反应中的反应。
8.某反应B(s) + A2+(aq)⇌B2+(aq) +A(s),EΘA2+/A =0.8920V,EΘB2+/B =0.3000V,该反应的平衡常数是。
9.氢电极插入纯水中通氢气(p H2=100kPa),在298K时,其电极电势为,是因为。
10.以Mn2+ +2e ⇌ Mn及Mg2+ +2e ⇌Mg两个标准电极组成电池,则电池符号是。
11.在强酸性溶液中,高锰酸钾和亚铁盐反应,配平的离子方程式是。
12.电极电势是某电极与组成原电池的电动势值,如果此电极发生反应,则此值应加上负号。
13.在原电池中通常采用填充盐桥。
二、判断题(正确的请在括号内打√,错误的打×)14.当原电池没有电流通过或通过的电流接近零时,两极间的电势差叫做电池15.已知反应2Fe 2++I 2⇌2Fe 3+ +2I - ,Fe 3+/Fe 2+为负极,I 2/I -为正极。
( )16.由于E ΘLi +/Li = -3.0V ,E ΘNa +/Na = -2.7V ,所以与同一氧化剂发生化学反应时,Li 的反应速度一定比Na 的反应速度快。
( )17.电极的E Θ值越大,表明其氧化态越容易得到电子,是越强的氧化剂。
( )18.标准氢电极的电势为零,是实际测定的结果。
( )19.电极反应Cl 2 +2e ⇌2Cl -, E Θ= +1.36V ,因此21Cl 2 +e ⇌Cl -, E Θ=21×1.36V 。
( )20.在由铜片和CuSO 4溶液、银片和AgNO 3溶液组成的原电池中,如将CuSO 4溶液加水稀释,原电池的电动势会减少。
( )21.氢氧化钠长期放置,表面会转变为碳酸钠,这是因为发生氧化还原反应的结果。
( )22.根据E ΘAg +/Ag <E ΘAgCl /Ag 可以合理判定,K sp, AgI <K sp, AgCl 。
( )23.在任一原电池内,正极总是有金属沉淀出来,负极总是有金属溶解下来成为阳离子。
( )24.在酸性介质中Cl - → Cl 2,配平的半反应式为 Cl 2 +2e ⇌2Cl - 。
( )25.原电池工作一段时间后,其两极电动势将发生变化。
( )26. MnO 4- +8H + +5e ⇌ Mn 2+ +4H 2O E Θ= +1.51V ,高锰酸钾是强氧化剂,因为它在反应中得到的电子数多。
( )27.CuS 不溶解于水和盐酸,但能溶解于硝酸,因为硝酸的酸性比盐酸强。
( )28.SeO 42- +4H + + 2e ⇌H 2SeO 3 +H 2O ,E Θ= 1.15V ,因为H +在此处不是氧化剂,也不是还原剂,所以H +浓度的变化不影响电极电势。
( )29.在电势一定的铜电极溶液中,加入一些水使电极溶液体积增大,将会使电极电势有所升高。
( )30.查得E ΘA +/A >E ΘB +/B ,则可以判定在标准状态下B + +A ⇌ B+ A +是自发的。
( )31.同一元素在不同化合物中,氧化数越高,其得电子能力越强;氧化数越低,其失电子能力越强。
( )32.原电池电动势在反应过程中,随反应进行不断减少。
同样,两电极的电极电势值也随之不断减少。
( )33.对于某电极,如H +或OH -参加反应,则溶液的pH 改变时,其电极电势也34.铁能置换铜离子,因此铜片不能溶解于三氯化铁溶液中。
( )35.在Zn|ZnSO 4(1mol·L -1)║CuSO 4(1mol·L -1)|Cu 原电池中,向ZnSO 4溶液中通入NH 3后,原电池的电动势将升高。
( )36.两个电极都由锌片插入不同浓度的ZnSO 4溶液中构成,它们连接的电池电动势为零。
( )37.两电极分别是Pb 2+(1mol·L -1) +2e ⇌Pb, 21Pb 2+(1mol·L -1) +e ⇌21Pb 将两电极分别和标准氢电极连成电池,它们的电动势相同,但反映的K 值不同。
( )38.在浓度一定的锌盐溶液中,如插入面积不同的锌片,则大锌片构成的电极,其电极电势会比小锌片的高。
( )39.改变氧化还原反应中某反应物的浓度就很容易使反应逆转,是那些ε 接近零的反应。
( )40.已知E ΘH 3AsO 4 /HAsO 2 = 0.58V ,E ΘI 2 /I - = 0.54V ,当 H 3AsO 4和I -反应时,溶液pH 值愈小,则I -愈容易被氧化。
( )41.一个原电池反应ε值愈大,其自发进行的倾向愈大,所以反应速度愈快。
( )三、选择题(下列各题只有一个正确答案,请将正确答案填在括号内 )42. MA(s) +e ⇌M(s)+A -,此类难溶电解质溶解度越低的,其E ΘMA/A 将:( )A. 越高B. 越低C.不受影响43. Pb 2+ +2e ⇌Pb E Θ=-0.1263V ,则( )。
A.Pb 2+浓度增大时E 增大B.Pb 2+浓度增大时E 减小C.金属铅的量增大时E 增大D.金属铅的量增大时E 减小44.已知Fe 3+ +e ⇌Fe 2+ ,E Θ= 0.77V ,当Fe 3+/Fe 2+电极E =0.750V 时,则溶液中必定是:( )A.c (Fe 3+)<1B. c (Fe 2+) < 1C.c (Fe 2+)/c (Fe 3+)<1D. c (Fe 3+)/c (Fe 2+) < 145.由电极反应Cu 2+ + Zn ⇌ Cu + Zn 2+ 组成的电池,测得其电动势为1.00V ,由此两电极溶液中,(E ΘZn 2+/Zn = -0.76V ,E ΘCu 2+/Cu = 0.34V )。
( )A. c (Cu 2+) = c (Zn 2+)B. c (Cu 2+) > c (Zn 2+)C. c (Cu 2+) < c (Zn 2+)D. Cu 2+、Zn 2+的关系不得而知46.Cl2/Cl-和Cu2+/Cu的标准电极电势分别是+1.36V和+0.34V,反应Cu2+(aq) +2Cl-(aq) = Cu(s) + Cl2(g)的εΘ值是:()A. –2.38VB. –1.70VC. –1.02VD. +1.70V47.氢电极插入纯水,通H2(100 kPa)至饱和,则其电极电势()。
A.. E=0B. E>0C.E<0D. 因未加酸不可能产生48.由氧化还原反应Cu + 2Ag+ = Cu2+ + 2Ag组成的电池,若用E1、E2分别表示Cu2+/Cu和Ag+/Ag电对的电极电势,则电池电动势ε为()。
A. E1-E2B. E1-2 E2C. E2-E1D.2 E2-E149.在S4O62-中S的氧化数是:()。
A.+2B.+4C.+6D.+2.550.原电池(-)Zn|ZnSO4(1mol·L-1)║NiSO4(1mol·L-1)|Ni(+),在负极溶液中加入NaOH,其电动势()。
A. 增加B. 减少C. 不变D. 无法判断51.对于电对Cr2O72-/Cr3+,溶液pH值上升,则其()。
A. 电极电势下降B. 电极电势上升C. 电极电势不变D. EΘCr2O72-/Cr3+下降52.由电极MnO4-/Mn2+ 和Fe3+/Fe2+组成的原电池。
若加大溶液的酸度,原电池的电动势将:()A.增大B.减小C.不变D. 无法判断53.反应4Al +3O2 + 6H2O = 4Al(OH)3(s)△GΘ=-n FεΘ中的n = ( )。
A. 12B. 2C. 3D. 454.已知EΘFe3+/Fe2+= 0.77V,EΘCu2+/Cu = 0.34V,则反应2Fe3+(1mol·L-1) + Cu = 2Fe2+(1mol·L-1) +Cu2+(1mol·L-1) ( )。
A. 呈平衡态B. 正向自发进行C. 逆向自发进行55.已知EΘFe3+/ Fe2+>EΘI2 /I->EΘSn4+/ Sn2+,下列物质能共存的是( )。
A. Fe3+和Sn2+B. Fe2+和I2C. Fe3+和I-D. I2和Sn2+56. K2Cr2O7 + HCl→ KCl + CrCl3 + Cl2 + H2O 在完全配平的方程式中Cl2的系数是:()A.1B.2C.3D.457.下列反应在298K时的平衡常数为()。
Cr2O72-+3Sn2++14H+⇌ 2Cr3+ +3Sn4+ +7H2OA.lgK=0.05923ΘεB. lgK=0.05922ΘεC. lgK=0.05926ΘεD. lgK=0.059212Θε 58.电极反应 MnO 4- + 8H + + 5e = Mn 2+ + 4H 2O 的Nernst 方程式为( )。
A. 4O H Mn 8H MnO Mn MnO Mn MnO2242424c c lg 50.0592⋅⋅-=++-+-+-c c ΘE E B. ++-+-+-⋅-=242424Mn 8H MnO Mn MnO MnOc lg 50.0592c c ΘE E C. 8H MnO Mn Mn MnO 4224c lg 50.0592+-++-+-⋅-=c c Mn MnO ΘE E 24 59.两锌片分别插入不同浓度的ZnSO 4水溶液中,测得 E I = -0.70V ,E II = -0.76V ,说明两溶液中锌离子浓度是( )。
A. I 的Zn 2+浓度>II 的Zn 2+浓度B. I 的Zn 2+浓度等于II 的Zn 2+浓度C. I 的Zn 2+浓度<II 的Zn 2+浓度D. I 的Zn 2+浓度等于II 的Zn 2+浓度的2倍60.已知 A (s) + D 2+(aq) ⇌ A 2+(aq) + D (s) εΘ>0,A (s) + B 2+(aq) ⇌ A 2+(aq) + B (s) εΘ>0,则在标准态时,D 2+(aq) + B (s) ⇌ D (s) + B 2+(aq) 为( )。
