锰元素存在形式
锰元素
生
器官中: 肌肉/p.p.m.: 0.2 - 2.3
物
血/mg dm-3 : 0.0016 - 0.075
数
日摄入量/mg: 0.4 - 10
据
骨/p.p.m.: 0.2 - 100 人(70Kg)均体内总量/mg: 12
电子 模型
1744 年, 由 J.G. Gahn (瑞典,斯德哥尔
发
摩)分离出。
现
最丰富的矿物是软锰矿
用于制造钢、电池、陶瓷等。
来
{pyrolusite (MnO2)},和硬锰矿 用
源
{psilomelane [(BaH2O)2Mn5O10]}以 途
及菱锰矿{ rБайду номын сангаасodochrosite
(MnCO3)}。
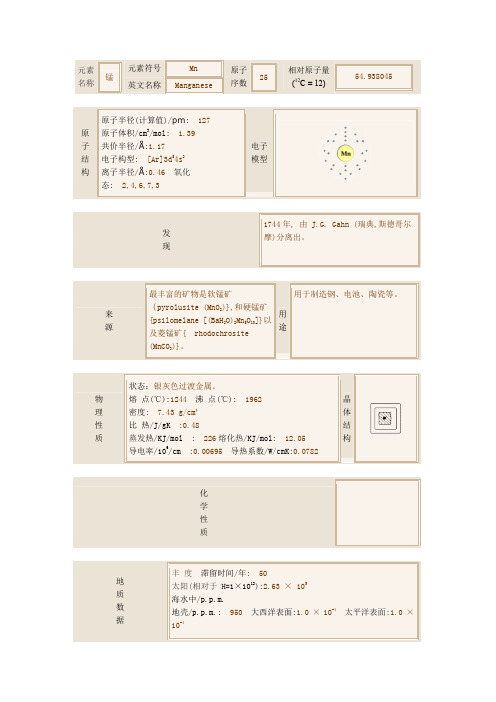
元素 锰
名称
元素符号 英文名称
Mn Manganese
原子 25
序数
相对原子量 (12C = 12)
54.938045
原子半径(计算值)/pm: 127 原 原子体积/cm3/mol: 1.39 子 共价半径/Å:1.17 结 电子构型: [Ar]3d54s2 构 离子半径/Å:0.46 氧化
态: 2,4,6,7,3
地
太阳(相对于 H=1×1012):2.63 × 105
质
海水中/p.p.m.
数
地壳/p.p.m.: 950 大西洋表面:1.0 × 10-4 太平洋表面:1.0 ×
据
10-4
大气/p.p.m.(体积): 大西洋深处: 0.96 × 10-4 太平洋深 处:0.4 × 10-4
人体中含量 肝/p.p.m.: 3.6 - 9.6
状态:银灰色过渡金属。
高考--常考元素--锰、碍、铼

高考--常考元素--锰副族(锰 Mn ,锝 Tc ,铼 Re )一、物理性质:锰单质的性质:金属锰是银白色金属,粉末状的锰为灰色。
活泼金属二、化学性质:存在形态:以Mn 2+ 最稳定,而锝(Ⅱ)、铼(Ⅱ)则不存在简单离子。
22222H Mn )(2H Mn H (s)Mn(OH)O 2H Mn +→++→+++稀与氧、卤素等非金属反应:34222432MnF MnF F Mn F)(X MnX X Mn O Mn ΔO 23Mn 和−→−+≠−→−+−→−+在氧化剂存在下与熔融的碱作用:O 2H MnO 2K 3O 4KOH 2Mn 2422+−−→−++熔融锰是钢的一种重要添加剂,因为它能脱除氧和硫.制备:3MnO 2 = Mn 3O 4 + O2 (直接反应太过剧烈) 3Mn 3O 4 + 8A1 = 9Mn + 4A12O 3 三:锰的化合物Mn 的价电子构型:3d 54s 2 Mn 的氧化值呈连续状:从+2~+7。
常见氧化值:+7,+6,+4和+2。
常见化合物:KMnO 4 ,K 2MnO 4,MnO 2, MnSO 4和MnCl 2。
除MnO 2外,余者均易溶于水,含锰离子分别为:。
和,+--2244Mn MnO MnO水溶液中锰的各种离子及其性质氧化值 +7 +6 +3 +2 颜色 紫红色 暗绿色 红色 淡红色 d 电子数 d 0 d 1 d 4 d 5 存在于溶液中的条件:中性 pH >13.5 易歧化 酸性 1、Mn(VII)化合物 溶液的酸度不同,MnO4被还原的产物不同:O 3H 5SO 2Mn 6H 5SO 2MnO 2242234++−→−++-++---24222342OHSO 32MnO O H 3SO 2MnO ++−→−++---OH SO 2MnO )(OH 2SO 2MnO 224-24234++−→−++----浓O 8H CO 102Mn 6H O C 5H 2MnO 2224224++−→−++++- (2) 不稳定性 遇酸分解O H 23O 4MnO )(H 44MnO 2224++−→−++-微酸 微碱性分解O H 2O 4MnO OH 44MnO 22244++−→−+----4MnO -24MnO +362O)H (Mn +262O)H (Mn见光分解4KMnO 4 + 2H 2O = 4MnO 2↓ + 3O 2↑ + 4KOH (光照也能使其分解,因此应保存在棕色试剂瓶中) 加热22424O (s)MnO MnO K C 2202KMnO ++−−−−→−︒>A) 歧化法, 酸性介质中, 有利于歧化:3 MnO 42- +4 H + = MnO 2 + 2MnO 4- + 2H 2O 3 MnO 42- + 2 CO 2 = MnO 2 + 2 MnO 4- + 2 CO 32-在中性或弱碱性溶液中也发生歧化反应,但趋势及速率小: 3 MnO 42- + 2 H 2O = 2 MnO 4- + MnO 2 + 4 OH - (3)高锰酸钾的制备以软锰矿为原料 (MnO 2) 制备高锰酸钾,先制K 2MnO 4: 3 MnO 2 + 6 KOH + KClO 3 = 3 K2MnO 4 + KCl + 3 H 2O 从 K 2MnO 4 制 KMnO 4 有三种方法。
锰元素——精选推荐

锰元素砂糖橘着⾊、起砂的关键肥料元素主要有:P、K、Ca、Mg、B、Mn、Mo等,在此之前我⼀⼀介绍好锰和钼以外的⼏个元素。
受⾃⼰⽔平限制,我在乡下的过程还没有遇到特别典型的缺锰或者锰中毒现象,所以今天的⽂章都是纯理论性。
⽐较⽣奥希望⼤家能看懂。
⼟壤中的锰以三种氧化态存在(Mn2+、Mn3+、Mn4+),此外还以螯合状态存在,但主要以Mn2+的状态被植物吸收。
锰对植物的⽣理作⽤是多⽅⾯的,它能参与光合作⽤,提⾼植物的呼吸强度,促进碳⽔化合物的⽔解;调节体内氧化还原过程;也是许多酶的活化剂,促进氨基酸合成肽键,有利于蛋⽩质的合成;促进种⼦萌发和幼苗的早期⽣长;还能加速萌发和成熟,增加磷和钙的有效性。
1、直接参与光合作⽤在光合作⽤中,锰参与⽔的光解和电⼦传递。
⽔可被分解并放出O2和电⼦,并把所产⽣的电⼦传递给光系统II。
在光合作⽤中,⽔的光解除需要Mn2+外,还需要Cl-,⽽且作⽤的场所在叶绿体中。
在叶绿体内,光合⽔解酶能使Mn2+进⾏光氧化变为Mn3+,从⽽有较强的氧化势,使H2O氧化分解。
Mn2+和C1-都存在于放氧系统中,组成光系统II的电⼦供体。
Cl-在此过程中起活化作⽤。
缺锰时,叶绿体仅能产⽣少量的氧,并且光合磷酸化作⽤减弱,糖和纤维素的合成也随之减少。
许多资料表明,叶绿体含锰量⾼,锰是维持叶绿体结构所必需的微量元素。
缺锰时,膜结构遭破坏⽽导致叶绿体解体,叶绿素含量下降。
植物缺锰时,在其他器官尚未出现症状时,叶绿体的结构就已经明显受损伤。
由此可见,在所有细胞器中,叶绿体对缺锰最为敏感。
缺锰既降低了希尔反应速率,也降低了⾮循环式磷酸化的速率;光合磷酸化的降低是由于缺锰导致叶绿体结构破坏⽽引起的。
此外,植物体内其他的氧化还原系统也受到锰的控制,例如缺锰时,抗坏⾎酸(维⽣素C)和⾕胱⽢肽易被氧化⽽影响植物正常⽣长。
植物体内锰和铁之间的关系⼗分密切。
在植物体中,铁以Fe2+和Fe3+两种形态存在。
锰
锰锰,化学符号是Mn,它的原子序数是25,灰白色,是一种过渡金属,性坚而脆,潮湿处会氧化。
1774manganese(锰)。
锰可用铝热法还原软锰矿制得。
外围电子层排布:3d5 4s2电子层分布:2-8-13-2化合价:+2、+3、+4、+6和+7晶体结构:晶胞为体心立方晶胞,每个晶胞含有2个金属原子。
锰在元素周期表上位于第四周期,第VIIB族,属于比较活泼的金属,加热时能和氧气化合,易溶于稀酸生成二价锰盐。
常见化合价:+2,+4,+7,+6+3价的锰和+6价的锰均比较容易发生歧化反应:2Mn3++2H2O ══Mn2++MnO2↓+4H+3MnO42-+4H+══2MnO4-+MnO2↓+2H2OMn较稳定,不容易被氧化,也不容易被还原。
MnO4和MnO2有强氧化性。
在碱性溶液中,Mn(OH)2不稳定,易被空气中的氧气氧化为MnO2;MnO4也能发生歧化反应,但反应不如在酸性溶液中进行得完全。
下面列出部分其化合价对应的化合物:Mn-3:Na3[Mn(CO)4] Mn-1:Na[Mn(CO)5] Mn0:MnMn2(CO)10,K6[Mn(CN)6] Mn+1:K5[Mn(CN)6] Mn+2:MnO ,二价锰盐Mn+3:MnF3,K3[Mn(CN)6]Mn+4:MnO2 ,K2[MnF6] ,MnF4 Mn+5:Na3MnO4Mn+6:MnO42- Mn+7:MnO4-,MnO3F ,KMnO4在空气中易氧化,生成褐色的氧化物覆盖层。
它也易在升温时氧化。
氧化时形成层状氧化锈皮,最靠近金属的氧化层是MnO(一氧化锰),而外层是Mn3O4(四氧化三锰):2Mn+O2══2MnO3Mn+2O2══Mn3O4在高于800℃的温度下氧化时,MnO的厚度逐渐增加,而Mn3O4层的厚度减少。
在800度以下出现第三种氧化层Mn2O2。
在约450℃以下最外面的第四层氧化物MnO2是稳定的。
锰和铁化学性质相似,常温与水反应缓慢,当自身高温时,反应迅速,水变为氢气,锰被氧化,形成复杂氧化物:Mn+H2O ══Mn3O4+H2↑(高温)锰易溶于稀酸,并有氢气放出,生成二价锰离子:锰和浓硫酸、浓硝酸等氧化性酸反应生成二氧化硫、二氧化氮,自身被氧化成二价锰:Mn+H2SO4══MnSO4+H2↑Mn+2H2SO4══MnSO4+2H2O+SO2↑Mn+4HNO3══Mn(NO3)2+2H2O+2NO2↑锰和锰矿是有些极大的分别的。
专题3-1:副族金属-锰及其化合物(解析版)

系列三副族金属专题1 锰及其化合物一、锰单质块状锰是呈灰色,是一种较活泼的金属,在空气中金属锰的表面被一层褐色的氧化膜所覆盖,甚至与冷的浓硝酸也形成强的氧化膜,所以呈化学惰性。
二、锰的化合物的价态规律稳定:Mn2+、MnO2(不溶于酸的固体)、MnO4-、Mn2O3(MnOOH(氢氧化氧锰))不稳定:Mn3+、MnO42-(酸性条件下会歧化:3MnO42-+4H+=====2MnO4-+MnO2+2H2O)三、Mn(Ⅱ)(1)溶解性:Mn(Ⅱ)强酸盐易溶,弱酸盐(MnCO3、硫化物),氧化物,氢氧化物为难溶(但可溶于稀酸)。
(2)Mn(H2O)62+离子为苹果绿色(3)还原性Ⅱ酸性介质中稳定,碱性介质中不稳定,易被氧化。
在Mn2+盐溶液中加OH-,生成Mn(OH)2白色沉淀,而后在空气中迅速被氧化生成MnO(OH)2的棕褐色沉淀。
Mn2+ + 2OH-=====Mn(OH)2↓白色,2Mn(OH)2 + O2=====2MnO(OH)2↓棕褐色Ⅱ酸性介质中,能被一些强氧化剂所氧化:2Mn2+ + 5S2O82-+ 8H2O=====2MnO4-+ 10SO42-+ 16H+2Mn2+ + 5NaBiO3 + 14H+ =====2MnO4-+ 5Na+ + 5Bi3+ + 7H2O2Mn2+ + 5PbO2 + 4H+=====2MnO4- + 5Pb2+ + 2H2O其中Mn2+的鉴定常用NaBiO3为氧化剂在H2SO4或HNO3介质下反应。
Ⅱ在浓硫酸中,MnSO4与KMnO4反应可生成深红色的Mn3+(实际是硫酸根的配合物):MnO4-+4Mn2++8H+=====5Mn3++4H2OⅡ在中性或近中性的溶液中,MnO4-与Mn2+反应生成MnO2:2MnO4-+3Mn2++2H2O =====5MnO2(s)+4H+⑤Mn(OH)2易被氧化:Mn2++2OH-=====Mn(OH)2(s)(白色),2Mn(OH)2+O2=====2MnO(OH)2(s)(棕色)(4)硫酸锰:白色或微红色细小结晶体。
地下水中的锰含量

锰铁铁合金工厂的水资源保护1.自然界地下水中锰的分布状况锰在地球上分布十分广泛,在花岗岩地质较为多见。
含铁和含锰地下水在我国分布很广,铁和锰均可存在于地下水中,但含铁量往往高于含锰量。
自然界中存在的主要是二价锰(Mn2+)和四价锰(Mn4+)。
Mn4+在天然水中溶解度甚低,不足为害,所以溶解状态的主要是 Mn2+。
我国地下水中含铁量一般小5-10mg/L,含锰量约在0.5-2.0mg/L之间。
(例如:沈阳开发区水厂、黑龙江省兰西镇水厂地下水中锰含量达0.65-1mg/l)与国内其它地区相比,义望铁合金厂周边水井地下水含锰量处于较低水平。
根据环评报告,除2012年11月王村旧井含量为0.27mg/l(2013年12月为0.087mg/l)外,其余各井地下水含锰量均低于0.1mg/l。
但义望铁合金公司仍需对水源保护给与重视。
水中含氧量低,是地下水中铁、锰存在的必要条件。
在酸度高的水中,锰含量较高。
反之,水的含氧量高,提高水的 pH值,有利于铁(Fe2+)、锰(Mn2+)的氧化,降低水中的锰含量。
地表水中含有溶解氧,铁、锰主要以不溶于水的三价铁和锰状态存在,所以铁、锰含量不高。
地下水中的锰主要以溶解的二价锰为主。
地下水、湖泊水和水库的深层水中,由于缺少溶解氧,所以三价铁和四价锰还原为溶解性的二价铁和二价锰,因而铁、锰含量较高。
铁和锰在地球表面分布很广。
地壳中的锰多半分散在各种晶质岩和沉积岩中,它们都是难溶性的化合物。
表1 列出了主要锰的化合物在水中的溶解度。
由表1可以看出,除了硫酸锰以外其它化合物在水中的溶解度都相当低。
锰和铁一般通过以下几种途径进入地下水:一般地下水中主要含有二价铁合锰的碳酸盐,含碳酸的地下水,对岩层中二价铁锰的氧化物起溶解作用。
在水的循环中,部分雨水由地表渗入地下的过程中,一般都要经过富含有机物的表土层。
土壤中的有机物在微生物的作用下,被分解而产生出大量二氧化碳,这些二氧化碳溶于水中便使地下水含有大量的碳酸。
锰及其化合物

锰属黑色金属,钢灰色,有金属光泽,硬而脆;熔点1244o C,沸点1962o C;密度7.2g/cm3。
锰的导电性出奇的差,锰是导电性和导热性最差的金属!原因不明。
锰是活泼金属,易溶于稀盐酸;易被空气氧化;加热时与氮、硫、氟、氯、溴···反应。
MnO2+C=(1500o C)Mn+CO2高锰酸钾的还原产物由哪些因素决定?•溶液的pH•高锰酸钾浓度•还原剂品种•还原剂浓度•高锰酸钾和还原剂的相对量•温度•溶液中的其他组分,如作为杂质的非氧化还原组分(作为金属的配体等,如磷酸根对于铁)大多数情况下KMnO4的还原产物•酸性溶液KMnO4→Mn2+KMnO4→MnO2•中性溶液• KMnO4→MnO2•碱性溶液• KMnO4→MnO 2• KMnO4→MnO 42-• 2 MnO2+ 4 KOH + O2 = 2 K2MnO4 + 2 H2O• 3 K2MnO4 + 2 CO2 = 2 KMnO4 + MnO2 + 2 K2CO3•锰原子的理论利用率仅2/3 !• 3K2MnO4+4HAc=2KMnO4 + MnO2 +4KAc+2H2O 仅2/3 !•阳极氧化MnO42- - e- = MnO4-这才是工业制法• 2K2MnO4 + 2H2O = 2KMnO4 + 2KOH + H2↑Mn2+ + 2H2O -2e- = MnO2 + 4H+一、锰的存在与制备软锰矿:MnO2·xH2O铝热法还原Mn3O4,电解MnCl2二、锰的化合物Mn2+:粉红色,稳定MnO2:+HCl(Cl2↑);H2SO4(O2↑);去极化剂:MnO(OH)2MnO2+4KOH+O2→2K2MnO4+2H2O;3K2MnO4+2H2O→2KMnO4+MnO2+4KOH电解(最好)或Cl2氧化三、几个名词解释1.锰(manganese):化学元素。
化合价+2、+3、+4、+6、+7。
自然界只有一种稳定同位素55Mn,另有十一种放射性同位素。
锰元素

1.环保用锰:在环境保护方面,锰主要用于对污水和废 气的处理。 2.焊接用锰 在焊接工业中,锰的用途也非常广泛,如在手工电 弧焊中,锰作为良好的脱氧剂和合金剂而用于钢芯和 药皮中。 3.农业用锰 (1)锰是植物正常生长不可缺少的微量营养元素之 一,锰参与光合作用和氮素的转化,参与许多酶的活 动和氧化还原过程,能促进叶绿素的合成和碳水化合 物的运转。 (2)锰在农业上的用途还有很多,如微量肥料、杀 菌剂、动物食用添料等。
锰 的 存 在
锰在地壳中大量存在,平均含量 约为0.1%,其含量之大在已知元 素中占第15位,在重金属中锰仅 次于铁而居第二位。其多以化合物 形式广泛分布于自然 软锰矿 硬锰矿 偏锰酸矿 水锰矿 褐锰矿 黑锰矿 锰榍石 高锰酸钾(PP粉) 水锰矿 锰的有机酸盐 羟锰矿 恩苏塔矿 基性锰铅矿
锰的用途
1.钢铁工业用锰 2.有色金属用锰(脱氧剂或合金元素 ) 3.电子及轻化工用锰 4.锰的其他用途
一.炼铁过程中加入锰的主要作用是改善生铁 冶炼的操作和加工及其使用性能。 (1)炼钢生铁(白口铁)锰的含量为0.3%~0.5% (2)铸造生铁(灰口铁)一般用含锰20%~25%的铁锰 矿石 二.锰在炼钢中的主要作用:其一是脱氧,其二是合金化。 (1)脱氧:锰是炼钢过程中最主要的脱氧剂之一,几乎 所有的钢种都需要用锰来脱氧。因为用锰来脱氧时所生 成的氧产物熔点较低,易于上浮;锰还能增大硅和铝等 强脱氧剂的脱氧效果。 (2)合金化:锰是各钢种中最重要的合金元素,通常以 锰合金、金属锰匹配形式加入钢液中。
锰元素
--------锰的存在及应用
特能1102 赵建斌
锰元素的发现
1771年瑞典化学家谢勒(Scheele)在鉴定软锰矿中发现 这一新的元素。1774 年瑞典矿物学家卡恩和伯格曼几乎同时在 各自用碳还原软锰矿的方法时制得金属锰,同年由谢勒和伯格曼 确认命名,他们并对由软锰矿中制取的金属锰以及锰的性质首次 进行了详尽的研究和描述,这为以后锰及其系列产品的开发应用 提供了基础。 从我国冶金发展史来看,早在出土的战国时期的铁箭中就发 现含有锰,其他朝代的出土钢铁件中也有含量不同的锰。到 1851年,近代化学家徐寿,在他所译的《化学鉴源》一书中,才 首次将化学元素 “Mn”译为“锰”而引入中国。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
锰元素在自然界中主要以以下几种化合物形式存在:
1. 氧化物:
- 二氧化锰(MnO2),是常见的锰矿物之一,例如出现在软锰矿和黑锰矿中。
- 四氧化三锰(Mn3O4),这种形式的锰氧化物存在于某些锰矿石中。
2. 碳酸盐:
- 碳酸锰(MnCO3),在自然界中以菱锰矿的形式存在。
3. 氢氧化物:
- 氢氧化锰—氧化锰矿石,这类矿石中含有不同比例的氢氧化锰(Mn(OH)2)和氧化锰。
4. 硫化物:
- 在一些情况下,锰还以硫化物形式存在,如硫化锰(MnS),虽然它们在自然界的分布不如氧化物和碳酸盐常见。
5. 其他复合矿石:
- 还有各种混合型的矿石,如氧化锰—碳酸锰矿石、硫化锰—氧化锰矿石等。
此外,在高温或特定条件下,锰还可以形成金属态的同素异形体,包括α-Mn、β-Mn、γ-Mn等。
不过在自然环境中,这些纯金属形态并不常见,而是在工业冶炼过程中可以得到。
