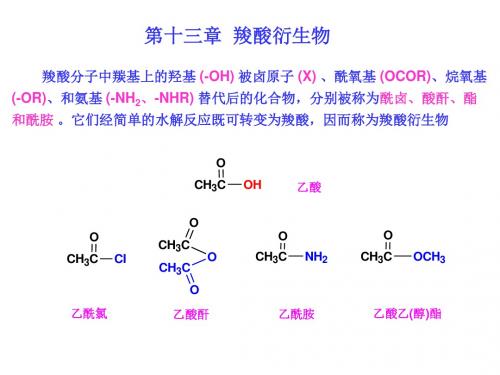
羧酸衍生物
15 第十四章 羧酸衍生物

+ H O C R'
O 'R C
O 'R C NH2
+
OR'
30
用途:① 酰氯在吡啶存在下酸解可以制备单酐
O
O
例:Cl
CCl
+ Cl
C5H5N
COH
O Cl C 2 O
+
HCl
96%~98%
酰氯和羧酸盐反应可以制备混合酐:
O R C Cl
O O
+
R'COONa
R C O C R'
O R O R'
13
碱性水解: BAc2:碱性双分子酰氧断裂
O R
O R C 'RO OH
OR'
+
OH
慢
R
O C 'RO OH
快
R
O
+
OH
OR'
O
+
R OH
OR'
快
O
+
R O
HOR'
注意:酯的碱性水解是不可逆的;碱既是催化剂又是试剂。
14
酸性水解:
AAc2:酸性双分子酰氧断裂
O
+
R OR'
OH R
OH R C OR' OH2
H
快
OH R OR'
OH R C OR' OH2
+ H2O
慢
OR'
快
R OH
C OR' + OH
H
15
OH R C OR' OH
13-羧酸衍生物
衍生物命名注意事项:
• 1 酰卤:首先正确叫出原羧酸的名称,改 成酰氯即可。 • 2 酸酐:准确叫出两个羧酸的名称,然后 再改成酸酐,相同羧酸的酸酐可以省略一 个。 • 3 酯:首先准确叫出羧酸的名称,然后准 确叫出醇的名称,最后定名为某酸某酯。 • 4 酰胺:先叫出N上的取代基,然后再叫出 羧酸名称,最后定名为酰胺。
酸性:
HCl > RCOOH > ROH > NH3
4~ 5 16~19 34
pKa: ~2.2
离去能力:Cl-> -OCOR> -OR’ > -NH2
∴活性:酰氯 > 酸酐> 酯 > 酰胺
(2) 酸碱理论:离去基团的难易 碱性越弱,越容易离去。离去基团L 的碱性由强到弱的次序:
Cl
> RCOO > RO > NH2
O C O
O C CH3
庚二酸单酰氯 6-氯甲酰基-己酸
O C O O C CH3
甲乙酸酐
O C O CH(CH3)2
COOEt
乙酸苯甲酸酐 混合酸酐命名:分别叫出 两个羧酸然后加” 酐” 。 O C OH 邻羟基苯甲酰苯胺 N-苯基邻羟基苯甲酰胺 NH
Cl 间氯苯甲酸异丙酯 3-氯苯甲酸异丙酯 COOCH3 对苯二甲酸甲乙酯
L
d
-
① p- 共轭使羰基碳上正电密度降低
R-C
使C-L具有部分双键性质 不利于酰基化反应发生
O p- -Cl <
期元素
-O-C-R
酰基是 吸电子基
<
-O-R' < -NH2
烃基是 斥电子基 电负性:
共轭的强度: 第三周
O>N
即酰氯的羰基碳最正。
∴活性:酰氯>酸酐>酯>酰胺
12羧酸衍生物

O CH2C
O
CH3CH2C O
O O
O
乙酸酐 乙丙酸酐 邻苯二甲酸酐
O O O
顺丁烯二酸酐
CH3CN 乙腈
CH2CN 苯乙腈
3) 酯是依据形成它的酸和醇,称为某酸某酯。
O CH3COEt
O
CH3
CH3COCH2CH2CHCH3
O
CH3
CH3(CH2)3COCH2CH2CHCH3
乙酸乙酯
乙酸异戊酯 香蕉香味
通常将室温下呈固体的称为脂, 呈液体的叫做油. 常见的 油脂有牛油、猪油、花生油、椰子油及蓖麻油等。
油脂的主要成分是多种高级脂肪酸甘油酯的混合物,其 结构如下:
O
CH2 O C R O
CH O C R' O
CH2 O C R"
若R、R’、R”相同,则为单纯甘油酯;
若不同,则为混合甘油酯。但天然油 脂多为混合甘油酯。
比较而言: (1) X原子和-OCOR的-I 效应大于+C 效应; (2) -OR’的-I 与+C大致相当; (3) -NH2的+C 效应大于-I 效应。
所以可知它们的反应活性次序为: 酰卤 > 酸酐 > 酯 > 酰胺
此外,L-的稳定性也影响反应的进行,研究表明次序同上.
12.3 油脂和合成洗涤剂 1. 油脂: 是油和脂肪的简称, 广泛存在于动植物体内。
RC
F CCR'3 R'3C+ + H2O F
O R C OH + +CCR'3
R'3C OH + H+
2) 酰基衍生物的水解、氨解及醇解机理 除酯外,其它多数酰基衍生物的水解、氨解、醇解也是按加 成-消除机理进行的。
羧酸衍生物知识点

羧酸衍生物知识点羧酸衍生物是一类化合物,它们在化学反应和有机合成中有着广泛的应用。
羧酸衍生物的结构中包含一个羧酸基团,它们的化学性质也与羧酸有关。
本文将从羧酸衍生物的性质、合成和应用三个方面进行阐述。
一、羧酸衍生物的性质羧酸衍生物中含有一个羧酸基团(-COOH),这个基团可以参与许多化学反应。
例如,在碱性条件下,羧酸基团会失去一个质子,形成相应的负离子,即羧酸盐,这种反应叫做羧化反应。
除此之外,羧酸衍生物还能与醇、胺等反应,生成相应的酯、酰胺等衍生物。
二、羧酸衍生物的合成羧酸衍生物的合成方法非常多,下面介绍两种常用的方法:1.羧化反应羧化反应是一种重要的合成羧酸衍生物的方法。
在这种反应中,通常使用羧酸和一定量的碱反应,生成相应的羧酸盐。
羧酸盐再与酸反应,失去一个水分子,形成相应的酯。
这种反应常用的催化剂有酸性离子交换树脂、三氧化硫等。
2.加成反应加成反应是另一种合成羧酸衍生物的方法。
在这种反应中,羧酸衍生物的反应物通常是烯烃或炔烃。
它们与羧酸在催化剂的存在下发生加成反应,生成相应的羧酸衍生物。
加成反应的催化剂有酸性离子交换树脂、钯等。
三、羧酸衍生物的应用羧酸衍生物在有机合成、材料科学、生物化学等领域有着广泛的应用。
1.有机合成羧酸衍生物是有机合成中常用的反应物和中间体。
它们可以通过羧化反应、加成反应等多种方法进行合成。
羧酸衍生物可以与醇、胺等反应,生成相应的酯、酰胺等衍生物。
2.材料科学羧酸衍生物可以与金属离子、聚合物等反应,形成新的材料。
例如,聚丙烯酸可以与铁离子反应,生成Fe3O4/聚丙烯酸复合材料。
这种材料具有磁性,可以应用于磁性材料、制备催化剂等领域。
3.生物化学羧酸衍生物在生物化学中也有着重要的应用。
例如,羧酸基团是许多生物分子的一部分,例如脂肪酸、氨基酸等。
羧酸衍生物还可以用于制备生物活性分子,例如药物、抗生素等。
羧酸衍生物是一类重要的化合物,在化学反应和有机合成中有着广泛的应用。
通过羧化反应、加成反应等方法可以合成羧酸衍生物。
羧酸衍生物
4. 酰胺的命名
O R
R R
O H C N
C
O C O C
NH2
NHR ′ ′ NR2
O
某酰胺
CO CO NH
N-某基某酰胺
N,N-二某基某酰胺
O
NH
丁二酰亚胺
CH3 CH3
O
NH
CH2
CHC NH2
丙烯酰胺
N,N-二甲基甲酰胺 己内酰胺 (DMF)
O
邻苯二甲酰亚胺
三、羧酸衍生物的光谱性质
1. IR
O R C OR' + HCl (碱吸收)
Et3NHCl or N HCl
合成上用于制备酯
O R C OH
SOCl2
O R C Cl
R'OH Et3N or 吡啶 R
O C OR'
优点:反应完全,产率好,特别适用于仲醇和叔醇的酯。 如香料乙酸薄荷酯。
酸酐的醇解反应
O R
O
R'OH
O R C OR' + R
酸酐:C = O ~1820,~1760 cm-1 ; C—O ~1100 cm-1
共轭,移向低频
酯:C = O ~1740 cm-1,共轭移向低频 C—O 1300~1000 cm-1 两个吸收峰(两个C-O)
酰胺:C = O ~1690 cm-1, N—H 3500~3100 cm-1
2. NMR 酯:
COOC2H5 + ?
H3O+
OH
MgBr
2) 羧酸衍生物与 R2Cd 和 R2CuLi 的反应
R'2Cd R O C Cl R'2CuLi
羧酸的衍生物知识点总结

羧酸的衍生物知识点总结一、羧酸的结构及性质1.1 结构羧酸是一类含有一个或多个羧基(-COOH)官能团的有机化合物。
在羧酸中,羧基结构可以与芳香环或脂肪烃环相连,也可以存在于分子中的其他位置。
羧酸的基本结构可以表示为R-COOH,其中R代表羧基所连接的有机基团。
1.2 性质羧酸的结构使其具有一系列特定的物理化学性质。
常见的羧酸通常以无色或白色晶体的形式存在,有时也呈液态。
它们在水中易溶解,并能够与碱反应生成相应的盐,因此具有一定的酸性。
此外,羧酸还表现出一些特定的化学反应活性,如酯化反应、醛化反应等。
1.3 羧酸的共振结构羧酸分子中的羧基(-COOH)可以发生共振结构,即通过π电子的转移,使得羧基中碳与氧之间的键产生双键和单键的交替存在。
这种共振结构的存在使得羧酸分子更加稳定,同时也对其化学性质产生影响。
二、羧酸的主要衍生物类型2.1 酯酯是由羧酸和醇经酯化反应生成的产物。
在这种反应中,羧基上的氧原子与醇中的羟基发生酯键结合,形成一种新的有机化合物。
酯具有独特的香味,因此广泛用于食品、香精等行业。
2.2 醛醛是由羧酸通过脱羧反应生成的产物。
在脱羧反应中,羧酸失去一个CO2分子,生成相应的醛。
醛化反应是一种重要的有机合成反应,广泛应用于制备醇、醚等化合物。
2.3 酰胺酰胺是由羧酸与氨或胺反应生成的产物,它是一类重要的有机化合物。
酰胺在生物体内起着重要的生物活性作用,同时也广泛应用于有机合成领域。
2.4 酰氯酰氯是由羧酸与氯化亚砜、硫酰氯等发生酰化反应生成的一种有机化合物。
酰氯是一类重要的有机合成试剂,广泛用于有机化学合成反应中。
2.5 醛酸醛酸是羧酸分子失去一个羧基而形成的产物,它在有机合成及医药领域有着重要的应用价值。
醛酸可以被还原成相应的醇,也可以通过酰化反应生成酯等化合物。
2.6 酰胺酰胺是由羧酸与胺类化合物经过缩合生成的有机化合物,它在生物体内发挥着重要的生理活性作用。
在有机合成中,酰胺也是一类重要的合成中间体。
有机化学12羧酸衍生物

环状酸酐与氨或胺反应,先开环生成酰胺羧酸,然后很容易转变成环状酰亚胺。
酯的氨解,与氨反应不需加酸碱催化,氨本身就是碱。
酯的氨解反应比酸酐温和,与亲核性较弱的胺反应,常在碱催化剂存在下进行。
反应可用于酯的鉴别,酰卤和酸酐也呈正反应。
羟肟酸和FeCl3作用时,生成红色络合物。
氨的衍生物,也可以和羧酸衍生物发生氨解反应。
碳酸在结构上,可以看成羟基甲酸,碳酸在结构上可以看作是羟基甲酸,或共有一个羰基的二元酸。 由于二个羟基连在同一个碳上,H2CO3不稳定,不能以游离态存在,但它的许多的衍生物却很稳定。 碳酰氯(光气) 碳酰胺(尿素) 碳酸二乙酯
*
碳酸是二元酸,应有二种衍生物,即酸性衍生物和中性衍生物,但酸性衍生物都是不稳定的。 氯甲酸乙酯 氨基甲酸乙酯 Y为:卤素、RO、NH2等。 碳酸的混合衍生物是稳定的。
原因:酰胺分子中氨基上的氢原子可以形成氢键。
酰胺是有机物和无机物的良好溶剂。
N,N-二甲基甲酰胺,是常用的非质子极性溶剂。
第三节 化学反应
*
反应的活性和离去基团的性质有关,羧酸衍生物的离去基团L同时具有-I和+C效应。 第一步亲核加成,取决于羰基碳原子的亲电性。 电子效应:-I效应使羰基碳原子的电子密度减小,更容易与亲核试剂起加成反应; +C效应,使反应物的稳定性增加,羰基更不容易和亲核试剂起加成反应。 -I效应 +C效应
尿素与次卤酸钠溶液作用时,放出氮气,机理与霍夫曼反应相似。
尿素与亚硝酸作用,也能放出氮气和二氧化碳。 常用尿素在一些有机合成反应,如重氮化反应中, 除去过量的亚硝酸。
把固体尿素小心加热,分子间脱去一分子氨,生成双缩脲。 双缩脲反应:双缩脲和少量的CuSO4的碱性溶液生成紫红色。 分子链中含有不只一个酰胺键的化合物,都能发生这个显色反应,常用于蛋白质和多肽的定性检验。
羧酸衍生物

b
O C CH3
酯缩合反应在合成中应用
水解 脱羧
β-酮酸酯 酮酸酯
2 CH3CH2CO2C2H5
β-酮酸 酮酸
A B
酮类化合物
CH3CH2COCH2CH3
O CH2CH2CO2C2H5 CH2CH2CO2C2H5 A B
O C2H5
O O
1,3-二酮 , 二酮
O CH3C(CH2)3CO2C2H5
羧酸的酸性
羧酸可以发生的化学反应
O R
烃基反应 α-卤代反应 卤代反应 针对羰基的反应—— 针对羰基的反应 亲核取代; 亲核取代;还原反应
脱羧反应
C H
C
O
H
羧酸的酸性
O R CH C W
α-H的活性 的
氧的碱性 离去基团
H
羰基的活性
O RCH2 C W
O R C X
O R C R C O
卤素) 酰卤 (-X, 卤素
Carboxylic Acid Derivatives (羧酸衍生物 羧酸衍生物) 羧酸衍生物 . O
(Ar)R C O .. H
(Ar)R
.
C
O
O (Ar)R C O
..
O H
羧基中键长平均化 降低了羰基碳的电正性
非典型的羰基 羰基活性下降 不易发生亲核加成反应
p-π 共轭
O-H键极性增大,羧基阴离子稳定性增强 键极性增大, 键极性增大
RMgX + CO2 羧酸
腈
. Structures and Chemical Properties (结构与化学性质 结构与化学性质) 结构与化学性质
O R C L sp2杂化
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第十三章羧酸衍生物一、基本内容1.定义与分类羧酸分子中羧基上的羟基被其他原子或原子团取代后生成的化合物称为羧酸衍生物,羧酸衍生物包括酰卤、酸酐、酯、酰胺和腈,除腈以外,都含有酰基。
本章重点讨论重要的羧酸衍生物—酰卤、酸酐、酯和酰胺。
酰卤是羧酸分子中的羟基被卤原子取代后的生成物,其通式为RCOX,X为卤原子(F、Cl、Br、I)。
酸酐是两个羧酸分子间脱水后的生成物,酸酐的通式为(RCO)2O。
两个相同的羧酸分子脱水后生成单纯的酸酐(R相同),两个不同的羧酸分子脱水后生成混酐(R 不相同),羧酸还可以与另一分子的无机酸脱水而成混酐,某些二元羧酸后生成环状的酸酐,如邻苯二甲酸酐。
酯可分为有机酸酯和无机酸酯两种,前者如硫酸氢乙酯和三硝酸甘油酯。
有机酸酯中的羧酸酯是羧酸和醇的脱水产物,其通式可表示为RCO2R′。
酰胺为羧酸分子中的羟基被氨基或胺基(-NHR,-NR)取代后的生成物,酰胺的通式为RCONR′R″2(R′R″为氢、烃基或其他取代基)。
2.反应羧酸衍生物是一类重要的有机合成原料或有机合成中间体,在有机合成中起着重要的作用。
其主要反应有亲核取代反应(包括水解、醇解、氨解、酸解、与有机金属化合物的反应)、还原(Rosenmund还原,Bouveault-Blanc还原和LiAlH4还原等)及它们各自的特殊反应(霍夫曼降解、克莱森酯缩合,里特反应等)。
羧酸衍生物的亲核取代反应是分两步进行:第一步先加成,形成一个四面体中间体;第二步发生消去,转变成另一个羧酸衍生物。
一般来说,总反应速率和这两步反应速率都有关,但第一步更为重要。
第一步四面体中间体形成的影响因素:吸电子作用有利于反应,因为它使负电荷稳定;大体积基团存在由于位阻效应会阻碍反应进行。
第二步反应取决于离去基团的碱性,碱性越弱的基团愈容易离去,因而羧酸衍生物反应活性次序为:酰卤>酸酐>酯~羧酸>酰胺。
3.羧酸衍生物在有机合成中的应用本章主要阐述乙酰乙酸乙酯和丙二酸二乙酯在有机合成中的应用。
乙酰乙酸乙酯和丙二酸二乙酯中,由于相邻两个吸电子基团使中间的亚甲基酸性加强,与碱作用生成碳负离子,可以发生亲核反应,使它们在有机合成上占重要的地位。
乙酰乙酸乙酯的应用:(1)合成甲基酮;(2)合成酮酸。
丙二酸二乙酯:(1)合成一元羧酸;(2)合成二元羧酸。
二.重点与难点评述本章的重点是羧酸衍生物中羰基上的亲核取代反应和亲核取代反应历程(特别是酯的水解反应历程)、羧酸衍生物在有机合成中的应用和几个重要的有机人名反应等。
难点是对不同结构的羧酸衍生物中羰基上的亲核取代反应历程的理解。
1.结构与反应活性羧酸衍生物中除了腈以外,都含有酰基。
由于羰基的存在,就决定了这些化合物的特征活性,这是了解羧酸衍生物化学性质的关键。
羧酸衍生物羰基碳原子直接相连的原子(O,N,Cl )上都有孤电子对,它与羰基上的π电子共轭,它们的结构式最好用共振式表示。
对于酰氯,氯具有较强的吸电子诱导效应和较弱的供电子的共轭效应,使羰基的正电性增强,有利于亲核试剂的进攻,同时,Cl -碱性较弱,即稳定性较高,易于离去,因此酰氯表现出很大的反应活性。
相反,对酰胺来说,氨基的吸电子诱导效应较弱,而供电子的共轭效应很强,不有利于亲核试剂的进攻,同时,NH 2-碱性较强,即稳定性较差,难于离去,因此酰胺表现出较小的反应活性。
不难得出,羧酸衍生物的亲核取代(加成-消去)反应活性次序为:RCOCl > (RCO)2O > RCO 2R ′> RCONH 22. 羰基上的亲核取代(加成—消去)反应历程羧酸衍生物的亲核取代(加成-消去)反应一般分为两步,首先是亲核试剂进攻羰基碳原子,发生亲核加成反应,形成一个带负电荷的四面体中间体。
然后,中间体消去一个负离子,恢复碳-氧双键,形成另一个羧酸衍生物。
Nu(亲核试剂) = H 2O 、ROH 、NH 3等 Z ˉ(离去基团) =―X 、―OR 、―OCOR 、―NH 2等3. 羧酸衍生物的水解反应历程羧酸衍生物可被水、醇、氨等亲核试剂进攻,其中酯的水解历程研究得最多。
因此,本章主要对酯的酸催化和碱催化水解历程进行讨论。
酯的水解是酯化反应的逆反应,水解时可能是酰氧键断裂,也可能是烷-氧键断裂;每种断裂方式都可按单分子或双分子历程进行,所以有四种可能的历程。
同样碱性水解也有四种可能历程。
这八种酯水解机理中,以酯的酸性(A Ac 2)或碱性(B Ac 2)水解双分子酰氧键断裂最为常见,以(B Ac 2)为例作一说明。
由于四面体中间体具有负电荷,同时比较拥挤,酯的碱性水解将受极性和立体效应的影响。
当酯的酰基上连有吸电子基时,将加速反应的进行,且随其吸电能力的增强,反应速度增大。
值得注意的是,若酯的水解能生成稳定的碳正离子,则有利于单分子烷-氧键断裂。
4. 几个重要的有机人名反应1. Rosenmund 反应R+C RZRO ZNuCR CO OR'OH -R+++RCO 2H RO -R CO 2-ROH2. Bouveault-Blanc 反应 3. Baeyer-Villiger 氧化不对称酮用过酸氧化,在重排步骤中,两个烃基都可能迁移,烃基迁移的近似次序为:H>叔烷基>仲烷基,苯>伯烷基>甲基。
4. Ritter 反应在强酸性溶液中,由叔醇生成的碳正离子同质子一样,可以进攻氰基氮原子,生成的正离子迅速加水,转变为N-烃基取代酰胺,水解后生成胺:5. Claisen 缩合6. Dieckmann 缩合7.Reformatsky 反应8.Perkin 反应9.Knoevenagel 缩合10.Hofmann 重排RCOClH 25%Pd/BaSORCHO HCl++(g)RCOOR'+25RCH 2OH R'OH+OCOOHO OOCOOHClCl++EtOOC (CH 2)4COOEtEtOHOCOOEtO BrCH 2COOEtOH CH 2COOEt+ZnH 3O++PhCHO(CH 3CO)2OKOAcPh COOH+PhCHOCH 2(COOEt)2C H NPhCH CH(COOEt)22CH 3CO 2Et()NaOEt,EtOH 2322CH 3COCH 2CO 2EtEtOH+RCONH 22RNH 2(CH 3)3COH H +-2(CH 3)3C +RC NC(CH 3)3+2+R C NC(CH 3)3OHRC ONHC(CH 3)3RCO 2H(CH 3)3CNH 2+2+在Hofmann 重排中,迁移的烃基的构型保持不变。
三、 精选题及其解13-1.在一个含有醋酸、丁醇、水、硫酸和醋酸丁酯的混合物中,如何提纯醋酸丁酯? 解 将混合物蒸馏,去除硫酸,加入饱和的碳酸钠溶液洗涤,分液去除醋酸,有机相加入饱和氯化钙溶液,使酯游离出来,分液、干燥、蒸馏得纯的醋酸丁酯。
13-2.写出下列反应或反应系列的主要有机产物。
CH 3CH 2CH 2COOHCH 3OH +ACH 3MgBr3+BCH 3COCH 2COOEt22ACH 3IEtONa/EtOHB(1)OH -/H 2O (2)H 3O +,CCH 2COOEt CH 2COOEtEtONaA(1)OH -/H 2O (2)H 3O ,BC22CH 3H 6H 5C 6H 5OOLiAlH 47.8.9.10.11.COOCH 34Et 2OA+B+COOH2A3B2-CH 3CH 2CH 2OH 3A500CBC+CONH2H 2NCH 2CO 2H12(2)C 2H 5OHCH 3CH 2CH 2COOH(CH )NH 1.2.3.4.5.6.CO65312.OOPhCH 3NH 213.解16.N OH()LiAlH (2)H 3O CN65252H 3O +17.18.CH 3CH 2COOC 2H 5AB+19.CH 3OCOCH 2CH 2COCl20.C 6H 5COCH 3ClCH 2CO 2EtNaOEt+CH 2OH A B CH 3OH 1.COClCONH 2NH 2ABC2.A CH 3CH 2CH 2OCCH 3OBCH 3CH CH 2C CH 3COOHCH 3CH 2CH 2CON(CH 3)24.5.H 2NCH 2CO 2CH 2CH 3.HCl6.CH 3CH 2CH 2CO 2CH 3CH 3CH 2CH 2C(CH 3)2OH7.AB8.OOCOOEtCOOEtOOCOOEt COOEtABCOOCH 2CH 2CO 2C 2H 52CH 2CO 2C 2H 5NaOC H 5C 2H 5OH14.15.OHCO 2H3NaOHOOPhCOCH 2CONHCH 3CO 2C 2H 5OOCOCH 3CO 2-N H12.13.14.15.16.C 6H 5O17.18.A CH 3CH 2CH 2OH BC 2H 5OHOO 2C 2H 59.ABCOHHC 6H 5DC 6H 510.11.13-3.甲基环己基酮在三氯甲烷中用过氧苯甲酸在25℃处理16小时,从反应混合物中得到化合物A,A 的部分光谱数据如下:IR :1740,1250cm -1有吸收;1HNMR:δ2.0(s,3H),4.0(m,1H);MS :m/z M +142, 最强峰43。
求A 的结构并推测该反应的反应机理。
解 从反应条件可知该反应为Baeyer-Villiger 氧化反应。
IR :1740cm -1为羰基的红外吸收;1HNMR:δ2.0(s,3H,CH 3CO-),4.0(m,1H,-O-CH=);MS :m/z M + 142,即A 的分子量,最强峰43为CH 3C ≡O +碎片吸收。
由此可知,A 的结构为:该反应的反应机理:13-4.由丙二酸二乙酯合成下列化合物;(1)庚二酸 (2)3-甲基丁酸 (3)环丁基甲酸 (4)2-苄基丁酸解13-5.由乙醇为原料经乙酰乙酸乙酯合成:(1)3-乙基-2-戊酮,(2)2,5-己二酮,(3)2-甲基-4-戊酮酸。
解CH 3C OOCH 3CO +CH+C OHO O CC 6H 53O+CH 3C O O HC H CO -H +CH 3C OO (EtOCO)2CH(CH 2)3CH(COOEt)(HO 2C)2CH(CH 2)3CH(CO 2H)2EtOH EtONa(2) CH 2(COOC 2H 5)232(CH 3)2CHCH(COOEt)2(CH 3)2CHCH(CO 2H)T.M.T.M.(3) CH 2(CO 2Et)2EtONaBr(CH 2)3BrCO 2EtCO 2Et (2)HCl1(2)H Cl(1)N aOH (2)HCl(1)NaOH T.M.EtOHEtONa (4) CH 2(COOC 2H 5)2Br(CH 2)3BrEtOHEtONa (1) CH 2(COOC 2H 5)2CH 3CH 2ClCH 3CH 2CH(CO 2Et)2EtONa EtOH652C 6H 5CH 22Et)2C 2H 51(2)HClT.M.CH 3OCOCH 2CH 2CHO 19.20.C O2EtCH 3C 6H 513-6.反应机理解释: 1.反应速度(1)》(2),解释为什么? 2.反应(1)和(2)中的平衡混合物各以什么占优势,并解释为什么? 解 1. 反应式(1)中反应物之-OCOPh 基团处于直立键,与离去基团-Ots 处于反式位置,它很容易起邻基参与作用促使-OTs 迅速离去,反应速度很快;而反应式(2)中,反应物中-OCOPh 与离去基团-OTs 处于顺式,难起邻基参与作用。
