醇酚醚习题答案(第五版)
有机化学习题答案第7章醇、酚、醚

第 7 章 醇、酚、醚一、问题参考答案问题7.1 命名下列化合物或根据名称写出结构式:H 2CCHCHCHCH 3OHCH 3CHH H 3CH 2CCH 2CH 2OH(4) 三苯甲醇 (5) 5-甲基-2,4-己二醇 (6) 2,2-二氯乙醇答:(1) 4-甲基-1-戊烯-3-醇 (2) 反-2-甲基-1-环己醇 (3) 顺-3-己烯-1-醇 或Z -3-己烯-1-醇(4) (5)(6)问题7.2 将下列化合物按沸点由高到低排列次序,并陈述作此排列的理由。
(1) 正丁醇 (2) 丙醇 (3) 丙烷答:沸点由高到低顺序为:正丁醇、丙醇、丙烷。
原因是醇分子之间可以形成氢键缔合,要将其变为气态,除了需要克服分子间的范德华力外,还需要破坏氢键。
因此正丁醇和丙醇的沸点高于丙烷。
正丁醇比丙醇的相对分子质量大,因此沸点更高。
问题7.3 为什么丙醇易溶于水,而丙烷不溶于水?答:丙醇分子中的羟基与水分子之间可以形成氢键,而丙烷分子则与水分子不能形成氢键缔合,因此丙醇易溶于水,而丙烷不溶于水。
问题7.4 将下列醇按与金属钠反应的速率由快到慢排列次序。
(1) 正丁醇 (2) 乙醇 (3) 叔丁醇 (4) 仲丁醇 答:乙醇>正丁醇>仲丁醇>叔丁醇问题7.5 用化学方法鉴别环己醇、叔丁醇和正丁醇。
答:问题7.6 写出下列醇发生分子内脱水反应后的主要产物名称。
(1) 2-甲基-3-己醇 (2) 1-甲基-1-环己醇(1)(2) (3)正丁醇 环己醇 叔丁醇Lucas 试剂无明显现象 数分钟后出现浑浊 立即出现浑浊C CH 3CHCH 2CHCHCH 3OHOHCH 3CHCH 2OHClCl答:(1) 2-甲基-2-己烯 (2) 1-甲基-1-环己烯 问题7.7 以溴代环己烷为原料,合成环己酮。
答:H 2O OH227Br+NaOC 2H 5 / C 2H 5OHO问题7.8 一种化合物被高碘酸氧化后,生成丙酮、乙醛和甲酸,试推断它的结构。
醇酚醚习题答案
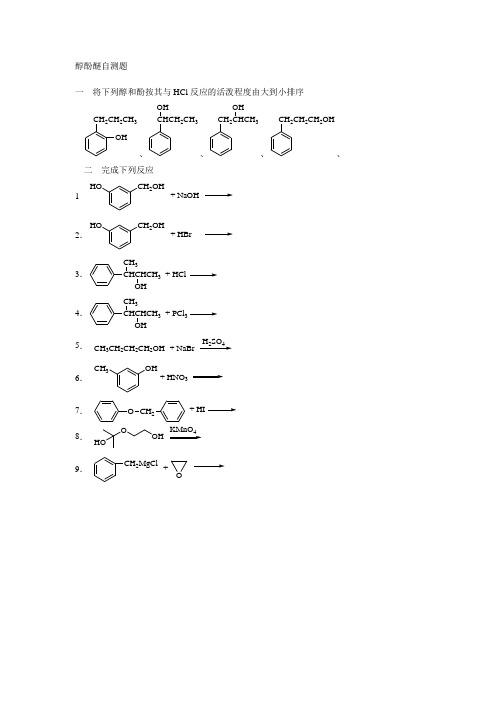
醇酚醚自测题一 将下列醇和酚按其与HCl 反应的活泼程度由大到小排序 CH 2CH 2CH 3OH 、CHCH 2CH 3OH 、CH 23OH 、CH 2CH 2CH 2OH、二 完成下列反应1CH 2OH HO + NaOH2.CH 2OHHO + HBr3.+ HClCHCHCH 3CH 3 4.+ PCl CHCHCH 3CH 35. CH 3CH 2CH 2CH 2OH + NaBr H 2SO 46. OH + HNO 3CH 37.O CH 2+ HI 8. OOH HO KMnO 49. CH 2MgCl +O醇酚醚自测题答案一 CHCH 2CH 3OH >CH 23OH >CH 2CH 2CH 2OH >CH 2CH 2CH 3OH 。
苄醇容易生成稳定的碳正离子,反应快;仲醇的取代反应比伯醇快;酚羟基不能与HCl 作用发生取代反应。
二1.CH 2OHNaO 。
酚羟基解离度大,能与NaOH 作用;醇羟基不能。
2.CH 2BrHO 。
酚羟基不能被卤离子取代,醇羟基可以发生取代反应。
3.CCH 2CH 3CH 3。
氢卤酸使醇质子化过程中,会使2o 醇脱羟基,形成2o 碳正离子CHCHCH 3CH 3,此碳正离子容易重排成更稳定的3o 碳正离子CCH 2CH 3CH 3(也是苄基碳正离子)。
4.。
PCl 3作为卤化剂不会产生碳正离子,因此不会得到重排产物。
5.CH 3CH 2CH 2CH 2Br 。
用H 2SO 4与 NaBr 反应生成的 HBr 直接作用于醇的取代反应是实验室常用的方法。
6.OH CH 3O 2N 及OHCH 3NO 2。
2位上由于位阻影响难于发生取代反应。
7.OH 和ICH 2。
酚的环上羟基不会被I -取代。
8.OCOOH HO 。
醚不会被氧化,叔醇在非酸性的条件下也不被氧化。
9.CH 2CH 2CH 2OMgCl 。
格氏试剂作为亲核试剂对环氧乙烷发生开环的加成反应。
(2021年整理)醇酚醚习题解答

(完整)醇酚醚习题解答编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望((完整)醇酚醚习题解答)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为(完整)醇酚醚习题解答的全部内容。
醇酚醚练习题一、填空1、伯醇仲醇和叔醇中,与卢卡斯试剂作用最快的是2、伯醇仲醇和叔醇中,最易发生分子内脱水的是3、叔醇与碱金属反应慢的原因是4、2,4,6-三硝基苯酚酸性强于间硝苯酚的原因是5、伯醇仲醇和叔醇中,与钠反应最快的是6、将丙三醇、丙醇、丙烷的沸点由高到低排列7、伯醇仲醇和叔醇中,最难与浓盐酸生成氯代烃的是8、将:A.苯磺酸 B.环己硫醇 C.环己醇 D。
苯硫酚的酸性由大到小排列解:叔醇;叔醇;烷基+I使O—H键极性减小;三个硝基产生强吸电子作用使酚羟基O—H键极性增强;伯醇;丙三醇>丙醇>丙烷;伯醇;A>D〉B〉C二、完成反应式1、CH2CHCH3解:CH=CHCH32、CH2OHNaOHHBrA B解A:CH2BrB:CH2OH三、鉴别1、醇,酚,醚,烷解:酚醇醚烷紫色(-)(-)(-)Na(-)(-)浓HCl溶解分层32、正丙醇,异丙醇,叔丁醇,甘油解:丙醇异丙醇叔丁醇甘油Cu(OH)2(-)(-)(-)深蓝溶液2HCl(-)稍后分层立即分层3、苯甲醇,甲苯,乙醚解:苯甲醇甲苯乙醚Na(-)(-)+KMnO4褪色(-)四、合成1、由乙烯和溴苯合成CH2CH2OH解:(1)产物与原料溴苯相比,为多了2C的醇,故考虑通过格氏试剂与环氧乙烷反应制备;(2)环氧乙烷可由乙烯制得(氯醇法或催化氧化法);(3)格氏试剂可由溴苯制得,但溴苯活性较差,需要升温且改用THF体系(一般格氏试剂的制备用无水乙醚).CH2ClCH2OH 2OCH2=CH或:O2O CH2=CH2BrMgMgBr/ THFCH2CH2OH2、由1—丁醇合成2-丁醇CH3CH2CH2CH2OH CH3CH2CHCH3OH解:(1)产物羟基移位,考虑先脱去(醇高温脱水成烯)再加上(加成反应);(2)烯烃的酸水合因其副反应较多而实用性差,一般采用与卤化氢加成再碱水解制备醇。
第六章 醇、酚、醚习题解答

第六章醇、酚、醚一、学习要求1.掌握醇、酚、醚的结构和命名。
2.掌握醇、酚、醚的主要化学性质和醇的重要的物理性质。
3.了解硫醇、硫醚和冠醚的结构、命名、性质及其重要用途。
二、本章要点醇、酚、醚是三类重要的有机化合物,有的在医药上用作消毒剂、麻醉剂、溶剂,有的是有机合成的常用原料。
(一)醇1.结构醇分子中的羟基氧为不等性sp3杂化,其中2个杂化轨道被2对未成键电子占据,另2个杂化轨道分别与α- C的sp3杂化轨道和氢原子的S轨道形成σ键。
由于氧的电负性大,故羟基氧电子云密度大,氢电子云密度小,因此氢氧键极性较大。
2. 命名醇的普通命名是在“醇”前加上烃基名称,并省去“基”字。
醇的系统命名原则是:(1)选择含有羟基的最长碳链作为主链,称为“某醇”,并使羟基相连的碳原子编号最小,将羟基位次写在“某醇”之前,其余的原则与烷烃相同。
(2)多元醇,应选择含羟基数目最多的最长碳链作主链,按羟基数目的多少称为“某二醇”、“某三醇”等。
(3)不饱和一元醇:选择既含羟基又含不饱和键数目最多的最长碳链作主链,编号时应使羟基位次最小,根据主链碳原子数称为“某烯(炔)醇”,并在“烯(炔)”、“醇”前面标明不饱和键和羟基的位次。
(4)命名芳香醇时,将芳环作为取代基,以侧链脂肪醇为母体。
(5)脂环醇,根据脂环烃基的名称,称为“环某醇”,从羟基所连接的碳原子开始,按“取代基位次之和最小”的原则给环碳原子编号,将取代基的位次、数目、名称依次写在“环某醇”的名称之前。
3. 性质(1)重要物理性质:由于醇可形成分子间氢键,故低级醇的沸点通常比相对分子质量相近的烷烃高得多。
随着醇中烷基的增大,醇羟基与水形成氢键的能力逐渐减弱,因此低级醇易溶于水,中级醇部分溶于水,高级醇则不溶于水。
(2)主要化学性质:①醇与活泼金属(如Na、K、Mg、Al等)反应,生成相应的醇盐,并放出氢气。
醇与活泼金属的反应速率顺序为:1)低级醇>中级醇>高级醇;2)甲醇>伯醇>仲醇>叔醇②醇可以与氢卤酸、卤化磷及氯化亚砜等发生亲核取代反应。
第十章 醇、酚、醚参考答案(第5版)
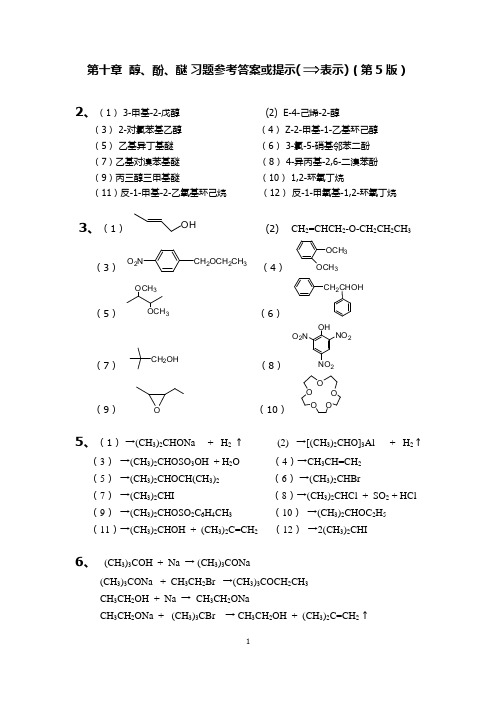
第十章 醇、酚、醚 习题参考答案或提示(表示)(第5版)2、(1) 3-甲基-2-戊醇 (2) E-4-己烯-2-醇(3) 2-对氯苯基乙醇 (4) Z-2-甲基-1-乙基环己醇 (5) 乙基异丁基醚 (6) 3-氯-5-硝基邻苯二酚 (7)乙基对溴苯基醚 (8) 4-异丙基-2,6-二溴苯酚 (9)丙三醇三甲基醚 (10) 1,2-环氧丁烷(11)反-1-甲基-2-乙氧基环己烷 (12) 反-1-甲氧基-1,2-环氧丁烷3、(1)(2) CH 2=CHCH 2-O-CH 2CH 2CH 3(3)(4)(5) (6)(7)(8)(9)(10)5、(1) →(CH 3)2CHONa + H 2 ↑ (2) →[(CH 3)2CHO]3Al + H 2 ↑(3) →(CH 3)2CHOSO 3OH + H 2O (4)→CH 3CH=CH 2 (5) →(CH 3)2CHOCH(CH 3)2 (6) →(CH 3)2CHBr(7) →(CH 3)2CHI (8)→(CH 3)2CHCl + SO 2 + HCl (9) →(CH 3)2CHOSO 2C 6H 4CH 3 (10) →(CH 3)2CHOC 2H 5 (11)→(CH 3)2CHOH + (CH 3)2C=CH 2 (12) →2(CH 3)2CHI6、 (CH 3)3COH + Na → (CH 3)3CONa(CH 3)3CONa + CH 3CH 2Br →(CH 3)3COCH 2CH 3 CH 3CH 2OH + Na → CH 3CH 2ONaCH 3CH 2ONa + (CH 3)3CBr → CH 3CH 2OH + (CH 3)2C=CH 2 ↑OH CH 2OCH 2CH 3O 2N OCH 3OCH 3OCH 3OCH 3CH 2CHOHCH 2OHOHNO 2O 2NNO 2OOOO OO7、 反应过程发生了重排反应8、(1) → CH 2NO 2CH 2NO 2 (2)(3) (4(5)(6) →(CH 3CH 2)2CHI + CH 3I(7) (8)(9) (10)(11)(12)(13)(14)(15)(16)(17)(18)(19)9、 (1)、(2)、(3)、CH 3Ph3Ph HCH 2H 3CHC CH 2OH CH 3-CH-CH 2OCH 3OHCH 3H 3CBr BrCH 2SCH 2CH 3H 3C OHCH 2CH(CH 3)2H 3COHH 3CCHCH 3H 3OCH 2CH 3S O O+(主要)OOCH 3OHOHOCH 3OHOHCH 3-CH-CH-C(CH 3)2OH OH OH C 2H 5C 2H 5H OH10、 (1)、(2)、13、(2)、CH 2=CH 2 + O 2 (PdCl 2/CuCl 2) → CH 3CHOCH 2=CH 2 + HBr CH 3CH 2Br CH 3CH 2MgBr CH 3CH 2MgBr + CH 3CHO CH 3CH 2CH(OH)CH 3 CH 3CH=CHCH 3( 3 )、 CH 3CH =CH 2 + O 2 (PdCl 2/CuCl 2) → CH 3COCH 3 CH 3CH=CH 2 + HBr CH 3CH 2CH 2Br CH 3CH 2CH 2MgBrCH 3CH=CH 2 + NBS → CH 2=CHCH 2BrCH 3COCH 3 + CH 3CH 2CH 2MgBr (CH3)2C(OH)CH 2CH 2CH 3( 4 )、 CH 3CH=CH 2 + HBrCH 3CH 2CH 2BrCH 3CH=CH 2 + HBr → CH 3CHBrCH3CH 3CH=CH-CHOHHBrCH 3CH=CH-CHOH 2+CH 3CH=CH-CH+CH 3CH=CH-CH+CH 3CH-CH=CH+CH 3CH=CH-CHBrBr -CH 3CH-CH=CHBr+Br --H 2O++CH 3CHCH(CH 3)2OHCH 3CHCH(CH 3)2OH2CH 3CHCH(CH 3)2++Br -CH 3CH 2C(CH 3)2+CH 3CHCH(CH 3)2CH 3CH 2C(CH 3)2Br重排CH 3CH=CHCH 3MCPBA 22H 3CHC CHCH3O HOCH 3CH 3O CH 3CH 3KO CH 3CH 3KH HOCH 33O CH 3CH 3NaO CH 3CH 3Na+3HClO 2/0.4MPa O-OH14、 (1)、(2)、15、 (1)、 加入无水CaCl 2或 MgCl 2,少量乙醇与CaCl2或MgCl2反应生成不溶于乙醚的结晶醇沉淀,过滤后即可除去少量乙醇。
有机化学第五版第十章酚和醚部分答案

第十章酚、醚参考答案
2 写出下列结构式的系统命名
(6)5-硝基-3-氯-1,2-苯二酚(考察内容:较优官能团的确定,取代基的优先顺序)(7)对溴苯乙醚(对溴苯基乙基醚;考察内容:较优官能团的确定,醚的命名)
3 写出下列化合物的结构式
8 完成下列各反应
(6)(CH3CH2)2CHI + CH3 (考察内容:醚键的断裂,思考:醚键断裂顺序,如果HI不过量产物是什么?)
(8)CH3CHBrCH2OH (考察内容:环氧乙烷的酸性开环,注意酸性开环和碱性开环的不同)
(13)(考察内容:环氧乙烷的碱性开环,S N2开环机理)
(14)(考出内容:环氧乙烷的酸性开环,断键位置类似S N1,反应实质S N2,注意反应的反应机理)
(16)(考察内容:醚键的断裂规律,脂环烃中氢原子表示方法)
(18)(考察内容:酸性开环的断键位置及原因,亲核试剂进攻方向,产物构型)
(19)(考察内容:碱性开环的断键位置,亲核试剂进攻位点、方向,产物
构型)
13 合成题:
3 参考答案:
丙烯在过氧化氢的作用下与HBr加成得到正溴丙烷,正溴丙烷与镁形成丙基溴化镁格氏试剂,后者与丙酮发生加成反应后水解,即可得到1,1-二甲基丁醇,1,1-二甲基丁醇与金属钠反应可得到相应的醇钠;
丙烯与NBS发生自由基取代可得到3-溴丙烯,3-溴丙烯与上面制备得到的醇钠反应即可得到目标产物。
(考察内容:威廉森制醚法: 醇钠和卤代烃的选择原则;醇钠的制备;由烯烃制备一级卤代烃的方法(过氧化效应);烯烃中α氢的取代反应;格氏试剂的制备及应用)。
第八章醇酚醚习题答案
CH3 CH3 (8) CH3OCH2CH2OCH 3
3. 写出下列醇在硫酸作用下发生消除反应的产物: (1)1-丁醇 (2)2-甲基-2-丁醇 (3)4,4-二甲基-3-己醇 (4)3-甲基-1-苯基-2-丁醇 (5)1-乙基-3-环己烯-1-醇 【解】 这些醇在硫酸作用下发生消除反应,所得产物的结构 式如下:
(+) 蓝绿色,比苄醇慢
(2)CH3
OH OCH3 FeCl3
(+)显色
(-)
K2Cr2O7 H+
(-) 橙黄色 (+) 蓝绿色
CH2OH (3) CH3CH2CH2CH2Cl CH3CH2OCH2CH2CH3 CH3(CH2)4CH2OH AgNO3 C2H5OH
(-)
(+)白色↓ (-) (-) K2Cr2O7 H+ (-) 橙黄色 (+)蓝绿色
(1)
CH2OH
CHCH3 OH
C(CH3)2 OH CH2OH CH3(CH2)4CH2OH
(2) (3)
CH3
OH
OCH3
CH3CH2CH2CH2Cl CH3CH2OCH2CH2CH3
【解】 (1)
CH2OH C(CH3)2 OH CHCH3 OH K2Cr2O7 H+
(+) 蓝绿色
(-) 橙黄色
CH3CH2CH2CH2Cl CH3CH2C CH
KOH/醇
CH3CH2CH
KOH/醇
O (3) HOCH2CH (4) H2C C2H5ONa CH2 CHCH2Cl O2 /Ag 加压 Na NaOCH2CH CH2 HCN CHCH2Cl 醇 H2/Ni SOCl2
O
H2C
HOCH2CH2CN
【解】 (1)√ 分子间 (2)× (3)√ 分子间 (4)√ 分子内 (5)√ 分子 (6)√ 分子内 (7) × (8)√ 分子间
第九章 醇酚醚勘误和参考答案

醇、酚、醚一章勘误和思考题、习题参考答案勘误:1. P236 思考题9-5,第3小题,CH 2CH 3CH 3C CH 2CH 3CH 3CH 3C 将改成2. P236 倒数第二行,将烷基磺酸钠改成烷基硫酸钠。
3. P271 第一行,CH 3CH 2ONa CH 3CH 2Na 将改成。
4. P274 最后一行,不对称环氧化合物在酸性中的开环反应为S N 1反应,应先形成碳正离子。
反应历程改为:O C CH OCH 3CH 33CH 3CH 3OH CH CH 3CH 3HOCH 3CH 233OCH 3H C CH OHCH 3CH 35. P288 第19题化合物B(C 7H 5Br 3)应改成B(C 7H 5OBr 3)。
思考题参考答案:思考题9-1 不查表将下列化合物按沸点由高到低排序。
(1)1,2,3-丁三醇 > 1,2-丁二醇 > 正丁醇 > 丁烷(2)正辛醇 > 正己醇 > 3-己醇 > 二甲基正丙基甲醇 > 正己烷思考题9-2 将下列化合物按在水中的溶解度由大到小排序,并说明理由。
(3) >(2) >(1) >(4) >(5)理由:醇分子中羟基越多,与水形成的氢键越多,在水中的溶解度越大,醚也能与水形成氢键,因此溶解度比烃大。
思考题9-3 比较下列化合物与金属钠反应的活性,再将三种醇钠的碱性强弱排序。
CH 3CH 2CH 2CH 2OH CH 3CHCH 2CH 3CH 3C CH 3CH 3>>>(与金属钠反应的活性)CH 3C CH 3CH 3CH 3CHCH 2CH 3CH 3CH 2CH 2CH 2ONa (醇钠的碱性)>思考题9-4 将下列各组醇按与HBr 水溶液反应的相对活性排列成序。
CH 3CH 2OH CH 2OHO 2NCH 2OH >>(1)CH 2CH 2OHCH 2OH >>(2)CH 3思考题9-5 将下列各醇按脱水的活性大小排序。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第十章醇、酚、醚(P306-310)1.写出戊醇C5H11OH的异构体的构造式,用系统命名法命名。
解:(1) (2)1-戊醇3-戊醇(3)(4)2-戊醇3-甲基-1-丁醇(5)(6)2-甲基-1-丁醇2-甲基-2-丁醇(7)(8)3-甲基-2-丁醇2,2-二甲基-1-丙醇2.写出下列结构式的系统命名:(1) 3-甲基-2-戊醇(2)反-4-己烯-2-醇或(E)-4-己烯-2-醇(3) 2-对氯苯基乙醇(4)(顺)-2-甲基-1-乙基环己醇(1-己醇中的1可以省)(5) 2-甲基-1-乙氧基丙烷或乙基异丁基醚(6) 5- 硝基-3-氯-1,2-苯二酚(7) 对溴乙氧基苯或对溴苯基乙醚(8) 2,6-二溴-4-异丙基苯酚(9) 1,2,3- 三甲氧基丙烷或丙三醇三甲醚(10) 1,2-环氧丁烷(11)反-1-甲基-2-乙氧基环己烷或反乙基-2-甲基环己基醚 (12)1-甲氧基-1,2-环氧丁烷 3.写出下列化合物的构造式:(1)(2)OCH 3OCH3(4)(9)(10)OOOO4 .写出下列化合物的构造式5.写出异丙醇与下列试剂作用的反应式: (1) Na(2) Al(3) 冷浓H2SO4(4) H2SO4 > 1600C(5) H2SO4 < 1400C(6) NaBr+H2SO4(7) 红P + I2(8) SOCl2(9) CH3C6H4SO2Cl(10) (1) 的产物+C2H5Br(11) (1)的产物+ 叔丁基氯(12) (5)的产物+HI(过量)6.7 .有试剂氘代醇和HBr,H2SO4共热制备,的具有正确的沸点,但经对光谱性质的仔细考察,发现该产物是CH3CHDCHBrCH3和CH3CH2CDBrCH3的混合物,试问反应过程中发了什么变化用反应式表明。
解:第一个实验是亲核反应,第二个实验以消除反应为主,生成烯烃气体放出,过量的乙醇没参加反应而留下。
8.完成下列反应式注:MCPBA:间氯过氧苯甲酸9、写出下各题中括弧中的构造式:10.用反应式表示下列反应解:11.化合物A为反-2-甲基环己醇,将A与对甲苯磺酰氯反应的产物以叔丁醇钠处理获得的唯一烯烃是3-甲基环己烯:(1)写出以上各步反应式(2)指出最后一步的立体化学(3)若将A用硫酸脱水,能否得到上述烯烃。
解:(2)最后一步反应的立体化学是E2反式消除。
(3)若将A用H2SO4脱水,能得到少量上述烯烃和另外一种主要产物烯烃因为(CH3)3COK是个体积大的碱在反应是只能脱去空间位阻小的H,而得到3-甲基环己烯,而用硫酸脱水时,都是E1历程,所以主要产物是12.选择合适的醛酮和格氏试剂合成下列化合物(1) 3-苯基-1-丙醇(2) 1-环己基乙醇(3) 2-苯基-2-丙醇(4) 2,4-二甲基—3-戊醇(5) 1-甲基环己烯解:13、利用指定原料进行合成( 无机试剂和C2以下的有机试剂可以任选):(1)用正丁醇合成:正丁酸1,2-二溴丁烷,1-氯-2-丁醇,1-丁炔,2-丁酮。
解:用正丁醇合成(2)用乙烯合成解:(3)用丙烯合成(4)用丙烯和苯合成(5)用甲烷合成(6)用苯酚合成(7)用乙炔合成(8)用甲苯合成(9)用叔丁醇合成14.用简单的化学方法区别以下各组化合物(1) 1,2-丙二醇,丁醇,甲丙醚,环己烷(2) 丙醚,溴代正丁烷,烯丙基异丙基醚解:(1) 方法1:与新制氢氧化铜反应生成绛蓝色溶液者为1,2-丙二醇;与钠作用有大量的气体析出者丁醇;溶于H2SO4者甲丙醚;余者环己烷。
方法2:(2) 与银氨溶液反应生成白色沉淀者为溴代正丁烷;使溴/四氯化碳溶液褪色者烯丙基异丙基醚;余者丙醚。
15.试用适的化学方法结合必要的处理方法将下列化合物中的杂质除去:(1) 乙醚中含有少乙醇;(2) 乙醇中含有少水;(3) 环己醇中含有少苯酚解:(1) 用金属钠干燥,蒸馏;(2) 用少量金属镁一起加热回馏;(3) 用氢氧化钠溶液振荡分液,干燥,蒸馏。
16.分子式C6H10O的化合物(A),能与lucas试剂反应,亦可被KMnO4氧化,并吸收1molBr2,(A)经催化加氢得(B),将(B)氧化得(C)(分子式为C6H10O),将(B)在加热下与浓H2SO4作用的产物还原可得到环已烷,试推测(A)可的结构,写出各步骤的反应式。
解:分子式C6H10O,饱和度2,与卢卡斯试剂反应就说明化合物为醇,可被高锰酸钾氧化,且吸收1mol Br2,说明分中含有C=C。
环己烷的构造说明原化合物的骨架。
综合考虑可推其结构:或着A 2-环己烯醇B 环己醇C 环己酮17.化合物(A)分子式C6H14O,与Na作用,在酸催化作用下可脱水生成(B),以冷KMnO4溶液氧化(B)可得到(C),其分式C6H14O2,(C)与HIO4作用只得丙酮,试推(A),(B),(C)的构造式,写出有关反应式解:A、B、C的结构式如下:18.分子式C5H12O 的一般纯度的醇,具有下列1HNMR数据,试写出该醇的结构式。
解:19. 某化合物分子式为C8H16O(A),不与金属Na、NaOH及KMnO4反应,而能与浓氢碘酸作用生成化合物C7H14O(B),B与浓H2SO4共热生成化合物C7H12(C),C经臭氧化水解后得产物C7H12O2(D),D的IR图上在1750~1700cm-1处有强吸收峰,而在NMR图中有两组峰具有如下特征:一组为(1H)的三重峰(δ值10),另一组是(3H)的单峰(δ值2)。
C在过氧化物存在下与氢溴酸作用得C7H13Br (E),E经水解得化合物B。
是推导出A的结构式,并用反应式表示上述变化过程。
解:化合物A不与金属Na、NaOH及KMnO4反应,说明不是醇或酚及带有碳碳双键和叁键等基团的物质,有可能是醚类,其推导过程如下:20.某化合物(A)C4H10O,NMR中δ=(双重峰6H),δ=(复杂多重峰,1H)δ=(双重峰,2H)以及δ=(单峰,1H 样品与D2O 共振此峰消失),试推测A 的结构。
解:A的结构式:以下21-23为原第四版题目21.画出下列取代乙醇的构象异构体的Newman投影式,预测各占的相对比例。
(1) FCH2CH2OH (2) BrCH2CH2OH由于分子内氢键的形成,优势构象为2。
构象式3为该化合物的优势构象。
22.试判断下列反历程是E1或E2还是S N1或S N2 写出各反应的主要反应解:注意书写格式是S N1 、S N2、E1 、E2。
好的离去基团,较强的亲核试剂,一级卤代烃主要发生S N2反应。
二级卤代烃,在强碱醇钠的醇溶液中主要发生E2反应。
醇在强酸性溶液中主要按E1反应历程进行反应,产物为重排后的主要产物。
乙烯式卤代烃难以被取代,在强碱条件下进一步发生E2消去反应。
一级卤代烃在强亲核性试剂醇钠作用下主要发生S N2取代,在更强的碱性试剂氨基钠作用下以E2消去反应为主。
一级卤代烃在醇钾的作用下主要发生S N2取代,在叔丁醇钾的作用下主要发生E2消去三级卤代烃在强碱作用下主要发生E1消去取代,而在乙醇溶液中只发生S N1取代反应。
β-碳上的取代基增多,更有利于消去反应,前者以S N2取代反应为主,后者以E2消去反应为主。
溶剂对反应历程产生影响,水溶液中主要以S N2取代反应为主,醇溶液中E2消去反应为主。
醇钠的浓度很低时,乙醇分子作亲核试剂而发生S N1取代反应为主,醇钠的浓度增加时醇钠作碱而以E1消去反应为主。
23.就以下几个方面对E1和E2反进行比较名称E1反应E2反应反应步骤分两步反应一步进行动力学一级反应二级反应过渡态立体化学经C+消除有重排产物外消旋化反式消除构型翻转竞争反应SN1SN2底物(RX或ROH)结构对速率的影响α-C取代基越大,对E1历程越有利叔卤代烷,醇有利于E1伯卤代烷有利于E2历程离去基团L的碱性对反应速度的影响碱性越弱,越易离去,反应速度越大碱性越弱,越易离去,反应速度越大消去的β-H的酸性对反应速率的影响酸性越强反应速度越快酸性愈强反应速度加快有利于E2历程21. 用两种方法合成2-乙氧基-1-苯基丙烷得到的产物具有相反的光学活性。
试解释之。
解:(1)经过1-苯基-2-丙醇与钾的反应生成1-苯基-2-丙醇钾一步没有构型的变化,第二步与溴乙烷的反应,1-苯基-2-丙氧基负离子为亲核试剂进攻溴乙烷的碳原子,没有改变手性碳的构型,因此来自1-苯基-2-丙醇的手性碳原子在反应中构型保持。
(2)经过1-苯基-2-丙醇与对甲苯磺酰氯的反应生成1-苯基-2-丙醇对甲苯磺酸酯一步没有构型的变化,第二步与乙醇的反应,亲核试剂乙醇从对甲苯磺酸基的背面进攻手性碳原子,发生S N2取代反应,改变了手性碳的构型,因此来自1-苯基-2-丙醇的手性碳原子在反应中构型翻转。
22. 从下列式中的信息推断化合物A、B、C的结构解:23. 以环己醇为原料合成反-1-环己基-2-甲氧基环己烷,试写出下列中间体A-H的构造式。
解:24. 用反应机理解释下列反应。
(1)(2)解:(1)(2)25. 解释下列反应。
解:。
