实验室电导率法
测量物质导电性的物理实验技术详解

测量物质导电性的物理实验技术详解导电性是物质特性的重要指标之一,对于实验室研究和工程应用都具有非常重要的意义。
本文将详细介绍几种常见的物理实验技术,用于测量物质的导电性。
一、电阻测量技术电阻是导电性的重要参数之一,测量电阻值可以帮助我们了解物质导电性的特点。
常见的电阻测量技术有电流-电压法和四引线法。
1. 电流-电压法电流-电压法是一种简单而常用的电阻测量技术。
实验中,我们需要通过物质样品施加电压,并测量电路中的电流,通过欧姆定律可得到电阻的值。
这种测量技术适用于大多数物质,但是对于高阻抗的物质要注意电流的选择,以避免测量误差。
2. 四引线法四引线法是一种更加精确的电阻测量技术。
在传统的电流-电压法中,测量电阻时会受到电路电阻的影响,导致测量结果不准确。
四引线法通过引入两组电线,一组用于施加电压,另一组用于测量电流,有效地消除了电路电阻对测量结果的影响。
这种技术在对电阻测量要求较高的实验中尤为重要。
二、电导率测量技术电导率是描述物质导电性的重要参数,与电阻呈反比。
常用的电导率测量技术有电阻-电导法和霍尔效应法。
1. 电阻-电导法电阻-电导法是通过测量电阻来间接计算电导率的一种常见方法。
在实验中,我们通过测量物质的电阻值,结合物质的尺寸和几何形状等参数,可以计算出物质的电导率。
这种方法比较简单,适用于常见的物质测量。
2. 霍尔效应法霍尔效应法是一种通过测量磁场引起的电势差来计算电导率的方法。
在实验中,我们将物质样品置于磁场中,当电流通过样品时,由于洛伦兹力的作用,将产生一定的电势差。
通过测量这个电势差以及电流和磁场的相关参数,可以计算出物质的电导率。
这种方法对于测量导电性较低或特殊的物质非常有效。
三、溶液导电性测量技术在实验室中,我们经常需要测量溶液的导电性,以研究溶液中的离子含量和离子迁移率等参数。
常见的溶液导电性测量技术有电导率测量法和电动漂移法。
1. 电导率测量法电导率测量法是通过测量溶液的电导率来反映其中离子的浓度和迁移率的方法。
2-1实验室电导率仪法
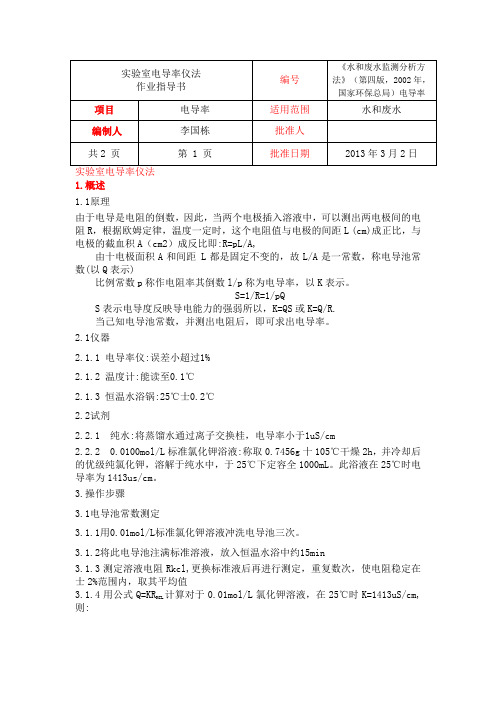
1.概述1.1原理由于电导是电阻的倒数,因此,当两个电极插入溶液中,可以测出两电极间的电阻R,根据欧姆定律,温度一定时,这个电阻值与电极的间距L (cm)成正比,与电极的截血积A(cm2)成反比即:R=pL/A,由十电极面积A和间距 L都是固定不变的,故L/A是一常数,称电导池常数(以Q表示)比例常数p称作电阻率其倒数l/p称为电导率,以K表示。
S=1/R=1/pQS表示电导度反映导电能力的强弱所以,K=QS或K=Q/R.当己知电导池常数,并测出电阻后,即可求出电导率。
2.1仪器2.1.1 电导率仪:误差小超过1%2.1.2 温度计:能读至0.1℃2.1.3 恒温水浴锅:25℃士0.2℃2.2试剂2.2.1 纯水:将蒸馏水通过离子交换桂,电导率小于1uS/cm2.2.2 0.0100mol/L标准氯化钾浴液:称取0.7456g十105℃干燥2h,并冷却后的优级纯氯化钾,溶解于纯水中,于25℃下定容全1000mL。
此浴液在25℃时电导率为1413us/cm。
3.操作步骤3.1电导池常数测定3.1.1用0.01mol/L标准氯化钾溶液冲洗电导池三次。
3.1.2将此电导池注满标准溶液,放入恒温水浴中约15min3.1.3测定溶液电阻Rkcl,更换标准液后再进行测定,重复数次,使电阻稳定在士2%范围内,取其平均值计算对于0.01mol/L氯化钾溶液,在25℃时K=1413uS/cm, 3.1.4用公式Q=KRKCL则:Q=1413R KCl4.1样品的测定用水冲洗数次电导池,再用水样冲洗后,装满水样,同3.1.3步骤测定水样电阻R,由已知电导池常数Q,得出水样电导率K 。
同时记录测定温度· 3.注意事项最好使用和水样电导率相近的氯化钾标准溶液测定电导池常数 如使用已知电导池常数的电导池,不需测定电导池常数,可调节奸仪器直接测定 5.结果计算电导率K( uS/cm)=RQ =R Rkcl 1413式中: R KCl -0.01mol/L 标准氯化钾溶液电阻R 一水样电阻 Q-电导池常数。
实验八-电导法测定乙酸乙酯皂化反应的速率常数

实验八-电导法测定乙酸乙酯皂化反应的速率常数实验四电导法测定乙酸乙酯皂化反应的速率常数一、目的要求1.用电导率仪测定乙酸乙酯皂化反应进程中的电导率2.学会用图解法求二级反应的速率常数,并计算该反应的活化能3.学会使用电导率仪和恒温水浴二、基本原理1 乙酸乙酯皂化是一个二级反应,其反应式为CH3COOC2H5+Na++OH-→CH3COO-+Na++C2H OH5在反应过程中,各物质的浓度随时间改变。
某一时刻的OH-离子浓度,可以用标准酸滴定,也可以通过测量溶液的某些物理性质而求出。
以电导率仪测定溶液的电导率值随时间的变化关系,可以监测反应的进程,进而可以求算反应的速率常数。
反二级反应的速率与应物的浓度有关。
方便起见,设计实验时应物的浓度均采用a 作为起始浓度。
当反应时间为t时,反应所生成的CH3COO-和C2H5OH的浓度为x,则CH3COOC2H5和NaOH的浓度为(a-x)。
设逆反应可以忽略,则有CH3COOC2H5CH3COOC2H5+NaOH→CH3COONa+C2H5OH t=0 c c 0 0t=t a-x a-x x xt→∞ →0 →0 →c →a二级反应的速率方程可表示为(1)积分得(2)起始浓度a为已知,因此只要由实验测得不同时间t时的x值,以对t作图,应得一直线,从直线的斜率m(=ak)便可求出k值。
由于反应是在稀水溶液中进行的,因此可以假定CH3COONa全部电离。
溶液中参与导电的离子有Na+,OH-和CH3COO-等,而Na+在反应前后浓度不变,OH-的迁移率比CH3COO-大得多。
随反应时间的增加,OH-不断减少,而CH3COO-不断增加,所以体系的电导值不断下降。
在一定范围内可以认为体系的电导值减少量和CH3COONa的浓度x的增加量成正比,即t=t时, x=β(κ0-κt) (3)t=∞时,a=β(κ0-κ∞) (4)式中κ0和κt分别为起始和t时的电导值,κ∞为反应终了时的电导值,β为比例常数。
化学中酸碱溶液的鉴别方法

化学中酸碱溶液的鉴别方法化学实验室中,酸碱溶液的鉴别是一项基本的实验技能。
正确鉴别酸碱溶液的性质对于化学实验的进行至关重要。
本文将介绍几种常见的酸碱溶液鉴别方法。
一、酸碱指示剂法酸碱指示剂法是最常见的鉴别酸碱溶液的方法之一。
指示剂是一种能够根据溶液的酸碱性质而发生颜色变化的物质。
常见的指示剂有酚酞、甲基橙、溴酚蓝等。
在实验中,我们可以将待鉴别的溶液滴在白色滴漏纸上,然后滴加少量的指示剂。
如果溶液变成红色或橙色,说明它是酸性溶液;如果溶液变成黄色或绿色,说明它是碱性溶液。
二、电导率法电导率法是通过测量溶液的电导率来鉴别酸碱溶液的方法。
酸性溶液和碱性溶液的电导率不同,可以通过电导仪器进行测量。
在实验中,我们可以将待鉴别的溶液倒入两个电极之间的导电池中,然后测量电导仪器的读数。
如果读数较高,说明溶液是酸性的;如果读数较低,说明溶液是碱性的。
三、中性化反应法中性化反应法是通过酸碱中和反应来鉴别酸碱溶液的方法。
酸性溶液和碱性溶液可以相互中和,产生中性溶液。
在实验中,我们可以将待鉴别的溶液滴入酸碱溶液中,观察是否发生颜色变化或产生气体。
如果溶液变成中性,说明它是酸性溶液;如果产生气体,说明它是碱性溶液。
四、金属反应法金属反应法是通过金属与酸碱溶液的反应来鉴别酸碱溶液的方法。
酸性溶液和碱性溶液与金属反应时,会产生不同的气体。
在实验中,我们可以将待鉴别的溶液与锌片或铝片等金属反应,观察是否产生气泡。
如果产生气泡,说明溶液是酸性的;如果没有产生气泡,说明溶液是碱性的。
总结起来,酸碱溶液的鉴别方法主要有酸碱指示剂法、电导率法、中性化反应法和金属反应法。
这些方法各有优劣,可以根据实验需求选择合适的方法进行鉴别。
在实验中,我们需要仔细观察和记录实验现象,确保鉴别结果的准确性。
同时,安全操作也是非常重要的,避免对实验人员造成伤害。
通过学习和掌握这些酸碱溶液的鉴别方法,我们可以更好地进行化学实验,提高实验的准确性和可靠性。
测试物质的电导性的方法

测试物质的电导性的方法
测试物质的电导性的方法可以采用以下几种常见的方式:
1. 电导仪法:使用电导仪测量物质的电导率。
这种方法涉及将电导仪的电极插入待测物质中,然后通过对电流和电压的测量来计算电导率。
电导仪可以是手持式的便携设备或实验室中的仪器。
2. 导线连接法:将待测物质与电极连接,并将电流通入物质中。
通过测量电流的大小和电压的差异,可以计算出物质的电导率。
这种方法通常适用于固体或液体样品。
3. 电阻法:测量物质的电阻以间接计算其电导率。
该方法涉及将样品夹在两个电极之间形成电路,并通过测量电阻值来推断电导率。
这种方法适用于固体或液体样品。
4. 电极极化法:通过在物质中施加外部电势来研究其电导性。
这个方法包括使用电极对物质施加交流或直流电势,并测量在不同频率下的电导率。
这种方法可以提供更详细的电导率信息。
请注意,具体应用哪种方法取决于待测物质的性质和实验条件。
在进行实际测试之前,请确保按照相关安全操作规程和仪器操作指南进行操作,并遵守适当的实
验室安全措施。
电导率的测定

电导率的测定A1 方法提要电导率是距离1 cm和截面积1 cm2之两个电极间所测得电阻的倒数,由电导率仪直接读数。
A2 仪器和试剂A2.1 仪器A2.1.1 电导率仪(附配套电导电极)。
A2.1.2 恒温水浴锅。
A2.1.3 100 mL或250 mL烧杯。
A2.2 试剂0.010 0 mol/L氯化钾标准溶液:取少量氯化钾(优级纯),在110℃烘箱内干燥2 h,冷却后精确称取0.745 6 g,溶于新煮沸放冷的重蒸馏水中(电导率小于1 μS/cm),转移到1 000 mL容量瓶中,并稀释至刻度。
此溶液在25℃时的电导率为1 411.83μS/cm。
溶液储存在具有玻璃塞的硬质玻璃瓶中。
A3 分析步骤按电导率仪使用说明,选好电极和测量条件,并调校好电导率仪,将电极用待测溶液洗涤3次后,插入盛放待测溶液的烧杯(A2.1.2)中。
选择适当量程,读出表上读数,即可计算出待测溶液的电导率值。
注1 电极引线不要受潮,否则将影响测量的准确度。
2 盛放待测溶液的烧杯应用待测溶液清洗3次,以避免离子污染。
A4 精密度和准确度同一实验室对电导率为1.36 μS/cm的水样,经10次测定,其相对标准偏差为1.0%。
A5 电极常数的测定取未知电极常数的电极,用氯化钾标准溶液(A2.2)洗涤5次后,插入盛放氯化钾标准溶液(A2.2)的烧杯中,测量一定温度下的电导率,即可计算出电极的电极常数。
电极常数=K/S ………………(A1)式中:K——一定温度下氯化钾标准溶液的电导率,可从GB 6682附录A中查出。
S——同一实验条件下,测出的氯化钾标准溶液的电导。
注:有的电导率仪出厂时已标明配套电极的电极常数,可直接进行电极常数的补偿校正。
若未知电极的电极常数,则可用本法测定。
(二)注意事项1.在测量高纯水时应避免污染。
2.若需要保证高纯水测量精度,应采用不补偿方式测量利用查表而得。
3.温度补偿采用固定的2%的温度系数补偿。
4.为确保测量精度,电极使用前应用小于0.5μs/cm的蒸馏水(或去离子水)冲洗两次,然后用被测试样冲洗三次后方可测量。
化学反应速率的电导率测定

化学反应速率的电导率测定引言:化学反应的速率是指反应物消耗或生成的量与时间的比率。
了解反应速率对于研究和应用化学反应非常重要。
在实验室中,可以通过多种方法来测定反应速率,其中之一是利用电导率测定法。
本文将介绍化学反应速率的电导率测定方法及其在实验中的应用。
一、电导率原理电导率是指单位长度和单位横截面积的电流通过导电体时,导电介质的电阻程度。
在化学反应中,如果反应体系中存在离子或电解质,反应发生时,离子浓度的变化会导致电解质溶液的电导率发生变化。
通过测定反应体系的电导率随时间的变化,可以获得反应速率的相关信息。
二、实验步骤1. 准备实验仪器和试剂:实验仪器包括电导率计、玻璃容器等;试剂则根据实验设计不同而异。
2. 设计实验方案:根据所需测定的化学反应,确定反应体系的成分和浓度,并设置反应条件。
同时,确定所需测定的反应速率。
3. 实验操作:按照设计的反应体系和浓度,将试剂按照一定比例加入玻璃容器中,并保持恒定温度。
使用电导率计测量反应体系的电导率,并记录时间和电导率数据。
4. 数据处理:根据测得的电导率数据,绘制电导率随时间的变化曲线。
根据曲线的变化趋势,确定反应速率。
三、实验应用1. 确定反应速率与反应物浓度的关系:通过改变反应物浓度,测量电导率随时间的变化,可以确定反应速率与反应物浓度之间的关系,进而了解反应的反应级数。
2. 研究温度对反应速率的影响:在恒定浓度下,改变反应体系的温度,测量电导率随时间的变化,可以确定反应速率与温度之间的关系,得到反应的活化能。
3. 比较不同反应体系的反应速率:通过测量不同反应体系的电导率随时间的变化,可以对不同反应体系的反应速率进行比较,了解不同反应的反应特性。
结论:化学反应速率的电导率测定是一种简便有效的测定反应速率的方法。
通过测量反应体系的电导率随时间的变化,可以了解反应速率与反应物浓度、温度等因素之间的关系,并对不同反应体系的反应速率进行比较。
电导率测定方法的应用可以为化学反应的研究和应用提供重要参考。
实验室检验氯离子的方法

实验室检验氯离子的方法氯离子是一种重要的水质指标,其含量的变化可以反映出水体的污染程度,因此实验室对氯离子的检测十分重要。
下面主要介绍实验室检测氯离子的一些常用方法。
(一)化学分析法化学分析法是目前实验室检测氯离子最常用的方法,其原理是利用氯离子与高分子聚合物结合后,产生化学反应或结晶,再利用测定其吸光度的方法检验氯离子含量。
该方法的优点是检测技术简单,分析数据准确而可行;缺点是测定所需要的试剂较多,耗时较长。
(二)电导率法电导率法是实验室用于检测氯离子含量较低的有效方法,它原理是利用氯离子溶液能通过电流而使溶液电导率改变,再通过测定电导率值,分析出氯离子含量。
该方法的优点是检测结果准确可靠,精度高,耗时短;缺点是检测范围有限,浓度在10~100mg/L之间,超出此范围时无法准确测定。
(三)氢电极法氢电极法是一种简便、快速的检测方法,它原理是在被测溶液内,将氢电极和电极放入,通过电极传递电量,当氯离子与氢电极发生作用时,可检出氯离子的浓度,然后结合实验数据计算出氯离子的含量。
该方法的优点是对氯离子浓度没有限制,耗时短;缺点是容易受到外界污染,检测结果容易受到影响。
(四)溴分光光度法溴分光光度法是一种快速准确的实验室检测氯离子的传统方法,它原理是在被测溶液中添加溴化试剂,当氯离子与溴化试剂发生化学反应后,改变溶液的颜色,然后通过分光光度仪分析出溶液中氯离子的含量。
该方法的优点是准确度高,结果可靠;缺点是检测范围有限,仅能测定低至0.2mg/L的氯离子,超出此范围时则无法检测。
综上所述,实验室检测氯离子的常见方法有化学分析法、电导率法、氢电极法和溴分光光度法,这些方法各有优缺点,可以综合考虑后选择适合的检测方案,以提高检测结果的准确性。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实验室电导率法
电导率法是实验室中常用的一种分析方法,用于测量溶液的电导率以判断其导电性能。
通过测量溶液中的离子浓度和电导率,可以推断出溶液中的溶质浓度和离子种类,从而对溶液的性质进行分析和评估。
电导率是指单位长度内物质的电导能力,通常用电导率常数来表示。
电导率常数是指单位长度内物质单位浓度时的电导能力,用符号κ表示。
电导率常数与溶液的电导率呈正比,即电导率越高,电导率常数越大。
实验室中常用的电导率仪器有电导率计和电导仪。
电导率计是一种测量溶液电导率的仪器,它通过测量电流和电压之间的关系来计算电导率。
电导仪是一种测量离子浓度的仪器,它利用电导率法来测量溶液中的离子浓度,并根据离子浓度推算出溶液的电导率。
在进行电导率实验时,首先需要准备样品溶液。
溶液的制备应严格按照实验要求进行,遵循溶质的浓度要求和配比要求。
接下来,将样品溶液倒入电导率计的电池槽中,并确保电极与溶液充分接触。
在开始测量前,应对电导率计进行校准。
校准是为了保证测量结果的准确性和可靠性。
校准时需要使用标准溶液,根据标准溶液的电导率值进行调整,使电导率计的读数与标准值相符。
在进行测量时,应注意避免外界因素对实验结果的影响。
例如,避免阳光直射、避免电极与容器壁接触等。
在测量过程中,需要记录电导率计的读数,并在一定时间内进行多次测量,取平均值作为最终结果。
电导率法在实验室中有着广泛的应用。
它可以用于测量各种类型的溶液,包括酸碱溶液、盐溶液、金属离子溶液等。
通过测量溶液的电导率,可以推断出溶液中的溶质浓度和离子种类,进而对溶液的性质进行分析和评估。
电导率法的优点是快速、准确、可靠。
相比传统的化学分析方法,电导率法具有操作简便、结果直观等优势。
同时,电导率法还可以实现在线监测,实时掌握溶液的电导性能。
然而,电导率法也存在一些局限性。
例如,电导率法只适用于导电性较好的溶液,对于非电解质溶液或电导率较低的溶液,其测量结果可能不准确。
此外,电导率法无法提供溶质的化学组成信息,只能对溶液的电导性能进行分析。
总结来说,实验室电导率法是一种常用的分析方法,通过测量溶液的电导率来判断其导电性能。
电导率法具有快速、准确、可靠的优点,并可以实现在线监测。
然而,电导率法的应用范围有限,对于某些溶液可能不适用。
在进行电导率实验时,应严格按照实验要求进行操作,并注意排除外界因素对实验结果的影响。
通过电导率法
的应用,可以对溶液的性质进行分析和评估,为科学研究和工程实践提供重要的参考依据。
