催化反应工程(华东理工大学) 习题及解答
华东理工大学反应工程阶段辅导(3)

当 1, 2 1 3 当 5 , 2
可忽略
Da 1 , Da 5 ,
1 1
1 1 Da
严重
⑶ 影响
2 的因素
T k 2
Cat .活性 k
rP 2
Cb
n=1, n>1, n<1,
C P ,b
C A ,b
①
C A ,es ②
④
C A ,is
③
③ 反应物在颗粒内表面上进
行化学反应(表面反应) ④ 反应产物从内孔深处向孔
C P ,es
C P ,is
口逆向扩散(内)
⑤ 反应产物从催化剂外表面
气膜
外表面
中心
扩散返回气流主体(外)
气固催化反应过程的传递现象 浓度与温度分布
主 气 体 膜 A 气 主 膜 体 A 气 气 相 膜 主 体 气 气 膜 相 主 体
Φ—西勒(Thiele)准数或西勒模数
rP kC De
n 1 b
双曲正切函数 e x e x tanh x x e e x
对一级不可逆反应,球形颗粒:
3 1 1 2 ( ) tanh
当 1, 2 1 3 当 5 , 2
C es 1 1 = Cb 1 Da
一般情况下
1 (
C es Cb
) (1 1 Da )
n
n
Da 1 , Da 5 ,
1 1
1 1 Da
1 Da
1 Da
的测定:
R ( rA ) lim R 1 Da ( rA ) lim ( N A ) lim kgaC b
华东理工大学化学反应工程(本)期末复习题及参考答案

化学反应工程(网络教育)-题库注:找到所考试题直接看该试题所有题目和答案即可。
查找按键:Ctrl+F 超越高度1、可逆放热反应的最优温度随转化率xA变大而。
A、降低B、变大C、不变D、都有可能答案: A2、对自催化反应而言,必然存在最优反应时间使最大。
A、转化率B、反应速率C、收率D、选择率答案: B3、在列管式固定床反应器中进行强放热反应,为保证反应器稳定操作,若反应活化能越大,则最大允许温差。
A、越小B、越大C、不变D、不能判断答案: A4、工业反应过程优化的技术指标包括 .A、反应速率B、反应选择率C、反应工艺D、能量消耗答案: ABD5、化学反应工程的研究方法主要采用数学模型方法。
答案:正确6、在CSTR中小于平均停留时间的流体粒子占全部粒子的百分比为36.8%。
答案:错误7、若气相反应2A+B→P+S,则膨胀因子dA等于()。
A、 -1/2B、 1/2C、 2D、 -2答案: A8、活化能E与反应的热效应相关,活化能大的反应其反应热也大。
答案:错误9、理想间歇反应器中搅拌越激烈,混合越均匀,则反应速率越快。
答案:错误10、空速的物理意义是单位时间单位反应器体积所能处理进口物料的体积,单位为[时间]-1。
答案:正确11、对自催化反应A+P→P+S而言,必定存在最优反应时间使反应的转化率最大。
答案:错误12答案:外扩散消除,内扩散有影响。
13、有一全混釜反应器,已知反应器体积为100 升,流量为10升/min,试估计离开反应器的物料中,停留时间为0~1min,2~10min和大于30min的物料所占的分率。
答案:0.095,0.451,0.05014、一级液相可逆反应在等温80℃下间歇反应器中进行反应,反应物A,产物P。
已知cA0=2.00mol/L,cP0=0时,反应时间t=30min,测得cA=1.5mol/L,且该温度下平衡浓度cAe =0.5mol/L,求(a)平衡常数K;(b)反应速率常数k1和k2。
化学反应工程_华东理工大学中国大学mooc课后章节答案期末考试题库2023年

化学反应工程_华东理工大学中国大学mooc课后章节答案期末考试题库2023年1.对简单不可逆二级反应,根据要求的处理量、初浓度和转化率,所需的反应器体积最小。
参考答案:平推流2.工业反应过程优化的决策变量包括参考答案:操作方式_工艺条件_结构变量3.均相反应应该满足下述哪2个条件?参考答案:反应体系互溶_预混合过程很快4.对串联反应而言,存在一个最优反应温度使反应产物收率最大。
参考答案:错误5.化学反应工程的研究方法是经验放大方法参考答案:错误6.连续流动釜式反应器中物料浓度和温度处处相等,并且等于反应器进口物料的浓度和温度。
参考答案:错误7.理想间歇反应器中搅拌越激烈,混合越均匀,则反应速率越快。
参考答案:错误8.化学反应的前提是参与反应的所有物料达到分子尺度上的均匀,成为均一的气相或液相。
参考答案:错误9.产生返混的原因是参考答案:不均匀的速度分布_空间上的反向流动10.限制返混的措施包括参考答案:横向分割_纵向分割11.化学反应工程的研究对象是以化学实验室中进行的化学反应过程。
参考答案:错误12.化学反应工程优化的技术指标是参考答案:反应选择率_能耗_反应速率13.活化能E与反应的热效应相关,活化能大的反应其反应热也大。
参考答案:错误14.零级反应的重要特征是反应时间由残余浓度决定,与初始浓度关系不大。
参考答案:错误15.可逆放热反应的最优温度随转化率xA变大而增大。
参考答案:错误16.限制返混的措施是分割,主要是横向分割。
参考答案:正确17.理想管式反应器的径向具有严格均匀的速度分布,也就是在径向不存在浓度变化,所以反应速率随空间位置的变化将只限于轴向。
参考答案:正确18.对自催化反应A+P®P+S而言,必定存在最优反应时间使反应的转化率最大。
参考答案:错误19.小于1级的简单不可逆反应,反应转化率可以在有限时间里达到100%。
参考答案:正确20.空速1000(1/h)表示每小时能够处理的进口物料体积为反应器体积的1000倍。
化学反应工程1-2章习题答案

化学反应工程1-2章答案(华东理工大学张濂版课后习题)第一章1-1 乙苯循环量:46kg/h 补充的新鲜乙苯:100-46=54 kg/h单程转化率=(100-46)/100×100%=54%选择率=(48/105)/(54/107)×100%=90.6%单程摩尔收率=(48/105)/(100/107)×100%=48.9% 单程质量收率=48/100×100%=48% 总摩尔收率=(48/105)/(54/107)×100%=90.6% 总质量收率=48/54×100%=88.9%单耗(摩尔)=1/90.6%=1.104 单耗(质量)=1/88.9%=1.1241-2以100kg进口气体为基准,设甲醛转化量为xkg则:进口出口100kg 100kg甲醛:10kg 1.6kg丁炔二醇:0kg 7.65kg转化率=(10-1.6)/10×100%=84%选择率=(7.65/86)/((10-1.6)/30)×100%=31.76%单程质量收率=7.65/100×100%=7.65%总质量收率=7.65/(10-1.6)×100%=91.07%1-3得到的顺丁烯二酸酐:20.27×34.5%=6.99t质量收率:6.99/7.21×100%=96.9%摩尔收率:(6.99/98)/(7.21/78)×100%=72.7%第二章2-1 化学计量方程式不影响速率表达式,因此以反应物B和产物P表示的反应速率表达式为:(-r B)=k B C B2C p22-2k C=(-r A)/C A n k P=(-r A)/P A nn=0 (-r A)=k C=k P mol/m3﹒hn=1 k C =(-r A)/C A=( mol/m3﹒h)/(mol/L)=(103h)-1k P=(-r A)/P A=( mol/m3﹒h)/Mpa=mol/m3﹒h﹒Mpan=2 k C=(-r A)/C A2=( mol/m3﹒h)/ (mol/L)2=(106h﹒mol)-1k P=(-r A)/P A2=( mol/m3﹒h)/(Mpa)2= mol/m3﹒h﹒Mpa2 2-3 t1=8d=11520min T1=20℃=293Kt2=10min T2=120℃=393Kln(r2/r1)=ln(k2/k1)=E/R(1/T1-1/T2)ln(11520/10)=E/8.314(1/293-1/393)E=67751J/mol2-4 ln(r2/r1)=ln(k2/k1)=E/R(1/T1-1/T2)1)r2/r1=2 T1=473K E1=156.9kJ/molln2=156.9×103 /8.314(1/473-1/T2)T2=482.3K=209.3℃△T=9.3℃2)同1),ln2=104.6×103 /8.314(1/473-1/T2)T2=489K=216℃△T=16℃2-5 ln(r2/r1)=ln(k2/k1)=E/R(1/T1-1/T2)ln2=E1/8.314(1/300-1/310) E1=57616J/mol同理:ln2=E2/8.314(1/400-1/410) E2=94607J/mol ln2=E3/8.314(1/500-1/510) E3=144040J/molln2=E4/8.314(1/600-1/610) E4=208332J/mol。
化学反应工程原理(华东理工大学版)第二版第八章答案

化学反应工程原理(华东理工大学版)第二版第八章答案篇一:化学反应工程原理(华东理工大学版)第三章答案华东版3-1 解:cA0kt?xA1?xA?1把数据代入得cA0k?当xA=时解得t=15min所以,增加的时间为15-5=10min3-2解:?1?xA?1?nn?1?1??n?1?cA0kt (式A)把xA=和t=10min代入解得cA0k?再把t=30min代入(式A)解得xA=所以,转化率应为13-3 解:设反应动力学方程为:?则?1?xA?1?nn?1dcAn ?kcAdtn?1?1??n?1?cA0kt,且cA0=1?11??n?1?k8因此有 1?n?11??n?1?k18解得:n=2;k=/mol·min3-41)计算进料中酸、醇和水的摩尔浓度cA0、cB0、cS0(注意进料中水的浓度cS0不为0)。
2)列出当酸的转化率为xA时,各组分浓度的表示式: -11?ncA?cA0?1?xA?cB?cB0?cA0xAcR?cA0xAcS?cS0?cA0xA3)将上列各式及各组分初浓度代入反应速率式,整理得dxA2 10?6?dt4)计算转化率达35%所需的时间为t??0dxA 上述积分可查积分表用公式计算,也可用MATLAB语言的quad解算子计算,结果为 t?7153s?2h5)计算所需反应器体积。
先计算每天的反应批数,再计算每m3反应体积每天的生产量,然后再计算达到要求产量所需反应器体积。
答案为VR=3-51)设酯的平衡转化率为xAe,将平衡时各组分浓度代入化学平衡方程得:? ??化简整理上述方程并求解得xAe?%2)此题解法与3-4中的步骤2~4相同,答案为t=276min3)此时各组分的浓度为酯:/L;水: mol/L;醇、酸: mol/L;反应物系的组成为酯:%;水:%;醇、酸:%;3-6对可逆放热反应,当反应温度过低时,因反应速率过低转化率偏低,当反应温度过高时,转化率又会受化学平衡的限制。
催化反应工程华东理工大学 第一二次课.ppt

3.移热问题 4.反应速率与活性温度
催化反应工程
流态化技术
1.气体分布2.颗粒的流动特性3.特征流速 4.床层的膨胀与压降5.气泡行为6.乳相行为 7流化床的热、质传递8.颗粒夹带与分离9.数学模型
催化反应工程
教材
1. 朱炳辰,翁惠新,朱子彬编著. 催化反应工程,北京:中国 石化出版社,2001
2.加氢裂化反应器
3.催化重整反应器
催化反应工程
催化反应工程
三.基本有机化工中的催化反应器
平行 连串 平行连串反应系统
温度
反应器进口气体组成,操作压力,操作温度, 产量
1.深度氧化的副反应,活化能大于主反应,反应热大于主反应的;
降低温度有利,若温度高,副反应加剧,飞温,可能烧坏
催化剂,反应器
2.平衡常数与温度的关系 若在某一温度下,平衡常数小,可提高操作压力
参考书目
1. 朱开红,袁渭康编著. 化学反应工程分析,北京:高等教育 出版社,2002
2.G F Froment, K B Bischoff. Chemical Reactor Analysis and Design 2nd ed. New York: Wkley&Sons, 1990
催化反应工程
kt
1 CA
1 C A0
1 C A0
1
x
x
、C
A
C A0 1 C A0kt
x C A0kt 1 C A0kt
Batch
kt
n0
CA
kt
n 1
CA
kt
n2
CA
PFR
k p
CAf
k p
化学反应工程原理(华东理工大学版)第六章答案
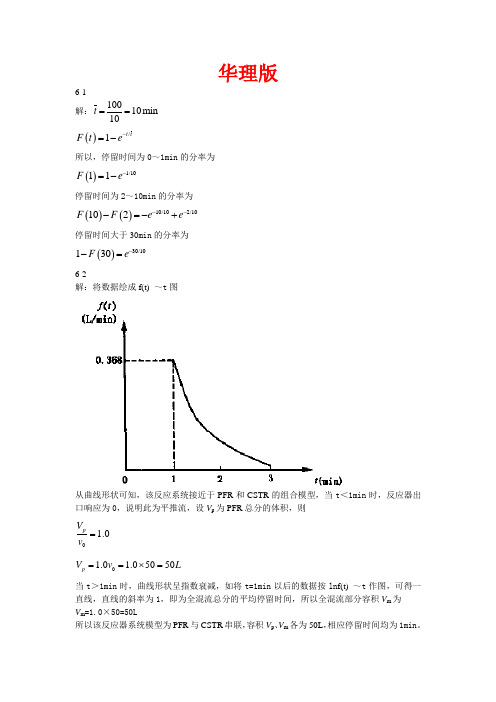
华理版6-1 解:10010min 10t == ()/1t t F t e -=-所以,停留时间为0~1min 的分率为()1/1011F e -=-停留时间为2~10min 的分率为()()10/102/10102F F e e ---=-+停留时间大于30min 的分率为()30/10130F e --=6-2解:将数据绘成f(t) ~t 图从曲线形状可知,该反应系统接近于PFR 和CSTR 的组合模型,当t <1min 时,反应器出口响应为0,说明此为平推流,设V p 为PFR 总分的体积,则0 1.0pV v =01.0 1.05050p V v L ==⨯=当t >1min 时,曲线形状呈指数衰减,如将t=1min 以后的数据按ln f(t) ~t 作图,可得一直线,直线的斜率为1,即为全混流总分的平均停留时间,所以全混流部分容积V m 为 V m =1.0×50=50L所以该反应器系统模型为PFR 与CSTR 串联,容积V p 、V m 各为50L ,相应停留时间均为1min 。
6-3解:CSTR中均相二级反应00c c ====0.435 即转化率为0.565CSTR 中固相二级反应:0100011i c k c e e c c k c k τττ⎛⎫=∙ ⎪⎝⎭6-4 解:()()000c t c f t dt c c ∞=⎰ 根据动力学方程可知,()21/200022c t c kt c c ⎛⎫-= ⎪⎝⎭,f(t)=0.5 代入已知条件,()21/200022c t c kt c c ⎛⎫-= ⎪⎝⎭= ()21t - ()()000c t c f t dt c c ∞=⎰=()2201t dt -⎰=0.667 所以转化率为A x =1-0.667=0.3336-5解:(1)由图知,反应器为通过一PFR 反应器和一全混釜反应器,0.4P ks τ=,求()dF t dt ,再取对数,用ln f(t) ~t 作图,可得一直线,斜率为1.25,所以0.8m ks τ=,平均停留时间为1.2ks 。
华东理工大学化学反应工程原理习题

cB 0 / c A0 1和5时,转化率分别为0.5,0.9,0.99时所需的反
应时间,并对计算结果进行讨论。
2 rA kcAcB kcA0 (1 xA )(cB0 cA0 xA ) kcA 0 (1 xA )(
cB0 cB0 2 xA ) kcA (1 x )( x ) ( 令 ) 0 A A cA0 cA0
第1章 绪论
1-5 2 HCHO C2 H 2 C4 H 6O2 ,原料分离回收循环操作,
甲醛初始浓度10%(质量比),出反应器1.6%,丁炔二醇 初浓度0,出口浓度7.65%,求
x A , , ,
nA0 nA 10% 1.6% xA 0.84 nA0 10%
代入数据,求平均值
k1 =6.37 104 s 1 k2 =1.25 104 s 1
3-23* 在等温间歇釜式反应器中进行下列液相反应:
A B P 2 A R rp 2c A kmol / (m3 h) rR 0.5c 2 A kmol / (m3 h)
k2 Ea 1 1 ln ( ) k1 R T1 T 2
Ea 67.55 kJ / mol
2-5 C2H4二聚反应:(1) T=200℃,Ea=156.9 kJ/mol; C2H6二聚反应:(2) T=200℃,Ea=104.6 kJ/mol。为使反应 速率加倍,要提高多少温度?
k2 Ea 1 1 ln ( ) k1 R T1 T 2
t t 2 t 1 10 min
3-2 n=1,等温,证明xA=99.9%时所需反应时间是xA=50%
时所需反应时间的10倍
1 kt ln 1 xA
Ea k k 0 exp( ) RT
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
催化反应工程(华东理工大学)习题及解答
习题
1:CO 变换反应的平衡常数
1222=⋅⋅=
O
H co H CO c c c c Kc
已知原料气中,CO :H 2O =1:2(摩尔比),试确定反应混合物的平衡组成和平衡转化率。
2:等温下在间歇反应器中进行一级不可逆分解反应
C B A +−→−
在5min 内有50%的A 分解,要达到分解率为75%,问需多少时间?若反
应为二级,则需多少时间?
3:在体积为V R 的反应器中进行均相等温反应 2
,A kc r R A =−→−。
(1) 当该反应器为CSTR 时,Af x =50%,若将此反应器改为PFR ,Af x 等
于多少?
(2) 当该反应器为CSTR 时,Af x =50%,若将此反应器体积增大6倍(仍
为CSTR ),Af x 等于多少?
(3) 若反应级数为零级,求(1)、(2)的计算结果。
(4) 若反应级数为1级,求(1)、(2)的计算结果。
4:在理想管式反应器中进行两级反应,当进料初浓度从30%降到4%,若要求反应结果的残余浓度维持在0.1%,问进料体积流量应作何调整?
习题
5:下述基元反应⎪⎩⎪⎨⎧−→−
−→−
S P A 21,原料中0A c =1,000==S R c c ,加到两只串联的CSTR
中,m in 5.21=τ,m in 52=τ,已知第一只CSTR 出口4.01=A c ,4.01=R c ,
2.01=S c ,求第二只CSTR 出料组成。
6:证明在内、外扩散同时影响宏观速率时, (1)对一级可逆气-固相催化反应,ζ
111s k s k c R s e g Ag +
=
;
(2)对n 级不可逆气-固相催化反应,宏观速率近似按下式计算:
1
11-+=
n Ag
s e g Ag
c s k s k n c R ζ宏
7:用直径5mm 球形催化剂进行一级不可逆反应P A −→−
,颗粒外部传质阻力可忽略不计,气流主体温度500℃,p =1atm ,反应组分为纯A ,已知以催化
剂颗粒体积为基准的反应速率常数为k=5s-1,组分A 在颗粒内的有效扩散系数De =0.004cm2/s ,试计算颗粒内部有效因子ζ与表观反应速率R 。
8:推导单段绝热式一氧化碳变换反应器的一维拟均相数学模型。
1:
解:,121,,,,,,2222222=⎪⎪⎭
⎫
⎝
⎛-⎪⎪⎭⎫ ⎝⎛-⋅=
=
V n V n V n V n C C C C K l CO l CO l
CO l CO l
O H l CO l H l CO c 得3
2,2=
l CO n 即3
2)1(1)
(,0
,,0,=--=-=e CO CO e CO CO e n n n n x
⎪⎪⎪⎪
⎩⎪⎪⎪
⎪⎨⎧⇒ 2:
解:(1)反应为一级不可逆反应:
m i n 10 5.04ln 2ln 75
.011ln
5.011ln 522=⇒==--=t t
(2)反应为二级不可逆反应:
m i n
15 311ln 1ln
22
2
11
21=⇒=--=t x x x x t t 3:
解:(1)n=2,
667.0 )1()
5.01(5
.02
=⇒-=-Af Af Af x x x (2)n=2, 75.0 )
1()5.01(5
.062,2
2,2,2=⇒-=-⨯Af Af Af x x x
9
131,,,,2=-==
∑e
CO e i e
CO e CO n n n y 9432,,,,222
=-==∑e CO e i e O H e O H n n n y 9
2,,,22=
=∑e i e CO e CO n n y
5:
解:对#1,⎩⎨
⎧====111
2111
1//ττs A s R A R C C k r C C k r ,⎪⎪⎩
⎪⎪⎨⎧⨯==⨯==--11112
1
1111min 2.05.24.02.0min 4.05.24.04.0==ττA S A R C C k C C k
对#2,组分A :2212
200)()
(A R A A A C k k V C C V r +=-=
1.0 )
2.04.0(4.0522
2
2=+-=
=A A A C C C 得,τ
组分B :1.04.04
.05221122⨯-=-=
=R A R R C C k C C τ,得6.02=R C
组分C :1
.02.02
.05222122⨯-=-==S A S S C C k C C τ,得3.02=S C
6:
解:(1)一级不可逆反应:
ζ
ζζi s e g Ag i s As
e g As Ag As i s As Ag e g s k s k C S k C S k C C C S k C C S k R 1
111)(+
=
=-=
=-=宏 (2)n 级不可逆反应:
[]
111
11)(1
)
(1---+=
-+-+==-=n Ag
i s e g Ag i s n Ag Ag As Ag Ag As n Ag n Ag i s n As i s e
g As
Ag C S k s k n c S k C n C C C n C C nC C S k C S k S k C C R ζζζζ=宏
7:
解:Φ=
95.210004.06
2353
2
=⨯⨯=eff v p D k R 3.095.231)95.23(195.2131)3(11 =⎥⎦
⎤
⎢⎣⎡⨯-⨯=⎥⎦⎤⎢⎣⎡-=
∴th th φφφζ。
