第二章 化学平衡习题
高中化学必修选修第二章 化学平衡 单元练习

第二章 化学平衡 单元练习第Ⅰ卷(选择题 共46分)一.选择题(本题包括8小题,每小题2分,共16分。
每小题只有一个选项符合题意。
) 1.将SO 2和18O 2充入反应容器,当反应达到平衡时18O 原子将存在于A. 氧气和三氧化硫中B. 只存在于SO 3中C. 三种物质中都有D. 无法判断 2.反应2A(气)B(气)+x C(气)在一定条件下达到平衡,容器内压强增大了p %,测得A 的转化率为p %,则x 值为A. 1B. 2C. 3D. 43.在合成氨反应中,开始充入amolN 2和bmolH 2,在一定条件下,反应达平衡,测得NH 3占混合气体的25%,则平衡时N 2的转化率是A. )%101.0(ab + B. 0.1(a+b) C. 33.3% D. 1010(b +4.在容积固定的2L 密闭容器中,充入X 、Y 各2mol ,发生可逆反应X(g)+2Y(g)2Z(g)衡,以Y 的浓度改变表示的反应速率v 正、v 逆与时间t 的关系如图。
则Y 的平衡浓度表达式正确的是(式中S 指对应区域的面积 A. 2-S aob B. 1- S aob C. 2-S abdo D. 1-S bod 0 d t/s 5.在一定条件下,某容器中充入N 2和H 2合成NH 3,以下叙述中错误的是 A. 开始时,正反应速率最大,逆反应速率为零B. 随反应的进行,逆反应速率逐渐减小,最后正反应速率减小为0C. 随着反应的进行,逆反应速率逐渐增大,最后保持恒定D. 随着反应的进行,正反应速率逐渐减小,最后与逆反应速率相等,且都保持恒定 6.在下列四种液体中,加入少量固体二氧化锰能产生气体的是A. 蒸馏水B. 稀盐酸C. 30%双氧水D. 氯酸钾溶液7.100mL6mol/LH 2SO 4跟过量锌粉反应,一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量的A. 碳酸钠(s)B. 氢氧化钠(s)C. 硫酸钾溶液D. 硫酸铵(s)8.在温度恒定下,把2mol(a)SO 2和1mol(b)O 2或2mol(c)SO 3,通入一个定容的装有催化剂的密闭容器里反应达到平衡。
第二章 化学反应速率与化学平衡 习题-高二上学期化学人教版(2019)选择性必修1
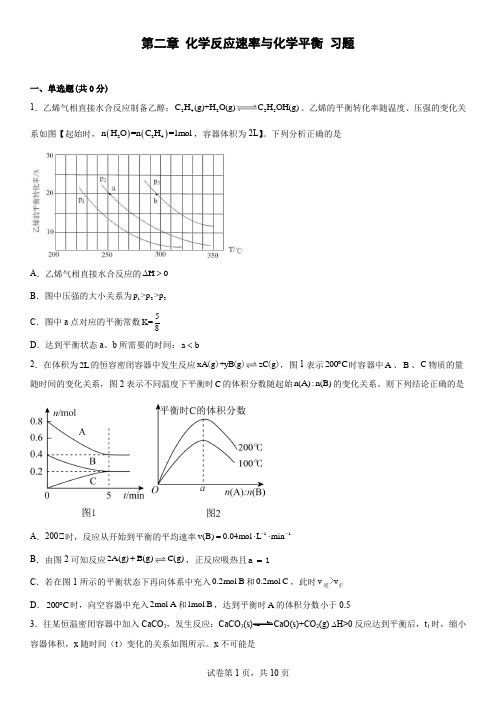
第二章 化学反应速率与化学平衡 习题一、单选题(共0分)1.乙烯气相直接水合反应制备乙醇:24225C H (g)+H O(g)C H OH(g)。
乙烯的平衡转化率随温度、压强的变化关系如图【起始时,()()224n H O =n C H =1mol ,容器体积为2L 】。
下列分析正确的是A .乙烯气相直接水合反应的H 0∆>B .图中压强的大小关系为123p >p >pC .图中a 点对应的平衡常数5K=8D .达到平衡状态a 、b 所需要的时间:a b <2.在体积为2L 的恒容密闭容器中发生反应xA g yB g zC g ()+()(),图1表示200C ︒时容器中A 、B 、C 物质的量随时间的变化关系,图2表示不同温度下平衡时C 的体积分数随起始n(A):n(B)的变化关系。
则下列结论正确的是A .200℃时,反应从开始到平衡的平均速率11v(B)0.04mol L min --=⋅⋅B .由图2可知反应2A(g)B(g)C(g)+,正反应吸热且a 1=C .若在图1所示的平衡状态下再向体系中充入0.2mol B 和0.2mol C ,此时逆正v >vD .200C ︒时,向空容器中充入2mol A 和1mol B ,达到平衡时A 的体积分数小于0.5 3.往某恒温密闭容器中加入CaCO 3,发生反应:CaCO 3(s)CaO(s)+CO 2(g) ∆H>0反应达到平衡后,t 1时,缩小容器体积,x 随时间(t )变化的关系如图所示。
x 不可能是A .v 逆B .c(CO 2)C .∆HD .ρ(容器内气体密度)4.下列叙述及解释正确的是 A .2242NO (g)(红棕色)N O (g)(无色) 0H ∆<,在达到平衡后,对平衡体系采取缩小容积、增大压强的措施,因为平衡向正反应方向移动,故体系颜色变浅 B .22H (g)+I (g)2HI(g) 0H ∆<,在达到平衡后,对平衡体系采取增大容积、减小压强的措施,因为平衡不移动,故体系颜色不变 C .22C(s)+O (g)2CO(g),在达到平衡后,加入碳,平衡向正反应方向移动D .223N (g)+3H (g)2NH (g),在达到平衡后,保持压强不变,充入2O ,平衡向左移动5.甲苯(用C 7H 8表示)是一种挥发性的大气污染物。
人教版高中化学选择性必修1第二章化学反应速率与化学平衡第二节化学平衡第1课时化学平衡状态练习含答案

第二章化学反应速率与化学平衡第二节化学平衡第1课时化学平衡状态基础过关练题组一化学平衡状态的理解与应用1.如图是可逆反应X(g)+3Y(g) 2Z(g)在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是()A.t2~t3时,各物质的浓度不再发生变化B.t2时,反应未达到限度C.t2~t3时,反应已停止进行D.t1时,反应只向正反应方向进行2.(经典题)(2023黑龙江铁人中学月考)在密闭容器中进行反应:X2(g)+Y2(g) 2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.2 mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度可能是()A.X2为0.2 mol·L-1B.Y2为0.2 mol·L-1C.Z为0.3 mol·L-1D.Z为0.45 mol·L-13.(2024江苏苏州月考)向容积为1 L的密闭容器中通入一定量N2O4和NO2的混合气体,发生反应N2O4(g) 2NO2(g)ΔH>0。
体系中各物质浓度随时间的变化如图所示。
下列有关说法正确的是()A.64 s时,反应达到化学平衡状态B.达到化学平衡前,混合气体的颜色逐渐变深C.容器中气体的总物质的量浓度最多为2.6 mol·L-1D.若该容器与外界无热传递,则反应达到平衡前,容器内气体的温度逐渐升高题组二化学平衡状态的判断4.工业上用化学气相沉积法制备氮化硅,其反应为3SiCl4(g)+2N2(g)+6H2(g) Si3N4(s)+12HCl(g)。
一定条件下,在恒容密闭容器中,能表示上述反应达到化学平衡状态的是()A.3v(N2)=v(H2)B.v正(HCl)=4v正(SiCl4)C.混合气体密度保持不变D.c(N2)∶c(H2)∶c(HCl)=1∶3∶65.(2023河北省示范高中期中)一定温度下,在恒容密闭容器中发生反应C2H4(g)+H2(g) C2H6(g)ΔH<0。
第二章 化学反应速率与化学平衡 分层习题2022—2023学年上学期高二化学

第二章化学反应速率与化学平衡分层习题含答案2022—2023学年上学期高二化学人教(2019)选择性必修一一、选择题。
(18题)1、在四种不同条件下测得反应2SO2+O22SO3的反应速率如下表所示:编号(1) (2) (3) (4)v(SO2) v(O2) v(SO3) v(O2)0.4 0.25 0.5 0.3其中反应速率最大的是()A.(1)B.(2)C.(3)D.(4)2、A2(g)+B2(g)=2AB(g),ΔH >0。
下列因素能使活化分子百分数增加的是()A. 降温B. 使用催化剂C. 增大反应物浓度D. 增大气体的压强3、下列事实能说明影响化学反应速率的主要因素是反应物自身性质的是( )A. Cu能与浓硝酸反应,但不能与浓盐酸反应B. Fe与浓盐酸反应比与稀盐酸反应快C. N2与O2在常温、常压下不反应,放电时可反应D. Cu与浓硝酸反应比与稀硝酸反应快4、对可逆反应4NH3(g)+5O2(g)4NO(g)+6H2O(g),下列叙述正确的是() A.达到化学平衡时,若增加容器体积,则正反应速率增大,逆反应速率减少B.化学反应速率关系是:2v正(NH3)=3v正(H2O)C.达到化学平衡时,4v正(O2)=5v逆(NO)D.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态5、在一定条件下,向密闭容器中充入30 mL CO和20 mL水蒸气,使其发生反应CO(g)+H2O(g)CO2(g)+H2(g)并达到平衡时,水蒸气的体积分数与H2的体积分数相等,则下列叙述错误的是()A.平衡后CO的体积分数为40%B.平衡后CO的转化率为25%C.平衡后水的转化率为50%D.平衡后混合气体的平均相对分子质量为246、下列措施或事实不能用勒夏特列原理解释的是()A.H2、I2(g)、HI平衡混合气体加压后颜色变深(已知:H2+I22HI) B.红棕色的NO2加压后颜色先变深后变浅(已知:2NO2 (g)N2O4 (g)) C.工业上生产硫酸的过程中,使用过量的空气以提高SO2的利用率D.滴加酚酞的氨水中加入氯化铵固体后红色变浅7、配制硫酸铝溶液时,为得到澄清的溶液经常在配制过程中加入少量的()A. H2OB. NaOH溶液C. H2SO4溶液D. Na2SO4溶液8、二氧化碳的捕捉与封存是实现温室气体减排的重要途径之一,也是未来实现低碳经济转型的重要环节。
第二章 化学反应速率与化学平衡 测试题 2022-2023学年高二上学期化学
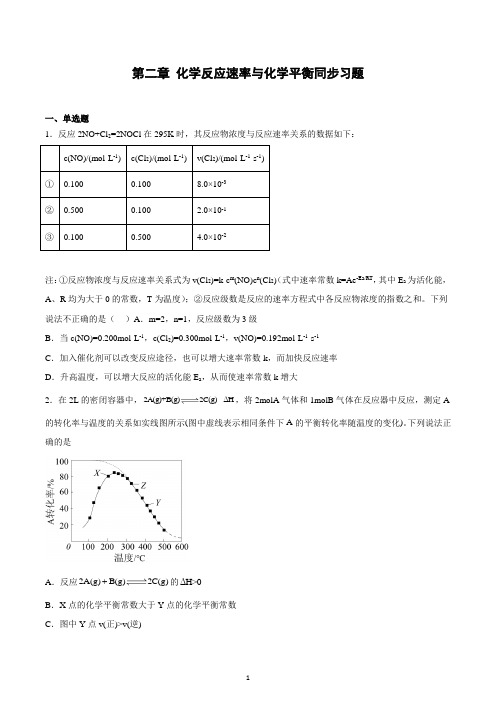
第二章化学反应速率与化学平衡同步习题一、单选题1.反应2NO+Cl2=2NOCl在295K时,其反应物浓度与反应速率关系的数据如下:注:①反应物浓度与反应速率关系式为v(Cl2)=k·c m(NO)c n(Cl2)(式中速率常数k=Ae-Ea/RT,其中E a为活化能,A、R均为大于0的常数,T为温度);②反应级数是反应的速率方程式中各反应物浓度的指数之和。
下列说法不正确的是()A.m=2,n=1,反应级数为3级B.当c(NO)=0.200mol·L-1,c(Cl2)=0.300mol·L-1,v(NO)=0.192mol·L-1·s-1C.加入催化剂可以改变反应途径,也可以增大速率常数k,而加快反应速率D.升高温度,可以增大反应的活化能E a,从而使速率常数k增大2.在2L的密闭容器中,2A(g)+B(g)2C(g)ΔH,将2molA气体和1molB气体在反应器中反应,测定A 的转化率与温度的关系如实线图所示(图中虚线表示相同条件下A的平衡转化率随温度的变化)。
下列说法正确的是的ΔH>0A.反应2A(g)B(g)2C(g)B.X点的化学平衡常数大于Y点的化学平衡常数C.图中Y点v(正)>v(逆)D .图中Z 点,增加B 的浓度不能提高A 的转化率3.100mL6mol/LH 2SO 4跟过量的锌粉反应,在一定温度下,为了减缓反应速率,但又不影响生成氢气的总量。
可向反应物中加入适量的 A .碳酸钠(固体)B .水C .硫酸铜溶液D .硫酸铵(固体)4.化学反应进行的方向是一个比较复杂的问题。
下列有关说法正确的是 A .反应3224SO (g)H O(1)H SO (l)+=的ΔS>0B .1mol 2CO 在不同状态时的熵值:[][]22S CO (g)<S CO (s)C .反应25222N O (g)4NO (g)O (g)=+H 0∆>能否自发进行与温度有关D .H 0∆<或ΔS>0的反应一定能自发进行 5.合成氨反应为223N (g)+3H (g)2NH (g) 1ΔH=92.4kJ mol --⋅。
第二章 化学平衡习题

第二章 化学平衡习题一.选择题 1. 下列反应Kc 的单位是( ) 2.2X(g)+2Y(g)=3Z(g)A L·mol -1B mol·L -1C L 2·mol 2D mol 2·mol -23.下列哪一个反应的Kc 和Kp 的数值相等( ) A. 3H 2(g)+N 2(g)=2NH 3(g) B. H 2(g)+I 2(g)=2HI(g) C. CaCO 3(s)=CaO(s)+CO 2(g) D. 2F 2(g)+2H 2O(l)=2HF(g)+O 2(g) 4.一定条件下,合成氨反应呈平衡状态, 3H 2+N 2=2NH 3-------K 1 32 H 2+12 N 2=NH 3--------K 2 则K 1与K 2的关系为( ) A. K 1=K 2 B. K 22=K 1 C. K 12 = K 2 D. 无法确定 5.已知: 2SO 2+O 2=2SO 3反应达平衡后,加入V 2O 5催化剂,则SO 2的转化率( ) A. 增大 B. 不变 C. 减小 D. 无法确定6. 正反应能自发进行和反应达平衡的条件分别为( ) A. Qp>Kp ,△G<0 B. Qp>Kp ,△G>0 C. Qp<Kp ,△G<0 D. Qp<Kp ,△G>0 E. Qp=Kp ,△G=07. 醋酸铵在水中存在着如下平衡:NH 3+H 2O NH 4+ + OH - -------K 1 HAc+H 2O Ac - + H 3O + -------K 2 NH 4+ + Ac - HAc + NH 3 -------K 3 2H 2OH 3O + + OH - --------K 4以上四个反应平衡常数之间的关系是( ) A. K 3=K 1K 2K 4 B. K 4=K 1K 2K 38.可逆反应,C(s)+H 2OCO(g)+H 2(g) △H>0,下列说法正确的是( )A. 达到平衡时,反应物的浓度和生成物的浓度相等B. 达到平衡时,反应物和生成物的浓度不随时间的变化而变化C. 由于反应前后分子数相等,所以增加压力对平衡没有影响D . 加入正催化剂可以加快反应达到平衡的速度E. 升高温度使V 正增大,V 逆减小,结果平衡向右移动 9.合成氨反应: N 2(g)+3H 2(g)2NH 3(g)的平衡常数3N NH p2H23p p p K =:当体系总压力增大一倍时,同温下重新建立平衡,此时:3H N 2NH p 223'p 'p 'p 'K =, K p 与K p ’ 的关系为( )A. K p =1/4K p ’B. K p =4K p ’C. K p =K p ’D. K p 与K p ’没有如上关系10. 下列因素对转化率无影响的是( )A. 温度B. 浓度C. 压力(对气相反应)D. 催化剂11. 反应物的浓度相同,反应温度相同,反应:(1) mA + nBpC (2) X+2YZ对A 和X 而言,转化率大的是( )A. X>AB. A>XC. X=AD. 无法确定 12. 反应: A(g)+B(s)C(g),在400K 时,平衡常数Kp=0.5.当平衡时,体系总压力为100kPa 时,A的转化率是( )A. 50%B. 33%C. 66%D. 15%13. 已知反应N 2O 4(g)→2NO 2(g)在873K 时,K 1=1.78×104,转化率为a%,改变条件,并在1273K 时,K 2=2.8×104,转化率为b%(b>a),则下列叙述正确的是( ) A. 由于1273K 时的转化率大于873K 时的,所以此反应为吸热反应 B. 由于K 随温度升高而增大,所以此反应的△H>0 C. 由于K 随温度升高而增大,所以此反应的△H<0 D. 由于温度不同,反应机理不同,因而转化率不同 14. 在276K时反应: CO(g)+H 2O(g)CO 2(g)+H 2(g)的Kc=2.6,当CO(g)与H 2O(g)的浓度(mol·L -1)以何种比例(与下列各组数据接近的)混合时,可得到90%的CO 的转化率( )15.对于反应: C(S)+H2O(g) = CO(g)+H2(g),△H>0,为了提高C(S)的转化率,可采取的措施是( )A. 升高反应温度B. 降低反应温度C. 增大体系的总压力D. 增大H2O(g)的分压E. 多加入C(S)16.反应: 2SO2(g)+O2(g) 2SO3(g),△H<0,根据勒夏特列原理,和生产的实际要求,在硫酸生产中,下列哪一个条件是不适宜的( )A. 选用V2O5作催化剂B. 空气过量些C. 适当的压力和温度D. 低压,低温17.下列反应处于平衡状态,2SO2(g)+O2(g) 2SO3(g) △H=-200kJ·mol-1,欲提高平衡常数Kc的值,应采取的措施是( )A. 降低温度B. 增大压力C. 加入氧气D. 去掉三氧化硫17.下列叙述正确的是( )A. 在化学平衡体系中加入惰性气体,平衡不发生移动B. 在化学平衡体系中加入惰性气体,平衡发生移动C. 恒压下,在反应之后气体分子数相同的体系中加入惰性气体,化学平衡不发生移动D. 在封闭体系中加入惰性气体,平衡向气体分子数减小的方向移E. 在封闭体系中加入惰性气体,平衡向气体分子数增多的方向移动18.下列关于催化剂作用的叙述中错误的为( )i.可以加速某些反应的进行B. 可以抑制某些反应的进行C. 可以使正逆反应速度以相等的速度加快D. 可以改变反应进行的方向19.勒沙特列原理( )A. 只适用于气体间的反应B. 适用所有化学反应C,只限于平衡时的化学反应 D. 适用于平衡状态下的所有体系a)一定温度下反应: PCl5(g) PCl3(g)+Cl2(g)达平衡时,此时已有50%的PCl5分解,下列方法可使PCl5分解程度增大的是( )A. 体积增大一倍B. 保持体积不变,加入氮气使总压力增大一倍C. 保持总压不变,加入氮气使总体积增大一倍D. 增大PCl5的分压E. 降低PCl5的分压20.已知下列反应的平衡常数,H2(g)+S(s) H2S(g) (1) K1S(s)+O2(g) SO2(g) (2) K2则反应: H2(g)+SO2(g) O2(g)+H2S(g) 和反应: SO2S(s)+O2(g)的平衡常数分别为( )A. 1/K1B. 1/K2C. K1-K2D. K2/K1E. K1/K2二.填空题1.已知:(1) H2O(g)=H2(g)+12 O2(g),Kp=8.73×10-11(2) CO2(g)=CO(g)+ 12 2O2(g),Kp=6.33×10-11则反应: CO2(g)+H2(g)=CO(g)+H2O(g)的Kp为_________,Kc为__________2.298K时,HBr(aq)离解反应的△Gø=-58kJ·mol-1,其Ka应为__________由Ka的数值说明_______3.1073K时,反应: CO(g)+H2O(g) CO2(g)+H2(g)的Kc=1,在最初含有1.0molCO(g)和1.0molH2O(g)的混合物经反应达到平衡时,CO的物质的量为___mol,其转化率为________________ 4.已知反应: A(g)+B(g) C(g)+D(g)在450K时Kp=4,当平衡压力为100kPa时,且反应开始时,A与B的物质的量相等,则A的转化率为_____________,C物质的分压(kPa)为__________5.下列反应处于平衡状态,X(g)+Y(g) 4Z(g) △H=-45kJ·mol-1当同时升高温度加入正催化剂时,正反应速度将___________,化学平衡将___________.6.反应: (a) C+H2O CO+H2 (b) 3H2+N22NH3,在密闭容器中进行,且呈平衡状态,当温度不变时,在上述反应里加入氮气以增加总压力,对反应(a)将_______________,对反应(b)将_____________三.问答题1.乙酸和甲醇可按下式反应:CH3COOH+CH3OH CH3COOCH3+H2O298K时K C=4,经过计算,(1)反应物均为1mol,(2)甲醇为1mol,乙酸为3mol时甲醇的转化率?对结果作出解释.2.对反应: mA+nB pC,△H<0 ,升高温度,对反应速度和化学平衡有何影响. 为什么?3.催化剂能影响反应速度,但不能影响化学平衡,为什么?4.简述在合成氨生产中: N2(g)+3H2(g)2NH3(g). △Hø=-92.4KJ·mol-1,工业上采用温度控制在673---773K,而不是更低些,压力控制在30390kPa而不是更高?四.计算题1.在某温度下密闭容器中发生如下反应: 2A(g)+B(g) 2C(g),若将2molA和1molB反应,测得即将开始和平衡时混合气体的压力分别为3×105Pa.和2.2×105Pa,则该条件下A的转化率为多少?平衡常数Kp是多少?2.已知某反应在25℃时,K p=5.0×1017,求此反应的△Gø.3.把3体积H2和1体积N2混合加热,在10Pø条件下,达到平衡,其中NH3含3.85%(体积百分数).计算:当压力为50Pø时NH3占的体积百分数.(Pø=101.3 kPa)4.反应: CO+H2O CO2+H2(均为气体)达到平衡时,Pco=40kPa ,P CO2=40kPa,P H2= 12kPa,P H2O =20kPa,在恒温恒容下通入CO气体,P H2=17 kPa,试计算新平衡下各气体的分压.5.设H2,N2和NH3在达平衡时总压力为500kPa,N2的分压为100kPa,此时H2的物质的量的分数为0.40,试计算下列几种情况的Kp值.1. N2(g)+3H2(g) 2NH3(g) K p12. NH3(g) N2(g)+3H2(g) K p26.已知反应: PCl5(g) PCl3(g)+Cl2(g)523K时在2L容器中的0.7molPCl5有0.5mol分解了,计算:(1) 该温度下反应的K c和K p(2) 若在上述密闭容器中又加入0.1molCl2, PCl5的分解百分率是多少.第二章化学平衡习题答案一.选择题1. A2. B3. B4. B5. C E6. B7. B D8. C9. D 10. D 11. B 12. B 13. C 14. A D 15. D 16. A 17. C D 18. D 19. D 20. A C 二.填空题1.7.25×10-17.25×10-12. 1.46×1010HBr(aq)离解的很完全3.0.5mol 50%4.67% 33.35.加快向左移动6.无影响使平衡右移三.问答题1.答:(1) CH3COOH + CH3OH CH3COOCH3 + H2O始: 1 1 0 0平: 1-X 1-X X XX2(1-X)2= K C = 4 X=0.67α1=0.671×100%=67%(2) y2/(1-y)(3-y)=K c=4,y=0.9 α2=90%α2>α1,是由乙酸的浓度增大,使平衡右移导致甲醇的转化率升高2.答: 升高温度,可以加快正逆反应的反应速度,平衡将逆向移动.因升高温度使速度常数增大,反应速度则加快.(或从活化分子百分数增大,有效碰撞增多,微观角度说明).依据勒夏特列原理,升高温度,平衡向吸热方向移动.给出反应,逆向吸热,正向放热,所以平衡将逆向移动.3.答: 因为催化剂能起到改变反应历程,从而改变反应活化能的作用,所以能影响反应速度,但由于催化剂同时改变正,逆反应的活化能,同等速度的影响正,逆反应速度,而改变反应的始态和终态,所以不影响化学平衡.4. 答: 对于此反应,低温有利于提高反应物的转化率,但低温反应速度慢,使设备利用率低,单位时间合成氨量少,为使其有较高的转化率,和较快的反应速度,单位时间内合成较多的氨,常以催化剂的活性温度为该反应的控制温度.高压对合成氨有利,但压力过高对设备要求高,运转费高,因此,压力不宜过高,为了得到更多的氨,常用加压,冷却合成气的方法,以分离氨,使平衡右移.四.计算题 1.解:2A(g) + B(g)2C(g)始: 2×105 1×105 0平: (2×105-X) (1×105-1/2X) X 有 (2×105-X)+(1×105-1/2X)+X=2.2×105 X=1.6×105(Pa) =1.6×1052×105×100%=80% K=P C 2P A 2P B= 1.6×105(0.4×105)(0.2×105) =8×10-4 2.解:∵ △G ø=-2.30RTlgK p∴ △G ø=-2.30×8.31×(273+25)×lg5.0×1017=100813(J·mol -1) =1.008×102(kJ·mol -1)3.解:平衡时,P(NH 3)=10×3.85%=0.385P ø P(N 2)=10-0.3854 =2.40P øP(H 2) =3P(N 2) = 7.2P ø K p =P(NH 3)/P(H 2)P(N 2) = 0.3857.2×2.4= 1.65×10-4设50P ø时,NH 3占X P=50XP ø P(N 2) =504(1-X)=(12.5-12.5X)P øP(H 2) =(37.5-37.5X)P ø(50X)(37.5-37.5X)3(12.5-12.5X)= 1.65×10-4X=0.15 NH 3占15%. 4.解:K P =OH CO CO H 222p p p p =40×1240×20=0.6 恒容下通入CO 使P(H 2)增大 17-12=5(kPa)P’(CO 2)= 40+5 = 45(kPa) P’(H 2O) = 20-5=15(kPa)K P =OH CO CO H 222p p p pP ’CO =pO H CO H K p p p 222 =17×450.6×15=85(kPa) 5. 解:N 2的物质的量的分数为100500=0.2,则NH 3的为1-0.2-0.4=0.4 则P=500×0.4=200kPa , P(H 2)=500×0.4=200kPa(1) K p1=P(NH 3)/[P(H 2)P(N 2) =200200×100 =5×10-5(2) K p2=1K=1.4×1026.解:(1) PCl 5 PCl 3 + Cl 2平衡:0.7-0.520.5/2 0.5/2 (mol/L) 即: 0.1 0.25 0.25 K c =[PCl 3][Cl 2][PCl 5] = (0.25)0.1= 0.625K p = K c (RT)2 -11= 0.625(0.082×523)1 = 26.8 (2) 设有X mol 转化为PCl 5 PCl 5PCl 3 + Cl 2平衡:0.1+X 2 0.25-X 2 0.25+(0.1-X)20.25-X20.3-X 20.1+X2= 0.625 解,得: X = 0.045 (mol)PCl5的分解百分率为: 0.25-X2×20.70×100% =65%。
高二化学选择性必修一第二章化学反应速率与化学平衡练习题

故选D。
4.C
【详解】A.对比A、B两点,升高温度Y的体积分数增加,说明反应正向吸热, ,故A错误;
B.对比A、C两点,增大压强Y的体积分数减小,说明反应正向体积增大, ,故B错误;
C.对比A、B两点,升高温度Y的体积分数增加,相同温度下平衡常数相等,有 ,故C正确;
故选D。
3.D
【详解】①浓氨水加入NaOH固体,NaOH固体溶解放热,使NH3•H2O分解生成NH3,化学平衡 逆向进行,能用化学平衡移动原理解释,故不选;
②合成氨反应为放热反应,低于利于合成氨正向进行, 左右比室温更有利于合成氨的反应,是因为此时催化剂活性最大,不能用勒夏特列原理解释,故选;
③啤酒中存在如下平衡:H2O+CO2(g)⇌H2CO3(aq),开启啤酒瓶后,气体压强减小,平衡逆向移动,瓶中马上泛起大量泡沫,则开启啤酒瓶后,瓶中马上泛起大量泡沫能用平衡移动原理解释,故不选;
B.将食物放进冰箱使温度降低,食物变质的速率变慢,B错误;
C.工业合成氨时加入催化剂,使用催化剂可以加快反应速率,C正确;
D.向食品袋中加入脱氧剂可以减少氧气含量,降低氧气浓度,减少反应速率,D错误;
答案选C。
7.C
【详解】A.*CO→CO的活化能低于*CO→CH2O的活化能,因此相对较多的副产物为CO,故A正确;
⑥晒自来水养小金鱼
⑦硫酸工业中的重要反应 ,工业上常加入 做催化剂
A.②⑤⑥B.①⑤⑦C.②⑦D.②⑤⑦
4.反应 ,在不同温度下的平衡体系中物质Y的体积分数随压强变化的曲线如图所示。下列说法正确的是
A.该反应的 B.
C.B、C两点化学平衡常数: D.A、C两点的反应速率
化学平衡移动练习题(含答案)

第二章第三节化学平衡移动练习题(1)一、选择题1.对已达平衡状态的反应:2X(g)+Y(g)2Z(g),减小压强时,下列说法正确的是()A.逆反应速率增大,正反应速率减小,平衡向逆反应方向移动B.逆反应速率减小,正反应速率增大,平衡向正反应方向移动C.正、逆反应速率都减小,平衡向逆反应方向移动D.正、逆反应速率都增大,平衡向正反应方向移动2.在一定条件下,可逆反应:N 2(g)+3H2(g)2NH3(g) △H<0,达到平衡时,当单独改变下列条件后,有关叙述错误的是()A.加催化剂υ(正)、υ(逆)都发生变化且变化的倍数相等B.加压,υ(正)、υ(逆)都增大,且υ(正)增大倍数大于υ(逆)增大倍数C.降温,υ(正)、υ(逆)都减小,且υ(正)减小倍数小于υ(逆)减小倍数D.在体积不变时加入氩气,υ(正)、υ(逆)都增大,且υ(正)增大倍数大于υ(逆)增大倍数3.下列说法正确的是() A.可逆反应的特征是正反应速率总是和逆反应速率相等B.其他条件不变时,使用催化剂只改变反应速率,而不能改变化学平衡状态C.在其他条件不变时,升高温度可以使化学平衡向放热反应的方向移动D.在其他条件不变时,增大压强一定会破坏气体反应的平衡状态4.对于任何一个平衡体系,采取下列措施后,一定会使平衡移动的是()A.加入一种反应物 B.对平衡体系加压C.升高温度 D.使用催化剂5.对平衡CO 2(g)CO2(aq) △H= -19.75 kJ/mol,为增大二氧化碳气体在水中的溶解度,应采用的方法是()A.升温增压B.降温减压 C.升温减压D.降温增压6.2007年10月10日,德国科学家格哈德·埃尔特生日的当天获得了诺贝尔化学奖,以奖励他在表面化学领域做出开拓性的贡献。
合成氨反应在铁催化剂表面进行时效率显着提高,就是埃尔特的研究成果,下列关于合成氨反应的叙述中正确的是()A.铁做催化剂可加快反应速率,且有利于平衡向合成氨的方向移动B.将氨气从混合气中分离,可加快反应速率,且有利于平衡向合成氨的方向移动C.升高温度可加快反应速率,且有利于平衡向合成氨的方向移动D.增大压强可加快反应速率,且有利于平衡向合成氨的方向移动7.关于催化剂的叙述,正确的是()A.催化剂在化学反应前后性质不变B.催化剂在反应前后质量不变,故催化剂不参加化学反应C.使用催化剂可以改变反应达到平衡的时间D.催化剂可以提高反应物的转化率8.对于可逆反应2A2(g)+B22B(1)(正反应为放热反应)达到平衡,要使正、逆反应的速率都增大,而且平衡向右移动,可以采取的措施是()A.升高温度B.降低温度C.增大压强D.减小压强9.在一容积固定的密闭容器中,反应 2SO2(g)+O2(g) 2SO3(g)达平衡后,再通入18O2气体,重新达平衡。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第二章 化学平衡习题一.选择题 1. 下列反应Kc 的单位是( ) 2.2X(g)+2Y(g)=3Z(g)A L·mol -1B mol·L -1C L 2·mol 2D mol 2·mol -23.下列哪一个反应的Kc 和Kp 的数值相等( ) A. 3H 2(g)+N 2(g)=2NH 3(g) B. H 2(g)+I 2(g)=2HI(g) C. CaCO 3(s)=CaO(s)+CO 2(g) D. 2F 2(g)+2H 2O(l)=2HF(g)+O 2(g) 4.一定条件下,合成氨反应呈平衡状态, 3H 2+N 2=2NH 3-------K 1 32 H 2+12 N 2=NH 3--------K 2 则K 1与K 2的关系为( ) A. K 1=K 2 B. K 22=K 1 C. K 12 = K 2 D. 无法确定 5.已知: 2SO 2+O 2=2SO 3反应达平衡后,加入V 2O 5催化剂,则SO 2的转化率( ) A. 增大 B. 不变 C. 减小 D. 无法确定6. 正反应能自发进行和反应达平衡的条件分别为( ) A. Qp>Kp ,△G<0 B. Qp>Kp ,△G>0 C. Qp<Kp ,△G<0 D. Qp<Kp ,△G>0 E. Qp=Kp ,△G=07. 醋酸铵在水中存在着如下平衡:NH 3+H 2O NH 4+ + OH - -------K 1 HAc+H 2O Ac - + H 3O + -------K 2 NH 4+ + Ac - HAc + NH 3 -------K 3 2H 2OH 3O + + OH - --------K 4以上四个反应平衡常数之间的关系是( ) A. K 3=K 1K 2K 4 B. K 4=K 1K 2K 38.可逆反应,C(s)+H 2OCO(g)+H 2(g) △H>0,下列说法正确的是( )A. 达到平衡时,反应物的浓度和生成物的浓度相等B. 达到平衡时,反应物和生成物的浓度不随时间的变化而变化C. 由于反应前后分子数相等,所以增加压力对平衡没有影响D . 加入正催化剂可以加快反应达到平衡的速度E. 升高温度使V 正增大,V 逆减小,结果平衡向右移动 9.合成氨反应: N 2(g)+3H 2(g)2NH 3(g)的平衡常数3N NH p2H23p p p K =:当体系总压力增大一倍时,同温下重新建立平衡,此时:3H N 2NH p 223'p 'p 'p 'K =, K p 与K p ’ 的关系为( )A. K p =1/4K p ’B. K p =4K p ’C. K p =K p ’D. K p 与K p ’没有如上关系10. 下列因素对转化率无影响的是( )A. 温度B. 浓度C. 压力(对气相反应)D. 催化剂11. 反应物的浓度相同,反应温度相同,反应:(1) mA + nBpC (2) X+2YZ对A 和X 而言,转化率大的是( )A. X>AB. A>XC. X=AD. 无法确定 12. 反应: A(g)+B(s)C(g),在400K 时,平衡常数Kp=.当平衡时,体系总压力为100kPa 时,A 的转化率是( )A. 50%B. 33%C. 66%D. 15%13. 已知反应N 2O 4(g)→2NO 2(g)在873K 时,K 1=×104,转化率为a%,改变条件,并在1273K 时,K 2=×104,转化率为b%(b>a),则下列叙述正确的是( )A. 由于1273K 时的转化率大于873K 时的,所以此反应为吸热反应B. 由于K 随温度升高而增大,所以此反应的△H>0C. 由于K 随温度升高而增大,所以此反应的△H<0D. 由于温度不同,反应机理不同,因而转化率不同 14. 在276K时反应: CO(g)+H 2O(g)CO 2(g)+H 2(g)的Kc=,当CO(g)与H 2O(g)的浓度(mol·L -1)以何种比例(与下列各组数据接近的)混合时,可得到90%的CO 的转化率( )15.对于反应: C(S)+H2O(g) = CO(g)+H2(g),△H>0,为了提高C(S)的转化率,可采取的措施是( )A. 升高反应温度B. 降低反应温度C. 增大体系的总压力D. 增大H2O(g)的分压E. 多加入C(S)16.反应: 2SO2(g)+O2(g) 2SO3(g),△H<0,根据勒夏特列原理,和生产的实际要求,在硫酸生产中,下列哪一个条件是不适宜的( )A. 选用V2O5作催化剂B. 空气过量些C. 适当的压力和温度D. 低压,低温17.下列反应处于平衡状态,2SO2(g)+O2(g) 2SO3(g) △H=-200kJ·mol-1,欲提高平衡常数Kc的值,应采取的措施是( )A. 降低温度B. 增大压力C. 加入氧气D. 去掉三氧化硫17.下列叙述正确的是( )A. 在化学平衡体系中加入惰性气体,平衡不发生移动B. 在化学平衡体系中加入惰性气体,平衡发生移动C. 恒压下,在反应之后气体分子数相同的体系中加入惰性气体,化学平衡不发生移动D. 在封闭体系中加入惰性气体,平衡向气体分子数减小的方向移E. 在封闭体系中加入惰性气体,平衡向气体分子数增多的方向移动18.下列关于催化剂作用的叙述中错误的为( )i.可以加速某些反应的进行B. 可以抑制某些反应的进行C. 可以使正逆反应速度以相等的速度加快D. 可以改变反应进行的方向19.勒沙特列原理( )A. 只适用于气体间的反应B. 适用所有化学反应C,只限于平衡时的化学反应 D. 适用于平衡状态下的所有体系a)一定温度下反应: PCl5(g) PCl3(g)+Cl2(g)达平衡时,此时已有50%的PCl5分解,下列方法可使PCl5分解程度增大的是( )A. 体积增大一倍B. 保持体积不变,加入氮气使总压力增大一倍C. 保持总压不变,加入氮气使总体积增大一倍D. 增大PCl5的分压E. 降低PCl5的分压20.已知下列反应的平衡常数,H2(g)+S(s) H2S(g) (1) K1S(s)+O2(g) SO2(g) (2) K2则反应: H2(g)+SO2(g) O2(g)+H2S(g) 和反应: SO2S(s)+O2(g)的平衡常数分别为( )A. 1/K1B. 1/K2C. K1-K2D. K2/K1E. K1/K2二.填空题1.已知:(1) H2O(g)=H2(g)+12 O2(g),Kp=×10-11(2) CO2(g)=CO(g)+ 12 2O2(g),Kp=×10-11则反应: CO2(g)+H2(g)=CO(g)+H2O(g)的Kp为_________,Kc为__________2.298K时,HBr(aq)离解反应的△Gø=-58kJ·mol-1,其Ka应为__________由Ka的数值说明_______3.1073K时,反应: CO(g)+H2O(g) CO2(g)+H2(g)的Kc=1,在最初含有(g)和(g)的混合物经反应达到平衡时,CO的物质的量为___mol,其转化率为________________4.已知反应: A(g)+B(g) C(g)+D(g)在450K时Kp=4,当平衡压力为100kPa时,且反应开始时,A与B的物质的量相等,则A的转化率为_____________,C物质的分压(kPa)为__________5.下列反应处于平衡状态,X(g)+Y(g) 4Z(g) △H=-45kJ·mol-1当同时升高温度加入正催化剂时,正反应速度将___________,化学平衡将___________.6.反应: (a) C+H2O CO+H2 (b) 3H2+N22NH3,在密闭容器中进行,且呈平衡状态,当温度不变时,在上述反应里加入氮气以增加总压力,对反应(a)将_______________,对反应(b)将_____________三.问答题1.乙酸和甲醇可按下式反应:CH3COOH+CH3OH CH3COOCH3+H2O298K时K C=4,经过计算,(1)反应物均为1mol,(2)甲醇为1mol,乙酸为3mol时甲醇的转化率?对结果作出解释.2.对反应: mA+nB pC,△H<0 ,升高温度,对反应速度和化学平衡有何影响. 为什么?3.催化剂能影响反应速度,但不能影响化学平衡,为什么?4.简述在合成氨生产中: N2(g)+3H2(g)2NH3(g). △Hø=·mol-1,工业上采用温度控制在673---773K,而不是更低些,压力控制在30390kPa而不是更高?四.计算题1.在某温度下密闭容器中发生如下反应: 2A(g)+B(g) 2C(g),若将2molA和1molB反应,测得即将开始和平衡时混合气体的压力分别为3×105Pa.和×105Pa,则该条件下A的转化率为多少?平衡常数Kp是多少?2.已知某反应在25℃时,K p=×1017,求此反应的△Gø.3.把3体积H2和1体积N2混合加热,在10Pø条件下,达到平衡,其中NH3含%(体积百分数).计算:当压力为50Pø时NH3占的体积百分数.(Pø= kPa)4.反应: CO+H2O CO2+H2(均为气体)达到平衡时,Pco=40kPa ,P CO2=40kPa,P H2= 12kPa,P H2O =20kPa,在恒温恒容下通入CO气体,P H2=17 kPa,试计算新平衡下各气体的分压.5.设H2,N2和NH3在达平衡时总压力为500kPa,N2的分压为100kPa,此时H2的物质的量的分数为,试计算下列几种情况的Kp值.1. N2(g)+3H2(g) 2NH3(g) K p12. NH3(g) N2(g)+3H2(g) K p26.已知反应: PCl5(g) PCl3(g)+Cl2(g)523K时在2L容器中的有分解了,计算:(1) 该温度下反应的K c和K p(2) 若在上述密闭容器中又加入, PCl5的分解百分率是多少.第二章化学平衡习题答案一.选择题1. A2. B3. B4. B5. C E6. B7. B D8. C9. D 10. D 11. B 12. B13. C 14. A D 15. D 16. A17. C D 18. D 19. D 20. A C二.填空题1.×10-1×10-12.×1010HBr(aq)离解的很完全3.50%4.67%5.加快向左移动6.无影响使平衡右移三.问答题1.答:(1) CH3COOH + CH3OH CH3COOCH3 + H2O始: 1 1 0 0平: 1-X 1-X X XX2(1-X)2= K C = 4 X=α1=错误!×100%=67%(2) y2/(1-y)(3-y)=K c=4,y= α2=90%α2>α1,是由乙酸的浓度增大,使平衡右移导致甲醇的转化率升高2.答: 升高温度,可以加快正逆反应的反应速度,平衡将逆向移动.因升高温度使速度常数增大,反应速度则加快.(或从活化分子百分数增大,有效碰撞增多,微观角度说明).依据勒夏特列原理,升高温度,平衡向吸热方向移动.给出反应,逆向吸热,正向放热,所以平衡将逆向移动.3.答: 因为催化剂能起到改变反应历程,从而改变反应活化能的作用,所以能影响反应速度,但由于催化剂同时改变正,逆反应的活化能,同等速度的影响正,逆反应速度,而改变反应的始态和终态,所以不影响化学平衡.4.答: 对于此反应,低温有利于提高反应物的转化率,但低温反应速度慢,使设备利用率低,单位时间合成氨量少,为使其有较高的转化率,和较快的反应速度,单位时间内合成较多的氨,常以催化剂的活性温度为该反应的控制温度.高压对合成氨有利,但压力过高对设备要求高,运转费高,因此,压力不宜过高,为了得到更多的氨,常用加压,冷却合成气的方法,以分离氨,使平衡右移. 四.计算题 1.解:2A(g) + B(g)2C(g)始: 2×105 1×105 0平: (2×105-X) (1×105-1/2X) X 有 (2×105-X)+(1×105-1/2X)+X=×105 X=×105(Pa)=错误!×100%=80% K=P C 2P A 2P B=错误!=8×10-4 2.解:∵ △G ø= ∴ △G ø=××(273+25)××1017=100813(J·mol -1) =×102(kJ·mol -1)3.解:平衡时,P(NH 3)=10×%=ø P(N 2)=错误!=ø P(H 2) =3P(N 2) = øK p =P(NH 3)/P(H 2)P(N 2) = 错误! = ×10-4 设50P ø时,NH 3占X P=50XP ø P(N 2) =504(1-X)= =错误! = ×10-4X= NH 3占15%. 4.解:K P =OH CO CO H 222p p p p =40×1240×20= 恒容下通入CO 使P(H 2)增大 17-12=5(kPa)P’(CO 2)= 40+5 = 45(kPa) P’(H 2O) = 20-5=15(kPa)K P =OH CO CO H 222p p p pP ’CO =pO H CO H K p p p 222 =17×45×15=85(kPa) 5. 解:N 2的物质的量的分数为100500=,则NH 3的为则P =500×=200kPa , P(H 2)=500×=200kPa(1) K p1=P(NH 3)/[P(H 2)P(N 2) =200200×100 =5×10-5(2) K p2=1K=×1026.解:(1) PCl 5PCl 3 + Cl 2平衡: 错误! 2 2 (mol/L) 即: K c =[PCl 3][Cl 2][PCl 5]= 错误! =K p = K c (RT)2 -11= ×523)1 =(2) 设有X mol 转化为PCl 5 PCl 5PCl 3 + Cl 2平衡: 错误! 错误! 错误! 错误!= 解,得: X = (mol)PCl 5的分解百分率为: 错误!×100% =65%。
