铜、锌、铅、铁各含量测定方法
ICP-AES法测定铅锌混合矿中的铁、铜、砷、锌、镉、汞

ICP-AES法测定铅锌混合矿中的铁、铜、砷、锌、镉、汞陈芳;张旭龙;岳凡;付潇【摘要】采用ICP-AES同时测定铅锌混合矿中铁、铜、砷、锌、镉、汞六种元素的含量,优化了实验条件,各元素的检出限为0.0069-0.07ug/mL,相对标准偏差为0.3%-4.72%,样品加标回收率为85.5%-112.8%。
测试结果表明,该法测定铅锌矿的简单、准确、快速。
%Contents of elements(Fe,Cu,As,Zn,Cd,Hg )in Pb-Zn ore were determined by ICP—AES.The detection limts of various elements were from0.0069ug / mL to 0.07ug / mL,RSDs were between 0.3 % and 4.72 %, and recoveries were in the range of 85.5%-112.8%.The results show that the method is simple,rapid and accurate,and can be applied to determination of Pb-Zn ore.【期刊名称】《电子测试》【年(卷),期】2015(000)011【总页数】4页(P124-127)【关键词】电感耦合等离子体-原子发射光谱仪;铅锌混合矿;元素测定【作者】陈芳;张旭龙;岳凡;付潇【作者单位】新疆大学化学化工学院,新疆乌鲁木齐,830046;新疆出入境检验检疫局,新疆乌鲁木齐,830063;新疆大学化学化工学院,新疆乌鲁木齐,830046;新疆大学化学化工学院,新疆乌鲁木齐,830046【正文语种】中文铅锌矿是富含金属元素铅和锌的矿产,用途广泛,是国民经济持续增长的重要物质基础,因此,有效利用开发混合铅锌矿物中有价值金属这一资源具有重要意义和经济效益。
t1铜 杂质含量 标准

t1铜杂质含量标准T1铜是一种高纯度、低杂质含量的铜合金,被广泛应用于电子、电器、汽车等领域。
在T1铜中,杂质含量的标准是非常严格的,因为它们会直接影响铜合金的性能和质量。
以下是关于T1铜杂质含量的详细说明:一、T1铜的成分和杂质含量标准T1铜是一种含铜量高达99.95%的铜合金,其杂质含量极低,主要包括铅、铁、锌等元素。
其中,铅的含量不得超过0.003%,铁的含量不得超过0.003%,锌的含量不得超过0.002%。
这些杂质的含量超标会影响铜合金的导电性能和机械性能。
二、杂质对T1铜性能的影响1.铅的影响:铅是一种有害元素,会对人体健康造成影响。
在T1铜中,铅的含量必须严格控制,因为铅会降低铜合金的导电性能和耐腐蚀性。
此外,铅还会影响铜合金的加工性能,导致加工过程中出现堵塞等问题。
2.铁的影响:铁是T1铜中的一种杂质,其含量过高会影响铜合金的导电性能和机械性能。
铁的存在还会导致铜合金中出现微小的气孔和裂纹,从而降低其耐腐蚀性和使用寿命。
3.锌的影响:锌是一种常见的金属元素,在T1铜中含量过高也会影响其导电性能和机械性能。
锌的存在还会导致铜合金的表面出现氧化膜,从而降低其抗氧化性和耐腐蚀性。
三、T1铜杂质含量的检测方法目前,检测T1铜杂质含量的方法主要包括光谱分析和化学分析。
光谱分析是通过分析铜合金中不同元素的原子光谱来确定其含量,而化学分析则是通过化学试验和分析方法来确定杂质含量。
这些方法都需要专业的设备和专业的技术人员来完成。
四、T1铜杂质含量的控制措施为了确保T1铜的质量和性能符合要求,必须采取以下措施控制其杂质含量:1.选用高质量的原材料:选择符合标准的原材料是控制T1铜杂质含量的关键步骤。
应该选择符合要求的高纯度铜材作为基础材料,并确保其杂质含量符合标准。
2.优化生产工艺:优化生产工艺可以降低T1铜中的杂质含量。
例如,采用先进的熔炼技术和合理的浇注工艺可以减少铜合金中的气孔和裂纹数量,从而降低杂质的影响。
滴定法连续测定铅锌矿中铅锌铜

滴定法连续测定铅锌矿中铅锌铜摘要:随着国家经济的不断发展,各行各业对有色金属的需求量也不断增加。
有色金属矿石的质量直接影响着企业的经济效益,因此,矿石中各种金属含量的分析显得尤为重要。
铅锌矿是重要的有色金属矿物,它的主要组成成分是铅、锌、铜。
铅、锌和铜在不同的矿石中含量不等,有的含量高达50%以上,有的含量低至1%以下。
用滴定法连续测定铅锌矿中的铅、锌和铜,能更好地保证测定结果的准确性和可靠性,也便于进行综合分析。
关键词:铅锌矿;铅、锌、铜;测定方法;滴定法;连续测定引言:铅锌矿中铅、锌和铜的分析测定方法主要有重量法、容量法(包括滴定重量法、容量法)和滴定法。
重量法是根据化学方程式计算出铅、锌、铜的含量,重量法测定相对误差大,不能满足大批量样品检测的要求;容量法操作复杂,不适合于实验室长期连续分析;滴定法是将铅锌矿中的铅、铜分离出来,并通过一定的化学方程式计算出其含量。
滴定法操作简单,反应快,重现性好,能满足分析质量控制和管理的需要。
一、方法原理铅锌矿中的铅、锌和铜在氧化反应中发生分解,生成氧化铅、氧化锌、氧化铜等。
这些氧化物和铅、锌、铜都有络合物的存在,在分析前可先用硫酸溶解,除去部分有色物质。
铅、锌、铜含量越高,络合物越多,分析时先用硫酸将溶液中的铅锌络合生成氧化铅,然后用硫酸溶液溶解氧化铜和氧化铜,将沉淀过滤后,溶液中含有铅的成分除去。
通过分析试样中所含的铅,根据不同的化学方程式计算出各种金属的含量。
如:用硫酸溶解样品时,在水浴锅上加热后,溶液中生成较多的氧化铅和铜离子。
通过比较不同量的硫酸溶液和硫酸沉淀中含有的铅、锌、铜含量,即可计算出矿石中含铅量。
此外还可以通过氧化铅滴定锌(或铜)的终点速度来计算:先以硫酸溶解样品后加入硫酸溶液,然后滴定终点时滴定速度为10 mL/min。
滴定终点时如果出现了沉淀生成,就说明所用硫酸量不足。
二、仪器与试剂仪器:电热套(温度:20±1)℃;电热板(温度:90±1)℃;三用石英比色皿。
铜,铅,锌的原子吸收仪测定

一.铜的测定称取0.1000~0.5000g试样于250ml烧杯中,加10ml盐酸,加热数分钟,加5ml硝酸,蒸发至约2ml,加3ml硫酸,加热至冒三氧化硫白烟,冷却后加入5ml盐酸,加水煮沸,使盐类溶解,冷却后移入100ml容量瓶中,以水定容。
待溶液澄清或干过滤后,在原子吸收分光光度计上于324.8nm处测定其吸光度。
与此同时测定标准溶液(不低于6个点)系列的吸光度。
在分析试样的同时进行空白试验。
结果计算如下:ρ2—ρ1W(Cu)= ———— ×V S×10-4Mg二.铅的测定称取0.1000~0.5000g试样于250ml烧杯中,加15ml盐酸,加热数分钟,加5ml硝酸,蒸发至近干,冷却后加入5ml盐酸,加水煮沸,使盐类溶解,冷却后移入100ml容量瓶中,以水定容。
待溶液澄清后测定,在原子吸收分光光度计上于283.3nm处测定其吸光度。
与此同时测定标准溶液(不低于6个点)系列的吸光度。
在分析试样的同时进行空白试验。
结果计算如下:ρ2—ρ1W(Pb)= ———— ×V S×10-4Mg三.锌的测定称取0.1000~0.5000g试样于250ml烧杯中,加10ml盐酸,加热数分钟,加5ml硝酸,高氯酸3ml,加热分解并蒸发至冒尽白烟。
冷却后加入5ml盐酸,加少量水煮沸,使盐类溶解,冷却后移入100ml容量瓶中,以水定容。
待溶液澄清后测定,在原子吸收分光光度计上于213.9nm处测定其吸光度。
与此同时测定标准溶液(不低于6个点)系列的吸光度。
在分析试样的同时进行空白试验。
结果计算如下:ρ2—ρ1W(Zn)= ———— ×V S×10-4Mg注:1.测定锌含量较低的试样,应该注意分子吸收,可用氘灯或209.99nm谱线进行分子吸收校正。
2.在测定样品溶液中,当铁或铬的含量不小于10mg/ml时,对微量锌的测定有影响。
此时,应在酸分解试样后用高氯酸冒烟,并逐滴加入浓盐酸,使铬生成氯化铬酰挥发出去;铁的干扰用氘灯扣除背景;当其他共存元素含量太高时,可用标准加入法进行锌的测定。
八大离子的检验方法

八大离子的检验方法离子是指在水溶液中存在的带电粒子,水溶液中的离子种类繁多,其中包括八大离子,即铵离子、铁离子、铬离子、钙离子、镁离子、铜离子、锌离子和铅离子。
这些离子的存在与否直接影响着水的质量,因此对于水的检验中,八大离子的检测是非常重要的。
本文将介绍八大离子的检验方法。
一、铵离子的检验方法铵离子是一种常见的离子,它的存在对于水的质量有很大的影响。
铵离子的检验方法主要有两种,一种是使用氯化钡溶液进行检验,另一种是使用红外光谱法进行检验。
使用氯化钡溶液进行检验的方法是将待检测的水样加入少量的氯化钡溶液中,如果出现白色沉淀,则说明水中存在铵离子。
这种方法简单易行,但是只能检测到铵离子的存在,不能确定铵离子的浓度。
红外光谱法是一种比较先进的检验方法,它可以通过检测水中铵离子的吸收峰来确定铵离子的存在和浓度。
这种方法需要使用专门的仪器进行检测,但是具有准确性高、灵敏度高等优点。
二、铁离子的检验方法铁离子是一种常见的离子,它的存在对于水的质量有很大的影响。
铁离子的检验方法主要有两种,一种是使用硫酸亚铁溶液进行检验,另一种是使用原子吸收光谱法进行检验。
使用硫酸亚铁溶液进行检验的方法是将待检测的水样加入少量的硫酸亚铁溶液中,如果出现深蓝色沉淀,则说明水中存在铁离子。
的浓度。
原子吸收光谱法是一种比较先进的检验方法,它可以通过检测水中铁离子的吸收峰来确定铁离子的存在和浓度。
这种方法需要使用专门的仪器进行检测,但是具有准确性高、灵敏度高等优点。
三、铬离子的检验方法铬离子是一种常见的离子,它的存在对于水的质量有很大的影响。
铬离子的检验方法主要有两种,一种是使用硫酸亚铁溶液进行检验,另一种是使用离子色谱法进行检验。
使用硫酸亚铁溶液进行检验的方法是将待检测的水样加入少量的硫酸亚铁溶液中,如果出现绿色沉淀,则说明水中存在铬离子。
这种方法简单易行,但是只能检测到铬离子的存在,不能确定铬离子的浓度。
离子色谱法是一种比较先进的检验方法,它可以通过检测水中铬离子的峰面积来确定铬离子的存在和浓度。
水质 铜、锌、铅、镉的测定方法

水质铜、锌、铅、镉的测定方法
水质中铜、锌、铅、镉的测定方法可以通过以下几种常见的方法来进行:
1. 原子吸收光谱法(AAS):该方法通过测量溶液中金属元
素的吸收光谱来确定其浓度。
先将水样中的金属元素溶解到溶液中,然后使用原子吸收光谱仪测定吸收光谱,再根据校准曲线计算出金属元素的浓度。
2. 电感耦合等离子体质谱法(ICP-MS):该方法是一种高灵
敏度、高精度的分析方法,可以同时测定多种金属元素。
首先将水样溶解成溶液,然后使用电感耦合等离子体质谱仪测定溶液中的金属元素浓度。
3. 恒电位伏安法(DPASV):该方法是一种电化学分析方法,适用于铅和镉的测定。
在恒定电位下,通过测量电流来确定铅和镉的浓度。
该方法需要先将水样中的金属离子还原成金属,然后通过电流测定其浓度。
4. 原子荧光光谱法(AFS):该方法是一种基于金属元素的荧
光特性来确定其浓度的分析方法。
先将水样中的金属元素溶解到溶液中,然后使用原子荧光光谱仪测定荧光光谱,再通过校准曲线计算金属元素的浓度。
以上是常见的几种方法,具体选择哪种方法需要根据实际情况和分析要求来确定。
原子吸收光谱法测定铜
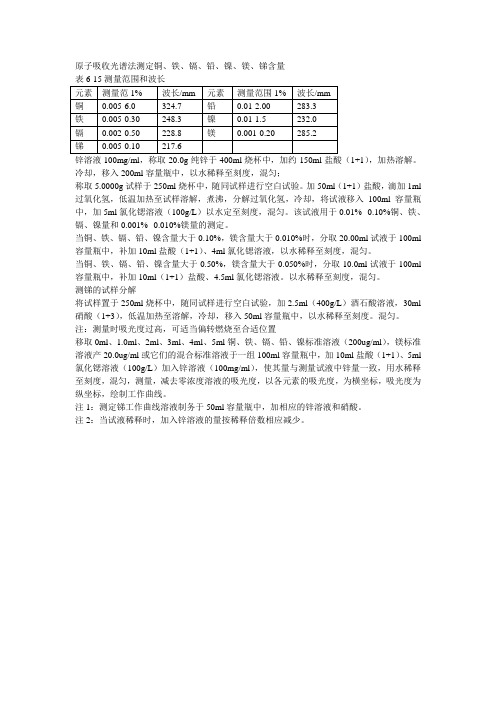
原子吸收光谱法测定铜、铁、镉、铅、镍、镁、锑含量锌溶液100mg/ml,称取20.0g纯锌于400ml烧杯中,加约150ml盐酸(1+1),加热溶解。
冷却,移入200ml容量瓶中,以水稀释至刻度,混匀;称取5.0000g试样于250ml烧杯中,随同试样进行空白试验。
加50ml(1+1)盐酸,滴加1ml 过氧化氢,低温加热至试样溶解,煮沸,分解过氧化氢,冷却,将试液移入100ml容量瓶中,加5ml氯化锶溶液(100g/L)以水定至刻度,混匀。
该试液用于0.01%--0.10%铜、铁、镉、镍量和0.001%--0.010%镁量的测定。
当铜、铁、镉、铅、镍含量大于0.10%,镁含量大于0.010%时,分取20.00ml试液于100ml 容量瓶中,补加10ml盐酸(1+1)、4ml氯化锶溶液,以水稀释至刻度,混匀。
当铜、铁、镉、铅、镍含量大于0.50%,镁含量大于0.050%时,分取10.0ml试液于100ml 容量瓶中,补加10ml(1+1)盐酸、4.5ml氯化锶溶液。
以水稀释至刻度,混匀。
测锑的试样分解将试样置于250ml烧杯中,随同试样进行空白试验,加2.5ml(400g/L)酒石酸溶液,30ml 硝酸(1+3),低温加热至溶解,冷却,移入50ml容量瓶中,以水稀释至刻度。
混匀。
注:测量时吸光度过高,可适当偏转燃烧至合适位置移取0ml、1.0ml、2ml、3ml、4ml、5ml铜、铁、镉、铅、镍标准溶液(200ug/ml),镁标准溶液产20.0ug/ml或它们的混合标准溶液于一组100ml容量瓶中,加10ml盐酸(1+1)、5ml 氯化锶溶液(100g/L)加入锌溶液(100mg/ml),使其量与测量试液中锌量一致,用水稀释至刻度,混匀,测量,减去零浓度溶液的吸光度,以各元素的吸光度,为横坐标,吸光度为纵坐标,绘制工作曲线。
注1:测定锑工作曲线溶液制务于50ml容量瓶中,加相应的锌溶液和硝酸。
注2:当试液稀释时,加入锌溶液的量按稀释倍数相应减少。
生铁 多元素含量的测定 火花放电原子发射光谱法(常规法)-最新国标

生铁多元素含量的测定火花放电原子发射光谱法(常规法)1范围本文件规定了生铁中碳、锰、硅、磷、硫、铬、镍、钼、钒、铜、钛、铝、硼、砷、铌、钨、钴、铅、锡、锑、铋、锌和锆元素含量的火花放电原子发射光谱分析方法。
本方法适用于炼钢生铁、铸造生铁、球墨铸铁用生铁、含钒生铁、高纯生铁等白口化样品的分析。
本方法可同时测定白口化生铁样品中的23个元素,各元素的测定范围见表1。
表1各元素测定范围元素测定范围/%C Si Mn P S Cr Ni Mo V Cu Ti Al B As Nb W Co Pb Sn Sb Bi Zn Zr 2.0~4.500.10~4.300.05~2.500.01~1.300.005~0.250.02~2.800.006~4.500.001~1.000.01~1.200.01~2.200.01~0.500.002~1.200.001~0.400.002~0.1000.003~0.1000.01~0.900.01~0.300.002~0.0500.003~0.450.01~0.400.002~0.0300.001~0.0500.001~0.03012下列文件中的条款通过本标准的引用而成为本标准的条款。
凡是注日期的引用文件,其随后所有的修改单(不包括勘误的内容)或修订版均不适用于本标准,然而,鼓励根据本标准达成协议的各方研究是否可使用这些文件的最新版本。
凡是不注日期的引用文件,其最新版本适用于本标准2规范性引用文件。
GB/T 6379.1测量方法与结果的准确度(正确度与精密度)第1部分:总则与定义GB/T 6379.2测量方法与结果的准确度(正确度与精密度)第2部分:确定标准测量方法重复性与再现性的基本方法GB/T 20066钢和铁化学成分测定用试样的取样和制样方法3方法原理将制备好的生铁块状样品在火花光源的作用下与对电极之间发生放电,在高温和惰性气氛中产生等离子体。
被测元素的原子被激发时,电子在原子内不同能级间跃迁,当由高能级向低能级跃迁时产生特征谱线,测量选定的分析元素和内标元素特征谱线的光谱强度。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
铜合金分析
1)铜分析
(1) 碘量法
分桥步骤
称取0.2000g试样于高型烧杯中,加5mL HNO3(1+1),加热溶解并蒸发至湿润状,冷却。
用水洗涤表皿及杯壁,用氨水(1+1)逐滴中和至恰好生成沉淀。
滴加乙酸(1+4)至沉淀溶解并过量5-6滴,加入少量NaF使溶液黄色褪去转为蓝
色。
加5mL 200 g/L KI溶液,立即用c(Na2S2O3)为0.05mol/L标准溶液滴定至黄色,加10mL 200 g/L KSCN镕浓、5mL10g/L淀粉溶液,继续滴定至蓝色消失,即为终点。
(2)电解重量法
2)锌
分析步骤称取0.2000g试样子锥形瓶中,加10mL HCl(1+1)、l-2mL H2O2,微热使试样溶解并煮沸,冷却。
移入分液漏斗中,加10mL200g/L NH4F溶液(如出现浑浊,补加4mLHCl(1+1))、50mL80g/L硫脲溶液.加水至70mL,加l0mL 500g/L NH4SCN溶液,20mL MIBK,振荡2min。
分层后弃去水相,向有机相加l5mL洗涤液、5mL 200g/L NH4F溶液,振荡1min。
将有机相移入烧杯中,用50mL水冲洗分液漏斗,洗液并入烧杯中,加20mL缓冲镕液,剧烈搅拌1min,5mL200g/L NH4F溶液,5mL80g/L硫脲溶液,3-5滴XO指示剂,浓度大概为0.1mol/L的EDTA标准溶液滴定至由紫红色变为黄色,即为终点。
试剂需特殊配制的试剂(1)缓冲溶液:100g六亚甲基四胺溶于水中,加20mL HCl,加水至500mL。
(2)洗涤浓:取10mL 500g/L NH4SCN溶液,加2mLHCl,加水至100mL。
3)铅
铬酸铅沉淀—硫酸亚铁铵滴定法
分析步骤称取0.5000-1.0000g试样于烧杯中,加5-7mLHNO3(1+1)低温加热溶解并驱除氮的氧化物,冷却。
加3mL AgNO3—Sr(NO3)2混合溶液,在不停摇动下加入25.00mL K2Cr2O7标准溶液。
15s后加5mL H2SO4-H3PO4混合溶液,3滴5g/L二苯胺磺酸钠指示剂,用浓度为0.02mol/L左右的硫酸亚铁铵标准溶液滴定至溶液紫色怜消失,即为终点。
试剂需特殊配制的试剂:(1) AgNO3—Sr(NO3)2混合溶液:3g AgNO3和10g Sr(NO3)2100ml水中。
(2) H2SO4-H3PO4混合溶液:于700mL水中加入150mL H2SO4和150mL H3PO4。
(3) K2Cr2O7标准溶液:lL溶液中含170g结晶乙酸钠和55mL乙酸。
4)铁-
分析步骤称取0.2000-0.5000g试样于烧杯中,加入10-15mL HCl,低温加热数分钟,稍冷却,加5mL HNO3,继续加热至完全分解,冷却。
加4mLH2SO4(1+1),加热至冒浓白烟,稍冷却,加入l0-15mL HCl,加100mL水,加热使盐类溶解后,加入2-3g NH4Cl,用氨水中和至Fe(OH)3沉淀完全并过量5mL,煮沸。
用快速滤纸过滤,用热洗涤液洗涤沉淀。
将沉淀用热HCl(1+1)溶解于原烧杯中,滤纸用热水和HCl(1+1)交替洗涤(体积保持150ml),加热近沸。
趁热滴加10%SnCl2溶液至溶液黄色恰好退掉,再过量1~2滴,冷却,加入5ml HgCl2,放置片刻至Hg2Cl2
沉淀出现,加入水200ml;20ml硫-磷混合酸,二苯胺磺酸钠指示剂4~5滴;用K2Cr2O7标准液滴定至溶液由绿色至红紫色,为终点
试剂:(1)硫-磷混合酸(硫酸+磷酸+蒸馏水=15+15+70):将150ml的浓H2SO4在不断搅拌下慢慢地加入到700ml的蒸馏水中,冷却加入150ml浓H3PO4混合均匀;(2)洗液:20gNH4Cl溶于水中,在加20mL氨水,加水至1000mL.
参考资料:重金属分析。
