第十一章 醛和酮041019114139
有机化学第五版第十一章醛和酮课后习题答案

第十一章醛和酮习题答案最新版1. 用系统命名法命名下列醛、酮;解:1 2-甲基-3-戊酮24-甲基-2-乙基己醛3反-4己烯醛4Z-3-甲基-2庚烯-5-炔-4-酮53-甲氧基-4-羟基苯甲醛 6对甲氧基苯乙酮7反-2-甲基环己基甲醛83R-3-溴-2-丁酮93-甲酰基戊二醛10螺癸-8-酮2. 比较下列羰基化合物与HCN加成时的平衡常数K值大小;1Ph2CO 2PhCOCH3 3Cl3CHO 4ClCH2CHO5PhCHO6CH3CHO解:1<2<5<6<4<3原因: HCN对羰基加成是亲核加成,能降低羰基碳原子上电子云密度的结构因素将会使K值增大,故K值顺序是:6<4<3,而羰基碳原子的空间位阻愈小,则K值增大,故K 值的顺序是:1<2<5<6 ,综合考虑:则K值顺序是:1<2<5<6<4<3;6. 完成下列反应式对于有2种产物的请标明主次产物;解:7. 鉴别下列化合物:解:或12. 如何实现下列转变解:13. 以甲苯及必要的试剂合成下列化合物;解:1214. 以苯及不超过2个碳的有机物合成下列化合物;解:2解:18. 化合物F,分子式为C10H16O,能发生银镜反应,F对220 nm紫外线有强烈吸收,核磁共振数据表明F分子中有三个甲基,双键上的氢原子的核磁共振信号互相间无偶合作用,F经臭氧化还原水解后得等物质的量的乙二醛、丙酮和化合物G,G分子式为C5H8O2,G能发生银镜反应和碘仿反应;试推出化合物F和G的合理结构;解:19. 化合物A,分子式为C6H12O3其IR谱在1710 cm-1有强吸收峰,当用I2-NaOH处理时能生成黄色沉淀,但不能与托伦试剂生成银镜,然而,在先经稀硝酸处理后,再与托伦试剂作用下,有银镜生成;A的I HNMR 谱如下: δ s,3H,δ d, 2H , δs,6H , δt,1H;试推测其结构;解:20. 某化合物A,分子式为C5H12O,具有光学活性,当用K2Cr2O7氧化时得到没有旋光的B,分子式为 C5H10O,B与CH3CH2CH2MgBr作用后水解生成化合物C,C能被拆分为对映体;试推测A、B、C结构;解:2013-4-9。
第十一章 醛酮
O CH3 C CH2CHCH3
CH3
4 _ 甲 基 _ 2 _ 戊 酮
CH3COCHCO3CH
CH2CH=CH2
3_烯丙基_2,4 _戊二酮
O
= CH3 C CH C CH3
CH3
4 _ 甲 基 _ 3 _ 戊 烯 _ 2 _ 酮
O C CH CH3
CH3
2 _ 甲 基 _ 1 _ 环 己 基 _ 1 _ 丙 酮
8
O
CH3
C CH=C CH3
CH3
CH3
3 _ 甲 基 _ 1 _ 2 ' , 4 ' _ 二 甲 基 苯 基 _ 2 _ 丁 烯 _ 1 _ 酮
练习: 写出下列化合物的名称或结构式:
(1). H= C CCH 2CC = H CH HCH (2)O . C3HCC2HCC3H
C3H
OO
=
=
= =
R C OH M 3 O +R C g O X 3 ° 醇 H
R
RR ' '
RR ' '
例:选择适当的原料合成2-甲基-2-戊醇。
24
4、与醇的加成反应
R H CO+
( R' )
无水HCR l OH
R''OH
C
H OR''
( R' )
R''OH R C OR''+H2O 干HCH l OR''
( R' )
OH
(C3H)2CC2H NH 2
OH
20
2、与饱和亚硫酸氢钠的加成反应
醇 钠 O C O+NaO-S-OH C ONa
11章-醛和酮--课后习题答案
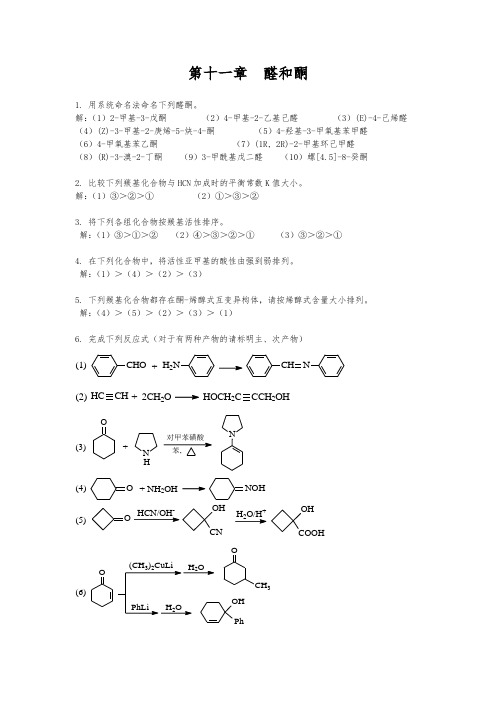
第十一章 醛和酮1. 用系统命名法命名下列醛酮。
解:(1)2-甲基-3-戊酮 (2)4-甲基-2-乙基己醛 (3)(E)-4-己烯醛 (4)(Z)-3-甲基-2-庚烯-5-炔-4-酮 (5)4-羟基-3-甲氧基苯甲醛 (6)4-甲氧基苯乙酮 (7)(1R, 2R)-2-甲基环己甲醛 (8)(R)-3-溴-2-丁酮 (9)3-甲酰基戊二醛 (10)螺[4.5]-8-癸酮2. 比较下列羰基化合物与HCN 加成时的平衡常数K 值大小。
解:(1)③>②>① (2)①>③>②3. 将下列各组化合物按羰基活性排序。
解:(1)③>①>② (2)④>③>②>① (3)③>②>①4. 在下列化合物中,将活性亚甲基的酸性由强到弱排列。
解:(1)>(4)>(2)>(3)5. 下列羰基化合物都存在酮-烯醇式互变异构体,请按烯醇式含量大小排列。
解:(4)>(5)>(2)>(3)>(1)6. 完成下列反应式(对于有两种产物的请标明主、次产物)(1)CHO +H 2NCH N(2)HCCH + 2CH 2O HOCH 2C CCH 2OH(3)O+N HN(4)O +NH 2OHNOH(5)OHCN/OH -OH CNH 2O/H +OH COOH(6)O3(7)PhO2PhOHPhOPh 次+主次(8)O CH 3+OEtO -OCH 3O(9)O O+CHOEtO -CHO OO(10)CH 32BrO22HClO CO CH 3CH 2Br(11)OCH 3+H 2Pd/COCH 3CH 3CH 3CH 3O(12)CH 3CH 3CH 3OHNaBH 432H 3O+CH 3CH 3CH 3OH+主次(13)O3H 3O +OH(主)(14)PhOMg H 3O +Ph CH 3OH OHPh CH 3或OPhPh(15)O+Br 2HOAcCH 2BrO(16)PhPh O+H 2CPPh 3-+Ph Ph(17)PhCHO HCHO+-PhCH 2OH + HCOO -(18)+O CH 3CO 3HCH 3COOEtOO7. 鉴别下列化合物。
醛和酮习题及答案5页word

第十一章醛和酮习题1、用系统命名法命名下列化合物:(1)(2)(3)(4)(5)(6)2、写出下列有机物的构造式:(1)2-methylbutanal (2)cyclohexanecarbaldehyde (3)4-penten-2-one (4)5-chloro-3-methylpentanal (5)3-ethylbenzaldehyde (6)1-phenyl-2-buten-1-one3、以沸点增高为序排列下列各化合物,并说明理由。
⑴CH2=CHCH2CHO ⑵CH2=CHOCH=CH2⑶CH2=CHCH2CH2OH⑷CH3CHO4、完成下列反应方程式:5、试设计一个最简便的化学方法,帮助某工厂分析其排出的废水中是否含有醛类,是否含有甲醛?并说明理由。
6、以HCN对羰基加成反应平衡常数K增大为序,排列下列化合物,并说明理由。
(1)(Ph)2CO (2)PhCOCH3(3)Cl3CCHO (4)ClCH2CHO(6)CH3CHO7、预料下列反应的主要产物:(1)(S)-C6H5CH(C2H5)CHO + C6H5CH2MgBr(28、用反应方程式表明由苯甲醛制取苄醇的三种不同方法,并指出各有什么特点。
9、写出CH3COCH3与苯肼反应的机制,并说明为什么弱酸性介质(PH~3.5)反应速度快,而过强的酸及碱性介质都降低反应速率。
10、对下列反应提出合理的机理:11、我国盛产山苍子精油,用其主要成分柠檬醛A可以合成具有工业价值的紫罗兰酮:试回答:(1)在每个箭头上注明必需的试剂和催化剂;(2)拟出能解释上述反应的历程;(3)第二步反应中β-紫罗兰酮是占优势的产物,为什么?(4)在紫外-可见光谱中,哪一个紫罗兰酮异构体吸收较长的光波,为什么?12、顺-1,2-环戊二醇和丙酮及少量酸的混合物进行回流,用分水器不断除水,获得分子式为C8H14O2的产物A,A对碱稳定,遇稀酸生成原料。
(1)推测A的结构;(2)用反-1,2-环戊二醇进行同样的实验,却不发生反应,为什么?13、化合物B(C9H10O)碘仿实验呈阴性,IR谱中1690cm-1处显一强吸收峰;NMR谱中δ值=1.2(3H)三重峰,δ=3.0(2H)四重峰,δ=7.7(5H)多重峰,试推测化合物B的结构。
第十一章 醛和酮
SO 3Na CH 3CH 2CH 2CHO +NaHSO 3 CH 3CH 2CH 2CH OH
SO 3Na Na 2CO 3 CH 3CH 2CH 2CH CH 3 CH 2CH 2CHO +Na 2SO 3 +NaHCO 3 H 2O OH
第十一章 醛和酮
Chapter 11 Aldehyde and Ketone
δ
+
δ
C
O
Company Logo
Contents
1
醛和酮的分类和命名★
醛和酮的物理性质◎
2
3 4
2
醛和酮的化学性质★
醛和酮的制备◎
Company Logo
第一节 醛和酮的分类和命名
醛和酮均含有羰基的化合物
O C
羰基碳原子上同时连有两个烃基的叫酮 羰基碳原子上至少连有一个氢原子的叫醛。
27
6、CH 3CC 6H 5 O
7、C 6H 5CHO
O
3>2>1>8>7>4>5>6
Company Logo
第三节 醛和酮的化学性质 2、与亚硫酸氢钠加成
醛酮与饱和(40%)亚硫酸氢钠溶液作用,很快 生成白色沉淀物。
R (R')H HO C =O + :S O Na
R C (R')H
OH SO3Na
-羟基磺酸钠易溶于水,不溶于饱和亚硫酸
氢钠,而是以白色晶体析出。
28
=
O
α- 羟基磺酸钠
Company Logo
第三节 醛和酮的化学性质
(1) 反应的应用范围:★ 所有的醛、脂肪族甲基酮、≤C8的环酮 (2) 应用: (A) 用于定性鉴别★ α-羟基磺酸钠易溶于水,但不溶于饱和的 NaHSO3溶液而析出无色针状结晶,故可定性 鉴别。
有机化学 第十一章 醛酮

O CCH3
山东科技大学
王鹏
化学与环境工程学院
11.3 醛酮的制备
丁酮的1H NMR谱图:
单峰
三重峰
四重峰
山东科技大学
王鹏
化学与环境工程学院
11.6 醛和酮的化学性质
醛和酮的反应部位:
氧化还原反应
亲核加成反应
O C C R (H) H
α-氢的反应
山东科技大学
王鹏
化学与环境工程学院
• 碳负离子 • 氧负离子 • 氮负离子 • 硫负离子
山东科技大学
王鹏
化学与环境工程学院
11.6.1 醛和酮的亲核加成
二、羰基与碳负电中心的加成
1. 与HCN的加成:
反应现象:
• 仅丙酮与氢氰酸混合,长时间加热仅得极少产物
• 加入极少量的碱,反应能迅速完成;而体系存在酸 时反应受到抑制,甚至不反应
δ+ Li
-n-BuH
H
+
_
(C6H5)3P CH2CH3Br
+ (C6H5)3P (C6H5)3P
_
CHCH3 Ylide CHCH3 磷 叶 立 德
• 磷叶立德可与羰基反应生成烯烃:
R1
Ph3P=CHR +
CO
R2
R1 C CHR
R2
山东科技大学
王鹏
化学与环境工程学院
11.6.1 醛和酮的亲核加成
CH3CH2CH2 C H
CH3
O CH
正丁醛
异戊醛
苯甲醛
酮:以甲酮作母体,“甲”字可省略
O
CH3 C CH2CH3
甲乙酮 甲基乙基(甲)酮
有机化学课件-11醛酮
R'
O2N
R C N NH
NO2
(2,4-二硝基苯腙)
H2N-B NH2NHCONH2 NH2C6H5
产物
R'
O
R C N NH C NH2 (缩氨脲)
R' R C N C6H5
(schiff碱)
由于氨的衍生物亲核性较强,除了空间位阻很大的酮(如二苯甲
酮等),几乎多数醛酮都可与氨衍生物发生加成-消去反应,产物
戊二醛
2,6-庚二酮
O
O
CH3 CCH2CH2CH2C H
CHO
COCH3
5-氧代己醛
CO2H
CO2H
对甲酰基苯甲酸 对乙酰基苯甲酸
三、物理性质:
(一)沸点: 分子间不能形成氢键,沸点远低于分子量相当的醇,但具有较大
的极性,沸点略大于RX;如:
CH3CHO
M
44
μ(D) 2.7
Bp℃ 20.2
CH3CH2OH CH3Cl
(三)亲核加成的立体化学(参见p616)
上方
R CO
R'
+ Nu-
Nu
R
R C O- + R' C O-
下方
R'
Nu
1.当醛酮羰基所在的平面为分子的对称面时,加非手性亲核试剂 时产物为外消旋体, 若加手性亲核试剂时,产物中新产生的C*构型R/S比例≠1;
例: H
OHC O + HCN
H3C
NC
H
H C OH + H3C C OH
H+ R C O + NaHSO3
R'
《醛和酮的》PPT课件
通式
此方法用于制备醇
1o醇 2o醇
甲醛
醛 3o醇
酮
精选ppt
39
与有机金属锂试剂的反应
O
O H
+ (C H 3 )2 C H C C H (C H 3 )2 (C H 3 )2 C H L i H 3 O +(C H 3 )2 C H C C H (C H 3 )2
H O O H
例二:
转化
O
COC2H5 O
CH2OH
O
II: 还原C=O生成CH2
精选ppt
33
(3) 与氢氰酸加成 RHC O HCN
R OH
C H
CN
α -氰醇
(α -羟基腈)
H2O H+
H
R C COOH OH
α -羟基酸
A: 反应在酸性条件下难以进行,在碱性条件下易进行
B: α-羟基腈多官能团中间体
26
(1) 水合反应
H 3C C O + H 2O
H
H 3C O H C
H O H
平衡偏向左边
机理:
精选ppt
27
(2)与醇的缩合
A. 反应通式:
半缩醛羟基
R H C=O
HOR/
干HCl
R OH H C OR/
R/OH,H+
R OR/ H C OR/
+
H2O
半缩醛
缩酮
(不稳定)
I:
II: 反应为平衡反应,除水可使平衡向右移动
(2)乙烯催化氧化 ➢乙酸、乙酸乙酯的原料
精选ppt
15
3、丙酮
➢无色液体 ➢工业制备
❖丙烯水化 ❖异丙苯制苯酚的付产物 ❖丙烯催化氧化
醛酮
RC CH
末端炔
H2O Hg++
O R C CH3
甲基酮
HC CH
RX
RCCH
H2O Hg++
O R C CH3
MC CH (M = Na, MgX 等)
(1) O R C R'
(2) H2O
RC CR
H2O Hg++
OH R C C CH
R'
H2O Hg++
O R C CH2R
OH O R C C CH3
O RCH
2 R'OH
2 R'OH H+
2019/8/18
No Reaction
R'OH 为弱亲核试剂
OH RCH
Organic Chemistry
OR'
RCH
缩醛
OR'
16
第 十一章 醛 和 酮
2. 醛酮羰基上的亲核加成反应(1)
一些常见的与羰基加成的亲核试剂
负离子型
Nu
分子型
NuH
亲核试剂
Organic Chemistry
3
第 十一章 醛 和 酮
醛酮的命名
O CHO
O
H3C
巴豆醛 反-2-丁烯醛 (E)-but-2-enal
甲基乙基甲酮 丁酮
butanone
1-环己基-2-丁酮 1-cyclohexylbutan-2-one
O CHO
3-氧代(正)戊醛 3-oxopentanal
R1
C R2
CH2
KMnO4
R1
C O + CO2 R2
第十一章 醛和酮
碳链的编号从与醛基或羰基相连的碳原子开始 用α,β,γ,δ……等表示,对于长链醛酮 最后一位用ω表示。
δγβα
C C C C CHO
γ βα
α, β, γ,
CCCCCCC
O
第一节 醛、酮的分类,同分异构和命名
Classification, isomerism and nomenclature of aldehydes and ketones
spectrum of aldehydes and ketones
三、光谱性质
1. 红外光谱(IR)特征:
1. 醛、酮的碳氧伸缩振动( νC=O ):1740~1705 ㎝-1 2. 醛羰基碳上的碳氢伸缩振动( νC-H ): 2900~2700 ㎝-1有两个吸收峰,一般约在2820 ㎝-1和 2720 ㎝-1,可用于醛基的鉴别 3. 环酮的吸收频率受环大小的影响,小环 由于环张力而吸收频率较高(环丙酮类νC=O 1810 ㎝-1, 环丁酮类νC=O 1775 ㎝-1,环戊酮类νC=O 1740 ㎝-1 ) 4. 羰基与双键共轭时,吸收频率向低波数方向移动
3. 沸点:醇>醛、酮>醚、烷烃 原因:羰基是一个极性双键,故醛、酮是极性分子, 分子间作用力大于非极性的烷烃和醚,但醛、酮分子 间不能形成氢键,故沸点又低于相应的醇。
4. 水溶性:低级醛、酮溶于水 原因:羰基氧能与水形成分子间氢键。
第二节 醛、酮的结构,物理性质和光谱 性质structure, physical properties and
CH3 C CH2NH2
OH
问题:以丙酮为原料合成有机玻璃的单体α-甲基丙烯酸甲酯
第三节 醛、酮的化学性质
Chemical properties of aldehydes and acetones
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
OO
OHC CHO
CH3CCH2CCH3
O
O
二元醛
二元酮
多元酮
碳原子数相同的饱和一元醛、酮互为同分异构体,具有相同的通式:
CnH2nO。 1.2 醛、酮的同分异构现象
醛酮的异构现象有碳连异构和羰基的位置异构。
1.3 醛、酮的命名
少数结构简单的醛、酮,可以采用普通命名法命名,即在与羰基相连的烃基
名称后面加上“醛”或“酮”字。例如:
水合茚三酮:
O
O
O + HOH O
OH
OH O
水合茚三酮在α-氨基酸的色谱分析中常用作显色剂。 3.2 还原反应 醛、酮可以发生还原反应,在不同的条件下,还原的产物不同。 1、羰基还原为羟基 ①用催化氢化的方法,醛、酮可分别被还原为伯醇或仲醇,常用的催化剂是 镍、钯、铂。
催化氢化的选择性不强,分子中同时存在的不饱和键也同时会被还原。例如:
C O + H+
C +OH
但反应的酸性不能太强,因为在强酸下,氨的衍生物能与质子结合形成盐,
这将丧失它们的亲核性:
H2N Y + H+
+ H3N Y
所以反应一般控制在弱酸性溶液(醋酸)中进行。 6、与魏悌希(Wittig)试剂的加成反应 魏悌希(Wittig)试剂是带有相邻“+”、“-”电荷的分子,为磷的内鎓盐, 又音译为叶立德(Ylide),是德国化学家魏悌希在 1945 年发现的。 磷叶立德(魏悌希试剂)通常由三苯基磷与 1 级或 2 级卤代物反应得季磷盐, 再与碱作用而生成。
CHO
CHO OH
1-苯基-2-丙酮
CH=CHCHO
苦杏仁油(苯甲醛) 水杨醛(2-羟基苯甲醛) 肉桂醛(3-苯基丙烯醛)
碳原子的位置也可用希腊字母表示。例如:
第二节 醛、酮的结构、物理性质和光谱性质
2.1 醛、酮的结构 醛酮的官能团是羰基,所以要了解醛酮必须先了解羰基的结构。
C=O = σ+π 与
激气味,中级醛具有果香味,所以含有 C9-C10 个碳原子的醛可用于配制香料。 醛、酮是极性化合物,但醛、酮分子间不能形成氢键,所以醛、酮的沸点较
分子量相近的烷烃和醚高,但比分子量相近的醇低。例如:
丁烷
丙醛
丙酮
丙醇
分子量 58
58
58
60
沸点/℃ -0.5
48.8
56.1
97.2
醛、酮的羰基能与水分子形成氢键,所以四个碳原子以下的低级醛、酮易溶
3、与饱和亚硫酸氢钠(40%)的加成反应 醛、酮与饱和亚硫酸氢钠溶液作用,亚硫酸氢钠分子中带未共用电子对的硫 原子作为亲核中心进攻羰基碳原子,生成 α-羟基磺酸钠。反应是可逆的,必须加 入过量的饱和亚硫酸氢钠溶液,以促使平衡向右移动。
由于 α-羟基磺酸钠不溶于饱和亚硫酸氢钠溶液,以白色沉淀析出,所以此反 应可用来鉴别醛、某些酮。另外,α-羟基磺酸钠溶于水而不溶于有机溶剂,与稀 酸或稀碱共热可分解析出原来的羰基化合物,所以此反应也可用于分离提纯醛、 某些酮。
上述反应的特点: 羰基化合物与羟胺、苯肼、2,4-二硝基苯肼及氨基脲的加成-消除产物大多 是白色晶体,有固定的晶形和熔点,收率高,易于提纯,在稀酸的作用下能水解 为原来的醛、酮。这些性质可用来分离、提纯、鉴别羰基化合物。其中 2,4—二 硝基苯肼与醛、酮反应现象非常明显,所得到的黄色晶体具有不同的熔点,常把 它作为鉴定醛、酮的灵敏试剂,称为羰基试剂。 该反应一般在酸催化下进行,羰基氧与质子结合,可以提高羰基的活性:
2、与格氏试剂的加成反应 格氏试剂是较强的亲核试剂,非常容易与醛、酮进行加成反应,加成的产物 不必分离便可直接水解生成相应的醇,是制备醇最重要的方法之一。
格氏试剂与甲醛作用,可得到比格氏试剂多一个碳原子的伯醇;与其它醛作
用,可得到仲醇;与酮作用,可得到叔醇。
RMgX + HCHO¸ÉÔïÒÒÃÑRCH2OMgX
CH
—CHO,但不能写成-COH。 羰基化合物广泛存在于自然界,它们既是参与生物代谢过程的重要物质,如
甘油醛(HOCH2CHOHCHO)和丙酮酸(HOOCCOCH3)是细胞代谢作用的基本成分, 又是有机合成的重要原料和中间体。
第一节 醛、酮的分类、同分异构和命名
1.1 醛、酮的分类 根据羰基所连烃基的结构,可把醛、酮分为脂肪族、脂环族和芳香族醛、酮
CN Y
醛、酮与氨或伯胺反应生成亚胺(西佛碱),亚胺不稳定,故不作要求。 醛、酮与芳胺反应生成的亚胺(西佛碱)较稳定,但在有机合成上无重要意 义,故也不作要求。 醛、酮与有 α-H 的仲胺反应生成烯胺,烯胺在有机合成上是个重要的中间 体。
醛、酮与氨的衍生物反应,其产物均为固体且各有其特点,是有实用价值的 反应。
第十一章 醛和酮
教学基本要求 1、掌握醛、酮的结构、命名法、化学性质及其制法; 2、掌握醛、酮的亲核加成反应历程; 3、了解α,β-不饱和醛、酮的特性。 教学重点 醛、酮的结构化学性质及其制法;醛、酮的亲核加成反应历程;α,β-不饱和醛、酮的特 性。 教学难点 醛、酮的化学性质及其制法;醛、酮的亲核加成反应历程;α,β-不饱和醛、酮的特性。 教学时数: 手段相结合; 3、启发式教学。 教学内容
R1 C O + (Ph)3P = C R2
R1 C C R2 + (Ph)3P =O
此反应即为魏悌希反应,是合成烯烃和共轭烯烃的好方法。其反应特点是:
1)可用与合成特定结构的烯烃(因卤代烃和醛酮的结构可以多种多样)。
2)醛酮分子中的 C=C、C≡C 对反应无影响,分子中的 COOH 对反应也无影
响。
在三氯乙醛分子中,由于三个氯原子的吸电子诱导效应,它的羰基有较大的
反应活性,容易与水加成生成水合三氯乙醛:
Cl Cl C C O + H OH
Cl H
Cl OH
Cl C CH OH
Cl
水合三氯乙醛简称水合氯醛,为白色晶体,可作为安眠药和麻醉药。
茚三酮分子中,由于羰基的吸电子诱导效应,它也容易和水分子形成稳定的
CH2=CHCHO
ROH ¸É HCl
OR CH2=CHCH OR
例 2: 必须要先把醛基保护起来后再氧化
5、与氨及其衍生物的反应 醛、酮可与氨及其衍生物发生亲核加成反应,最初生成的加成产物容易脱 水,生成含碳氮双键的化合物,所以此反应称为加成-消除反应。
C O+ δ+ δ-
H2N
Y
C NY -H2O OH H
半缩醛不稳定,容易分解成原来的醛和醇。在同样条件下,半缩醛可以与另 一分子醇反应生成稳定的缩醛。
也可以在分子内形成缩醛。
醛较易形成缩醛,酮在一般条件下形成缩酮较困难,但在无水酸催化下, 用 1,2 二醇或 1,3-二醇则易生成缩酮。
反应的应用:有机合成中用来保护羰基。 例如,要将丙烯醛转化为丙醛或 2,3-二羟基丙醛,如果直接用催化氢化的方 法或氧化的方法,醛基都将被破坏。如果先把醛转化为缩醛,然后再进行催化氢 化或氧化,待反应完成后用酸水解,就能达到保护醛基的目的:
②用还原剂(金属氢化物)还原
a.LiAlH4 还原
LiAlH4 是强还原剂,但①选择性差,除不还原 C=C、C≡C 外,其它不饱和 键都可被其还原;②不稳定,遇水剧烈反应,通常只能在无水醚或 THF 中使用。
相似
C=O 双键中氧原子的电负性比碳原子大,所以 π 电子云的分布偏向氧原子, 故羰基是极化的,氧原子上带部分负电荷,碳原子上带部分正电荷。
2.2 醛、酮的物理性质
室温下,除甲醛是气体外,十二个碳原子以下的脂肪醛、酮为液体,高级脂
肪醛、酮和芳香酮多为固体。酮和芳香醛具有愉快的气味,低级醛具有强烈的刺
O
O
O
CH3CHCHO
CH3CCH3
CH3CCH2CH3
CCH3
CH3
异丁醛
二甲(基)酮 甲(基)乙(基)酮 甲基苯基酮
结构复杂的醛、酮通常采用系统命名法命名。选择含有羰基的最长碳链为主
链,从距羰基最近的一端编号,根据主链的碳原子数称为“某醛”或“某酮”。
因为醛基处在分子的一端,命名醛时可不用标明醛基的位次,但酮基的位次必须
标明。主链上有取代基时,将取代基的位次和名称放在母体名称前。主链编号也
可用希腊字母α、β、γ、……表示。命名不饱和醛、酮时,需标出不饱和键的
位置。例如:
CH3 CHCHO
CH3 2-甲基丙醛 或 α-甲基丙醛
O CH3CHCCHCH3
Br Br
2,4-二溴-3-戊酮 或 α,α'-二溴-3-戊酮
O CH3 CH3C CH2CHCH3 4-甲基-2-戊酮 CH3CH=CHCHO
2-丁烯醛
羰基在环内的脂环酮,称为“环某酮”,如羰基在环外,则将环作为取代基。
例如:
O
CHO O
CH3
3-甲基环己酮
CH3
4-甲基环己基甲醛
O
1,4-环己二酮
命名芳香醛、酮时,把芳香烃基作为取代基。例如:
O
O
C CH3
C CH2 CH3
O CH2C CH3
苯乙酮
1-苯基-1-丙酮
某些醛常用俗名。例如:
等几类。例如:
CH3CHO
CH3CCH3
O
O
CHO
C CH3 O
脂肪醛
脂肪酮
脂环酮
芳香醛
芳香酮
根据羰基所连烃基的饱和程度,可把醛、酮分为饱和与不饱和醛、酮。例如:
O
CH3CH2CHO
CH2 CHCHO
CH2 CHCCH3
O
饱和醛
不饱和醛
不饱和酮
不饱和酮
根据分子中羰基的数目,可把醛、酮分为一元、二元和多元醛、酮等。例如:
