第十四章 羧酸衍生物
第十四章 羧酸衍生物 酰基碳上的亲核取代反应
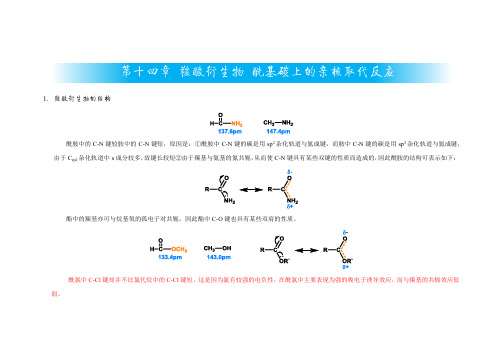
第十四章羧酸衍生物酰基碳上的亲核取代反应1.羧酸衍生物的结构酰胺中的C-N键较胺中的C-N键短,原因是:①酰胺中C-N键的碳是用sp2杂化轨道与氮成键,而胺中C-N键的碳是用sp3杂化轨道与氮成键,由于C sp2杂化轨道中s成分较多,故键长较短②由于羰基与氨基的氮共轭,从而使C-N键具有某些双键的性质而造成的,因此酰胺的结构可表示如下:酯中的羰基亦可与烷基氧的孤电子对共轭,因此酯中C-O键也具有某些双肩的性质。
酰氯中C-Cl键却并不比氯代烷中的C-Cl键短,这是因为氯有较强的电负性,在酰氯中主要表现为强的吸电子诱导效应,而与羰基的共轭效应很弱。
酰胺、酯、酰氯的共振式如下:在酰胺中具有相反电荷的偶系结构是主要的,酯中次之,而在酰氯中这种偶极结构很少。
2.羧酸衍生物的物理性质低级酰氯与酸酐是有刺激气味的液体。
高级的为固体。
低级酯具有芳香的气味,存在于水果中,可用作香料。
十四碳以下的甲酯/乙酯均为液体。
酰胺除甲酰胺外,均是固体,只是因为分子中形成氢键,如果氮上的氢逐个被取代,则氢键缔合减少,因此脂肪族的N-取代酰胺常为液体。
酰氯和酯的沸点因分子中没有缔合,比相应的羧酸低,酸酐与酰胺的沸点,比相应的羧酸高。
(乙酰氯bp:51℃乙酸酐bp:140℃乙酸乙酯bp:77℃乙酰胺bp:222℃)酰氯和酸酐不溶于水,低级的遇水分解;酯在水中的溶解度很小;低级的酰胺可溶于水,N,N-二甲基甲酰胺和N,N-二甲基乙酰胺是很好的非质子性溶剂,可与水以任何比例混合。
乙酸乙酯是很好的有机溶剂,大量用于油漆工业。
3.羧酸衍生物的反应1)酰基碳上的亲核取代反应①酰基碳上的亲核取代反应概述基团离去能力的次序是:I- > Br- > Cl- > -OCOOR > -OR > -OH > -NH2(氨基的碱性比氢氧根强)不管是酸催化还是碱催化的机理,羧酸衍生物亲核取代反应性顺序都是:卤酐醛酮(活泼)酯酸胺腈(较稳定)②羧酸衍生物的水解——形成羧酸a)酰卤的水解在羧酸衍生物中,酰卤的水解速率很快,低分子酰卤水解很猛烈,如乙酰氯在湿空气中会发烟,这是因为乙酰氯水解产生盐酸。
胡宏纹《有机化学》课后习题及详解(羧酸衍生物)【圣才出品】

第14章羧酸衍生物
1.推测下列化合物的结构。
提示:
答:各化合物的结构如下:
2.分离下列混合物。
(1)丁酸和丁酸丁酯
解:提纯一个化合物是要去掉其中的杂质。
分离一个混合物,则是要把其中各个组分一一分离,并使其达到一定的纯度。
例如,提纯由丁酸合成的丁酸丁酯,只要用碱洗去其中所含少量丁酸,而后蒸馏纯化,以得到丁酸丁酯。
而分离丁酸和丁酸丁酯的混合物,两种组分
都要分离提纯。
(2)苯甲醚、苯甲酸和苯酚。
(3)丁酸、苯酚、环己酮和丁醚。
(4)苯甲醇、苯甲醛和苯甲酸。
答:(1)略。
(2)分别用NaHCO3,NaOH溶液使三者分开,再各自分离提纯。
(3)分别用NaHCO3,NaOH和饱和NaHSO3溶液使四者分开,再各自分离提纯。
(4)分别用NaHCO3,饱和NaHSO3溶液使三者分开,再各自分离提纯。
3.推测下列反应的机理。
(提示:分子内的Claisen反应称为Dieckmann反应,它与Claisen反应都是可逆反应。
)
答:
(3)
4.下列化合物应如何合成?
答:(1)
(2)略。
(3)略。
第十四章 羧酸衍生物

R—C—X 酰卤
(腈由于与羧酸关系密切故被纳入羧酸衍生物)
2
★命名
1. 酰卤和酰胺根据相应的酰基来命名
O R—C—OH - —OH O R—C— [酰基]
羧酸去掉-OH后剩下的部分叫酰基
O CH3C Cl 乙酰氯
O HCN(CH3)2 N,N-二甲基甲酰胺 (DMF)
O C Br 苯甲酰溴
O
O CH2 CH
化合成的酯,也可将一个低沸点醇的酯转为高沸
点醇的酯。
12
★3. 酰氯、酸酐、酯和酰胺酸解
酰氯、酸酐、酯和酰胺与另一羧酸一起加热, 都得到平衡混合物。
O R C Cl
O O
O C R'
O R' C
O
Cl
O
R C O C R
'R C O C R
O
O R C OR'
O R C NH2
+ HO
O 'R C O OR'
酯水解反应机理: 碱催化(B) 酸催化(A)
H
+
或-OH
O RCOH + HOR´
酰氧断裂(Ac)
烷氧断裂(Al)
单分子 双分子
碱性水解
酸性水解
BAc2:碱性双分子酰氧断裂 AAc2:酸性双分子酰氧断裂
AAc1:酸性单分子酰氧断裂
注意:酯的碱性水解 是不可逆的;碱既是 BAl2: 碱性双分子烷氧断裂 催化剂又是试剂。
O
X
O
HX
O R C NR2'' +
HO O R'
R C O C R' + H NR2''
羧酸衍生物
4. 酰胺的命名
O R
R R
O H C N
C
O C O C
NH2
NHR ′ ′ NR2
O
某酰胺
CO CO NH
N-某基某酰胺
N,N-二某基某酰胺
O
NH
丁二酰亚胺
CH3 CH3
O
NH
CH2
CHC NH2
丙烯酰胺
N,N-二甲基甲酰胺 己内酰胺 (DMF)
O
邻苯二甲酰亚胺
三、羧酸衍生物的光谱性质
1. IR
O R C OR' + HCl (碱吸收)
Et3NHCl or N HCl
合成上用于制备酯
O R C OH
SOCl2
O R C Cl
R'OH Et3N or 吡啶 R
O C OR'
优点:反应完全,产率好,特别适用于仲醇和叔醇的酯。 如香料乙酸薄荷酯。
酸酐的醇解反应
O R
O
R'OH
O R C OR' + R
酸酐:C = O ~1820,~1760 cm-1 ; C—O ~1100 cm-1
共轭,移向低频
酯:C = O ~1740 cm-1,共轭移向低频 C—O 1300~1000 cm-1 两个吸收峰(两个C-O)
酰胺:C = O ~1690 cm-1, N—H 3500~3100 cm-1
2. NMR 酯:
COOC2H5 + ?
H3O+
OH
MgBr
2) 羧酸衍生物与 R2Cd 和 R2CuLi 的反应
R'2Cd R O C Cl R'2CuLi
(二) 羧酸衍生物

Nu-:进攻的亲核试剂,即H2O、ROH、NH3、RNH2或R2NH等。
L-:离去基团,即X、-OOCR 、-OR、-NH2、-NHR或-NR2
总的反应速度和两步反应的速度都有关系,但第一步更为重要。酰基中羰基碳原子是sp2杂化,三个σ键是平面形分布。羰基碳上如果连有吸电子基团,将增加羰基碳的正电性,有利于亲核试剂的进攻;反之,如果连有供电子基团,将不利于亲核试剂的进攻。亲核加成生成的中间体,其碳原子为sp3杂化,即四面体结构。如果原来羰基碳原子上连接的基团过于庞大,在四面体结构中就显得过于拥挤而不利于反应进行。上述电子效应和空间效应都将对第一步的反应速度有所影响。第二步反应易否进行,取决于离去基团L-的碱性,碱性越弱,越易离去。羧酸衍生物各离去基团离去的难易次序为:
在有机合成中酯的还原是使羧酸间接转变为伯醇的重要方法,因为羧酸的还原比酯困难。
14.8.3 α-氢化反应
羧酸衍生物分子中的α-氢由于受羰基影响(σ-π超共轭和吸电诱导效应),比较活泼,与醛酮相似,在一些碱性试剂催化下可以发生缩合反应。在有机合成中酯缩合反应应用较多。
由于酯的α-H酸性小于醛酮,也小于酰氯(但大于酰胺),所以酯缩合用的碱是醇钠或其他碱性催化剂(如氨基钠)而不是氢氧化钠的水溶液。酯在强碱作用下发生分子间的缩合反应,称为(Claisen)酯缩合反应,在制备β-二羰基化合物时很有用。
一般克莱森酯缩合反应是在两个相同的酯之间进行。虽然我们可以进行混合酯的交叉缩合反应,即采用两种不同的酯,但产物太复杂,没有实用价值,除非一个酯有α-氢,一个酯没有α-氢,才有制备意义。例如草酸乙酯、苯甲酸酯、甲酸酯等都是不含α-氢的酯,可用于交叉酯缩合反应。这时产物比较纯。
己二酸酯和庚二酸酯在醇钠作用下主要是发生分子内的酯缩合反应,称为狄克曼(Dieckmann) 缩合反应,生成环状的β-酮酸酯。
羧酸衍生物-有机化学

/
HCl
水解反应的活性次序是: 酰卤 > 酸酐 > 酯 > 酰胺 [提示]
羧酸衍生物易水解,在使用和保存含有该类结构 的药物时应注意防止水解失效。某些易水解的药物, 如含有酰胺结构的氨苄西林钠注射剂,都是在临用 时再加水配成注射液。许多酯类和酰胺类药物在一 定的pH范围内较稳定,配成水溶液时,必须控制溶 液的pH。羧酸衍生物类药物的注射剂消毒灭菌时, 应注意控制温度和时间。
酮式
O H
烯醇式
O
CH3 C CH C OC2H5
★ 凡是具有 H-C-C=O 基本结构的化合物都可能 发生酮式-烯醇式互变异构现象。 ★互变异构现象在其它化合物中也常见。 例如:
H O C N OH C N
S H C N
SH C N
第十章
羧酸衍生物
(carboxylic acid derivatives) 指羧酸分子中的羟基被其他原子或基 团取代后所生成的化合物。 包括 酰卤(acylhalide) 酸酐(anhydride) 酯(ester) 酰胺(amide)等,
ቤተ መጻሕፍቲ ባይዱ
它们的结构通式如下:
O R C O O R C OH R C O R C O R C NH2
CH3 C Cl + H2O
O
O
CH3 C OH + HCl↑
加热
CH3 CH3
C O C O + H2O 2 CH3COOH
加热 酸碱 加热 回流
O R C OR + H2O
O R C NH2 + H2O
NaOH
/
O
NaOH
R C ONa + ROH
O R C O R C ONa + NH3↑ OH + NH4Cl
羧酸的衍生物

羧酸的衍生物
工业上,在合成纤维“涤纶”的生产中就利用了酯交换反应。 通过酯交换反应可以从廉价的低级醇来制备高级醇。例如: 酰胺的醇解反应是可逆的,需要过量的醇才能生成酯并释放出氨。
羧酸的衍生物
3. 溶解性
所有羧酸衍生物均能溶于乙醚、氯仿、丙酮、苯等有机 溶剂。酰卤和酸酐遇水就分解,酯在水中的溶解性很低,但 低级的酰胺(如N,N-二甲基甲酰胺)能与水混溶,是优良的 非质子极性溶剂。
部分羧酸衍生物的物理常数列于表11-4。
羧酸的衍生物
表11-4 部分羧酸衍生物的物理常数
羧酸的衍生物
羧酸的衍生物
(2)酸酐的命名
酸酐的名称是由两个羧酸的名称加上“酐”字来命名。相 同羧酸形成的酸酐称为单酐;不同羧酸形成的酸酐称为混酐。 混酐命名时,通常将简单的羧酸写在前面,复杂的羧酸写在 后面。例如:
羧酸的衍生物
(3)酯的命名
酯的名称是由相应的羧酸和醇中的烃基名称组合后加“酯” 字来命名的。例如:
羧酸的衍生物
4. 还原反应
(1)催化加氢
羧酸衍生物在催化加氢条件下都可以被还原,但一般具有制备意 义的是酰卤的选择性还原和酯的还原。
酰卤选择性加氢的催化体系是Pd/BaSO4-硫-喹啉(或硫脲),此 催化体系可使酰卤的加氢反应停止在生成醛的阶段,称为罗森门德 (Rosenmund)反应,这是一种制备醛的方法。
的杂原子(X、O、N)上都具有未共用电子对,它们所占据的p轨道
与羰基的π轨道形成p-π共轭体系,未共用电子对向羰基离域,使C-L
键具有部分双键的性质。因此,羧酸衍生物的C-L键较典型的单键C-L
《羧酸衍生物 》课件

羧酸衍生物可以与醇反应,生成酯类物质,常用于酯化反应的有机合成。
3 加成反应
羧酸衍生物可通过加成反应与其他有机物发生化学反应,生成功能化的有机化合物。
羧酸衍生物的应用领域
1
染料领域
2
羧酸衍生物在染料的合成和染色工艺中
起到重要的作用,用于改善染料的染色
性能和稳定性。
3
食品工业
4
羧酸衍生物在食品工业中可以作为调味 剂、增酸剂和防腐剂等添加剂。
医药领域
羧酸衍生物广泛应用于药物研发领域, 用于合成医药品、制药工艺中的反应催 化剂等。
聚合物领域
羧酸衍生物可作为聚合物的功能单体, 用于合成具有特定性能的聚合物材料。
羧酸衍生物的市场前景
市场需求增长 技术创新推动 环境友好性
羧酸衍生物的应用领域广泛,市场需求稳步增长, 尤其是在医药、染料和聚合物等领域。
酯化反应是将羧酸与醇反应生成酯类产物的方法, 常用酯化剂包括酸、酸酐等。
羰基化反应
羰基化反应是将羧酸与羰基化试剂反应生成酮类产 物的方法,常用羰基化试剂包括酰氯、酸酐等。
特殊制备方法
特定的有机化学反应可用于制备特定的羧酸衍生物, 例如将邻羟基苯甲酸酰化得到苯甲酸。
羧酸衍生物的化学性质
1 酸性性质
羧酸衍生物具有酸性,可以与碱发生中和反应,生成相应的盐和水。
随着科学技术的进步,对羧酸衍生物性能的研究 和改良不断推动着羧酸衍生物市场的发展。
羧酸衍生物具有较好的环境友好性,符合环保趋 势,因此在绿色化学领域具有广阔的市场前景。
总结
通过本课件的学习,我们了解了羧酸衍生物的定义、结构特点、制备方法、 化学性质、应用领域以及市场前景。希望这些知识能够对大家有所启发。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
水溶性: 低级酰胺溶于水。 N,N-二甲基甲酰胺和N,N-二 甲基乙酰胺可与水混溶,是很好的非质子极性溶剂.
14.3 酯的水解
一、酯水解历程
RCOOR ′ + 水解 H2O 酯化 RCOOH + R ′OH
要解决的问题:
① 断键方式;
② 单分子历程还是双分子历程。
1. 碱性水解
•实验事实:
(1)断键方式:酰氧键断裂(同位素结果) (2)反应历程:双分子历程(相关数据) 皂化速率 v=k[RCOOR][OH-]
第十四章 羧酸衍生物
羧酸中的羟基被其它的原子或原子团所取代——酰卤, 酸酐,酯和酰胺
O R C X R O C O O C R R O C OR R O C NH2
14.1 结构和命名
酰卤
酸酐
酯
酰胺
14.2 物理性质
14.3 酯的水解 14.4 互相转变
14.5 其他羧酸衍生物
14.6 乙酰乙酸乙酯和丙二酸二乙酯
H3O △
+
R CHCOOH ′ R
用二卤代物制备环状化合物
例:制备
COOH
思路:找出目标产物的结构单元,确定烷基化 试剂或酰基化试剂
Br
COOH
CH COOH
Br
CH2(COOCH2CH3)
具体反应式:
Br Br
CH Br
CH2
COOC2H5 NaOC2H5 COOC2H5
COOC COO-
H2 C H2C C C H2
R R
C
O C O C
O
NH2
NHR ′ ′ NR2
CH3 CH3
某酰胺
N-某基某酰胺
N,N-二某基某酰胺
O NH
O NH O
H
C N
N,N-二甲基甲酰胺 (DMF)
己内酰胺
邻苯二甲酰亚胺
14.2 羧酸衍生物的物理性质
酰胺有分子间氢键缔合作用,故除甲酰胺外,其他酰胺均为 固体,氮上氢被取代后,沸点和熔点显著降低:
O CH3C CH R
O C OH + C2H5OH
β-酮酸
制备甲基酮 CH3COCHR
△ 脱羧
O CH3C CH2 + CO2 R
4、乙酰乙酸乙酯合成法
O
RX B
O
(1) 烯碱 (2)H+, 加热
CH3CCHCOC2 H5 R
O
H2CR
(1) 烯碱 (2)H+, 加热
② 离去基团的稳定性 L越稳定,越易形成,离去活性越大。 稳定性:
14.5 其它羧酸衍生物
腈 烯酮 原酸酯 过氧酸和二酰基过氧化物 内酯 碳酸衍生物
过氧酸和二酰基过氧化物
14.6 乙酰乙酸乙酯和丙二酸二乙酯
O O O H O CH3CCHCOC2H5 H 乙酰乙酸乙酯 C2H5OCCHCOC2H5
COOC2H5 COOC2H5
稀 OH
CH2 CH2
H3O △
+
COOH
作业: 14.3;14.4;习题:2;3;4
O R C OMe
故不是SN2,而是BAC2(碱催化、
酰氧键断裂、双分子历程)
+
18
OH
-
BAC2历程:
慢 HO + R C OR ′
O R C OH + R ′O
O <
O
O
-
[ R C OR ′ ] OH
快
O
-
R C O + R′OH
因为 碱性: R C O 逆,可进行到底。
′ RO
所以不易夺取醇中的氢质子,碱催化水解反应不可
2. 酸性水解
(1)断键方式:
酰氧键断裂
(2)反应历程-酸性双分子酰氧断裂AAC2
慢
H
ν=k [RCOOCH3][H+]
AAC2(酸催化、酰氧键断裂、双分子历程) 酯水解就是酯化反应的逆过程。
(3)特殊结构的酯水解 酰基中R位阻大,按AAC1历程 烷氧基中R为3°,按AAL1历程
两种异构体之间发生可逆异构化作用,通常伴有H原 子及双键的位置转移。 烯醇式的比例由其稳定性决定。
H
O H3C C
O H C CH 3 CH
O H3C C CH
O
分子 内 氢 键
C CH3
稳 定的 六 元闭 合 环
3、乙酰乙酸乙酯的烃化和水解——酮式分解
酯水解继而脱羧
O CH3C CH R O C OC2 H5 稀 OH -
O CH3COCH2 CH2CR
CH3CCHCOC2 H5 CH2CR O
二、丙二酸二乙酯 1.制备
ClCH2COOH NaCN NaOH CNCH2COONa
C2H5OH H2SO4 CH2 COOC2H5 COOC2H5
特点:① 易水解脱羧
CH2(COOC2H5)2 稀 OH COOH CH2 COOH
丙二酸二乙酯
1,3-二羰基化合物结构特点: 含有活泼的亚甲基氢(双羰基的-I效应影响), 强碱下可形成稳定的碳负离子(p-π共轭)。
一、乙酰乙酸乙酯
1、乙酰乙酸乙酯的合成——Claisen缩合反应
2、乙酰乙酸乙酯的酮—烯醇平衡
O
O
室 温
OH
7%
O
CCHCOC2H5 CH3 H 93%
CH3C CHCOC2H5
14.4 羧酸衍生物的互相转变
1、水解
2、醇解
3、酸解-形成平衡混合物
4、氨解
羧酸衍生物的水解、氨解、醇解
都是加成-消除历程。
O R C L + Nu 慢 O [ R C Nu L ]
快
O R C Nu L +
• 反应活性:酰卤>酸酐>酯>酰胺
活性顺序的原因: ① 羰基碳的正电性 与羰基相连的基团-I越强,活性越大。
O O CH3 COCCH3
O C R
(R=R′)某酐
(R≠R′)某某酸酐
O O O
O O O
O O CH3 COCCH2 CH3
顺丁烯二酸酐 (顺酐)
乙酸酐 (乙酐)
乙丙酸酐 (乙丙酐)
邻苯二甲酸酐 (苯酐)
3. 酯的命名
O R C OR
某酸某酯
O CH3COC2H5
乙酸乙酯
4. 酰胺的命名
O R
△
CH3COOH
② 活泼亚甲基易被烃基或酰基取代
2. 丙二酸二乙酯的应用 (1)制备一元羧酸:
R′ CHCOOH RCH2COOH R
RX B
COOC2H5 稀 OH R CH R CH COOC2H5
COOH H+O 3 COOH
△
RCH2COOH
① NaOC2H5 ② R′X COOC2H5 稀 OH R C ′ R COOC2H5
假设——两种可能的历程:
S N 2:
加成-消除:
O HO + R C OMe O O R C OH + OMe
[ R C OMe ] OH
如果是SN2,当反应尚未完全时,未水解的酯中 18O相对酯的含量应不变,但实际测得其含量减 少,说明发生了18O的交换。
18O的交换——质子转移
18
OH
[ R C OMe ] O
14.1 羧酸衍生物的结构和命名
羧酸分子中的羟基被其他原子或基团取代后 的化合物 ——羧酸衍生物。
O O X R C O O C R R O C OR R O C NH2
R
C
酰卤
酸酐
酯
酰胺
1. 酰卤的命名
O R C X
某酰某
酰基名称+卤素名称
O CH3CCl
乙酰氯
2. 酸酐的命名
O R′ C O
