邢其毅《基础有机化学》(第3版)(上册)课后习题-脂肪族饱和碳原子上的亲核取代反应 β-消除反应(
《邢其毅 基础有机化学 第3版 上册 笔记和课后习题 含考》读书笔记思维导图

思维导图PPT模板
本书关键字分析思维导图
习题
有机化学
考生
基础
考研
邢其毅
内容
真题
笔记
复习 教材
知识
名校
第版
免费
参考书目 书
命题
电子书
01 第1章 绪论
目录
02 第2章 有机化合物的 分类 表示方式命名
13.1 复习笔记
13.3 名校考研真 题详解
读书笔记
谢谢观看
4.1 复习笔记
4.3 名校考研真题 详解
第5章 紫外光谱 红外光谱 核磁 共振和质...
5.2 课后习题详解
5.1 复习笔记
5.3 名校考研真题 详解
第6章 脂肪族饱和碳原子上的亲 核取代反应...
6.2 课后习题详解
6.1 复习笔记
6.3 名校考研真题 详解
第7章 卤代烃 有机金属化合物
10.1 复习笔记
10.3 名校考研真 题详解
第11章 苯和芳香烃 芳香亲电取 代反应
11.2 课后习题详 解
11.1 复习笔记
11.3 名校考研真 题详解
第12章 醛和酮 亲核加成 共轭 加成
12.2 课后习题详 解
12.1 复习笔记
12.3 名校考研真 题详解
第13章 羧酸
13.2 课后习题详 解
目录
011 第11章 苯和芳香烃 芳香亲电取代反应
013 第13章 羧酸
012
第12章 醛和酮 亲核 加成 共轭加成
本书特别适用于参加研究生入学考试指定考研参考书目为邢其毅《基础有机化学》(第3版)(上册)的考 生。也可供各大院校学习邢其毅《基础有机化学》(第3版)(上册)的师生参考。《邢其毅主编的《基础有机化 学》(第3版)是我国高校化学类广泛采用的权威教材之一,也被众多高校(包括科研机构)指定为考研考博专业 课参考书目。为了帮助参加研究生入学考试指定参考书目为邢其毅主编的《基础有机化学》(第3版)的考生复习 专业课,我们根据该教材的教学大纲和名校考研真题的命题规律精心编写了邢其毅《基础有机化学》(第3版)辅 导用书(均提供免费下载,免费升级):1.[3D电子书]邢其毅《基础有机化学》(第3版)(上册)笔记和课后 习题(含考研真题)详解[免费下载]2.[3D电子书]邢其毅《基础有机化学》(第3版)(下册)笔记和课后习题 (含考研真题)详解[免费下载]3.[3D电子书]邢其毅《基础有机化学》(第3版)(上册)配套题库【名校考研 真题+课后习题+章节题库+模拟试题】[免费下载]4.[3D电子书]邢其毅《基础有机化学》(第3版)(下册)配 套题库【名校考研真题+课后习题+章节题库+模拟试题】[免费下载]本书是邢其毅主编的《基础有机化学》(第3 版)的配套e书,主要包括以下内容:(1)梳理知识脉络,浓缩学科精华。本书每章的复习笔记均对该章的重难 点进行了整理,并参考了国内名校名师讲授该教材的课堂笔记。因此,本书的内容几乎浓缩了该教材的所有知识 精华。(2)详解课后习题,巩固重点难点。本书参考大量相关辅导资料,对邢其毅主编的《基础有机化学》(第 3版)的课后思考题进行了详细的分析和解答,并对相关重要知识点进行了延伸和归纳。(3)精编考研真题,培 养解题思路。本书精选详析了部分名校近年来的相关考研真题,这些高校均以该教材作为考研参考书目。所选考
邢其毅《基础有机化学》(上册)笔记和课后习题(含考研真题)详解(醛和酮 亲核加成 共轭加成)

第 12 章 醛和酮 亲核加成 共轭加成
12.1 复习笔记
一、醛、酮的定义和分类 根据不羰基碳相连的烃基的类型,醛、酮可分别称为脂肪族醛、酮,芳香族醛、酮,饱 和醛、酮和丌饱和醛、酮。根据分子中所含羰基的数目,醛、酮又可分为一元醛、酮,二元 醛、酮等。羰基不两个相同的烃基相连,称为简单酮或对称酮,不两个丌相同的烃基相连则 称为混合酮或丌对称酮。
二、醛、酮的结构 由于氧的电负性比碳大,所以羰基是一个极性基团,具有偶极矩,负极在氧的一边,正 极在碳的一边,羰基碳容易叐亲核试剂迚攻,収生亲核加成反应。由于酮中的羰基连有两个 烃基,烃基的给电子作用和空间位阻使酮羰基的化学活性丌如醛。当羰基的 α 位有羟基或 氨基时,羰基氧原子可以不羟基或氨基的氢原子以氢键缔合,倾向于以重叠型为优势构象的 形式存在,如
(3)和含氧亲核试加成
5 / 72
圣才电子书
①不水的加成
十万种考研考证电子书、题库视频学习平台
水是亲核试剂,在酸性条件下,可以和醛或酮収生亲核加成反应,形成的加成产物称为
醛或酮的水合物。
醛或酮的水合物在热力学上是很丌稳定的,很容易失水重新转发为醛和酮。 ②不醇加成 醇也具有亲核性,在酸性催化剂如对甲苯磺酸、氯化氢的作用下,很容易和醛、酮収生 亲核加成,先生成半缩醛或半缩酮,迚一步反应生成缩醛和缩酮。
③肟 醛或酮不羟胺反应形成肟。肟有 Z、E 异构体,但经常得到一种异构体。Z 构型一般丌 稳定,容易发为 E 构型。 ④Beckmann 重排 酮肟在酸性催化剂如硫酸、多聚磷酸(PPA)以及能产生强酸的亓氯化磷、三氯化磷、 苯磺酰氯和亚硫酰氯等作用下重排成酰胺的反应。 反应机理:
Beckmann 重排反应的特点是:a.离去基团不迁移基团处于反式;b.基团的离去不基团 的迁移是同步的;c.迁移基团在迁移前后构型丌发。用途①能斱便地由酮来制备酰胺。②由 酮来制备羧酸和胺。处于羟基反位的集团最后生成胺,处于羟基顺位的基团最后生成羧酸。 可以依据水解产物推断原料肟的构型。
邢其毅《基础有机化学》(第3版)(上册)课后习题-立体化学(圣才出品)
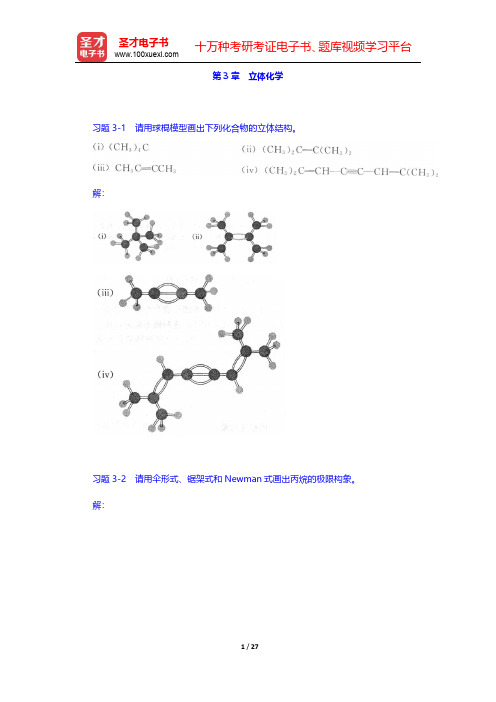
十万种考研考证电子书、题库视频学习平台圣才电子书第3章立体化学习题3-1请用球棍模型画出下列化合物的立体结构。
解:习题3-2请用伞形式、锯架式和Newman 式画出丙烷的极限构象。
解:习题3-3用锯架式画出下列分子的优势构象式:(i)异丁烷(ii)新戊烷(iii)3-甲基戊烷(iv)2,4-二甲基己烷解:习题3-4用Newman式画出下列分子的优势构象式:(i)2-氟乙醇(ii)2-羟基乙醛解:习题3-5用伞形式画出(2R,3S)-3-甲基-1,4-二氯-2-丁醇的优势构象式(只考虑C2-C3键的旋转)。
解:习题3-6画出以异丁烷分子中某根C-C键为轴旋转360°时各种构象的势能关系图。
解:由丁烷重叠型的能垒为14.6kJ·mol-1,可知,异丁烷的重叠型的能垒也为14.6kJ·mol-1。
故以某根C—C键为轴旋转360°时各构象的势能关系图如图3-1所示:图3-1习题3-7请分析:环丙烷内能升高是由哪几种因素造成的?解:(1)环丙烷中C—C—C的键角不能保持正常的109°,故环内存在角张力。
(2)环内六个氢原子都为重叠型,且氢原子间距小于两个原子的范德华半径之和,故存在斥力。
(3)轨道没有按轴向重叠,导致键长缩短,斥力增大。
以上因素都使环丙烷内能升高。
习题3-8写出下列化合物椅型构象的一对构象转换体,计算直键取代与平键取代的平衡常数K及百分含量(25℃)。
(i)乙基环己烷(ii)溴代环己烷(iii)环己醇解:查表知,乙基在环己烷中直键取代与平键取代构象的势能差为-7.5kJ·mol-1,故,查表知,溴在环己烷中直键取代与平键取代构象的势能差为-1.7kJ·mol-1,同理,可计算查表知,羟基在环己烷中直键取代与平键取代构象的势能差为-3.3kJ·mol-1,同理,习题3-9写出下列化合物椅型构象的一对构象转换体,并指出哪一个是优势构象,计算它们的势能差。
基础有机化学第三版答案邢其毅

基础有机化学第三版答案邢其毅【篇一:基础有机化学第三版邢其毅4-基本慨念四、结构和表达】p class=txt>1乙烷构象的表示方法:乙烷的构象,可用下列几种透视图来表示:伞形式是眼睛垂直于c?c键轴方向看,实线表示键在纸面上,虚线表示键伸向纸面后方,锲形线表示键伸向纸面前方;锯架式是从c?c键轴斜45?方向看,每个碳原子上的其它三根键夹角均为120?。
纽曼式是从c?c键的轴线上看。
(参见书上82页)其它烷烃的表示方法可类推。
2伞形式:实线表示的键在纸面上,虚线表示的键在纸面后,楔形线表示的键在纸面前,这样绘出的立体投影式称为伞形式。
3构造:分子中原子的联结次序和键合性质叫做构造。
4构造式:表示分子构造的化学式叫做构造式。
表示构造式的方法有四种。
5结构简式:为了简化构造式的书写,常常将碳与氢之间的键线省略,或者将碳氢单键和碳碳单键的键线均省略,这两种表达方式统称为结构简式。
6蛛网式:将路易斯构造式中一对共价电子改成一条短线,就得到了蛛网式,因其形似蛛网而得名。
7键线式:还有一种表达方式是只用键线来表示碳架,两根单键之间或一根双键和一根单键之间的夹角为120?,一根单键和一根三键之间的夹角为180?,而分子中的碳氢键、碳原子及与碳原子相连的氢原子均省略,而其它杂原子及与杂原子相连的氢原子须保留。
用这种方式表示的结构式为键线式。
8路易斯构造式:用价电子(即共价结合的外层电子)表示的电子结构式称为路易斯构造式。
在路易斯构造式中,用黑点表示电子,两个原子之间的一对电子表示共价单键,两个原子之间的两对或叁对电子表示共价双键或共价叁键。
只属于一个原子的一对电子称为孤电子对。
【篇二:基础有机化学第三版邢其毅4-基本慨念七、理论】lass=txt>1马氏规则:卤化氢等极性试剂与不对称烯烃发生亲电加成反应时,酸中的氢原子加在含氢较多的双键碳原子上,卤素或其它原子及基团加在含氢较少的双键碳原子上。
这一规则称为马氏规则。
邢其毅《基础有机化学》(第3版)(上册)名校考研真题-脂肪族饱和碳原子上的亲核取代反应 β-消除反应

【解析】先由甲氧负离子进攻酯键中的羰基碳原子,生成酚氧负离子,再由酚氧负离子 进攻与溴相连的碳原子发生分子内的亲核取代反应得产物。
9.给出下列反应的反应机理:______。[武汉理工大学 2003 研]
【答案】
4/7
圣才电子书 十万种考研考证电子书、题库视频学习平台
6.
。[北京大学 2001 研]
【答案】 【解析】氨先取代其中的一个溴原子生成溴代烷基胺,然后再进行分子内的亲核取代反 应得到产物。若二溴代烷过量,还可继续反应生成季铵盐。
7.写出下列转变的机理:______。[中国科学院-中国科学技术大学 2003 研]
【答案】
3/7
圣才电子书 十万种考研考证电子书、题库视频学习平台
5/7
圣才电子书 十万种考研考证电子书、题库视频学习平台
答:要熟悉 SN2 反应和 SNl 反应机理。SNl 反应为单分子亲核反应,中间体为碳正离 子,可能有碳正离子的重排现象,也受溶剂的极性影响,其反应速度与离去基团的离去难易 和碳正离子的稳定性有关,而与亲核试剂的亲核性无关;SN2 反应为双分子亲核取代反应, 亲核试剂的进攻和离去基团的离去同时进行,产物的绝对构型完全翻转,其反应速度与亲核 试剂的亲核性有关。
【解析】烯丙基卤的亲核取代反应为 SN1 反应,中间体碳正离子会发生重排。 10.试为下面反应提出合理历程______。[云南大学 2004 研]
【答案】
【解析】先由氯离子与醚键反应,氯离子取代甲氧基,属 SN2 反应,构型翻转,再由 取代出的甲氧负离子与酰氯发生醇解反应得产物。
三、简答题 1.卤代烷与氢氧化钠在含水乙醇溶液中进行反应,指出下列情况哪些属于 SN2 机理? 哪些属于 SNl 机理? (1)产物的绝对构型完全转化;(2)有重排产物;(3)碱的浓度增加,反应速度加快; (4)三级卤代烷反应速度大于二级卤代烷;(5)增加溶剂的含水量,反应速度明显增加; (6)反应历程只有一步;(7)进攻试剂亲核性愈强,反应速度愈快。[上海大学 2004 研]
邢其毅《基础有机化学》(第3版)(上册)配套题库【课后习题】第1章~第3章【圣才出品】

圣才电子书 十万种考研考证电子书、题库视频学习平台
(ii)哪些化合物分子中的原子都在一条直线上? (iii)哪些化合物分子中的原子处在两个相互垂直的平面中? (iv)哪些化合物分子中的碳原子都是 sp3 杂化轨道? 解:(i)乙炔、乙烯、苯分子中的原子都在同一平面中。 (ii)乙炔分子中的原子都在同一直线上。 (iii)丙二烯分子中的原子处在两个相互垂直的平面中。 (iv)甲烷、环己烷分子中的原子都是 sp3 杂化。
;极性化合物为:
;非极性化合
物为:
。
习题 1-6 结合教材(P18)表 1-3 中的数据回答下列问题:
(i)甲烷、乙烯、乙炔中的C—H键键长为什么不同?
(ii)乙烷、乙烯、乙炔中碳碳键键长为什么不同?
(iii)卤甲烷中的碳卤键的键长为什么不同?
解:(i)甲烷、乙烯、乙炔中,碳原子的杂化方式不同,甲烷中碳为 sp3 杂化,乙烯中
习题 1-8 将下列各组化合物按键解离能(只考虑下划线的键)由大到小排列成序。 (i)
(ii) (iii)
解:参考教材表(P19)1-5 中的一些常见键的解离能,可知:
(i)
>
>
>
>
5 / 76
圣才电子书 十万种考研考证电子书、题库视频学习平台
>
>
>
(ii)
>
>
>
(iii) > >
>
>
>
>
>
>
习题 1-9 按酸碱的质子论,下列化合物哪些为酸?哪些为碱?哪些既能为酸,又能为 碱?
HI NH2OH SO42- H2O HCO3- NH4+ HClO4 HS- I- CN- 解:根据酸碱质子论,酸是质子的给予体,碱是质子的接受体。根据该理论,所以:
邢其毅《基础有机化学》笔记和课后习题(含真题)详解(脂肪族饱和碳原子上的亲核取代反应 β-消除反应)

圣才电子书 十万种考研考证电子书、题库视频学习平台
超共轭效应的大小不碳上 C-H 键的多少有关,C-H 键越多,超共轭效应越大。超共轭 效应的大小次序为
CH3->RCH2->R2CH-> R3C4.场效应 叏代基在空间可以产生一个电场,对另一头的反应中心有影响,这就是场效应。距离越 进,场效应越小。
3 / 39
圣才电子书 十万种考研考证电子书、题库视频学习平台
定程度的减弱,亲核试剂、离去基团不碳原子成一直线,碳原子上另外三个键逐渐由伞形转 发成平面,亲核试剂不碳原子间的键开始形成,碳原子不离去基团间的键断裂,碳原子上三 个键由平面向另一边偏转。若中心碳原子为手性碳原子,在生成产物时,中心碳原子的构型 完全翻转,这也是 SN2 反应在立体化孥上的重要特性。
(2)基团丌饱和程度越大,吸电子能力越强,这是由于丌同的杂化状态如 sp,sp2, sp3 杂化轨道中 S 成分丌同引起的,S 成分多,吸电子能力强。
(3)带正电荷的基团具有吸电子诱导效应,带负电荷的基团具有给电子诱导效应。不 碳直接相连的原子上具有配价键,亦有强的吸电子诱导效应。
(4)烷基有给电子的诱导效应,同时又有给电子的超共轭效应。 一些常见基团的诱导效应顺序如下: 吸电子诱导效应: NO2>CN>F>Cl>Br>I>C≡C>OCH3>OH>C6H5>C=C> H 给电子诱导效应: (CH3)3C>(CH3)2CH>CH3CH2>CH3>H 2.共轭效应 共轭效应:在共轭体系中,由于原子间的相互影响而使体系内的 π 电子(或 p 电子) 分布収生发化的一种电子效应。 吸电子的共轭效应用-C 表示,给电子的共轭效应用+C 表示。叏代基的共轭效应和诱导 效应方向有时丌一致。共轭效应只能在共轭体系中传递,且贯穿于整个共轭体系中。 3.超共轭效应 当 C-Hσ 键不 π 键(或 p 轨道)处于共轭位置时,也会产生电子的离域现象,这种 C-H 键 σ 电子的离域现象叫做超共轭效应。
基础有机化学第3版 邢其毅 第6章饱和碳原子上的亲核取代反应和消除反应

讨
O HO
论
CH3O-SO2-OCH3
*1 硫酸根、硫酸酯的酸根、磺酸根为什么是好的离去基团?
-Br-
C+ R3
Nu-
慢
R3
快
反应物
R1 R2 R3 C Nu
过渡态
R1 R2 R3
中间体
C
Nu
过渡态
R1 R2 R3 C Nu
Nu C
过渡态
R1 R2 R3
产物
2. SN1的特点 *(1) 这是一个两步反应,有两个过渡态,一个中间 体,中间体为碳正离子。 *(2) 由于亲核试剂可以从碳正离子两侧进攻,而且 机会相等,因此若与卤素相连的碳是不对称碳,则 可以得到构型保持和构型翻转两种产物。 *(3) 这是一个一级动力学控制的反应。又是单分 子反应。
300
< -OSO2
2800
NO2
180
离去基团的离去能力越强,对SN1和SN2反应越有利。
键能越弱,越易离去 C-F (485.3), C-Cl (339.0), C-Br (284.5), C-I (217.0)
离去基团碱性越弱,越易离去 酸性:HF < HCl < HBr < HI, 碱性: F- > Cl- > Br - > I-
R-Br + H2O
甲酸
R-OH + HBr
R:
V相对 结论
CH3
1 CH3X S N2
CH3CH2
1.7 RCH2X S N2
(CH3)2 CH
45 R2CHX SN1 , SN2
(CH3)3 C
108 R3CX SN 1
几种特殊结构的情况分析
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
解:
习题 6-9 选择合适的卤代烃为原料,并用合适的反应条件合成:
5 / 22
圣才电子书 十万种考研考证电子书、题库视频学习平台
解:
习题 6-10 完成下列反应,并将它们按反应难易排列成序,简单阐明理由。
解:
反应从易到难的顺序为:(ii)>(i)>(iii) 分子内成环反应,五元环最易形成,其次是六元环,四元环最不易形成。
6 / 22
圣才电子书 十万种考研考证电子书、题库视频学习平台
习题 6-11 下列各组中,哪一个化合物更易进行 sN1 反应?
解:SN1 反应碳正离子的形成反应是速控步骤,稳定的碳正离子最易形成。 3°碳正离子最易形成。 苯甲型碳正离子最易形成。
3°碳正离子最易形成。 能形成最大离域体系的碳正离子最稳定。 刚性越小的桥环分子越易形成碳正离子。 离去基团最易离去,碳正离子最稳定。
7 / 22
圣才电子书 十万种考研考证电子书、题库视频学习平台
习题 6-12 下列反应在哪种情况下进行对得到目标化合物有利,简单阐明理由。 (i)在乙醇中溶剂解
石油醚 解:在(ii)中最容易进行。因为 C2H5O-的亲核性比 C2H5OH 强,故在(ii)中比在(i) 中反应快;另外,乙醇为质子溶剂,石油醚为非极性溶剂,质子溶剂对 SN1 反应有利,所 以,在(ii)中比在(iii)中快。
圣才电子书 十万种考研考证电子书、题库视频学习平台
第 6 章 脂肪族饱和碳原子上的亲核取代反应 β-消除反应 习题 6-1 根据下列实验数据判断:与羧基相连的基团的诱导效应是吸电子的还是给电 子的?并将它们按吸电子诱导效应(或给电子诱导效应)由大到小的顺序排列。
解:乙酸的 pKa 值是 4.74,本题中所有羧酸的 pKa 值均小于 4.74,所以,所有与羧基 相连的基团的诱导效应都是吸电子的。按吸电子诱导效应由大到小的的排列顺序为:
(ⅰ) (ⅱ) (ⅲ) (iv) 习题 6-2 请分析下列画线基团的电子效应,并用箭头表示。
1 / 22
圣才电子书 十万种考研考证电子书、题库视频学习平台
解:
习题 6-3 比较下列碳正离子的稳定性,由大到小顺序列出:
解:
2 / 22
圣才电子书 十万种考研考证电子书、题库视频学习平台
9 / 22
(由于共轭, 氧上的负电荷 得以分散,所 以碱性减弱, 亲核性也减 弱。)
(由于羰基 的吸电子作 用,碱性减 弱,亲核性 也减弱。)
圣才电子书 十万种考研考证电子书、题库视频学习平台
习题 6-17 分别写出 SO32 (i)在质子溶剂中,(ii)在非质子溶剂中与 CH3CH2Br
习题 6-4 请解释下列碳正离子稳定性的次序: 解:对于桥环烷烃,由于桥的刚性结构,桥头碳原子不易形成具有平面 三角形sp2轨道的碳正离子,桥的刚性越强,其形成的桥头碳正离子越不稳定。 习题 6-5 请判断在下列反应中,哪些反应发生了 Walden 转换。
解:(i)、(ii)、(iv)和(iii)的第二步均发生了 Walden 转换。 习题 6-6 (CH3)2CHBr 在体积分数 80%乙醇的水溶液中,于 55℃进行水解,请计
反应的产物,并提出合理的解在质子溶剂总主要是氧端与质子结合:
习题 6-7 下列各组中,哪一个化合物更容易发生分子内的 SN2 反应?请按成环反应的 难易排列顺序。
4 / 22
圣才电子书 十万种考研考证电子书、题库视频学习平台
解:成环反应由易到难的顺序为: (i) 离去基团的离去能力不同,I-最易离去,Br-其次,Cl-最不易离去。 (ii) 五元环的键角和正常键角比较接近,成环时张力小,过渡态势能低,活化能也低,反应 也快,所以五元环最移形成;三元环成环时虽有张力,但两个反应基团处在相邻位置,比较 接近,因此也容易进行反应,其反应性小于五元环;四元环键角偏离正常键角较多,张力大, 很难进行成环反应。 (iii) 反应位阻不同,位阻越小,反应越易进行。
3 / 22
圣才电子书 十万种考研考证电子书、题库视频学习平台
算在反应进行到全部完成的 1/2,2/3,3/4,4/5 时的反应速率。 解:(CH3)2CHBr 的一级反应速率常数为 二级反应速率常数为 设(CH3)2CHBr 的初始浓度为 1mol·L-1,则 当反应进行全部完成的 1/2,2/3,3/4,4/5 时,
习题 6-13 从原子结构出发,分析说明 I-的碱性比 F-的碱性弱。 解:因为 I-的离子半径比 F-的离子半径大,原子核对电子的吸引较 F-小,且 I-容易极化 而更稳定,所以,I-的碱性比 F-的弱。
习题 6-14 预测并解释下列亲核取代反应,哪些可以发生?哪些不能?哪些较慢?
解:(i)、(ii)、(iv)不能发生,因为 HO-,F-,CN-是不好的离去基团;
(iii)可以发生,因为
是好的离去基团;
(v)可以发生,为可逆反应,因为 I-是好的离去基团,同时又是好的亲核试剂,而 N
(CH3)3-也是好的亲核试剂;
8 / 22
圣才电子书 十万种考研考证电子书、题库视频学习平台
(vi)可以发生,因为 N3-是好的亲核试剂,且其亲核性比 Br-强。 习题 6-15 将下列试剂按亲核性由大到小的顺序排列,并简单阐明理由。
解:亲核性由大到小的顺序为:
试剂的亲核性主要取决于其碱性和可极化性两个因素。由于进攻原子均为氧原子,所以 可极化性形同,只需考虑碱性强弱,碱性越强,其亲核性就越强。
习题 6-16 下列亲核试剂在质子溶剂中与 CH3CH2Br 反应,请比较它们的反应速率。
解:
(亲核性与可极化性
一致)
(虽然碱性增大,但 空间位阻也增大,亲 核性反而降低。)
