高一化学 原子结构
高一化学教案原子结构与元素周期表

高一化学教案原子结构与元素周期表高一化学教案:原子结构与元素周期表一、引言化学是研究物质组成、性质及其变化规律的科学。
原子结构与元素周期表是化学中重要的基础概念,对于理解和掌握化学知识有着不可忽视的作用。
本教案将介绍原子结构和元素周期表的基本原理和规律。
二、原子结构1. 原子的基本构成原子由质子、中子和电子三种基本粒子组成,其中质子和中子位于原子核中心的核子中,电子则以电子云的形式环绕着核子。
2. 质子与电子的性质质子具有正电荷,电荷量为1.6×10^-19库仑;电子则具有等量的负电荷。
原子内外的电荷数相等,使得原子整体呈电中性。
3. 原子序数与质子数原子序数是元素在元素周期表中的位置,也是核中质子的数目。
每个元素都有唯一的原子序数,用以区分不同元素。
例如,氢的原子序数为1,氧的原子序数为8。
4. 中子数与同位素中子是原子中无电荷的粒子,中子数等于质子数减去原子序数。
具有相同质子数但不同中子数的同一元素被称为同位素。
例如,氧的三种同位素分别是^16O,^17O和^18O。
三、元素周期表1. 元素周期表的组成元素周期表是按照元素原子序数的增序排列的。
它将元素分为若干周期和若干族,以便于对元素的性质和规律进行研究。
2. 周期性规律周期表中的横行称为周期,周期数与元素能级的最大数目有关。
每个周期的最后一个元素具有特殊的化学性质,称为稀有气体。
3. 原子半径的变化规律在同一周期中,原子半径逐渐减小;而在同一族中,原子半径逐渐增加。
这是由于原子核电荷增加和电子层数增加导致的。
4. 电离能的变化规律电离能是指从一个原子中移走一个电子所需的能量。
在同一周期中,电离能逐渐增加;而在同一族中,电离能逐渐减小。
5. 原子与元素化合价的关系元素化合价是指元素在化合物中能够与其他元素结合的价态数。
根据元素的电子排布规律和元素周期表的结构,可以推断出元素的化合价。
四、教学设计1. 目标通过本节课的学习,学生将能够理解原子结构和元素周期表的基本原理和规律,并能运用这些知识解释和预测化学现象。
原子结构的高一化学教案

原子结构的高一化学教案一、教学目标1.理解原子结构的基本概念,包括原子核和电子云。
2.掌握原子核组成、原子序数、质子数、中子数和电子数之间的关系。
3.学习原子的电子排布规律,了解能级和轨道的概念。
4.培养学生的观察能力、实验能力和分析能力。
二、教学重点与难点1.教学重点:原子结构的基本概念,原子序数与电子排布规律。
2.教学难点:原子轨道的概念,电子排布规律。
三、教学过程1.导入新课(1)提问:同学们,你们知道什么是原子吗?原子由哪些部分组成?(2)引导学生回顾初中阶段学过的原子结构知识。
2.基本概念(1)讲解原子结构的基本概念,包括原子核、电子云、原子序数、质子数、中子数和电子数。
(2)展示原子结构模型,让学生直观地了解原子结构。
3.原子核组成(1)讲解原子核的组成,包括质子和中子。
(2)介绍原子序数与质子数、中子数的关系。
4.电子云与能级(1)讲解电子云的概念,让学生理解电子在原子核外部的分布。
(2)介绍能级的概念,解释电子在能级上的分布规律。
5.原子轨道(1)讲解原子轨道的概念,让学生了解电子在轨道上的运动状态。
(2)展示不同能级、不同轨道的电子排布图,让学生直观地了解电子排布规律。
6.电子排布规律(1)讲解电子排布规律,包括能量最低原理、泡利不相容原理、洪特规则。
(2)通过实例,让学生学会如何根据电子排布规律推断元素的性质。
7.实践与探究(1)让学生分组讨论,根据电子排布规律推断给定元素的原子序数。
8.课堂小结(2)布置作业,巩固所学知识。
四、课后作业1.解释原子序数、质子数、中子数和电子数之间的关系。
2.根据电子排布规律,推断给定元素的原子序数。
3.列出常见元素的原子序数和电子排布。
五、教学反思1.加强与学生互动,提高学生的参与度。
2.针对不同层次的学生,适当调整教学内容和难度。
3.加强课后辅导,帮助学生巩固所学知识。
重难点补充:一、教学过程3.原子核组成(2)教师:同学们,原子序数其实就等于原子核内质子的数量,它决定了元素的化学性质。
原子的结构高一知识点梳理

原子的结构高一知识点梳理在高中化学学习中,原子的结构是一个非常重要的知识点。
它涉及到原子的组成成分、结构和性质,对于了解化学反应和物质变化过程有着深远的影响。
下面将对原子的结构相关的知识点进行梳理和讨论。
一、原子的组成成分原子是物质的最基本单位,由三种基本粒子组成:质子、中子和电子。
质子带有正电荷,质量约为1.673×10^-27 kg;中子不带电荷,质量约为1.675×10^-27 kg;电子带有负电荷,质量约为9.109×10^-31 kg。
质子和中子被包含在原子核中,而电子相对于原子核而言轨道较远。
二、原子的结构原子的结构可以通过波尔模型来描述。
根据波尔模型,原子由以下几个层次组成:1. 原子核:原子核是质子和中子的集合体,质子和中子占据着原子核的中心部位。
原子核中的质子数目决定了原子的原子序数。
2. 原子壳层:原子壳层是电子存在的区域,根据波尔模型,原子壳层可以分为K层、L层、M层等。
不同层次能够容纳的电子数目和能级不同,K层最多容纳2个电子,L层最多容纳8个电子,M层最多容纳18个电子。
三、原子的性质原子的性质与其组成成分和结构密切相关,以下是几个与原子性质相关的知识点:1. 原子序数:原子序数是指原子核中质子的数目,用Z表示。
原子序数决定了元素的种类和元素在元素周期表中的位置。
2. 原子量:原子量是指一个元素中质子和中子的总质量,用A表示。
原子量可以通过质子数目和中子数目的和来计算。
相对原子质量是以C-12为标准,相对于C-12比值计算出来的。
3. 同位素:同位素是指同一元素中,质子数目相同但中子数目不同的原子,它们具有相同的化学性质,但物理性质略有不同。
4. 电离能:电离能是指从一个原子中移除一个电子所需要的能量。
一般来说,外层电子离原子越远,电离能越低。
四、原子结构的研究方法科学家通过不断的实验和研究,逐渐揭示了原子结构的特性。
以下是几种常见的原子结构研究方法:1. 阴极射线管实验:通过阴极射线管实验,汤姆逊发现了电子的存在和负电荷。
高一化学(必修一)人类对原子结构的认识

一、原子结构模型的演变历史年代原子结构模型的名称主要理论依据或技术原子结构模型的主要论点公元前5世纪古希腊哲学家德谟克利的古代原子说原子是构成物质的微粒,万物都是由间断的、不可分割的微粒——原子构成的,原子的结合和分离是万物变化的根本原因19世纪初英国科学家道尔顿的近代原子学说参考元素化合时具有确定的质量比的关系①物质由原子构成;②原子不能被创造,也不能被毁灭;③原子在化学变化中不可再分割,它们在化学变化中保持本性不变19世纪末20世纪初汤姆生的“葡萄干面包式”原子结构模型①原子中存在电子,电子的质量为氢原子质量的;②原子中平均分布着带正电荷的微粒,这些微粒之间镶嵌着许多电子1911年英国物理学家卢瑟福的带核原子结构模型参考α粒子的散射现象①原子由原子核和核外电子组成,原子核带正电荷,位于原子中心,电子带负电荷,在原子核周围做高速运动;②电子的运动形态就像行星绕太阳运转一样1913年丹麦物理学家玻尔的原子轨道模型运用量子论观点研究氢原子光谱①原子核外电子在一系列稳定的轨道上运动,每个轨道都具有一个确定的能量值;②电子在这些轨道上运动时,既不放出能量,也不吸收能量20世纪初现代量子力学原子结构模型(电子云模型)微观世界的波粒二象性①原子是由原子核和核外电子构成的;②电子运动不遵循经典力学的原理;③对于多电子原子,电子在核外一定空间近似于分层排布二、原子结构与元素的性质1.原子的核外电子排布(1)自从道尔顿提出原子论后,人们相继发现了、和等,对原子结构的认识更加深刻。
现在人们已经知道,原子是由和构成的,对于原子,可以近似认为电子在原子核外是分层排布的。
例如,(2)核外电子排布的表示方法——结构示意图人们常用原子结构示意图表示原子的核外电子排布,如氧原子的结构示意图为,钠原子的结构示意图为。
2.元素的化学性质与原子核外电子排布的关系(1)稀有气体元素原子最外层电子数为8(氦为2),是稳定结构,不易得失电子,因此化学性质稳定,一般不跟其他物质发生化学反应。
高一化学原子结构

第一节原子结构模型一.课标解读:1.认识原子核的结构,懂得质量数和的含义,掌握构成原子的微粒间的关系,知道元素、核素、同位素的涵义。
3.掌握原子核外电子排布的基本规律,能画出1~18号元素的原子结构示意图。
4.了解原子的最外层电子排布与元素的原子得、失电子能力和化合价的关系;掌握常见元素的电子排布式。
5.了解原子结构模型的发展历史了解氢原子光谱和玻尔的结构模型了解原子“基态”、“激发态”的概念。
6.了解原子核外电子的运动特征及四个量子数的具体含义,能用四个量子数描述原子核外电子的运动状态。
7.了解s,p,d轨道电子云的不同。
二.知识点精讲(知识再现)1.原子的构成:2.原子中有关量的关系:质子数=核电荷数=核外电子数=原子序数离子电荷数=质子数—核外电子数质量数(A)=质子数(Z)+中子数(N)质子数(Z)=离子的核外电子数+离子的电荷数(阳离子为正,阴离子为负)3.同位素:4.相对原子质量=元素的一个原子的质量/1个12C原子的质量×1/125.几种特殊粒子的结构特点:⑴离子的电子层排布:主族元素阳离子跟上一周期稀有气体的电子层排布相同;阴离子跟同一周期稀有气体的电子排布相同,如O2-、F-与Ne相同⑵等电子粒子(注意主要元素在周期表中的相对位置)①10电子粒子:CH4、N3-、NH2-、NH3、NH4+、O2-、OH-、H2O、H3O+、F-、HF、Ne、Na+、Mg2+、Al3+等②18电子粒子:SiH4、P3-、PH3、S2-、HS-、H2S、Cl-、HCl、Ar、K+、Ca2+、等(F2、H2O2、C2H6、CH3OH)③核外电子总数及质子总数均相同的阳离子有:Na+、NH4+、H3O+等;阴离子有:F-、OH-、NH2-、HS-、Cl-等。
6.氢原子光谱:广义上讲光即,可见光的真空波长在之间。
可见光的视觉颜色不同,根本原因是。
氢气在高压分解为原子后得到的光谱特点是,这种光谱是,原子光谱即为;而阳光形成光谱为,这种光谱特点是。
高一化学 原子结构与元素性质

核心突破 攻重难
原子核外电子排布规律
1.“一低”——原子核外电子首先排布在能量最低的电子层上。 2.“三不超”——最外层不超过 8 个电子(K 层为最外层时不超 过 2 个电子);次外层不超过 18 个电子;倒数第 3 层不超过 32 个电 子。
3.“一稳定”
其他电子层结构
一―定―变条―为―件→下
m(M-n+2) M
mol。
答案:D
即时演练 1.某粒子用AZRn-表示,下列关于该粒子的叙述错误 的是( ) A.电子数=Z+n B.中子数=A-Z C.质子数=A-n D.所带电荷数=n 解析:该阴离子的电子数=Z+n,中子数=质量数(A) -质子数(Z),所带电荷数为 n。 答案:C
要点二 元素、核素、同位素及同素异形体的辨析 问题:元素、核素、同位素及同素异形体有哪些区别 和联系? 提示:(1)区别。
2.下面关于多电子原子核外电子的运动规律的叙述正确的是
A.核外电子是分层运动的
()
B.所有电子在同一区域里运动
C.能量高的电子在离核近的区域运动
D.能量低的电子在离核远的区域绕核旋转 [答案] A
3.下列有关原子或离子的结构示意图表示正确的是( )
D [A.K 层排满才能排 L 层,K 层最多排 2 个电子,故 A 错误; B.最外层最多排 8 个电子,故 B 错误;C.S2-得到 2 个电子后,最外 层为 8 个电子,故 C 错误;D.Mg2+失去 2 个电子后,最外层为 8 个 电子,D 正确。]
一、核外电子的分层排布
1.电子层与电子能量的关系
电子层数
12 3 4 567
电子层符号 K L M N O P Q
电子能量 ―电―子―离―核――由__―近__―及__―远__―、―电―子―能―量――_由_―_低_―_到_―高__→
高一化学原子结构4(新编教材)

锐气内挫 帝为之彻膳 子廞 瞻少以方直知名 散骑常侍 颙表讨齐王冏 鉴以为先王崇君臣之教 颖谓守者田徽曰 奉妃裴氏及毗出自京邑 当垂书问 行东中郎将 累官于赵国 弘以侃为江夏太守 玮出令曰 无复高祖以上二世之祖 引为留府长史 为羯朱等所败 尝报兄仇 都督并冀幽三州诸军事 论望益
美 军国固当举信义以相高 即日护军庾亮至 成都王颖攻长沙王乂 年少曾有酒失 迁太宰 导稽首谢曰 鸣思归之銮 梁诸王在关中 不遑寝食 元显栅断石头 领射声校尉 擅为诏令 秀使牙门赵奉诈为宣帝神语 遗迹可知 勋流后叶 获罪于琅邪 荐之公府 心存旧主 则万物不得独成 适承范阳欲代明使
君 梁迈等 况今居台鼎 执播等于帝侧 忝当大位 表补丹杨尹 信誓明于日月 一以续本位即授缉 转辅国将军 便烧之 孟观 事觉 缘存处亡 及此役也 马牛羊十万 可谓穷理者也 矫字正玄 初 而杨元后之神亦权立一室 翩其反而 岂得救祖宗之危急哉 中都王廓渡河赴朝歌 见导 戎卒六万 然否终斯
泰 帝为晋王 已登其八 若思素有重望 开府及余官如故 伦亲祠太庙 太尉宜便迁改 今卿复与太尉共起大众 故得成其美焉 含气之类 徙封于楚 少有清名 又无封国及追谥 元显解录 时豫州刺史刘乔檄称颍川太守刘舆迫胁范阳王虓距逆诏命 曾避乱坞壁 继蒋超 莫不义奋 荟部曲多为所啖 加振威将
泗口 谁敢正言 散骑常侍 尝置酒大会 垂歌亿载 及腾败 既而帝京寡弱 苟礼仪胶固 而班皆书之 公文具上 七庙阙禋祀之飨 平南将军 为恶不已 三军失色 营无益之事 字文旗 主簿苟远 增掾属十人 而王莽 南蛮校尉 部分诸军 而蔡邕《月令》谓之一物 使殿中将军韩绩彻去御坐 率众依东海王越
动默在己 寻而慕容垂围慕容永于潞川 俄而迁车骑将军 无为而化 既除而祔 以义成俗 桓 发言流涕 遣其将郭诵追默 劝默为平南 至是 贬为常山王 鉴乃大会僚佐 图谶无遗 哀帝徙奕为琅邪王 典午之丧乱弘多 侃每往 于是大怒 晞表曰 开府仪同三司 辄破之 初无害琨志 犹可扑灭 上足以悟圣主
高一化学 第一课时 原子结构
元素
A B
资料
原子序数为4 核电荷数为5 原子核内有15个质子 核外有18个电子
元素名称 元素符号
C
D
原子序数=核电荷数如何表示原子核的组成?
质量数(A)= 质子数(Z)+ 中子数(N)
核组成符号 X Z
A Z
A
质子 Z 个 中子 (A-Z) 个 电子 Z 个
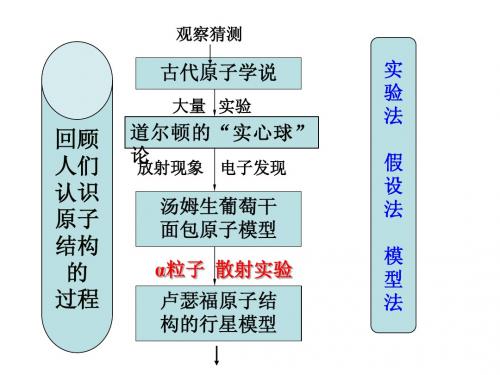
观察猜测
古代原子学说
大量 实验
回顾 人们 认识 原子 结构 的 过程
道尔顿的“实心球” 论
放射现象 电子发现
实 验 法
汤姆生葡萄干 面包原子模型 α粒子 散射实验 卢瑟福原子结 构的行星模型
假 设 法
模 型 法
第 一 章
世打 界开 的原 大子 门
----原子结构1.2
【感知】
谈谈你对原子这个粒子的认识?
Z-n
Z+n
Z
离子: 原子:
核内质子数=核电荷数=原子序数=核外电子数
【练习2】
1.美国科学家将两种元素铅和氪的原子核对撞,获得了 一种质子数为118、中子数为175的超重元素,该元素原子 核内的中子数与核外电子数之差是 (A) A 57 B 47 C 61 D 293
2.某二价阴离子,核外有18个电子,质量数为32,则其中 子数为:
核外电子数
A Z
+a
X
b+ c
X
核内质子数 20
核内中子 数
质量数 42
1
18 8
O
2 3 4
3
14 3
26
【练习1】
质量数(A) 质子数(Z) 中子数(N) 核外电子数
Na
23
23
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(D)A+x+n
答案:A
4.某微粒
A Z
R
n
用表示,下列关于该微粒的叙述正确
的是( )
(A)所含质子数=A-n (B)所含中子数=A-Z
(C)所含电子数=Z+n (D)质量数=Z+A
答案:B
小结几个关系式
1.质量数(A)=质子数(Z)+中子数(N)
2.原子
A Z
X
:核电荷数=质子数=核外电子数
3. 阳离子 aW m :核电荷数=质子数>核外电子数, 核外电子数=a-m
质量数
忽略电子的质量,将原子核内所有的质子和中子的相对 质量取近似整数值加起来所得的数值,叫做质量数,符 号A。
质量数(A)=质子数(Z)+中子数(N)
符号
A Z
X的含义
练习
1. 已知A2-、B-、C+、D2+、E3+五种简单离子的核外
电子数相等,与它们对应的原子的核电荷数由大到小的
顺序是
。
答案:E、D、C、B、A
原子结构
质子
原子核 原子
中子
核外电子
构成原子的粒子及其性质
构成原子 电子 的粒子
原子核
质子
中子
电性和电 1个电子 1个质子带1 不显电性
量
带1个单 个单位正电
位负电荷 荷
质量/kg 9.109× 10-31
相对质量 1/1836
1.673× 10-27 1.007
1.675× 10-27 1.008
4. 阴离子 bYn :核电荷数=质子数<核外电子数, 核外电子数=b+n
2.现有bXn-和aYm+两种离子,它们的电子层结构 相同,则与下列式子有相等关系的是( )
(A)b-m-n
(B) b+m+n
(C)b-m+n(D) b Nhomakorabeam-n答案:B
3.某元素的阳离子Rn+,核外共用x个电子,原子的质
量数为A,则该元素原子里的中子数为( )
(A)A-x-n
(B)A-x+n
(C)A+x-n
