82011-2012(2)第八章 正常使用极限状态.
一次性使用手术衣(第二类)产品注册技术审查指导原则

医用一次性使用防护服产品注册技术审查指导原则本指导原则旨在指导和规范医用一次性使用防护服产品的技术审评工作,帮助审评人员理解和掌握该类产品结构、性能、预期用途等内容,把握技术审评工作基本要求和尺度,对产品安全性、有效性做出系统评价。
本指导原则所确定的主要内容是在目前的科技认识水平和现有产品技术基础上形成的,因此,审评人员应注意其适宜性,密切关注适用标准及相关技术的最新进展,考虑产品的更新和变化。
本指导原则不作为法规强制执行,不包括行政审批要求。
但是,审评人员需密切关注相关法规的变化,以确认申报产品是否符合法规要求。
一、适用范围本指导原则适用于GB19082-2009《医用一次性使用防护服技术要求》标准中的防护服。
防护服在《医疗器械分类目录》中为第二类医疗器械产品,类代号为6864。
二、技术审评要点(一)产品名称的要求产品名称应以预期用途为依据命名,产品名称为医用一次性使用防护服。
(二)产品的结构和组成医用一次性使用防护服为具有特定液体阻隔功能、特定强度、过滤效率阻燃性能、抗静电和静电衰减功能的适宜材料制成,分为连身式或分身式两种,由连帽上衣、裤子组成,袖口、脚踝口为弹性收口,帽子面部收口及腰部收口可采用弹性收口、拉绳收口或搭扣。
产品图示举例:注:防护服的关键部位是防护服的左右前襟,左右臂及背部位置。
(三)产品适用的相关标准GB/T191-2008 包装储运图示标志GB/T3923.1-2013纺织品织物拉伸性能第1部分:断裂强力和断裂伸长率的测定条样法GB/T4744-2012纺织品防水性能的检测和评价静水压法(eqv ISO 811:1981)GB/T4745-2012纺织品防水性能的检测和评价沾水法 (eqv ISO 4920:2012)GB/T5455-2014纺织品燃烧性能垂直方向损毁长度阴燃和续燃时间的测定GB/T5549-2010表面活性剂用拉起液膜法测定表面张力GB/T12703.1-2008纺织品静电性能的评定第1部分:静电压半衰期GB/T12704.1-2009纺织品织物透湿性试验方法第1部分:吸湿法GB/T12704.2-2009纺织品织物透湿性试验方法第2部分:蒸发法GB 15980-2009 一次性使用医疗用品卫生标准GB 18278.1-2015 医疗保健产品灭菌确认和常规控制要求工业湿热灭菌GB 18279.1、GB/T 18279.2-2015 医疗器械环氧乙烷灭菌确认和常规控制GB 18280.1-2015、GB 18280.2-2015 医疗保健产品灭菌确认和常规控制要求辐射灭菌GB/T 16886.1-2011 医疗器械生物学评价第1部分:评价与试验GB/T 16886.7-2015 医疗器械生物学评价第7部分:环氧乙烷灭菌残留量GB/T 16886.10-2005 医疗器械生物学评价第10部分:刺激与迟发型超敏反应试验GB/T 19633.1, GB/T 19633.2-2015 最终灭菌医疗器械的包装GB/T 14233.1-2008 医用输血、输液、注射器具检测方法第1部分:化学分析方法GB/T 14233.2-2005 医用输血、输液、注射器具检测方法第2部分:生物试验方法YY/T 0313-2014 医用高分子制品包装、标志、运输和贮存YY/T 0287-2017 医疗器械质量管理体系用于法规的要求YY/T 0466.1-2016 医疗器械用于医疗器械标签、标记和提供信息的符号第1部分:通用要求YY/T 0466.2-2015 医疗器械用于医疗器械标签、标记和提供信息的符号第2部分:符号的制订、选择和确认YY/T 0615.1-2007 标示“无菌”医疗器械的要求第1部分:最终灭菌医疗器械的要求YY/T 0316-2016 医疗器械风险管理对医疗器械的应用YY∕T 1498-2016 医用防护服的选用评估指南YY∕T 1499-2016 医用防护服的液体阻隔性能和分级GB 19082-2009 医用一次性防护服技术要求GB 15979-2002 一次性使用卫生用品卫生标准中华人民共和国药典产品适用及引用标准的审查可以分两步来进行。
手部防护——电离辐射及放射性污染物防护手套

手部防护电离辐射及放射性污染物防护手套1 范围本标准规定了电离辐射及放射性污染物防护手套的要求、测试方法、标识及产品信息。
本标准适用于保护穿戴者的手部免遭作业区域电离辐射及放射性污染物危害的手套、可安装在永久性密封箱室的手套,以及手套与永久性密封箱室之间的中间袖筒。
不适用于医用辐射防护手套。
2 规范性引用文件下列文件对于本文件的应用是必不可少的。
凡是注日期的引用文件,仅注日期的版本适用于本文件。
凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
GB/T 2941-2006 橡胶物理试验方法试样制备和调节通用程序GB/T 7762 硫化橡胶或热塑性橡胶耐臭氧龟裂静态拉伸试验GB/T 12624-2009 手部防护通用技术条件及测试方法GB 24541-2009 手部防护机械危害防护手套GB 28881-2012 手部防护化学品及微生物防护手套EJ/T 1175.1-2004 密封箱室部件第1部分:手套接盘、封袋接盘、手套孔盖、封袋孔盖、密封环及可互换件EJ/T 1175.2-2004 密封箱室部件第2部分:手套、焊封袋、剑式机械手护套及主从机械手护套YY 0292.1-1997 医用诊断X射线辐射防护器具第1部分:材料衰减性能的测定3 术语和定义下列术语和定义适用于本文件。
3.1放射性污染物radioactive contamination存在于废弃或有害的物质或场所中的放射性物质。
3.2电离辐射ionizing radiation由直接或间接电离粒子或两者混合体构成的辐射,通常不包括紫外辐射。
[ GB/T 10149-1988,定义2.1.1 ]3.3轫致辐射bremsstrahlung带电粒子通过原子核或其他带电粒子的电场时,减速或加速产生的X射线辐射。
[ GB/T 10149-1988,定义2.1.2 ]3.4水蒸气渗透性water vapour permeability在规定的温度和相对湿度的环境下,每24小时每平方米透过某材料的水蒸气重量。
【指导原则】医疗器械安全和性能的基本原则(2020年第18号)

附件医疗器械安全和性能的基本原则1.医疗器械的安全和性能—总则注册人/备案人应能设计和生产在医疗器械全生命周期内均能达到预期安全和性能要求的产品。
本原则描述了基本的设计和生产要求,以帮助注册人/备案人实现上述目的。
本文分为两个部分,第一部分是适用于所有医疗器械的通用基本原则(第2节);第二部分是适用于非体外诊断类医疗器械(第3节)和体外诊断类医疗器械(第4节)的专用基本原则。
注册人/备案人的设计和生产活动应在质量管理体系的控制下进行。
注册人/备案人应提供产品与适用基本原则条款符合的证据,并由监管机构按照相关程序进行评审。
2.适用于所有医疗器械的通用基本原则本部分所列设计和生产通用基本原则适用于所有医疗器械。
2.1概述2.1.1医疗器械应实现注册人/备案人的预期性能,其设计和生产应确保器械在预期使用条件下达到预期目的。
这些器械应是安全的并且能够实现其预期性能,与患者受益相比,其风险应是可接受的,且不会损害医疗环境、患者安全、使用者及他人的安全和健康。
2.1.2注册人/备案人应建立、实施、形成文件和维护风险管—1 —理体系,确保医疗器械安全、有效且质量可控。
在医疗器械全生命周期内,风险管理是一个持续、反复的过程,需要定期进行系统性的改进更新。
在开展风险管理时,注册人/备案人应:a)建立涵盖所有医疗器械风险管理计划并形成文件;b)识别并分析涵盖所有医疗器械的相关的已知和可预见的危险(源);c)估计和评价在预期使用和可合理预见的误使用过程中,发生的相关风险;d)依据2.1.3和2.1.4相关要求,消除或控制c)点所述的风险;e)评价生产和生产后阶段信息对综合风险、风险受益判定和风险可接受性的影响。
上述评价应包括先前未识别的危险(源)或危险情况,由危险情况导致的一个或多个风险对可接受性的影响,以及对先进技术水平的改变等。
f)基于对e)点所述信息影响的评价,必要时修改控制措施以符合2.1.3和2.1.4相关要求。
转基因相关标准汇总
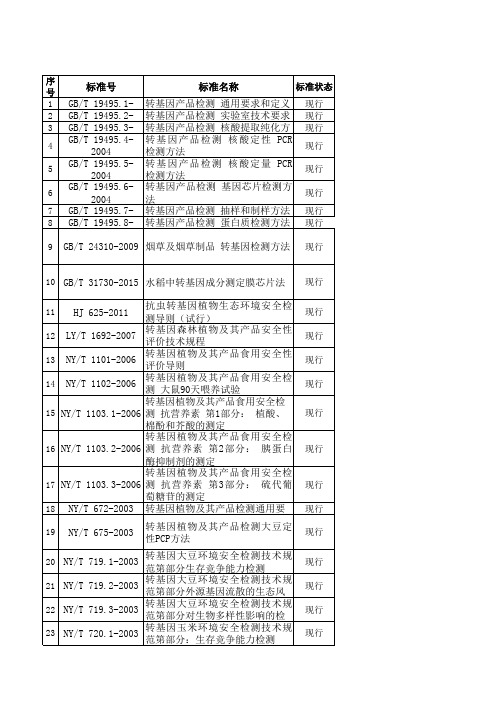
现行 SN/T 3496-2013 动物源性饲料中转基因成分实时荧光PCR检测方法 现行 SN/T 3576-2013 转基因成分检测 大豆PCR-DHPLC检测方法 现行 SN/T 3577-2013 转基因成分检测 棉花PCR-DHPLC检测方法
SN/T3690-2013 SN/T3691-2013
现行
现行
现行
现行
现行
现行
现行
现行
现行
现行
现行
现行Βιβλιοθήκη 现行现行现行
现行
现行
87 SN/T 3767.7-2014
88 SN/T 3767.8-2014
89 SN/T 3767.9-2014 90 91 92 93 94 95 96 97 98 99 ##
SN/T 3895-2014 SN/T 3959-2014 SN/T 4103-2015 SN/T 4288-2015 SN/T 4413-2015 YC/T 149-2002 YC/T 150-2002 YC/T 194-2005 YC/T 339-2010 农业部1193号公告 -1-2009 农业部1193号公告 -2-2009 农业部1193号公告 -3-2009 农业部1485号公告 -1-2010 农业部1485号公告 -10-2010
16 NY/T 1103.2-2006
17 NY/T 1103.3-2006 18 19
NY/T 672-2003 NY/T 675-2003
抗虫转基因植物生态环境安全检 测导则(试行) 转基因森林植物及其产品安全性 评价技术规程 转基因植物及其产品食用安全性 评价导则 转基因植物及其产品食用安全检 测 大鼠90天喂养试验 转基因植物及其产品食用安全检 测 抗营养素 第1部分: 植酸、 棉酚和芥酸的测定 转基因植物及其产品食用安全检 测 抗营养素 第 2 部分: 胰蛋白 酶抑制剂的测定 转基因植物及其产品食用安全检 测 抗营养素 第 3 部分: 硫代葡 萄糖苷的测定 转基因植物及其产品检测通用要 转基因植物及其产品检测大豆定 性PCP方法
有源医疗器械安全有效要求一览表

产品属于理疗设备
B9.4
预期用于监视患者一个或多个临床参数的医疗器械,应当配备适当的报警系统,在患者生命健康严重恶化或生命危急时,进行警告。
否
产品属于理疗设备
B9.5
医疗器械的设计和生产,应当具有减少产生电磁干扰的方法。
是
YY/T 0316
YY0505:2012
八、产品风险分析资料
B9.6
医疗器械的设计和生产,应当确保产品具备足够的抗电磁骚扰能力,以保证产品能按照预期运行。
是
YY/T 0316
GB9706.1:2007
八、产品风险分析资料
十、产品注册检验报告
B1.4
医疗器械的设计和生产应当尽可能减少滤出物或泄漏物造成的风险,特别注意其致癌、致畸和生殖毒性。
否
器械不含有滤出物
B1.5
医疗器械的设计和生产应当考虑在预期使用条件下,产品及其使用环境的特性,尽可能减少物质意外从该产品进出所造成的风险。
是
YY/T 0316
八、产品风险分析资料
B10.5
如果医疗器械的某些部分在使用前或使用中需要进行连接或重新连接,则其设计和生产应将连接错误的风险降到最低。
是
YY/T 0316
八、产品风险分析资料
B10.6
可触及的医疗器械部件(不包括预期提供热量或达到给定温度的部件和区域)及其周围,在正常使用时,不应达到造成危害的温度。
标有微生物要求的医疗器械,应当确保在使用前符合微生物要求。
否
产品对微生物无要求
B2.3
无菌医疗器械应当确保在使用前符合无菌要求。
否
非无菌医疗器械
B2.4
无菌或标有微生物要求的医疗器械应当采用已验证的方法对其进行加工、制造或灭菌。
防水游泳贴产品技术要求标准2023年

防水游泳贴1范围本标准规定了防水游泳贴的产品组成、规格、要求、试验方法、检验规则、包装、标识及储运。
本标准适用于本公司生产的防水游泳贴,用于女性在游泳、温泉、水上乐园、海边、漂流、酒店浴缸等涉水活动时,起到防水,防止细菌感染等保护作用。
2规范性引用文件下列文件对于本文件的应用是必不可少的。
凡是注日期的引用文件,仅所注日期的版本适用于本文件。
凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
GB/T191-2008包装储运图示标志GB/T9969-2008工业产品使用说明书总则GB/T2828.1-2012计数抽样检验程序第1部分:按接收质量限(AQL)检索的逐批检验抽样计划GB/T2829-2002周期检验计数抽样程序及表(适用于对过程稳定性的检验)YY/T0148-2006医用胶带通用要求YY/T0471.3-2004接触性创面敷料试验方法第3部分:阻水性3产品组成与规格3.1防水游泳贴由PU胶带、吸水棉和保护层(临用前去除)组成。
不含药物。
3.2规格型号型号:PU型规格:(1~6O)cm×(1~90)cm特殊规格型号按订货合同执行。
4技术要求4.1外观a)产品外观应均匀平整,无破洞、污渍、异物现象。
b)上层、底层切口应平齐。
4.2规格尺寸产品规格尺寸长×宽在(1~6O)cm×(1~90)cm范围内,最大偏差应不超过±10mm。
4.3阻水性能承受500mm静水压300s。
4.4剥离强度产品的剥离强度应≥1.0N/cm。
4.5持粘性产品的持粘性应≤2.5mm。
5检验方法5.1外观检查抽取10片产品,采用目测方法检验。
检验光线以正常自然光为准,如以日光灯照明时,照度不低于400lx。
5.2规格尺寸抽取10片产品,用通用量具测量。
5.3阻水性按YY/T0471.3-2004中规定的方法进行测试。
5.4剥离强度按YY/T0148-2006中附录B规定的方法进行测试。
无菌药品GMP检查指南
资料范本本资料为word版本,可以直接编辑和打印,感谢您的下载无菌药品GMP检查指南地点:__________________时间:__________________说明:本资料适用于约定双方经过谈判,协商而共同承认,共同遵守的责任与义务,仅供参考,文档可直接下载或修改,不需要的部分可直接删除,使用时请详细阅读内容无菌药品GMP检查指南2015年10月目录TOC \o "1-3" \h \z \u HYPERLINK \l "_Toc408229860" 一、目的 3HYPERLINK \l "_Toc408229862" 二、适用范围及检查依据 3三、无菌药品生产工艺概述 (3)HYPERLINK \l "_Toc408229866" 四、检查要点 6HYPERLINK \l "_Toc408229867" (一) 质量管理系统 6HYPERLINK \l "_Toc408229886" (二) 厂房、设施及设备系统9 HYPERLINK \l "_Toc408229887" (三) 物料系统15HYPERLINK \l "_Toc408229888" (四) 生产系统18HYPERLINK \l "_Toc408229889" (五) 包装和贴签系统 24HYPERLINK \l "_Toc408229891" (六) 实验室控制系统 26HYPERLINK \l "_Toc408229893" 五、参考文献 29目的本指南的主要目的是为检查员在实施无菌药品生产企业检查时提供指导。
检查组应参照本指南的要求检查无菌药品生产质量管理情况,评价企业无菌保证的能力,以确定企业是否符合《药品生产质量管理规范(2010年修订)》(以下简称GMP)的要求。
日用化学品体外哺乳动物细胞微核试验
日用化学品安全性评价体外哺乳动物细胞微核试验1范围本标准规定体外哺乳动物细胞微核试验的基本原理、规范性引用文件、术语及定义、试验方法、数据处理及结果评价和报告。
本标准适用于评价日用化学品及化学品原料的遗传毒性。
2规范性引用文件下列文件对于本文件的应用是必不可少的。
凡是注日期的引用文件,仅注日期的版本适用于本文件。
凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
OECD Guidelines for the testing of chemicals:In Vitro Mammalian Cell Micronucleus Test(No.487),2016年GB/T28646-2012《化学品体外哺乳动物细胞微核试验方法》3术语及定义GB/T28646-2012界定的以及下列术语及定义适用于本文件。
为了便于使用,以下重复列出了GB/T 28646-2012中的某些术语及定义。
3.1非整倍体诱发剂aneugen任何与细胞有丝分裂和减数分裂周期中有关的成分相互作用后导致细胞出现非整倍体现象的物质或因子。
3.2染色体断裂剂clastogen任何引起细胞或生物体中染色体结构畸变的物质或因子。
3.3胞质分裂cytokinesis随着核分裂(有丝分裂和减数分裂)之后的细胞质的分裂。
3.4细胞阻滞cytostasis细胞生长被抑制。
3.5细胞毒性cytotoxicity对细胞结构或功能的有害作用,最终可导致细胞死亡。
3.6微核micronuclei独立于细胞核主核以外的小核,由有丝分裂或减数分裂末期滞后的染色体片段或整条染色体构成。
3.7胞质分裂阻断增殖指数cytokinesis-block proliferation index,CBPI使用细胞松弛素B时计算细胞毒性的方法。
处理组中二次分裂细胞数相对于对照组的比值。
3.8复制指数replication index,RI使用细胞松弛素B时计算细胞毒性的方法。
干热灭菌柜、湿热灭菌柜验证的详细讲解
一、法规要求:1、无菌药品附录第六十一条无菌药品应当尽可能采用加热方式进行最终火菌,最终火菌产品中的微生物存活概率(即无菌保证水平,SAL)不得高于Io=采用湿热灭菌方法进行最终火菌的,通常标准火菌时间FO值应当大于8分钟,流通蒸汽处理不属于最终灭菌。
对热不稳立的产品,可采用无菌生产操作或过滤除菌的替代方法。
2、无菌药品附录第六十三条任何火菌工艺在投入使用前,必须采用物理检测手段和生物指示剂,验证其对产品或物品的适用性及所有部位达到了灭菌效果。
3、无菌药品附录第六十四条应当定期对火菌工艺的有效性进行再验证(每年至少一次)。
设备重大变更后,须进行再验证。
应当保存再验证记录。
4、无菌药品附录第六十五条应当通过验证确认火菌设备腔室内待火菌产品和物品的装载方式。
5、无菌药品附录第六十七条应当按照供应商的要求保存和使用生物指示剂,并通过阳性对照试验确认其质量,使用生物指示剂时,应当采取严格管理措施,防止由此所致的微生物污染。
6、无菌药品附录第六十九条每一次火菌操作应当有灭菌记录,并作为产品放行的依据之一。
7、无菌药品附录第七十条热力火菌通常有湿热灭菌和干热灭菌,应当符合以下要求:(一)在验证和生产过程中,用于监测或记录的温度探头与用于控制的温度探头应当分别设置,设置的位置应当通过验证确定。
每次火菌均应记录灭菌过程的时间-温度曲线采用自控和监测系统的,应当经过验证,保证符合关键工艺的要求。
自控和监测系统应当能够记录系统以及工艺运行过程中出现的故障,并有操作人员监控。
应当定期将独立的温度显示器的读数与灭菌过程中记录获得的图谱进行对照。
(二)可使用化学或生物指示剂监控灭菌工艺,但不得替代物理测试。
(三)应当监测每种装载方式所需升温时间,且从所有被火菌产品或物品达到设左的火菌温度后开始计算灭菌时间。
(四)应当有措施防止已灭菌产品或物品在冷却过程中被污染。
除非能证明生产过程中可剔除任何渗漏的产品或物品,任何与产品或物品相接触的冷却用介质(液体或气体)应当经过灭菌或除菌处理。
无菌医疗器械实施细则检查员培训(XXXX讲稿)
无菌医疗器械实施细则 及检查要求
国家食品药品监督管理局 济南医疗器械质量监督检验中心
王延伟
无菌医疗器械实施细则 通用要求的条款和《规范》 的内容是完全相同的,在
主要内容(1+x)
不同类别的医疗器械实施 细则中也是完全一样的, 其主要内容来源于YY/T
通用要求(1)
0287 (ISO13485)和相关 法规要求。
宜高不宜 低的原则, 就低必须
• 应有压差指示装置。
验证。
• 相同洁净室(区)间压差梯度合理。
洁净器室械(按与区人)体洁接净触性度质级分别类设:置原则
((附GB录/T中1的68八86项.1内)容)
1一、表、面采接用触器使械污染降至最低限的生
2产染、a表 a牙生倡外或技))面 质部产导能血术皮接接路技肤有技,入入,、术效器术以c间b)械。排)进保接循粘除、步证环膜b污血,医)、液人染这保洁又作成组建疗c为是障净有保过)因织一的环先障程。议器素个概境进。中损 /,双念作生在尽骨用械伤重,保产产量最/硬既障技品减大先不件有,术形少程 受进
第六章 采购
第十章 不合格品控制 第十一章 顾客投诉和不良事 件监测 第十二章 分析和改进 第十三章 附则
• 动物源材料、初包装要求
第七章 生产管理
术语、适应范围、执行相关 法规和标准、不涉及条款
产品实现的过程控制
附录 洁净室设置原则
洁净区内设备设施要求
注:黑色(正体)为医疗器械通
灭菌过程要求
用要求;
在体系文件的编写依据中增加《规范》和本 《实施细则》等文件。
合理确定不涉及条款
消毒是相对的而不是绝对的,它只要求将有害 微生物的数量减少到无害的程度,而并不要求 把所有有害微生物全部杀灭,若能使微生物在
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(2)正常使用极限状态:超过该极限状态,结构 就不满足预定的适用性和耐久性要求。
产生过大的变形,影响正常使用和外观;
(不安全感、不能正常使用等)
产生过宽的裂缝,对耐久性有影响或者产生人们心理上
不能接受的感觉;(钢筋锈蚀、不安全感、漏水等)
产生过大的振动影响使用。
极限状态的分类
国 际 标 化 组 织
Ao=Ac + αEAs + αEAs ’
M cr m f tW0 I0 W0 h y0
W0——换算截面A0对受拉边缘的弹性抵抗矩;
y0——换算截面重心轴至受压边缘的距离; I0——换算截面对其重心轴的惯性矩。
为满足目标可靠指标的要求,引用拉应力限制系数
αct,荷载和材料强度均取用标准值。
正常使用极限状态
对应于结构或构件达到正常使用或耐久性能的某项规 定限值。 影响正常使用或外观的变形
影响正常使用或或外观的裂缝
影响正常使用的振动
正 常 使 用 极 限 状 态
Notes!
结构设计首先要满足承载能力的要求,以保 证结构安全使用;然后按正常使用极限状态进行 校核,以保结构的适用性及耐久性。
N cr f t Ac s As f t Ac E f t As f t ( Ac E As ) f t A0
为满足目标可靠指标要求,引进拉应力限制系数αct(0.85), ft 改用ftk :
Nk ct ftk A0
二、受弯构件
受弯构件正截面即将开裂时,应力处于第I阶段末。 受拉区近似假定为梯形,塑化区占受拉区高度的一半。
极限状态
承载能力 极限状态
正常使用 极限状态
承载能力极限状态
对应于结构或构件达到最大承载能力或不适于继续承 载的变形。
结构或结构构件产 生过大的塑性变形 5 而不适于继续承载
1 整个结构或结构的一部 分丧失稳定
承载能力 极限状态
4 构件截面因 材料强度不 足而破坏 3
结构转变 2 成机动体系
结构发生滑移、上浮 或倾覆
γm值与截面形状、截面高度h﹑配筋率和受力状态有关。
γm值与假定的受拉区应力图形有关,各种截面的γm值见附录五
表4,并乘以考虑截面高度影响的修正系数 0.7+300/h,其值不大
于1.1。h以mm计,当h>3000mm,取h=3000mm。
把钢筋换算为同位置的混凝土截面面积αEAs和αEAs′:
抗裂验算范围:承受水压的轴拉、小偏拉及发生裂缝后
引起严重渗漏构件。
裂缝宽度验算范围:需要控制裂缝宽度的构件。
变形验算范围:需要限制变形的构件。
第一节
一、轴心受拉构件
抗裂验算
钢筋与混凝土变形协调,即将开裂时, c=ft ; s=sES = tmaxEs =Es ft / Ec = E ft
荷载采用标准值而不用设计值,即荷载分项系数 γG及γQ取为1.0
采用荷载效应标准组合。
结构系数γd及设计状况系数ψ也均取为1.0。 SL191-2008取消了结构重要性系数
注意:
正常使用极限状态验算可能成为设计中控制情况。
一般只对持久状况进行验算。 验算内容:抗裂验算、裂缝宽度验算及变形验算。
M k mct ftkW0
Mk——由荷载标准值按荷载效应标准组合计 b)h f (bf b)hf E As E As
2 h hf bh0 f (bf b) (b f b)h f (h ) E As h0 E Asa 2 2 y0 2 bh (b f b)h f (bf b)hf E As E As 2
3 bf y0 (bf b)( y0 hf ) 3 b f (h y0 ) 3 I0 3 3 3 (b f b)(h y0 h f ) 3 E As (h0 y0 ) 2 E As ( y0 a) 2 3
三.偏心受拉构件
把钢筋换算为混凝土截面面积,将应力折换成直线分布,
Nk 偏拉 m ( m 1) m ( m 1) ct ftk A0 ct ftk
M k m Nk m ct f tk W0 A0
m ct f tk A0W0 Nk e0 A0 mW0
2、正常使用极限状态实用设计表达式 γ0Sk(Gk,Qk,fk,ak)≤c
c ——结构的功能限值(裂缝宽度或挠度);
Sk——荷载效应标准组合的功能函数; fk——材料强度的标准值;
3、设计表达式中分项系数取值
材料强度采用标准值而不用设计值,即材料分项系数取为1.0。
正常使用极限状态验算的可靠度要求较低,一般要求 β=1.0∼2.0
第八章
钢筋混凝土构件正常使用极限状态验算
本章主要内容
抗裂验算 裂缝开展宽度的验算 变形验算 混凝土结构耐久性要求
1、结构的极限状态分为两类: (1)承载能力极限状态:结构或构件达到最大 承载力或不适应承载的过大变形。
超过该极限状态,结构就不能满足预定的安
全性要求。
对各种结构构件都应进行该极限状态设计。 采用荷载设计值及材料强度设计值。
利用平截面假定,根据力和力矩的平衡,求出Mcr。
更方便的是在保持 Mcr 相等的条件下,将受拉区梯形应
力图折换成直线分布应力图。
受拉边缘应力为γmft 。γm为截面抵抗矩的塑性系数。 换算后可直接用弹性体的材料力学公式进行计算。
γm是受拉区为梯形的应力图形,按抗裂弯矩相等的原则,折算
成直线应力图形时,相应受拉边缘应力比值。
引入γ偏拉,采用迭加原理,用材料力学公式进行计算 :
M k Nk 偏拉 ct f tk W0 A0
随应变梯度加大,塑性影响系数加大。 轴拉构件应变梯度为零, γ轴拉=1。 γ偏拉随平均拉应力σ的大小,按线性规律在1与γm之间变化。 σ=0时(受弯),γ偏拉=γm;σ=ft时(轴拉),γ偏拉=1。
