8-1热力学
第08章(热力学第二定律)习题答案

思 考 题8-1 根据热力学第二定律判断下列哪种说法是正确的.(A) 热量能从高温物体传到低温物体,但不能从低温物体传到高温物体.(B) 功可以全部变为热,但热不能全部变为功.(C) 气体能够自由膨胀,但不能自动收缩.(D) 有规则运动的能量能够变为无规则运动的能量,反之则不行. [ C ]8-2 有人说: “不可逆过程就是不能往反方向进行的过程” 对吗?为什么?[不可逆过程并不是一定不能往反方向进行的过程,而是往反方向进行的过程中用任何 方法都不能使系统和外界同时复原]8-3 有人设计一台卡诺热机(可逆的).每循环一次可从 400 K 的高温热源吸热1800 J ,向 300 K 的低温热源放热 800 J.同时对外作功 1000 J,这样的设计是(A) 可以的,符合热力学第一定律.(B) 可以的,符合热力学第二定律.(C) 不行的,卡诺循环所作的功不能大于向低温热源放出的热量.(D) 不行的,这个热机的效率超过理论值. [ D ][卡诺热机效率最大: % 25 1 12 = - = T T h ] 8-4 某人设想一台可逆卡诺热机, 循环一次可以从400K 的高温热源吸热1800J, 向300K 的低温热源放热 800J, 同时对外作功 1000J. 试分析这一设想是否合理?为什么?[ 违背熵 增原理 ]8-5 下列过程是否可逆,为什么?(1) 通过活塞(它与器壁无摩擦),极其缓慢地压缩绝热容器中的空气;(2) 用旋转的叶片使绝热容器中的水温上升(焦耳热功当量实验).解:(1)是可逆过程。
此过程是无损耗的准静态过程,当活塞(它与器壁无摩擦),极其缓慢地 绝热膨胀时,系统和外界都可复原,故是可逆过程。
(2)是不可逆过程。
功可完全转化为热,但在无外界影响下,热能却不能完全转化为 机械能。
8-6 关于可逆过程和不可逆过程的判断:(A) 可逆热力学过程一定是准静态过程.(B) 准静态过程一定是可逆过程.(C) 不可逆过程就是不能向相反方向进行的过程.(D) 凡有摩擦的过程,一定是不可逆过程.以上四种判断,其中正确的是哪些? [ A,D ]8-7 在所给出的四个图象中,哪个图象能够描述一定质量的理想气体,在可逆绝热过 程中,密度随压强的变化? [ D ]88 从统计的意义来解释, 不可逆过程实质上是一个怎样的状态转变过程?一切实际 过程都向着什么方向进行? [ 从几率较小的状态到几率较大的状态;状态的几率增大 (或 熵值增加) ]89 由绝热材料包围的容器被隔板隔为两半,左边是理想气体,右边真空.如果把隔 板撤去,气体将进行自由膨胀过程,达到平衡后气体的温度及熵如何变化? [ 温度不变; 熵增加 ]810 在一个孤立系统内, 一切实际过程都向着什么方向进行?这就是热力学第二定律 的统计意义. 从宏观上说, 一切与热现象有关的实际过程都是可逆的吗? [ 状态几率增大; 都是不可逆的 ]811 所谓第二类永动机,从功能量转换角度来讲,是一种什么形式的机器?它不可能 制成是因为违背了热学中的哪条定律? [ 从单一热源吸热,在循环中不断对外作功的热 机;热力学第二定律 ]812 熵是什么的定量量度?若一定量的理想气体经历一个等温膨胀过程, 它的熵将如 何变化? [ 大量微观粒子热运动所引起的无序性(或热力学系统的无序性) ;增加] 思考题 8-7图。
大学物理第8章:热力学基础

说明:A. 准静态过程为理想过程
弛豫时间 ( ):系统的平衡态被 破坏后再恢复到新的平衡态所需 要的时间。
气缸
B.一个热力学过程为准静态过程的必要条件为过程 所经历的时间大于驰豫时间 t 如:若气缸缸长 L 101 (m ),则 103 ~ 104 ( s ) 若活塞以每秒几十次的频率运动时, 每移动一次经 1 tt 时 t 10 ( s ) ,则满足 , C.准静态过程可以用宏观参量图给予表示
讨论: (1) n=0, 等压过程,Cp=CV+R ,过程方程: T/V=C4; (2) n=1, 等温过程,CT = , 过程方程: pV=C5; (3) n= , 等体过程, CV =iR/2 , 过程方程: p/T=C6; (4) n= , 绝热过程,CQ=0, 过程方程:
pV C1 , TV
RdT
由 pV=RT 于是得
C CV
pdV
pdV+Vdp=RdT
R pdV (1 ) Vdp 0 C CV dp R dV (1 ) 0 p C CV V
令
R 1 n —多方指数 C C V
21
dp dV n 0 p V
完成积分就得多方过程的过程方程:
V1
V2
i ( p2V2 p1V1 ) 2
只与始末状态有关
M i RT 2
( if
c const )
Q cM (T2 T1 )
与过程有关
特点
与过程有关
对微小过程:dQ=dE + dA
M i dQ RdT pdV 2
14
例题 8-2 如图所示,一定量气体经过程abc吸热 700J,问:经历过程abcda吸热是多少? 解 Q= E2-E1 + A i 过程abc : 700= Ec -Ea+ Aabc= ( pcVc paVa ) Aabc
8-1 界面张力
dA SdT pdV μB (α)dnB (α)
α B
8.1 界面张力
当体系作表面功时,G 还是面积A的函数
G f (T , p, n B, n C, n DAS )
dG SdT Vdp μB( α )dnB( α ) γdAs
α B
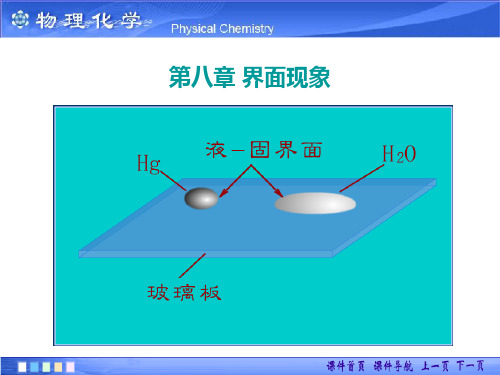
第八章 界面现象
第八章 界面现象 本章要求:
理解表面张力、表面功及表面吉布斯函数。 了解湿润现象,弯曲液面的附加压力和毛细现象,亚稳 状态和新相生成。 了解固体表面上的吸附作用,等温吸附,溶液表面的吸 附和表面活性物质。
第八章 界面现象 前言:
自然界的物质有三种相态,三种相态相互接触可以 产生五种界面。所谓界面即是:两相的接触面。表面: 与气体的接触面。 物质的存在状态:
(3)压力的影响
表面张力一般随压力的增加而下降。因为压力增加,气相 密度增加,表面分子受力不均匀性略有好转。另外,若是气相 中有别的物质,则压力增加,促使表面吸附增加,气体溶解度 增加,也使表面张力下降。
8.1 界面张力 4.影响表面张力的因素
(1)分子间相互作用力的影响 对纯液体或纯固体,表面张力决定于分子间形成的化学键 能的大小,一般化学键越强,表面张力越大。
(金属键)>
(离子键)>
(极性共价键)> (非极性共价键)
两种液体间的界面张力,界于两种液体表面张力之间。 (2)温度的影响 温度升高,表面张力下降。
因为
运用全微分的性质,可得:
S ( )T , P,nB ( ) A,P,nB A T
等式左方为正值,因为表面积增加,熵总是增加的。所 以 随T的增加而下降。
8.1 界面张力 Ramsay和Shields提出的 与T的经验式较常用:
8-1 热力学第一定律与常见的热力学过程

热量是过程量
使系统的状态改变,传热和作功是等效的。
作功是系统热能与外界其它形式能量转换的量度 热量是系统与外界热能转换的量度。
10
8-1 热力学第一定律与常见的热力学过程
五 热力学第一定律
作机械功改变系统
状态的焦耳实验
作电功改变系统
状态的实验
A V
11
8-1 热力学第一定律与常见的热力学过程
焦耳实验 1. 从外界传热, 2. 利用外界作功 结论: 改变系统状态(E )的方式有两种 作功 与 传热 实验证明系统从状态A 变化到状态B, 可以采用做功和传热的方法,不管经过什 么过程,只要始末状态确定,做功和传热 之和保持不变.
dQV CV dT
dQV CV dT
1 1
单位 J mol K
摩尔定体热容: 1mol 理想气体在等体 过程中吸收热量 , 用 CV ,m 表示。
CV CV ,m
20
8-1 热力学第一定律与常见的热力学过程
mol 理想气体
dQV CV ,mdT
QV CV ,m (T2 T1 )
微变过程
dQ dE dW dE pdV
准静态过程
Q E
V2
V1
pdV
14
8-1 热力学第一定律与常见的热力学过程
Q E2 E1 W E W
第一定律的符号规定
Q
E
内能增加
内能减少
W
系统对外界做功
外界对系统做功
+
系统吸热
系统放热
15
8-1 热力学第一定律与常见的热力学过程
宏观运动能量
热运动能量
5
8-1 热力学第一定律与常见的热力学过程
工程热力学第8-9章

∂w c =0 ∂p2
p2 = p1 p3 p2 p3 = p1 p2
pm+1 pm
π1 = π2 =⋅⋅⋅ = πi =⋅⋅⋅ = πm = m
第八、 第八、九章 气体压缩及动力循环
优 点:
(1)减小耗功; 减小耗功; 每级功耗相等,利于曲轴平衡; (2)每级功耗相等,利于曲轴平衡; 每级气体进出温度相同,可以采用相同的材料; (3)每级气体进出温度相同,可以采用相同的材料; 每级排热相同; (4)每级排热相同; 提高容积效率。 (5)提高容积效率。
第八、 第八、九章 气体压缩及动力循环
wC,s h2s − h1 QηC,s = = ′ wC h2 − h1 1 h2 = h1 + h2s − h1
′ ∴wC =
1
QηT =
′ wt,T
ηC,s
(
)
ηC,s
(h
2s
− h1
)
wt,T
′ ∴ wt,T = ηT h3 − h4s
(
h3 − h4 = h3 − h4s
h4 = h3 − ηT h3 − h4s
(
)
)
第八、 第八、九章 气体压缩及动力循环
′ wnet ηi = ′ q1
′ ′ ′ wnet = wt,T − wC = ηT h3 − h4s −
(
)
1
ηCs
(h
2s
− h1
)
′ q1 = h3 − h2 = h3 − h1 −
整理
ηi = ηT ( h3 − h4 ) −
燃烧室 废 气
燃 燃 气 空 气 气 轮 机
第八、 第八、九章 气体压缩及动力循环
8-1相变

有序—无序转变 四, 有序 无序转变
19
图8—4
20
4) 相变前后无成分变化; 原子的配位不变. ) 相变前后无成分变化; 原子的配位不变. 5)马氏体相变速度极快,高达声速 )马氏体相变速度极快, 无相变热,相变激活能小,转变速度快, 无相变热,相变激活能小,转变速度快,以近似于 声波传播的速度进行,比裂纹扩展速度大2~ 倍 声波传播的速度进行,比裂纹扩展速度大 ~3倍. 相 变伴随有体积变化------高温相向低温相转化引起体积 变伴随有体积变化 高温相向低温相转化引起体积 膨胀. 膨胀. 7)马氏体相变没有一个特定的温度,而是在一个温度 )马氏体相变没有一个特定的温度, 范围内进行的. 范围内进行的. 相变具有可逆性,并受外界因素(温度,应力等) 相变具有可逆性,并受外界因素(温度,应力等) 的影响,相变发生于一个温度区间内,而不是一个特 的影响,相变发生于一个温度区间内, 定的温度点. 定的温度点.
即: 1= 2
2 = Vβ P T
2
U = Vα TP
2
S1=S 2
V1=V2
α 1 ≠ α 2 (等压膨胀系数 )
β 1 ≠ β 2(等温压缩系数 )
C p1 ≠ C p2 (热容量 )
所以二级相变时, 系统的化学位, 体积, 熵无突变, 所以二级相变时 , 系统的化学位 , 体积 , 熵无突变 , 但
-黄铜的无序-有序固溶体
体心立方结构
Zn
大学物理 第八章 热力学基础
CV
2019/5/21
P.12/42
§8.2 热力学第一定律
热力学基础
§8.2.1 热力学第一定律 本质:包括热现象在内的能量守恒和转换定律。
E2 E1 W Q (E2 E1) W E W
Q
dQ dE dW
Q
E E2 E1
W
+ 系统吸热 内能增加 系统对外界做功
系统放热 内能减少 外界对系统做功
2019/5/21
P.13/42
热力学基础
热力学第一定律适用于任何系统(气液固)的任何过 程(非准静态过程也适用),
Q E PdV
热力学第一定律的另一叙述:第一类永动机 是不可 能制成的。
第一类永动机:Q = 0, E = 0 ,A > 0的机器;
过一系列变化后又回一开始的状态,用W1表示外界对 气体做的功,W2表示气体对外界做的功,Q1表示气体 吸收的热量,Q2表示气体放出的热量,则在整个过程中 一定有( A )
A.Q1—Q2=W2—W1 ; B.Q1=Q2
C.W1=W2 ;
D.Q1>Q2
2019/5/21
P.16/42
【例8-4】如图,一个四周绝热的气缸热,力中学基间础 有 一固定的用导热材料制成的导热板C把气缸分 成 A.B 两部分,D是一绝热活塞, A中盛有 1mol He, B中盛有1mol N2, 今外界缓慢地
等压膨胀过程 V2>V1 , A>0 又T2>T1, 即E2-E1>0 ∴Q>0 。气体吸收的热量,一部分用于内能的增加,
一部分用于对外作功;
等压压缩过程 A<0 , T2<T1, 即E2-E1<0 ∴Q<0 。
相变的概念与分类
为恒压热膨胀系数)
7
二级相变的特点:
相变时无热效应,无体积效应,熵(S) 和体积(V)连续变化,不发生突变。
但两相的恒压热容,恒温压缩系数, 恒压热膨胀系数不相等(在相变点发 生突变)。
G 1相 S
2相
T
C
T
V
T0
T
图8-3 在二级相变中热容的变化
T
T0
图8-2 二级相变时两相的自 由能、熵及体积的变化
TP TP
此时称为二 级相变。
6
分析:
(
2u T 2
)P
(
S T
)P
CP T
(CP)1 (CP)( 2 比热容不等)
2u
V
V V
( ) ( ) ( ) V
P2 T
P T
P T V
1
2
((V) P T
1为恒温压缩系数) V
2u
(
)
TP T
(V T
)p
(V T
)P
V V
V
1
2
(
(VT )P
1 V
16
亚稳区的特点:
(1)亚稳区具有不平衡状态的特征,物相理论上在该区
域内不能稳定存在,而实际上却能以介稳态存在的区域; (2)在亚稳区内,新相不能自发地产生,要形成新相必 须越过亚稳区,这就是过冷却的原因; (3)在亚稳区内,新相不能自发形成,但当有杂质存在 或外界条件的影响,也可能在亚稳区形成新相,此时亚 稳区被缩小。
17
二.相变过程推动力
过程自发进行
宏观推动力:⊿GT,P≤0
过程达到平衡
1.恒压下的温度条件 由热力学原理,在等温等压下有:ΔG=ΔH-TΔS 在平衡条件下:
8相变过程
马氏体转变特点:
1)相变前后存在习 性平面和晶面定向 关系。
2)快速。可达声速
3)无扩散
4)无特定温度:
四、按成核特点分类(略)
温度段。
均质转变:发生在单一均质中。
非均质转变:有相界面存在。
五、按成分、结构的变化分(略)
u
B
HT RT02
u T ,即说明在高温阶段,T ,u 。
b. 当T<<T0,则G>>RT,此时 u B
此时,生长速率达极大值,一般约在10-5cm/s范围。
上图是GeO2晶体生长速率和过冷度的关系。
可见生长速度随过冷度的增加先增大后减小,具有峰值。这是由于 高温段主要有液相变成晶相的速率控制,增大过冷度对该过程有利; 在低温段由扩散控制,低温对扩散不利,所以生长速度减慢。
重构式转变
位移式转变
§8-2 成核与生长的机理
一、析晶相变过程的热力学
相变过程的不平衡状态及亚稳区
Tg
A BX
C
O
L
D
E
Z
V
s
P/
P
说明:阴影区为亚稳区
结论 a、亚稳区具有不平衡状态。 b、在亚稳区要产生新相必须
过冷。 c、当加入杂质,可在亚稳区
形成新相,此时亚稳区 缩小。
原因:当发生相变时,是以微小液滴或晶粒出现,由于颗粒很小, 因此其饱和蒸汽压和溶解度>>平面态蒸汽压和溶解度,在相平衡温 度下,这些微粒还未达到饱和而重新蒸发和溶解。
广义相变:包括过程前后相组成的变化。
g L (凝聚、蒸发) g S (凝聚、升华) L S (结晶、熔融、溶解) S1 S2 (晶型转变、有序-无序转变) L1 L2 (液体) A+BC 亚稳分相 (Spinodal分相)
第八章 热力学第一定律1
i2 2 , i i 1
R 1 T1 T2 p1V1 p2V2 A 1 1
V 1 p1V1 1 1 1 V2
1
气体的摩尔定压热容为:
C p ,m 1 dQ 1 dE p dV dT p dT p dT p
i E RT , pV RT 2
C p,m
i RR 2
Qp C p,m T2 T1 C p,mT
QV CV ,m T2 T1 CV ,mT
热力学第一定律为: dQV dE 理想气体内能:
i E RT 2
i E RT CV , m T 2
i E RT CV , m T 2
p
2 ( p ,V , T ) 2 2 1
V
( p1 ,V , T1 )
p p1
p2
V T 1 ( p1, 1, )
p p1
2
V2
1 ( p1, 1, ) V T
( p2 , 2 ,T ) V
A
V1
p2
( p2 , 2 ,T ) V
A
V1
2
V2
o
V
o
V
QT
E
A
QT
E
A
等温膨胀,从外界吸热,等温压缩,气体对外界放热
例题8.1
气体等温过程:vmol的理想气体在保持温度T不变 的情况下,体积从V1经过准静态过程变化到V2。求 这一等温过程中气体对外做的功和它从外界吸收的 热。 解: pV=vRT 代入(9)式:
间为1s。内燃机的压缩时间0.01s。均可视这一过程为准静 态过程 • 3 准静态过程的表示方法:p-V图(p-T图、V-T图) a 曲线上的每一个点都是一个 准静态过程 b 非平衡态不能用一定的状态 参量描述,即不能表示为状态 图中的一条线!
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
热学
热力学
宏观规律 从现象中找规律
分子动理论
微观机制
透过现象追本质
根据热力学系统与外界的不同接触方式: 开放系统——有能量传递,有质量传递
孤立系统——没有能量传递,没有质量传递
封闭系统——有能量传递,没有质量传递
第8章 热力学基础
8-1
功和热量
准静态过程(理想化的过程)
准静态过程:从一个平衡态到另一平衡态所经 过的每一中间状态均可近似当作平衡态的过程 .
体 升 p1 压
等 p1 体 降 p2 压
p
1 ( p1,V , T1 ) 2
( p2 ,V , T2 )
o
V
o
E1
V
V
QV
E1
Q>0
E2
QV
E2
W=0,△E >0
W=0,△E <0 Q <0
第8章 热力学基础 二、等压过程 等压过程:气体在状态变化过程中压强保持不变。
p= 恒量
Q p E p (V2 V1 )
第8章 热力学基础 (2) p不变, Q = W+ E,热量转变为功和内能
7 Q p vCp ,m (T T0 ) 2 R (T T0 ) 2
500 T T0 273K 281.6K 7R 7 8.31
V0T 44.8 10 281.6 3 3 V m 0.046m T0 273
dQ Ci dT
第8章 热力学基础 功与热量的异同
1)过程量:功和热量都是过程量,而内能是状态量, 通过做功或传递热量的过程使系统的状态(内能) 发生变化。 2)等效性:改变系统热运动状态作用相同;
热功当量: 1卡 = 4.186 焦耳
3)功与热量的物理本质(能量转换)不同 .
第8章 热力学基础 做功是通过物体做宏观运动来完成能量的传递, 作用:物体有规则的定向运动转换为系统内分子无规则 的热运动; 传递热量是通过分子之间相互碰撞来完成能量的传递,
等压过程系统吸收或放出的热量:
Q p vCp ,m (T2 T1 )
等压过程系统内能的变化:
E vCV ,m (T2 T1 )
等压过程系统作功:
W p(V2 V1 ) vR(T2 T1 )
第8章 热力学基础
讨论:以下两个热力学过程Q、△E、W
p
等 压 膨 胀
p
( p,V1, T1 ) ( p,V2 , T2 )
第8章 热力学基础
p
A*
2 1 *B
p
A*
2 1 *B
o
V
o
V
i i E v RT v R(T2 T1 ) 2 2
△T>0, △E>0,即:温度升高,内能增加;
△T<0, △E < 0,即:温度降低,内能减少。
第8章 热力学基础 例1 一定量的理想气体,由平衡态 A 无论经过什么过程,系统必然: A)对外作正功; B)内能增加; C)从外界吸热; D) 向外界放热。
p
(10 Pa) a 4
5
解
d c
Qacb 200J
Wacb Qacb Eba
b V
1
o
e
1
PaVa PbVb Ta Tb
4 (103 m3 )
Wacb Qacb 200J
Qacbda 1000J
Qacbda Wacbda Wacb Wda
(2) p不变,热量变为什么?氢的T、V各为多少? 解:(1) V不变, Q = E,热量转变为内能
5 E QV vCV ,m (T T0 ) R (T T0 ) 2 2QV 2 500 T T0 273(K) 5R 5 2 8.31 285K
第8章 热力学基础
Q E W
Q 表示系统吸收或放出的热量,W 表示系统所作 的功,E 表示系统内能的变化。
第一定律的符号规定
Q
E2 E1
内能增加
内能减少
W
系统对外界做功
外界对系统做功
+
系统吸热
系统放热
第8章 热力学基础 例2一定量的理想气体经历 acb 过程时吸热 200 J, 则经历acbda 过程时,吸热多少?
C p,m CV ,m
i
5/3=1.6 7/5=1.4
i R 2
CV,m 3R/2 5R/2
Cp,m 5R/2 7R/2
单原子 双原子
He, Ar H2,O2
3 5
多原子
H2O,C
6
4/3=1.3
3R
4R
第8章 热力学基础
等压过程的热力学第一定律:
Q p E p (V2 V1 )
Wda 1200J
第8章 热力学基础 计算各等值过程的热量、功和内能的理论基础
( 1)
pV vRT(理想气体的共性)
dQ dE pdV
解决过程中能
量转换的问题
( 2)
Q E pdV
V1
V2
( 3)
i E v RT 2
(理想气体的状态函数)
(4) 各等值过程的特性 .
p
准静态过程的过程曲 线可以用p-V图来描述, 图上的每一点分别表示 系统的一个平衡态。
p1
p2
1 ( p ,V , T ) 1 1 1 2( p2 ,V2 , T2 )
o
V1
V2
V
第8章 热力学基础
一 功(过程量)
宏观运动能量
热运动能量
功是能量传递和转换的量度,引起系统热运动状态的变化 准静态过程功的计算
QV E dQV dE
吸收或放出的热量 内能的变化 系统对外做功=0
QV vCV ,m (T2 T1 )
i E v R (T2 T1 ) 2
第8章 热力学基础
讨论:以下两个热力学过程Q、△E、W
等 p2
p
2 ( p ,V , T ) 2 2 1
V
( p1 ,V , T1 )
内能的变化
W p(V2 V1 )
p
p
( p,V1, T1 ) ( p,V2 ,T2 ) 1 2
i E v R (T2 T1 ) 2
系统做功
o
V1
V2 V
W p(V2 V1 ) vR(T2 T1 )
PV vRT
第8章 热力学基础 吸收或放出的热量
Q p vCp ,m (T2 T1 )
P
B ,则
A *
B *
TB TA
答:( B )
V
o
第8章 热力学基础
§8-2 热力学第一定律
Q E2 E1 W
p
1*
*2
Q E
V2
V1
pdV
o
V1
V2 V
dQ dE dW dE pdV
系统从外界吸收的热量,一部分使系统的内能增 加, 另一部分使系统对外界做功 .
第8章 热力学基础
§8-3
一、等程中体积保持不变。
V= 恒量 , ΔV= 0 W=0
热力学第一定律
p2
p1
p
( p2 ,V , T2 )
( p1 ,V , T1 )
Q E W
等体过程的热力学第一定律:
o
QV E
V
V
第8章 热力学基础
dW Fdl pSdl
微小过程
dW pdV
W
V
V2
1
pdV
系统对外做功,体积膨胀,功为正;
外界对系统做功,体积压缩,功为负
第8章 热力学基础 注意:作功与过程有关 . 结论:
1、系统所做的功在数值上等于p-V 图上过程曲线 以下的面积
2、状态变化过程不同,过程曲线下面的面积也不 同,系统所作的功也不同 3、系统做功不仅与始末状态有关,而且与路径有 关,功不是状态函数,而是一个过程量
3
Qp
吸收或放出热量:
QV vCV ,m (T2 T1 )
摩尔定体热容: 1mol理想气体在体积不变的状态下, 温度升高一度所需要吸收的热量。
CV ,m
i R 2
单位
J mol1 K 1
系统内能的变化:
i E v RT 2
第8章 热力学基础
公式小结 等体过程的热力学第一定律:
i Q p v R(T2 T1 ) vR (T2 T1 ) 2
摩尔定压热容: 1mol理想气体在压强不变的状态 下,温度升高一度所需要吸收的热量。
C p ,m
i RR 2
第8章 热力学基础 可得摩尔定压热容和摩尔定体热容的关系
C p ,m CV ,m R
摩尔热容比
CV ,m
p
等 压 压 缩
1
2
p
( p,V2 , T2 ) ( p,V1, T1 )
2
1
W
W
o
V1
V2 V
o
V2
V1 V
Qp
E2
E1
Q <0
W
Qp
E1
W
w<0,△E <0
w>0,△E > 0
E2
Q>0
第8章 热力学基础 例4 将500J的热量传给标准状态下的2mol氢。
(1) V不变,热量变为什么?氢的温度为多少?
作用:系统内分子无规则热运动直接之间的交换。
宏观运动能量 分子热运动能量 功 分子热运动能量 分子热运动能量
热量
第8章 热力学基础 三 内能
