实验一 双缩脲法测定蛋白质含量
实验一双缩脲法测定蛋白质含量

实验一:双缩服法测定蛋白质含量一目的掌握双缩腺法测定蛍白质含■的原理及方法。
二原理双缩,眠()是两分于尿素经180°C左右加热,放出一分于氨(NHJ后得到的产物。
在强碱溶液中,双缩關与CUS(h形成紫色络台物,称为双缩腺反应。
其原因是含有两个及以上肽犍或类似肽犍有化台物都具有类似双缩臊反应。
蛋白质含有多个肽键,在碱性溶液中能与CM•络台成紫红色的络合物。
其颜色的深浅与被测样品中蛋白质浓度呈正比,而与蛋白质分于長和氨基酸成分无关,故可用来测定蛋白质含長。
该法对样品中蛋白质含長要求相对较高,一般在1—10mg/L蛋白质。
iris (三甲包基氨墓甲烷)、一些氨基酸、EDTA (乙二胺四乙酸)、草二醸胺、多肽等会于扰该测定。
在一定浓度范围內,反应后颜色与被测样品蛋白质含長呈线性关系,即蛋白质浓度越高, 体系的颜色越深。
反应产物在54()nm处有是大吸收峰(吸光度)。
将未知浓度的样品溶液与一系列已知浓度的标准蛋白质溶液同时与双缩腺试剂反应,并在540nm处比色,可通过标准浓度蛋白质绘制的标准曲线,求得未知样品中的蛋白质含長(浓度)。
由于本法操作简便、迅速、蛋白质浓度与光密度的线性关系奸,故对蛋白质快速而不雷要十分精确的测定可用此法。
三仪器与器材可见光分光光度计、水浴锅、分析天平、振荡机(器)、漏斗、试管架、具塞三角瓶(100ml)容長瓶(250 mk 500mk 1000 ml)刻度吸管(1.0ml 2.0 ml 5.0ml)试管(1.5cmX15cm)o 四试剂1、双缩廉试剂称取硫酸铜(CUSSCHQ) 1.5g,酒石酸钾衲()6-0g,分别用250 ml蒸憎水溶解后,一并转入1000 ml容量瓶中,在搅拌下(可用旋涡混合器或摇动)加入30 mllO%(质長分数)Na()H溶液,然后用蒸憎水稀释至刻度(1000m l)0将该试剂贮存于塑料瓶或内壁涂以石蜡的瓶内。
此试剂可长期保存(须无红色或黒色沉淀出现),长期使用。
双缩脲法测定实验报告

一、实验目的1. 学习双缩脲法测定蛋白质含量的原理和方法。
2. 掌握双缩脲试剂的配制和使用。
3. 了解实验过程中可能出现的误差及解决办法。
二、实验原理双缩脲法是一种经典的蛋白质定量方法,其原理基于蛋白质分子中的肽键与铜离子(Cu2+)在碱性条件下发生反应,生成紫红色络合物。
该络合物在特定波长(如540nm)处的吸光度与蛋白质含量呈正比关系。
通过测量吸光度,可以计算出蛋白质的浓度。
三、实验材料与仪器1. 实验材料:- 蛋白质标准液(已知浓度)- 待测样品(含有未知蛋白质)- 双缩脲试剂A(含CuSO4)- 双缩脲试剂B(含NaOH)- 6mol/L NaOH溶液- 0.1mol/L HCl溶液- 10g/L NaCl溶液- 移液器- 容量瓶- 烧杯- 比色皿- 分光光度计2. 实验仪器:- 移液器- 容量瓶- 烧杯- 比色皿- 分光光度计四、实验步骤1. 配制双缩脲试剂:- 称取0.1g硫酸酮(CuSO4)溶于50mL去离子水中。
- 称取1.5g酒石酸钾钠溶于50mL去离子水中。
- 称取0.05g碘化钾溶于50mL去离子水中。
- 将三种溶液混合,搅拌均匀,备用。
2. 准备蛋白质标准液:- 将蛋白质标准液用去离子水稀释至一定浓度,备用。
3. 准备待测样品:- 称取一定量的待测样品,用去离子水稀释至一定浓度,备用。
4. 标准曲线的制作:- 取7支试管,分别加入0、0.5、1.0、1.5、2.0、2.5、3.0mL蛋白质标准液,然后依次加入1.5mL双缩脲试剂A和1.5mL双缩脲试剂B。
- 将试管放入水浴中加热10分钟,取出冷却至室温。
- 用移液器取0.5mL溶液于比色皿中,以空白试剂为参比,在540nm波长处测定吸光度。
- 以蛋白质含量为横坐标,吸光度为纵坐标,绘制标准曲线。
5. 待测样品的测定:- 按照标准曲线的制作步骤,对待测样品进行测定。
- 根据标准曲线,计算出待测样品中蛋白质的含量。
五、实验结果与分析1. 标准曲线的制作:- 在540nm波长处,蛋白质含量与吸光度呈良好的线性关系,相关系数R²=0.998。
双缩脲法试验一蛋白质含量测定

0 0 3 2
1 2 3 4 5 6 0.3 0.6 0.9 1.2 1.5 1.8 2.7 2.4 2.1 1.8 1.5 1.2 2 2 2 2 2 2
实验一 蛋方法
2.样液测定
取未知浓度的蛋白液 3.0ml 置试管内,加入双缩尿试剂 2.0ml ,混匀,测其 540nm 的值,对照标准曲线方程, 求得未知液蛋白浓度。 ( 注意:计算浓度时,不要把 2ml 双缩脲试剂计算在内,只
生化技术实验
生物实验中心 2009.10
实验一 蛋白质含量测定--双缩脲法
一、 目的 学习掌握双缩脲法测定蛋白质含量。 了解其它一些蛋白质定量方法。
(BCA 法、 folin- 酚试剂法,即 lowry 法,紫外分光光度 法,280nm)
实验一 蛋白质含量测定--双缩脲法
二、原理:
一.
实验目的
了解热水提取多糖的过程与注意事项。并了解 目的物质提取过程中的主要影响因子及其相互
关系。
掌握sevag试剂法除蛋白和乙醇沉降多糖的方法
与注意事项。
并学会使用旋转蒸发仪分离浓缩目的物质。
二 .实验原理
用热水提取真菌植物子实体中的多糖 , 利用 多糖类物质在热水中溶解度较高 , 将其提取 出来。 利用 sevag 试剂将游离蛋白变性成为不溶性 物质,经离心分离去除,可达到去除杂蛋白的 目的 接着利用多糖在乙醇中溶解度降低的原理将 多糖从溶液当中沉降出来。
三、 仪器
中低速离心机、循环真空泵、布式漏斗、 高速干粉粉碎机、恒温水浴锅、旋转蒸发 仪,可见分光光度计。250ml烧杯、试管、 移液管若干、1000mL的磨口锥形瓶1个/组。
生化实验-蛋白定量分析实验报告
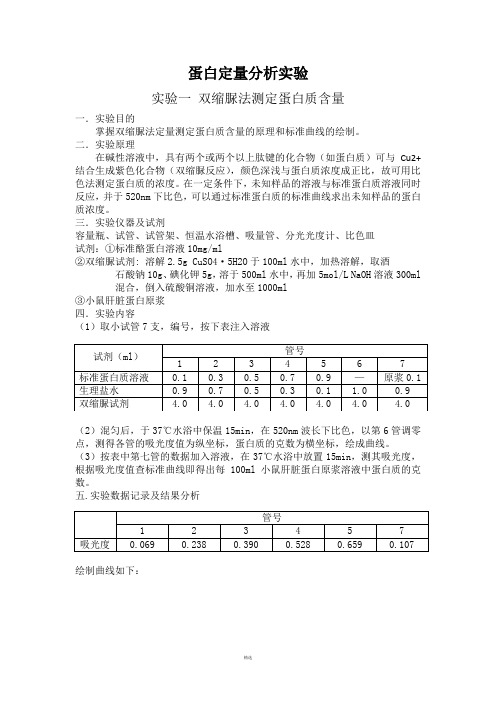
蛋白定量分析实验实验一双缩脲法测定蛋白质含量一.实验目的掌握双缩脲法定量测定蛋白质含量的原理和标准曲线的绘制。
二.实验原理在碱性溶液中,具有两个或两个以上肽键的化合物(如蛋白质)可与Cu2+结合生成紫色化合物(双缩脲反应),颜色深浅与蛋白质浓度成正比,故可用比色法测定蛋白质的浓度。
在一定条件下,未知样品的溶液与标准蛋白质溶液同时反应,并于520nm下比色,可以通过标准蛋白质的标准曲线求出未知样品的蛋白质浓度。
三.实验仪器及试剂容量瓶、试管、试管架、恒温水浴槽、吸量管、分光光度计、比色皿试剂:①标准酪蛋白溶液10mg/ml②双缩脲试剂: 溶解2.5g CuSO4·5H2O于100ml水中,加热溶解,取酒石酸钠10g、碘化钾5g,溶于500ml水中,再加5mol/L NaOH溶液300ml混合,倒入硫酸铜溶液,加水至1000ml③小鼠肝脏蛋白原浆四.实验内容(1)取小试管7支,编号,按下表注入溶液(2)混匀后,于37℃水浴中保温15min,在520nm波长下比色,以第6管调零点,测得各管的吸光度值为纵坐标,蛋白质的克数为横坐标,绘成曲线。
(3)按表中第七管的数据加入溶液,在37℃水浴中放置15min,测其吸光度,根据吸光度值查标准曲线即得出每100ml小鼠肝脏蛋白原浆溶液中蛋白质的克数。
五.实验数据记录及结果分析绘制曲线如下:由图可知,当吸光度为0.107时,相对应的蛋白质克数为1.38 mg,则100ml 小鼠肝脏蛋白原浆液中蛋白质克数为1.38 g。
实验二考马斯亮蓝法测定蛋白质含量一.实验目的掌握考马斯亮蓝法定量测定蛋白质含量的原理和方法;熟悉紫外分光光度计的使用。
二.实验原理考马斯亮蓝在游离状态下呈红色,当它与蛋白质结合后变为蓝色,在一定蛋白质浓度范围内,结合物在595 nm波长下有最大吸收峰,测其光的吸收量即可得结合蛋白质的量。
三.实验仪器及试剂仪器:分光光度计,试管,吸量管,比色皿试剂:①考马斯亮蓝试剂: 考马斯亮蓝G-250 100mg溶于50 ml 95%乙醇中,加入100ml 85%磷酸,用蒸馏水稀释至1000 ml。
双缩脲法测定蛋白质含量实验报告

1. 理解并掌握双缩脲法测定蛋白质含量的原理。
2. 学会使用双缩脲试剂进行蛋白质含量的测定。
3. 通过实验,了解实验误差的产生及其控制方法。
二、实验原理双缩脲法是一种基于蛋白质分子中肽键与铜离子反应产生紫色络合物的分析方法。
当蛋白质分子中的肽键在碱性条件下与铜离子作用时,会形成紫红色的络合物。
该络合物在540nm波长处的吸光度与蛋白质含量呈正比关系,因此可以通过测定吸光度来推算蛋白质的含量。
三、实验材料与仪器1. 实验材料:- 蛋白质标准品- 待测蛋白质样品- 双缩脲试剂- 6mol/L的NaOH溶液- 0.1g/mL的硫酸铜溶液- 7支试管- 移液器- 分光光度计2. 实验仪器:- 磁力搅拌器- 电子天平- 移液管- 量筒1. 标准曲线的制作:- 取7支试管,分别加入0、0.2、0.4、0.6、0.8、1.0ml的蛋白质标准品溶液,用水补足至1ml。
- 各管中加入4ml双缩脲试剂,充分摇匀。
- 在室温下反应30分钟。
- 使用分光光度计在540nm波长处测定吸光度。
- 以蛋白质标准品浓度为横坐标,吸光度为纵坐标,绘制标准曲线。
2. 样品测定:- 取待测蛋白质样品1ml,加入4ml双缩脲试剂,充分摇匀。
- 在室温下反应30分钟。
- 使用分光光度计在540nm波长处测定吸光度。
- 从标准曲线上查找对应的蛋白质含量。
五、实验结果与分析根据实验步骤,绘制标准曲线,并在标准曲线上查找待测样品的蛋白质含量。
实验结果显示,待测样品的蛋白质含量为X mg/mL。
六、实验讨论1. 误差分析:- 误差主要来源于实验操作、试剂质量、仪器精度等因素。
- 为了减少误差,需要严格控制实验操作,使用高精度的仪器,并确保试剂质量。
2. 干扰因素:- 双缩脲法测定蛋白质含量时,一些物质可能会产生干扰,如三羟甲基氨基甲烷、一些氨基酸和EDTA等。
- 为了排除干扰,可以在实验前对样品进行预处理,如透析、凝胶过滤等。
3. 注意事项:- 在使用双缩脲试剂时,必须注意试剂的配制和储存条件。
双缩脲法测定蛋白质含量实验报告

双缩脲法测定蛋白质含量实验报告一、实验目的1、掌握双缩脲法测定蛋白质含量的原理和方法。
2、熟悉分光光度计的使用。
3、学会绘制标准曲线,并通过标准曲线计算未知样品中蛋白质的含量。
二、实验原理双缩脲(NH₂CONHCONH₂)在碱性溶液中能与铜离子(Cu²⁺)作用,形成紫红色的络合物。
由于蛋白质分子中含有多个与双缩脲结构相似的肽键,因此也能发生类似的反应。
而且,反应所产生的颜色深浅与蛋白质的浓度成正比,在 540nm 波长处有最大吸收峰。
据此,可以通过比色法测定蛋白质的含量。
三、实验材料与仪器1、材料标准蛋白质溶液:浓度为 10mg/mL 的牛血清白蛋白溶液。
未知蛋白质样品溶液。
双缩脲试剂:由硫酸铜(CuSO₄·5H₂O)、酒石酸钾钠(NaKC₄H₄O₆·4H₂O)和氢氧化钠(NaOH)配制而成。
2、仪器分光光度计。
移液管(1mL、5mL、10mL)。
容量瓶(100mL)。
试管及试管架。
四、实验步骤1、标准曲线的绘制取 6 支干净的试管,编号为 1 6 号。
按照下表在各试管中分别加入试剂:|试管编号|1|2|3|4|5|6||||||||||标准蛋白质溶液(mL)|0|02|04|06|08|10||蒸馏水(mL)|10|08|06|04|02|0||蛋白质含量(mg)|0|2|4|6|8|10|向各试管中加入 4mL 双缩脲试剂,摇匀后,在室温下放置 30 分钟。
以 1 号试管为空白对照,在 540nm 波长处,用分光光度计测定各试管中溶液的吸光度值(A)。
以蛋白质含量为横坐标,吸光度值为纵坐标,绘制标准曲线。
2、样品蛋白质含量的测定取 2 支干净的试管,编号为 7 号和 8 号。
在 7 号试管中加入 1mL 未知蛋白质样品溶液,8 号试管中加入1mL 蒸馏水作为空白对照。
向 7 号和 8 号试管中分别加入 4mL 双缩脲试剂,摇匀后,在室温下放置 30 分钟。
以 8 号试管为空白对照,在 540nm 波长处,用分光光度计测定 7 号试管中溶液的吸光度值。
蛋白质的定量测定一-双缩脲法

06
CATALOGUE
双缩脲法的改进和发展方向
改进方法
优化试剂配比
通过调整试剂浓度和比例,提高方法的灵敏度和 准确性,减少误差。
扩大应用范围
针对不同来源和性质的蛋白质样品,优化实验条 件,使其能够适用于更多样品的测定。
ABCD
简化操作步骤
减少实验步骤,降低操作难度,提高实验效率。
提高检测速度
采用快速显色反应或缩短反应时间的方法,缩短 实验周期,提高检测速度。
蛋白质结构研究
通过双缩脲法测定不同蛋白质的含量,有助于研究蛋白质的结构和 功能,进一步了解生物体的生命活动。
蛋白质合成与代谢研究
双缩脲法可以用于研究生物体内蛋白质的合成与代谢过程,探索相 关生理机制。
在医学研究中的应用
临床诊断
双缩脲法可以用于检测尿液、血 液等生物样本中的蛋白质含量, 辅助医生进行临床诊断。
药物研发
在药物研发过程中,双缩脲法可 用于检测药物对蛋白质的影响, 评估药物的疗效和安全性。
病理学研究
通过双缩脲法测定病变组织中蛋 白质的含量,有助于病理学研究 ,深入了解疾病的发生和发展机 制。
在食品工业中的应用
食品品质控制
01
双缩脲法可以用于检测食品中的蛋白质含量,确保食品品质符
合标准。
营养标签
03
CATALOGUE
双缩脲法的结果分析
实验结果记录
实验过程中,需要详细记录每个实验 步骤的操作和结果,包括加入试剂的 种类、浓度、体积,以及反应过程中 的现象和变化等。
实验结果记录应准确、详细,包括实 验数据和观察到的现象,以便后续分 析和处理。
结果计算与处理
根据实验记录的数据,进行相应的计 算和处理,以得出蛋白质的含量。
双缩脲法测定蛋白质实验报告

双缩脲法测定蛋白质实验报告
蛋白质的双缩脲法测定是常见的生物化学实验。
它是用来测定有机物中大量焦磷酸核苷(DNS)和蛋白质的10比热容变(TN)的定性分析试验。
一般根据实验结果,可求出有机物中蛋白质的含量。
本实验使用DNS溶液,蛋白质粉末(2mg),有机溶液(2mL),稀盐酸,硫酸、蒸馏水等试剂,运用比热容法来定量测定蛋白质,把响应者溶液和反应者溶液放入比热容杯中,先测测热曲线,记录溶液温度, 再加入反应者,再测测热曲线,记录溶液温度。
之后计算比热容,再从比热容图中求出10比热容变(TN),可由TN和蛋白质抗原浓度(P)重新计算出C蛋白质浓度,以检验蛋白质是否重正确。
本实验首先将22.725mL的2mol/L的硫酸溶液加入比热容杯中,用比热容仪对其温度变化进行测定,测得TN值为10.27 J/g•°C。
然后将8mg的蛋白质粉末和2 mL的稀盐酸中加入到比热容杯中,再测定温度,得到TN值为20.72 J/g•°C。
最后,将TN值相减,得出蛋白质的10比热容变(TN)值为10.45 J/g•°C,根据 TN与P的关系,得出蛋白质浓度C 为1.575mg/mL。
试验结果表明,采用双缩脲法测定有机物中蛋白质的含量是简单、准确、快捷的方法,可以更有效地进行蛋白质测定实验。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
创作编号:
GB8878185555334563BT9125XW
创作者:凤呜大王*
实验一:双缩脲法测定蛋白质含量
一目的掌握双缩脲法测定蛋白质含量的原理及方法。
二原理
双缩脲( )是两分子尿素经180℃左右加热,放出一分子氨( NH3)后得到的产物。
在强碱溶液中,双缩脲与CUSO4形成紫色络合物,称为双缩脲反应。
其原因是含有两个及以上肽键或类似肽键有化合物都具有类似双缩脲反应。
蛋白质含有多个肽键,在碱性溶液中能与CU2+络合成紫红色的络合物。
其颜色的深浅与被测样品中蛋白质浓度呈正比,而与蛋白质分子量和氨基酸成分无关,故可用来测定蛋白质含量。
该法对样品中蛋白质含量要求相对较高,一般在1—10mg/L蛋白质。
tris(三甲羟基氨基甲烷)、一些氨基酸、EDTA(乙二胺四乙酸)、草二酰胺、多肽等会于扰该测定。
在一定浓度范围内,反应后颜色与被测样品蛋白质含量呈线性关系,即蛋白质浓度越高,体系的颜色越深。
反应产物在540nm处有最大吸收峰(吸光度)。
将未知浓度的样品溶液与一系列已知浓度的标准蛋白质溶液同时与双缩脲试剂反应,并在540nm处比色,可通过标准浓度蛋白质绘制的标准曲线,求得未知样品中的蛋白质含量(浓度)。
由于本法操作简便、迅速、蛋白质浓度与光密度的线性关系好,故对蛋白质快速而不需要十分精确的测定可用此法。
三仪器与器材
可见光分光光度计、水浴锅、分析天平、振荡机(器)、漏斗、试管架、具塞三角瓶(100ml)
容量瓶(250 ml、500 ml、1000 ml)、刻度吸管(1.0 ml 2.0 ml 5.0 ml)试管(1.5cmX15cm)。
四试剂
1、双缩脲试剂称取硫酸铜(CUSO4·5H2O)1.5g,酒石酸钾钠()6.0g,分别用250 ml蒸馏水溶解后,一并转入1000 m l容量瓶中,在搅拌下(可用旋涡混合器或摇动)加入30 ml10%(质量分数)NaOH溶液,然后用蒸馏水稀释至刻度(1000ml)。
将该试剂贮存于塑料瓶或内壁涂以石蜡的瓶内。
此试剂可长期保存(须无红色或黑色沉淀出现),长期使用。
2、0.05 ml/L的NaOH(需标定)。
3、标准酪蛋白溶液准确称取0.5 g酪蛋白(干酪素)溶于0.05 ml/L的NaOH 溶液中,并定容于100ml,即为5mg/L的标准溶液。
4、未知蛋白质溶液浓度应在1—10mg/L范围内。
可根据条件选用小麦粉或家畜血清,后者需用水稀释10倍,置于冰箱保存备用。
五方法与步骤
1、标准曲线的绘制取12支试管分两组,分别加入0. 0ml、0.2 ml、0.4 ml、0.6
ml、0.8ml、1.0ml的标准蛋白质溶液,然后分别加入1.0ml、0.8ml、0.6 ml、
0.4 ml、、0.2 ml、0 .0ml蒸馏水,使每支试管总液量为1.0ml,最后分别加入
4 ml双缩脲试剂。
充分摇匀后,室温下(20—25℃)放置30min,于540nm
处进行比色测定,用未加蛋白质溶液的第一支试管作为空白对照液,并取两
组测定的平均值。
以蛋白质的含量作为横坐标,光吸收值为纵坐标绘制标准
曲线。
标准曲线绘制操作表见下。
(共12支管,分两组,只列出一组。
)
2、样品测定
(1)小麦样品的制备与测定①将磨碎过100目筛的小麦样品在80℃下烘至恒重,取出置于干燥器中冷却待用。
②称取烘干样品约0.2g两份,分别放入两个干燥的三角瓶中。
然后各瓶加入5 ml0.05 ml/L的NaOH溶液湿润,之后再加入场20 ml的双缩脲试剂(为什么?)振荡15 min,室温静置反应30min,分别过滤(为什么?),取滤液在540nm波长处比色,在标准曲线上查出相应的蛋白质含量(mg)(为什么?)。
(2)家畜血清样品的制备与测定①对动物空腹采静脉血,不加抗凝剂(为什么?)在室温与待自行凝固(5--10 min),通常经3h,血块收缩析出血清。
析出血清后及时分离之,以防溶血,并稀释10倍置于冰霜保存。
②取两份血清,每份1.0ml,分别加入4 ml双缩脲试剂,摇匀,37℃(为什么?),20 min后用分光光度计于540nm 波长处比色,在标准曲线上查出相应的蛋白质含量。
(3)每次测定中须用空白管调零。
六结果处理
从标准曲线上查得的蛋白质含量(mg)
样品蛋白质(%)=—————————————————X100X酪蛋白的纯度
样品重(mg)
测定管光密度100 测定管光密度
被测血清总蛋白质(g/100ml)=———————X0.05 X———=———————X5
标准管光密度0 .1 标准管光密度
七注意事项
1、三角瓶一定要干燥,勿使样品(小麦粉)粘在瓶壁上。
2、若用小牛血清(BSA)蛋白质含量(mg/ml)应以1mg/ml的A540(540nm波
长吸光度)为0.66来校正其纯度。
3、测定管与第6管操作同。
八思考题
1、分光光度法基本原理是什么?
2、双缩脲测定蛋白质含量的原理是什么?
3、为什么双缩脲法简便、快速而准确性不高?
创作编号:
GB8878185555334563BT9125XW
创作者:凤呜大王*。
