药品不良反应监测报告表模板
药品不良反应报告表

药品不良反应/ 事件报告表新的□严重□一般□医疗卫生机构□生产企业经营企业□个人□编码单位名称:部门:电话:报告日期:年月日制表单位:国家食品药品监督管理局◇不良反应/事件分析1.用药与不良反应/事件的出现有无合理的时间关系?有□无□2.反应是否符合该药已知的不良反应类型?是□否□不明□3.停药或减量后,反应/事件是否消失或减轻?是□否□不明□未停药或未减量□4.再次使用可疑药品后是否再次出现同样反应/事件?是□否□不明□未再使用□5.反应/事件是否可用并用药的作用、患者病情的进展、其他治疗的影响来解释?是□否□不明□◇严重药品不良反应/事件是指有下列情形之一者:①引起死亡□②致畸、致癌或出生缺陷□③对生命有危险并能够导致人体永久的或显著的伤残□④对器官功能产生永久损伤□⑤导致住院或住院时间延长□◇编码规则:省(自治区、直辖市)市(地区)县(区)单位年代流水号□□□□□□□□□□□□□□□□□□□注:省(自治区、直辖市)、市(地区)、县(区)编码按中华人民共和国行政区划代码填写。
单位编码第一位如下填写:医疗机构1、军队医院2、计生机构3、生产企业4、经营企业5。
个人报告单位编码一栏填写6000◇注:通用名称一栏,首次获准进口5年内的进口品种用*注明国家药品不良反应监测中心药品不良反应监测中心通信地址:北京市崇文区法华南里11号楼二层通信地址:邮编:100061邮编:电话:(010)67164979电话:传真:(010)67184951传真:E – mail :report@ E – mail:严重药品不良反应/事件是指因使用药品引起以下损害情形之一的反应/事件:1) 导致死亡;2)危及生命;3)致癌、致畸、致出生缺陷;4)导致显著的或永久的人体伤残或器官功能的损伤;5)导致住院或住院时间延长6)其他有意义的重要医学事件。
如,尽管事件不会立即危及生命或导致死亡和/或需住院,但为了预防出现任一上述所列情况可能需要进行治疗,通常也被认为是严重的。
药品不良反应报告表(模版)

附表1药品不良反应/ 事件报告表(书写模版)首次报告□跟踪报告□编码:报告类型:新的□严重□一般□报告单位类别:医疗机构□经营企业□生产企业□个人□其他□联系电话:职业:医生□药师□护士□其他□报告人信息电子邮箱:签名:报告单位信息单位名称:联系人:电话:报告日期:年月日生产企业请医疗机构□经营企业□个人□文献报道□上市后研究□其他□填写信息来源备注药品不良反应报告表部分项目填报注意事项一、药品不良反应事件名称及描述1.如果患者出现皮疹伴瘙痒,不要把二者同时列为一个不良反应,应当分类描述为“皮疹;瘙痒”,对于皮疹的发生部位、大约形态进行描述;2.如果患者发生多种过敏反应,就不用分类描述,直接描述为“过敏反应”或是“过敏样反应”;不属于过敏反应的其他症状,应当分类描述;3.如果患者出现过敏性休克,就必须描述患者的临床表现(包含呼吸道阻塞、微循环障碍、中枢神经系统症状及皮肤过敏症状)及体征;例如头晕、面色苍白、呼吸困难、胸闷、腹痛、出汗、脉搏增快及血压下降等;此时相应的体征进行描述,如体温、心率、血压、呼吸频率等;还包含不良反应发生前后的症状和体征的动态变化。
4.如果患者出现血象异常,要将不良反应发生前后相应指标、实验室检查进行描述;例如患者白细胞降低,此时就需要提供患者入院时(或服药前)白细胞指数,服药后发生不良反应是监测的白细胞指数以及采取措施停药后患者白细胞有所恢复的指数。
5.如果患者出现消化道反应,例如腹泻、呕吐等,请具体描述一哈相关的症状;例如腹泻,一日几次、什么性状;呕血,一日几次、颜色等性状;呕吐,一日几次、内容物是什么。
二、药品不良反应发生后采取的措施及转归1、药品不良反应发生以后,主要采取的治疗措施要进行描述。
例如立即停药,给与抗过敏治疗(过敏反应)、给与升白细胞治疗(白细胞下降)、给与物理降温(高热)等对症治疗。
具体的治疗措施,例如给与地塞米松10mg肌肉注射,要尽量详细描述对症治疗的药物及剂量。
药品不良反应快速报告登记表格模板(可修改)

药品不良反应快速报告登记表
尊敬的医务人员和患者朋友们:
您好!为了保障广大患者的用药安全,请您在使用药品过程中,如发现任何异常反应或疑似不良反应,务必及时、准确地填写本登记表,以便我们能够迅速收集、分析并采取相应的处理措施。
请您在填写本登记表时,尽量提供详细、准确的信息,我们将对您的个人信息严格保密,仅用
药品不良反应快速报告登记表
尊敬的医务人员和患者朋友们:
您好!为了保障广大患者的用药安全,请您在使用药品过程中,如发现任何异常反应或疑似不良反应,务必及时、准确地填写本登记表,以便我们能够迅速收集、分析并采取相应的处理措施。
请您在填写本登记表时,尽量提供详细、准确的信息,我们将对您的个人信息严格保密,仅用。
药品不良反应报告表模板

药品不良反应报告表部分项目填报注意事项一、药品不良反应事件名称及描述1.如果患者出现皮疹伴瘙痒,不要把二者同时列为一个不良反应,应当分类描述为“皮疹;瘙痒",对于皮疹的发生部位、大约形态进行描述;2.如果患者发生多种过敏反应,就不用分类描述,直接描述为“过敏反应"或是“过敏样反应”;不属于过敏反应的其他症状,应当分类描述;3.如果患者出现过敏性休克,就必须描述患者的临床表现(包含呼吸道阻塞、微循环障碍、中枢神经系统症状及皮肤过敏症状)及体征;例如头晕、面色苍白、呼吸困难、胸闷、腹痛、出汗、脉搏增快及血压下降等;此时相应的体征进行描述,如体温、心率、血压、呼吸频率等;还包含不良反应发生前后的症状和体征的动态变化.4.如果患者出现血象异常,要将不良反应发生前后相应指标、实验室检查进行描述;例如患者白细胞降低,此时就需要提供患者入院时(或服药前)白细胞指数,服药后发生不良反应是监测的白细胞指数以及采取措施停药后患者白细胞有所恢复的指数。
5.如果患者出现消化道反应,例如腹泻、呕吐等,请具体描述一哈相关的症状;例如腹泻,一日几次、什么性状;呕血,一日几次、颜色等性状;呕吐,一日几次、内容物是什么。
二、药品不良反应发生后采取的措施及转归1、药品不良反应发生以后,主要采取的治疗措施要进行描述。
例如立即停药,给与抗过敏治疗(过敏反应)、给与升白细胞治疗(白细胞下降)、给与物理降温(高热)等对症治疗。
具体的治疗措施,例如给与地塞米松10mg肌肉注射,要尽量详细描述对症治疗的药物及剂量.2、药品不良反应的转归,要尽量描述采取对症治疗之后患者的转归.有的医疗机构在患者刚刚发生不良反应,采取措施尚未缓解的时候就立即上报,这种是不规范的。
国家规定药品不良反应报告的上报时限。
大家应当按照规定时限完整的对药品不良反应进行上报。
备注:提供一个药品不良反应/事件报告表填写模板(见附表),供大家参考。
附表药品不良反应 / 事件报告表首次报告□跟踪报告□编码:。
药品不良反应报告表(国家)

药品不良反应报告(bàogào)表(国家)制表单位:国家(guójiā)食品药品监督管理局药品不良反应 / 事件报告表新的□严重(yánzhòng)□一般(yībān)□医疗卫生机构(jīgòu)□生产(shēngchǎn)企业经营企业□个人□编码□□□□□□□□□□□□□□□□□□□单位名称:部门:电话:报告日期:年月日◇不良反应/事件(shìjiàn)分析1.用药与不良反应/事件的出现有无合理的时间关系?有□无□2.反应是否符合该药已知的不良反应类型?是□否□不明□3.停药或减量后,反应/事件是否消失或减轻?是□否□不明□未停药或未减量□4.再次使用可疑药品后是否再次出现同样反应/事件?是□否□不明□未再使用□5.反应/事件是否可用并用药的作用、患者病情的进展、其他治疗的影响来解释?是□否□不明□◇严重药品不良反应/事件是指有下列(xiàliè)情形之一者:①引起(yǐnqǐ)死亡□②致畸、致癌或出生(chūshēng)缺陷□③对生命有危险并能够导致人体永久(yǒngjiǔ)的或显著的伤残□④对器官功能产生永久损伤□⑤导致住院或住院时间延长□◇编码规则:省(自治区、直辖市)市(地区)县(区)单位年代流水号□□□□□□□□□□□□□□□□□□□注:省(自治区、直辖市)、市(地区)、县(区)编码按中华人民共和国行政区划代码填写。
单位编码第一位如下填写:医疗机构1、军队医院2、计生机构3、生产企业4、经营企业5。
个人报告单位编码一栏填写6000◇注:通用名称一栏,首次获准进口5年内的进口品种用*注明国家药品不良反应监测中心药品不良反应监测中心通信地址:北京市崇文区法华南(Huánán)里11号楼二层通信地址:邮编:100061邮编:电话:(010)67164979电话:传真:(010)67184951传真:E – mail :report@ E – mail:新的、严重的药品(yàopǐn)不良反应/事件病例报告要求药品生产企业报告(bàogào)要求1.填报(tiánbào)《药品不良反应/事件报告表》;2.产品(chǎnpǐn)质量检验报告;3.药品(yàopǐn)说明书(进口药品还须报送国外药品说明书);4.产品注册、再注册时间,是否在监测期内(进口药是否为首次获准进口5年内);5.产品状态(是否是国家基本药物、国家非处方药、国家医疗保险药品、中药保护品种);6.国内上年度的销售量和销售范围;7.境外使用情况(包括注册国家、注册时间);8.变更情况(药品成分或处方、质量标准、生产工艺、说明书变更情况);9.国内外临床安全性研究及有关文献报道情况;10.除第1、2项以外,其他项目一年之内如无变更,可以免报。
药品不良反应报告表(示范模板)

附表1药品不良反应/ 事件报告表首次报告□跟踪报告□编码:报告类型:新的□严重□一般□报告单位类别:医疗机构□经营企业□生产企业□个人□其他□药品不良反应报告表部分项目填报注意事项一、药品不良反应事件名称及描述1.如果患者出现皮疹伴瘙痒,不要把二者同时列为一个不良反应,应当分类描述为“皮疹;瘙痒”,对于皮疹的发生部位、大约形态进行描述;2.如果患者发生多种过敏反应,就不用分类描述,直接描述为“过敏反应”或是“过敏样反应”;不属于过敏反应的其他症状,应当分类描述;3.如果患者出现过敏性休克,就必须描述患者的临床表现(包含呼吸道阻塞、微循环障碍、中枢神经系统症状及皮肤过敏症状)及体征;例如头晕、面色苍白、呼吸困难、胸闷、腹痛、出汗、脉搏增快及血压下降(80/50mmHg)等;此时相应的体征进行描述,如体温、心率、血压、呼吸频率等;还包含不良反应发生前后的症状和体征的动态变化。
4.如果患者出现血象异常,要将不良反应发生前后相应指标、实验室检查进行描述;例如患者白细胞降低,此时就需要提供患者入院时(或服药前)白细胞指数,服药后发生不良反应是监测的白细胞指数以及采取措施停药后患者白细胞有所恢复的指数。
5.如果患者出现消化道反应,例如腹泻、呕吐等,请具体描述一下相关的症状;例如腹泻,一日几次、什么性状;呕血,一日几次、颜色等性状;呕吐,一日几次、内容物是什么。
二、药品不良反应发生后采取的措施及转归1、药品不良反应发生以后,主要采取的治疗措施要进行描述。
例如立即停药,给与抗过敏治疗(过敏反应)、给与升白细胞治疗(白细胞下降)、给与物理降温(高热)等对症治疗。
具体的治疗措施,例如给与地塞米松10mg肌肉注射,要尽量详细描述对症治疗的药物及剂量。
2、药品不良反应的转归,要尽量描述采取对症治疗之后患者的转归。
有的医疗机构在患者刚刚发生不良反应,采取措施尚未缓解的时候就立即上报,这种是不规范的。
国家规定药品不良反应报告的上报时限。
药品不良反应报告表

制表单位:国家食品药品监督管理局药品不良反应/ 事件报告表(医疗单位使用)
新的□严重□一般□编码:□□□□□□□□□□□□□□□□□□□
单位名称:科别:电话:报告日期:年月日
《药品不良反应报告表》填表说明
一、《药品不良反应报告表》是药品安全性监测工作的重要档案资料,需要
永久保存,务必要用钢笔填写。
填写的内容和字迹要清查、整洁;不用
不规范的符号、代号,不通用的缩写和草体签名。
二、编号一栏,由省、自治区、直辖市药品不良反应监测机构填写,按以下
排列方式:
省(自治区、医疗预防
直辖市)市(地区)县(区)保健机构年代流水号
□□□□□□□□□□□□□□□
注:省(自治区、直辖市)、市(地区)、县(区)编码按中华人民共和
国行政区划代码填写。
三、在表格相应的方框中,应填入√。
四、不良反应名称应填写不良反应中最主要的表现。
五、不良反应的表现,要求摘要描述,与可疑不良反应有关的临床检查结果
要尽可能明确填写。
六、如有两种怀疑引起不良反应的药品,可同时填上。
药品名称要填写完整,
不可用简称。
七、紧急情况,包括严重的,特别是致死的不良反应,应以最快通讯方式(包
括电话、传真、特快专递、E-mail等)将情况报告国家药品不良反应监
测中心。
药品不良反应报告表样本
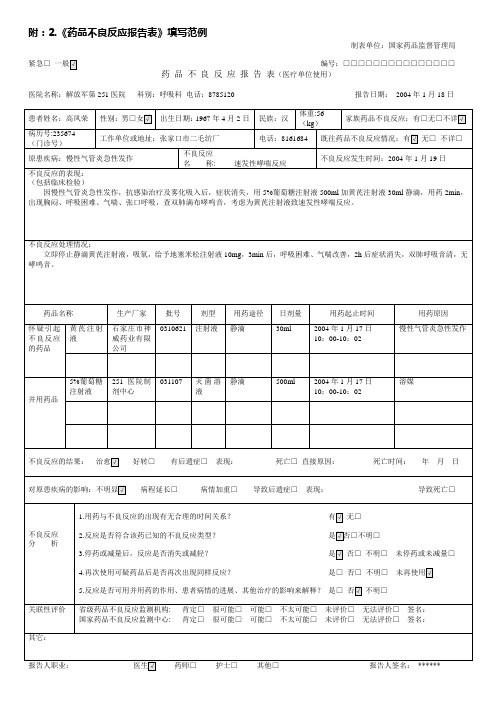
附:2.《药品不良反应报告表》填写范例制表单位:国家药品监督管理局紧急□一般√编号:□□□□□□□□□□□□□□□药品不良反应报告表(医疗单位使用)医院名称:解放军第251医院科别:呼吸科电话:8785120 报告日期:2004年1月18日患者姓名:高凤荣性别:男□女√出生日期:1967年4月2日民族:汉体重:56(kg)家族药品不良反应:有□无□不详√病历号:235674(门诊号)工作单位或地址:张家口市二毛纺厂电话:8161684 既往药品不良反应情况:有√无□不详□原患疾病:慢性气管炎急性发作不良反应名称: 速发性哮喘反应不良反应发生时间:2004年1月19日不良反应的表现:(包括临床检验)因慢性气管炎急性发作,抗感染治疗及雾化吸入后,症状消失,用5%葡萄糖注射液500ml加黄芪注射液30ml静滴,用药2min,出现胸闷、呼吸困难、气喘、张口呼吸,查双肺满布哮鸣音,考虑为黄芪注射液致速发性哮喘反应。
不良反应处理情况:立即停止静滴黄芪注射液,吸氧,给予地塞米松注射液10mg,3min后,呼吸困难、气喘改善,2h后症状消失,双肺呼吸音清,无哮鸣音。
药品名称生产厂家批号剂型用药途径日剂量用药起止时间用药原因怀疑引起不良反应的药品黄芪注射液石家庄市神威药业有限公司0310621 注射液静滴30ml 2004年1月17日10:00-10:02慢性气管炎急性发作并用药品5%葡萄糖注射液251医院制剂中心031107 灭菌溶液静滴500ml 2004年1月17日10:00-10:02溶媒不良反应的结果:治愈√好转□有后遗症□表现:死亡□直接原因:死亡时间:年月日对原患疾病的影响:不明显√病程延长□病情加重□导致后遗症□表现:导致死亡□不良反应分析1.用药与不良反应的出现有无合理的时间关系?有√无□2.反应是否符合该药已知的不良反应类型?是√否□不明□3.停药或减量后,反应是否消失或减轻?是√否□不明□未停药或未减量□4.再次使用可疑药品后是否再次出现同样反应?是□否□不明□未再使用√5.反应是否可用并用药的作用、患者病情的进展、其他治疗的影响来解释?是□否√不明□关联性评价省级药品不良反应监测机构: 肯定□很可能□可能□不太可能□未评价□无法评价□签名:国家药品不良反应监测中心: 肯定□很可能□可能□不太可能□未评价□无法评价□签名:其它:报告人职业:医生√药师□护士□其他□报告人签名:******。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
新的□严重□一般□
单位名称:菏泽市立医院部门:消化内科电话:报告日期:
患者姓名:
性别:男□女□
出生日期:
民族:
体重:(kg)
联系方式:
家族药品不良反应/事件:有□无□不详
既往药品不良反应/事件情况:有□无□不详
不良反应/事件名称:
不良反应/事件发生时间:
病历号/门诊号:
不良反应/事件过程描述(包括症状、体征、临床检验等)及处理情况:
关联性评价
报告人:肯定□很可能□可能□可能无关□待评价□无法评价□签名:
报告单位:肯定□很可能□可能□可能无关□待评价□无法评价□签名:
报告人职业(医疗机构):医生□药师□护士□其他□报告人职务职称(企业):报告人:
商品名称
通用名称(含剂型,监测期内品种用*注明)
生产厂家
批号
用法用量
用药起止时间
用药原因
怀
疑
药
品
并
用
药
品
不良反应/事件的结果:治愈□好转□有后遗症□表现:死亡□直接死因:死亡时间:年月日
原患疾病:
对原患疾病的影响:不明显□病程延长□病情加重□导致后遗症□表现:导致死亡□
国内有无类似不良反应(包括文献报道):有□无□不详□国外有无类似不良反应(包括文献报道):有□无□不详□
