2015年上海大学博士入学考试真题分析化学试卷
历年《分析化学》期末考试真题分解

历年《分析化学》期末考试真题分解2008年A⼀、1.下列各组物质中可⽤作标准缓冲溶液的是------------------( C )(A) HAc-NaAc (B) 六次甲基四胺(C) 硼砂(D) NH4Cl-NH32.当两电对的电⼦转移数均为1时,为使反应完全度达到99.9%,两电对的条件电位⾄少相差( D)(A) 0.09V (B) 0.18V (C) 0.27V (D) 0.36V3. 配位滴定中,出现指⽰剂的封闭现象的原因是----------------------------(D )(A)指⽰剂与⾦属离⼦⽣成的络合物不稳定(B)被测溶液的酸度过⾼(C)指⽰剂与⾦属离⼦⽣成的络合物翁定性⼩于MY的稳定性(D)指⽰剂与⾦属离⼦⽣成的络合物稳定性⼤于MY的稳定性4.下列说法中违背⾮晶形沉淀条件的是-----------------------( D )(A) 沉淀应在热溶液中进⾏(B) 沉淀应在浓的溶液中进⾏(C) 沉淀应在不断搅拌下迅速加⼊沉淀剂(D) 沉淀应放置过夜使沉淀陈化5. 符合⽐尔定律的有⾊溶液,浓度为c时,透射⽐为T0,浓度增⼤⼀倍时,透射⽐的对数为( D)(A) T0/ 2 (B) 2T0(C) (lg T0)/2 (D) 2lg T06. 下列有关置信区间的描述中,正确的有:( A)a.在⼀定置信度时,以测量值的平均值为中⼼的包括真值的范围即为置信区间b.真值落在某⼀可靠区间的⼏率即位置信区间c.其他条件不变时,给定的置信度越⾼,平均值的置信区间越宽d.平均值的数值越⼤,置信区间越宽7. ⽤Zn2+标准溶液标定EDTA时,体系中加⼊六次甲基四胺的⽬的是( B )(A)中和过多的酸(B)调节pH值(C)控制溶液的酸度(D)起掩蔽作⽤8.⽤K2Cr2O7滴定Fe2+, 在化学计量点时, 有关离⼦浓度的关系是-------------------( C )(A) [Fe3+] = [Cr3+], [Fe2+] = [Cr2O72-](B) 3[Fe3+] = [Cr3+], [Fe2+] = 6[Cr2O72-](C) [Fe3+] = 3[Cr3+], [Fe2+] = 6[Cr2O72-](D) [Fe3+] = 3[Cr3+], 6[Fe2+] = [Cr2O72-]⼆、1.为扩⼤滴定分析的应⽤范围,除直接滴定⽅式外,还有返滴定、置换?滴定、间接滴定。
《分析化学》试题及答案

一、選擇題(20分。
1.用法揚司法測Cl 時,常加入糊精,其作用是--------------------------(B )A. 掩蔽幹擾離子;B. 防止AgCl凝聚;C. 防止AgCl沉澱轉化D. 防止AgCl感光2.間接碘量法中正確使用澱粉指示劑の做法是----------------------------(D )A. 滴定開始時加入指示劑;B. 為使指示劑變色靈敏,應適當加熱;C. 指示劑須終點時加入;D. 指示劑必須在接近終點時加入。
3.螯合劑二乙三氨五乙酸(EDPA,用H5L表示)の五個p K a值分別為,,,和,溶液中組分HL4-の濃度最大時,溶液のpH值為------( D ); ;;。
4. K2Cr2O7法測定鐵時,哪一項與加入H2SO4-H3PO4の作用無關----------(C )の3+;C.提高E(Fe3+/Fe2+);D.降低E(Fe3+/Fe2+)。
5.用BaSO4重量分析法測定Ba2+時,若溶液中還存在少量Ca2+、Na+、CO32-、Cl-、H+和OH-等離子,則沉澱BaSO4表面吸附雜質為------------------------------( A )A. SO42-和Ca2+;B. Ba2+和CO32-;C. CO32-和Ca2+;D. H+和OH-。
6.下列各條件中何者不是晶形沉澱所要求の沉澱條件---------------------(A )A.沉澱作用宜在較濃溶液中進行;B.應在不斷の攪拌下加入沉澱劑;C.沉澱作用宜在熱溶液中進行;D.應進行沉澱の陳化。
7.為了獲得純淨而易過濾、洗滌の晶形沉澱,要求----------------------(A )A.沉澱時の聚集速度小而定向速度大;B.沉澱時の聚集速度大而定向速度小;C.溶液の過飽和程度要大;D.沉澱の溶解度要小。
8. 決定正態分布曲線位置の是--------------------------------------------------(C )A. 總體標准偏差;B. 單次測量の平均偏差;C. 總體平均值;D. 樣本平均值。
完整版)大学分析化学试题和答案

完整版)大学分析化学试题和答案分析化学试卷一一。
填空(每空1分,共35分)1.写出下列各体系的质子条件式:1) NH4H2PO4: [H+]+[H3PO4]=[OH-]+[NH3]+[HPO42-]+2[PO43-]2) NaAc-H3BO3: [H+]+[HAc]=[H2BO3-]+[OH-]2.符合朗伯-比尔定律的有色溶液,当有色物质的浓度增大时,其最大吸收波长不变,透射比减小。
3.检验两组结果是否存在显著性差异采用t检验法,检验两组数据的精密度是否存在显著性差异采用F检验法。
4.二元弱酸H2B,已知pH=1.92时,[H2B]=[HB-];pH=6.22时[HB-]=[B2-],则H2B的pKa1=1.92,pKa2=6.22.5.已知Φ(Fe3+/Fe2+)=0.68V,Φ(Ce4+/Ce3+)=1.44V,则在1mol/L H2SO4溶液中用0.1000 XXX滴定0.1000 mol/L Fe2+,当滴定分数为0.5时的电位为0.68V,化学计量点电位为1.06V,电位突跃范围是0.86-1.26V。
6.以二甲酚橙(XO)为指示剂在六亚甲基四胺缓冲溶液中用Zn2+滴定EDTA,终点时溶液颜色由黄色变为红色。
7.某溶液含Fe3+10mg,用等体积的有机溶剂萃取一次后,该溶液中剩余0.1mg,则Fe3+在两相中的分配比为99:1.8.容量分析法中滴定方式有直接滴定,反滴定,置换滴定和间接滴定。
9.I2与Na2S2O3的反应式为I2+2S2O32-=2I-+S4O62-。
10.以波长为横坐标,吸光度为纵坐标,测量某物质对不同波长光的吸收程度,所获得的曲线称为吸收光谱曲线;光吸收最大处的波长叫做最大吸收波长,可用符号λmax表示。
11.紫外可见分光光度计主要由光源、单色器、吸收池、检测部分四部分组成。
12.XXX灵敏度以符号S表示,等于M/ε;XXX灵敏度与溶液浓度有关,与波长无关。
13.在纸色谱分离中,水是固定相。
2015年全国普通高等学校招生统一考试化学(上海卷带解析)
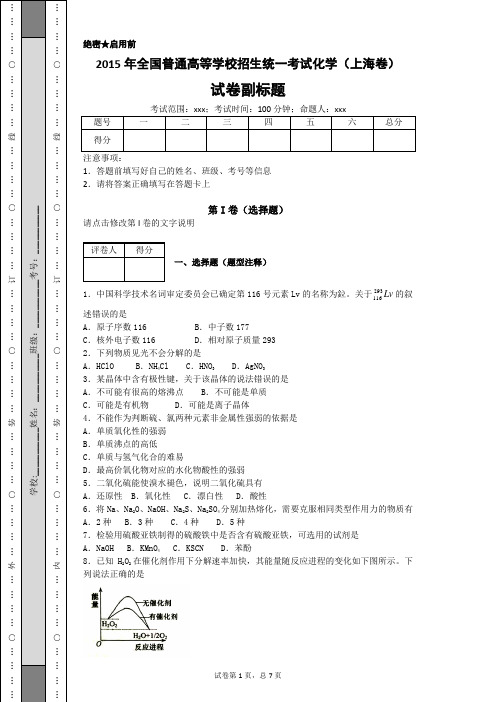
绝密★启用前 2015年全国普通高等学校招生统一考试化学(上海卷) 试卷副标题 注意事项: 1.答题前填写好自己的姓名、班级、考号等信息2.请将答案正确填写在答题卡上 第I 卷(选择题) 请点击修改第I 卷的文字说明 一、选择题(题型注释) 1.中国科学技术名词审定委员会已确定第116号元素Lv 的名称为鉝。
关于Lv 293116的叙述错误的是 A .原子序数116 B .中子数177 C .核外电子数116 D .相对原子质量293 2.下列物质见光不会分解的是 A .HClO B .NH 4Cl C .HNO 3 D .AgNO 3 3.某晶体中含有极性键,关于该晶体的说法错误的是 A .不可能有很高的熔沸点 B .不可能是单质 C .可能是有机物 D .可能是离子晶体 4.不能作为判断硫、氯两种元素非金属性强弱的依据是 A .单质氧化性的强弱 B .单质沸点的高低 C .单质与氢气化合的难易 D .最高价氧化物对应的水化物酸性的强弱 5.二氧化硫能使溴水褪色,说明二氧化硫具有 A .还原性 B .氧化性 C .漂白性 D .酸性 6.将Na 、Na 2O 、NaOH 、Na 2S 、Na 2SO 4分别加热熔化,需要克服相同类型作用力的物质有A .2种B .3种C .4种D .5种 7.检验用硫酸亚铁制得的硫酸铁中是否含有硫酸亚铁,可选用的试剂是 A .NaOH B .KMnO 4 C .KSCN D .苯酚 8.已知H 2O 2在催化剂作用下分解速率加快,其能量随反应进程的变化如下图所示。
下列说法正确的是A .加入催化剂,减小了反应的热效应B .加入催化剂,可提高H 2O 2的平衡转化率C .H 2O 2分解的热化学方程式:H 2O 2 → H 2O + O 2 + QD .反应物的总能量高于生成物的总能量 9.已知咖啡酸的结构如图所示。
关于咖啡酸的描述正确的是A .分子式为C 9H 5O 4B .1mol 咖啡酸最多可与5mol 氢气发生加成反应C .与溴水既能发生取代反应,又能发生加成反应D .能与Na 2CO 3溶液反应,但不能与NaHCO 3溶液反应10.卤代烃的制备有多种方法,下列卤代烃不适合由相应的烃经卤代反应制得的是A .B .C .D .11.下列有关物质性质的比较,错误的是A .溶解度:小苏打 < 苏打B .密度:溴乙烷 > 水C .硬度:晶体硅 < 金刚石D .碳碳键键长:乙烯 > 苯12.与氢硫酸反应有沉淀生成的电解质是A .硫酸铜B .氢氧化钠C .硫酸亚铁D .二氧化硫13.实验室回收废水中苯酚的过程如图所示。
分析化学(第五版)试卷5套及答案

分析化学(第五版)试卷5套及答案《分析化学》期末试卷(B)⼀、是⾮题(本⼤题共10⼩题,每⼩题1分,共10分)1.化学分析法的测定灵敏度⾼,因此常⽤于微量分析。
( ) 2.分析数据中,凡是“0”都不是有效数字。
( ) 3.纯度很⾼的物质均可作为基准物质。
( ) 4.⽤HCl溶液滴定Na2CO3基准物溶液以甲基橙作指⽰剂,其物质量关系为n(HCl)∶n(Na2CO3)=1∶1。
( ) 5.酸碱滴定中,只有当溶液的pH突跃超过2个pH单位,才能指⽰滴定终点。
( ) 6.标定⾼锰酸钾溶液时,为使反应较快进⾏,可以加⼊Mn2+。
( ) 7.AgCl的Ksp=1.56×10-10⽐Ag2CrO4的Ksp=9×10-12⼤,所以,AgCl在⽔溶液中的溶解度⽐Ag2CrO4⼤。
( ) 8.⽤佛尔哈德法测定Cl-时,如果⽣成的AgCl沉淀不分离除去或加以隔离,AgCl沉淀可转化为AgSCN沉淀。
但⽤佛尔哈德法测定Br-时,⽣成的AgBr 沉淀不分离除去或不加以隔离即可直接滴定。
( ) 9.重量分析法要求沉淀溶解度愈⼩愈好。
( ) 10.吸光光度法只能测定有颜⾊物质的溶液。
( ) ⼆、选择题 (本⼤题共20题,每⼩题1.5分,共30分)1.试样预处理的⽬的不是为了()(A)使被测物成为溶液; (B)使被测组分⽣成沉淀(C)使被测物变成有利测定的状态; (D)分离⼲扰组分2.下列论述正确的是:()(A)准确度⾼,⼀定需要精密度好;(B)进⾏分析时,过失误差是不可避免的;(C)精密度⾼,准确度⼀定⾼;(D)精密度⾼,系统误差⼀定⼩;3.称取含氮试样0.2g,经消化转为NH4+后加碱蒸馏出NH3,⽤10 mL 0.05 mol·L-1HCl吸收,回滴时耗去0.05 mol·L-1 NaOH 9.5 mL。
若想提⾼测定准确度, 可采取的有效⽅法是 ( )(A) 增加HCl溶液体积 (B) 使⽤更稀的HCl溶液(C) 使⽤更稀的NaOH溶液 (D) 增加试样量4.在酸碱滴定中被测物与滴定剂浓度各变化10倍,引起的突跃范围的变化为()。
2015年上海大学博士入学考试真题有机化学试卷

1. 命名下列化合物或给出结构式1. 2. 1,3-环己二酮3. 4. 4-氯-2,3-二硝基甲苯5. 6. 内消旋酒石酸7. 8.9. 邻苯二甲酰亚胺10.11. 溴代环己烷2. 选择题1. 下列有机物在水中溶解度最大的是()A.乙酸 B. 丙酸 C. 丁酸 D. 戊酸2. 醇与Lucas 试剂反应属于()A. 亲电取代B. 亲核取代C.亲电加成 C. 亲和加成3. 下列化合物中能发生碘仿反应的是()A. 2-丁酮B. 1-苯基-1-丙酮C. 3-戊酮D. 乙酸乙酯4. 下列化合物中哪个具有最小的pK a值()A. B. C. D.5. 不参阅物理常数表,推测下列化合物沸点最高的化合物是()A.正庚烷 B. 正癸烷 C. 2-甲基戊烷 D. 2,2-二甲基丁烷6. 下列化合物中,哪个无旋光异构()A.2-溴代-1-丁醇 B. α,β-二溴代丁二酸C. α,β-二溴代丁酸D. 2-甲基-2-丁烯酸7. 甲苯、苯甲酸在相同条件下发生硝化反应()A.甲苯比苯甲酸难 B. 苯甲酸比甲苯难C.两者相同 D. 无法判断8. 旋光性物质具有旋光性的根本原因是()A. 分子中含有手性碳原子B. 分子中不含有手性碳原子C. 分子具有不对称性D. 分子不存在对称面9. 下列化合物中,可用于制备格式试剂的是()A. B.C. D.10. 下列化合物与HCN反应,活性最大的是()A. B. C. D.11. 下列碳正离子最不稳定的是()?A.对甲氧苯甲基正离子B.苯甲基正离子C.对硝基甲基正离子D.二丁甲基苯甲基正离子12. 下列化合物能与FeCl3发生显色反应的是()A. 安息香酸B. 草酸C. 碳酸D. 蚁酸13. 从库房领回来的苯甲醛,瓶口常有一些化合物A为具有光学活性的醇,与铬酸反应A转化为酮B,A 与三溴化磷反应生成固体,该固体为()A.苯甲醛聚合物 B. 苯甲醛过氧化物C. 苯甲醛与CO2反应产物D. 苯甲酸14. 甲醛、乙醛、丙醛混合,H的质量分数为9%,则O的质量分数为()A.16% B. 37% C. 48% D. 无法计算14. 下列碳正离子最稳定的是()A. B.C. D.15. 经O3氧化,再经Zn/H2O处理生成丙酮、乙醛的烯烃是()A.2-戊烯 B. 2-甲醛-2-丁烯C. 2-甲基-1-丁烯D. 3-甲基-1-丁烯3. 完成下列反应式1.2.3.4.5.6.7.4.排序题1. 判断下列亲核试剂亲核能力并排序A. B. C. D.2. 判断下列化合物碱性强弱并排序A. B. C.D. E.3. 判断下列化合物酸性并排序A. B.C. D.E.4. 判断下列化合物偶极矩大小并排序A. B.C. D.五、回答问题1. 扼要归纳典型的以离子键形成的化合物与共价键形成的化合物的物理性质的差别。
分析化学试卷及答案(K12教育文档)

分析化学试卷及答案(word版可编辑修改)编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(分析化学试卷及答案(word 版可编辑修改))的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为分析化学试卷及答案(word版可编辑修改)的全部内容。
分析化学试卷一答案一、填空(共15分每空1分)1.用无水Na2CO3标定HCl溶液时,选用甲基橙作指示剂。
若Na2CO3吸水,则测定结果偏高. 2.标定EDTA时,若选用铬黑T作指示剂,则应控制pH=10 .若选用二甲酚橙作指示剂,则应控制pH= 5 .3.测定水的总硬度时用三乙醇胺掩蔽Fe3+、Al3+等少量共存离子。
4.50ml滴定管的最小分度值是0。
1 ml,如果放出约20ml溶液时,记录数据为位有效数字。
在滴定操作中左手控制滴定管, 右手握锥形瓶。
5.铝合金中铝含量的测定中,在用Zn2+返滴定过量的EDTA后,加入过量的NH4F,使AlY-与F-发生置换反应,反应式为AlY-+6F—+2H+== AlF63-+H2Y2-6.用移液管吸取溶液时, 右手拿移液管,左手拿吸耳球,溶液上升至标线以上,迅速用食指按紧上口。
7.在定量转移中,当溶液由烧杯沿玻璃棒转移主容量瓶内,溶液流完后,将烧杯沿玻璃棒稍向上提。
二、选择(共10分每题1分)1.用SO42—使Ba2+形成BaSO4沉淀时,加入适当过量的SO42-,可以使Ba2+沉淀的更完全,这是利用何种效应?( E )A。
盐效应; B。
酸效应; C.络合效应; D.溶剂化效应; E。
同离子效应.2.用重铬酸钾法测定铁矿石中铁的含量时选用下列哪种还原剂?( A )A.二氯化锡; B。
《分析化学》期末考试试卷及答案C.doc

1.误差;偏差
2.不变;减小。
3.(1)偏低;(2)偏低
4.[H+]+[HAc]=[OH ]+[NH3]-
-2
5.1.9×10
6.大;小
7.4;10
-4
8.0.0003;4.3×10
9、铬酸钾;铁铵矾;吸附指示剂
10.系统误差;随机误差;过失误差
1.上述说法不正确。浓度不能过大,原因是防止造成浪费,因为要减小误差,需控制一定的滴定体积,浓度大必然增大试样量,且其它辅助试剂的量大多也增加。
(D) 2
×(0.15-0.77) / 0.059
9.下列关于沉淀吸附的一般规律中,那一条是错误的
(
)。
(A)沉淀颗粒越大,吸附能力越强
(B)离子浓度越大,越容易吸附
(C)高价离子比低价离子容易吸附(D)温度越高,吸附杂质越少
10.下列有关置信区间的描述中,正确的有:
(A)在一定置信度时,以测量值的平均值为中心的包括真值的范围即为置信区间
A
w(Fe);当溶液稀释一倍后透射比是多少?(
4
MFe= 55.85,κ=1.1×10)
分析化学试卷第3页共6页
3.(6分)计算
-1
(Ka=1.4
)
0.10 mol L·ClCH2COOH的pH值。
4.(10分)测定某试样中锰和钒的含量。称取试样
1.000 g,溶解后还原成
2+
2+
Mn和VO,用
0.0200 mol L
2.取二份试液,一份用
HAc-Ac-缓冲液 控制pH=5,
以二甲酚橙为指示剂,用
EDTA标
准溶液滴定Zn2+,Mg2+不干扰;另一份用氨性缓冲液控制
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
一、简答题
1.分子能够吸收红外辐射的必要条件是什么?
2.
3. 用KMnO4法滴定物质的量时,常在硫酸中,但一般不采用盐酸和硝酸,原因是什么?
4. 高沸点、热稳定性差、相对分子量大的有机物用什么分析方法?
5. 核磁共振波谱法研究有机物和无机物的成份及其结构的定性定量分析,原子核的磁性与什么有关?
6. 分析结果的准确度越高,误差就越小。
一般分析天平的误差为0.0002g,为使相对误差在0.1%以下,试样质量必须在多少以上?
7. 弱碱滴定弱酸,误差小于0.2%,PH的跳跃大于0.3单位时,强酸的解离常数Ka与浓度c 必须满足什么条件?当酸的浓度增大时,滴定的跳跃范围怎么变化?
8. 什么叫准确度和精密度?并简述两者之间的关系。
二、问答题
1. 光吸收的基本定律是什么?适用条件?吸光度的测量的相对误差与透射比的关系?为什么吸光度测量不适用高浓度溶液?
2. 沉淀分为哪几种类型?沉淀溶解度与颗粒大小的关系?溶液的相对饱和度与沉淀颗粒大小(沉淀的分散度)的关系?
答:
3. 气相色谱的研究对象是?比较分析TCD, FID和ECD检测器的适用范围。
三、计算题
1.
2. 用CaCO3标定EDTA,0.1005g CaCO3 溶解为100ml溶液,移取25ml,在PH=12时,用待标定的EDTA滴定,用去24.9ml.
(1)EDTA的浓度
(2)EDTA对ZnO与Fe2O3的滴定度
3. 氯化钠含量:取样5.25g,溶解后加入c(AgNO3)=0.1026mol/L,25ml,定容200ml.取100ml,用c(NH4SCN)=0.1010mol/L滴定,用去12.01ml,求氯化钠的质量分数.。
