7-极性颠倒
化学溶剂极性大小顺序

化学溶剂极性大小顺序单一溶剂的极性从小到大顺序为:石油醚→环己烷→四氯化碳→三氯乙烯→苯→甲苯→二氯甲烷→氯仿→乙醚→乙酸乙酯→乙酸甲酯→丙酮→正丙醇→甲醇→吡啶→乙酸混合溶剂的极性顺序为:苯∶氯仿(1+1)→ 环己烷∶乙酸乙酯(8+2)→氯仿∶丙酮(95+5)→苯∶丙酮(9+1)→苯∶乙酸乙酯(8+2)→氯仿∶乙醚(9+1)→苯∶甲醇(95+5)→苯∶乙醚(6+4)→环己烷∶乙酸乙酯(1+1)→氯仿∶乙醚(8+2)→氯仿∶甲醇(99+1)→苯∶甲醇(9+1)→氯仿∶丙酮(85+15)→苯∶乙醚(4+6)→苯∶乙酸乙酯(1+1)→氯仿∶甲醇(95+5)→氯仿∶丙酮(7+3)→苯∶乙酸乙酯(3+7)→苯∶乙醚(1+9)→乙醚∶甲醇(99+1)→乙酸乙酯∶甲醇(99+1)→苯∶丙酮(1+1)→氯仿∶甲醇(9+1)常用流动相极性:石油醚<汽油<庚烷<己烷<二硫化碳<二甲苯<甲苯<氯丙烷<苯<溴乙烷<溴化苯<二氯乙烷<三氯甲烷<异丙醚<硝基甲烷<乙酸丁酯<乙醚<乙酸乙酯<正戊烷<正丁醇<苯酚<甲乙醇<叔丁醇<四氢呋喃<二氧六环<丙酮<乙醇<乙腈<甲醇<氮氮二甲基甲酰胺<水Isooctane(异辛烷)Trifluoroacetic acid(三氟乙酸)Trimethylpentane(三甲基戊烷)Cyclopentane(环戊烷)n-heptane(庚烷)Butyl chloride(丁基氯;丁酰氯)Trichloroethylene(三氯乙烯;乙炔化三氯)Carbon tetrachloride(四氯化碳)Trichlorotrifluoroethane(三氯三氟代乙烷)i-propyl ether(丙基醚;丙醚乙酸苯乙酯phenethyl acetate苯乙酸乙酯ethyl phenylacetate乙酸乙酯英文名: Ethyl acetate 俗称: 醋酸乙酯【参数】1、分子式: CH3COOC2H52、分子量: 88.113、性质: 无色透明液体, 带有水果香味, 沸点77.1, 比重为0.9006, 自然点425.5, 闪点-4易燃, 蒸汽与空气混合时爆炸极限2.2%-11.2%(V/V), 具有酯的通性, 可水解, 微溶于水, 溶于乙醇等一般有机溶剂。
常用溶剂极性顺序

常用溶剂极性顺序
常用溶剂极性顺序为:水(H2O)>甲醇(MeOH)>乙醇(EtOH)>丙酮(Me2CO)>正丁醇(n-BuOH)>乙酸乙酯(EtOAc)>乙醚(Et2O)>氯仿(CHCl3)>苯(C6H6)>四氯化碳(CCl4)>正己烷≈石油醚(Pet.et)。
其中甲醇、乙醇和丙酮三种溶剂能与水互溶,正丁醇是所有与水不相容(分层)的有机溶剂中极性最大的,常用于萃取苷类成分。
氯仿是唯一比重比水重的溶剂。
混合溶剂的极性顺序:苯∶氯仿(1+1)→环己烷∶乙酸乙酯(8+2)→氯仿∶丙酮(95+5)→苯∶
丙酮(9+1)→苯∶乙酸乙酯(8+2)→氯仿∶乙醚(9+1)→苯∶甲醇(95+5)→苯∶乙醚(6+4)→环己烷
乙酸乙酯(1+1)→氯仿∶乙醚(8+2)→氯仿∶甲醇(99+1)→苯∶甲醇(9+1)→氯仿∶丙酮(85+15)→苯∶乙醚(4+6)→苯∶乙酸乙酯(1+1)→氯仿
甲醇(95+5)→氯仿∶丙酮(7+3)→苯∶乙酸乙酯(3+7)→苯∶乙醚(1+9)→乙醚∶甲醇(99+1)→乙酸乙酯∶甲醇(99+1)→苯∶丙酮(1+1)→氯仿∶甲醇(9+1)
拓展资料:
水不具有任何药理与毒理作用,且廉价易得。
所以水是最常用的和最为人体所耐受的极性溶剂。
水能与乙醇、甘油、丙二醇及其他极性溶剂以任意比例混合。
水能溶解无机盐以及糖、蛋白质等多种极性有机物。
液体制剂用水应以蒸馏水为宜。
水的化学活性较有机溶剂强,能使某些药物水解,也容易增殖微生物,使药物霉变与酸败,所以一般以水为溶剂的制剂不宜久贮。
在使用水作溶剂时,要考虑药物的稳定性以及是否产生配伍禁忌。
极性反转

2
OH R2
O
R2 u m p o lu n g S S
R 1C H O
R
对α-氨基酸在α-碳和羧基间进行切断,得到一个不 合理的羧基碳负离子合成子。 解决这一问题的办法是在切断前首先进行官能团转 变,把羧基变成氰基,这样切断后就变成了一个合 理的氰基负离子合成子。
极性反转(umpolung) --在逆合成转化中的应 用
碳-杂原子键(C-X)通常是极 化的,含杂原子官能团化合物有 沿碳骨架给、吸电子反应性交替 这一现象。
X δ1 δ+
这一现象在逆合成分析中选定合 成子对时十分有用。
7 8 δ δ+
6 δ-
5 δ
+
3 4 δ2 δ+ δ
-
在上述的逆合成分析中,我们通 常选择具有常规反应性的合成子, 这样的选择比较稳当,因为常规 反应性经常意味着对应于已知的 反应,由此设计的合成路线成功 机会大。
C O 2H NH2 FGI CN NH2 HN R δ+ +
-
R HN δ+ +
-
C O 2H
CN
RCHO
+
NH3
1,4-双官能团的切断
O O O δδ+ O u m p o lu n g O Br O
一个由有机金属化合物造成的极性转化的例子,也 是生成酰基负离子等价物。
O O δ+ O u m p o lu n g O O C 2H 5 2C u L i δ-
概念:当卤代烷分解成R+和X-时,烷基是正离子。当它形 成格氏试剂后,烷基就变成了负离子,这就叫极性反转。 在逆合成分析中,如拆分的合成元极性与正常的相反,则 必须改变原来目标分子或合成元中的电性,以得到试剂。 有了极性反转这一技术,同一基团即可成正离子,又可成 负离子。这无疑扩大了可能进行的有机合成范围。
CT开路影响及处理.doc

一、CT外部开路,处理时将CT侧接地,然后在处理断线,(规程上是这么说的),请问怎么将CT侧接地?1、因为CT二次都有接地点,所以可以在端子排CT侧将断线相CT接地,将该相CT短接,再处理外部断线问题。
2、我认为,至少可以在CT二次端子接线柱上短接端子,处理后面的断线部分。
但有一点,处理时要站在绝缘垫上,防止伤及自身。
因为可能会有一定电压。
3、先退出相关保护,在电流端子排靠CT侧用短接线短接.然后将电流端子打开进行相关处理.注意使用绝缘工具并站在绝缘垫上.4、我遇到过一次很严重的CT开路,发电机的出口CT,在励磁间里的端子排上开路了,把整个二次柜都烧了,不停的放电,最后机子硬是挺过来了,开路的CT在发电机出口给重新短路了一下,就维持运行了。
二、当出现CT开路的时候,在CT开路处是电压最高的地方烧坏还是在回路中对地绝缘最薄弱的地方烧坏?电流互感器不许开路?开路后有如下现象,应如下处理(1)电流互感器一次电流大小与二次负载的电流大小无关。
互感器工作正常时,由于阻抗很小,接近于短路状态,一次电流所产生的磁化力大部分被二次电流所补偿,总磁通密度不大,二次线圈电势也不大。
当电流互感器开路时,阻抗无限增大,二次电流等于零,副磁化力等于零,总磁化力等于原绕组磁化力(I0W1=I1W1)。
也就是一次电流完全变成了激磁电流,在二次线圈产生很高的电势,其峰值可达几千伏,威胁人身安全,或造成仪表、保护装置、互感器二次损坏。
另一方面原绕组磁化力使铁芯磁通密度过度增大,可能造成铁芯强烈过热而损坏。
(2)电流互感器开路时,产生的电势大小与一次电流大小有关。
在处理电流互感器开路时一定将负荷减小或使负荷为零,然后带上绝缘工具处理,在处理时应停用相应的保护装置。
最先在CT开路处燃烧。
三、变电站 PT、CT障碍及异常处理一、PT、CT当有下列故障象征之一时,应退出相应保护,立即停用互感器。
1. 10KV PT高压侧熔丝连续熔断二次及以上者。
铅酸蓄电池反极现象

铅酸蓄电池反极现象引言:铅酸蓄电池是一种常见的电池类型,广泛应用于汽车、UPS等领域。
然而,在使用铅酸蓄电池的过程中,我们可能会遇到一种现象,即反极现象。
本文将对铅酸蓄电池反极现象进行详细介绍,并探讨其原因和应对方法。
一、什么是铅酸蓄电池反极现象?铅酸蓄电池反极现象,又称为极性颠倒,是指在使用铅酸蓄电池时,正负极的极性发生了颠倒的现象。
通常情况下,铅酸蓄电池的正极为铅(IV)氧化物(PbO2),负极为纯铅(Pb)。
而反极现象则是正负极之间的化学反应发生了异常,导致正负极的功能颠倒。
二、铅酸蓄电池反极现象的原因1. 过充电:铅酸蓄电池在充电时,如果超过其额定电压进行过充电,就容易发生反极现象。
过充电会引起正负极的化学反应逆转,导致正负极的功能发生颠倒。
2. 长时间放电:当铅酸蓄电池长时间处于放电状态时,也容易引发反极现象。
长时间放电会导致电池内部的酸浓度不均匀,从而使正极和负极的化学反应发生异常,出现反极现象。
3. 电解液温度过高:高温环境中使用铅酸蓄电池,会使电解液的温度升高,从而导致正负极的化学反应速率加快。
当温度过高时,正负极的化学反应会变得不稳定,容易产生反极现象。
三、铅酸蓄电池反极现象的危害铅酸蓄电池反极现象会对电池的性能和寿命产生严重的影响,具体表现在以下几个方面:1. 电池容量下降:反极现象会导致正负极的功能颠倒,从而使电池的容量下降。
电池容量下降会导致电池储存和释放电能的能力减弱,影响电池的使用效果。
2. 电池寿命缩短:反极现象会使电池的内部结构变得不稳定,加速电池的老化过程。
电池寿命的缩短会增加更换电池的频率和成本。
3. 电池损坏:反极现象会导致电池内部的化学反应异常,产生过多的气体和热量。
这些异常的化学反应会导致电池内部的压力增大,从而引发电池的损坏,甚至引发电池爆炸的危险。
四、如何应对铅酸蓄电池反极现象1. 控制充电电压:在使用铅酸蓄电池进行充电时,应遵循正确的充电电压范围,避免过充电引发反极现象。
电容器的特点

电容器的特点电容器是一种常见的电子元器件,具有很多独特的特点和性能。
它在电路中起到储存和释放电能的作用,并且在各种电子设备和系统中都有广泛的应用。
本文将重点介绍电容器的特点,包括电容性、电容值、极性、介质、尺寸、稳定性以及应用等方面。
1. 电容性电容器的最基本特点就是具有电容性,即能够存储和释放电荷。
当电容器两个导体之间施加电压时,正极就会吸收正电荷,负极则吸收负电荷,这样就在两极之间形成一个电场。
电容器的电容性取决于电场强度和两极之间的距离,电容值越大,电容器存储的电荷就越多。
2. 电容值电容器的电容值是衡量其存储电能能力的指标。
电容值的单位为法拉(F)。
常见的电容器电容值范围从纳法(F)到毫法(F)不等,不同应用场景需要不同的电容值。
一般来说,电容器的电容值越大,存储的能量就越多,但体积和成本也会增加。
3. 极性电容器的极性是指在实际应用中,电容器两个极的正负极性不能颠倒的特性。
极性电容器的两个极有明确的标识,一般用加号(+)和减号(-)或者标有正负符号表示。
电容器的极性有正极电容器和负极电容器两种类型。
正极电容器在正极上面可以施加正电压,负极电容器则在负极上施加负电压,如果极性颠倒,电容器可能会损坏或无法正确工作。
4. 介质电容器的介质是充当两个电极之间绝缘层的物质。
介质的选择对电容器的性能和特点具有重要影响。
常见的电容器介质包括塑料薄膜、陶瓷、液体等。
不同的介质具有不同的介电常数和耐压能力,影响着电容器的容量、稳定性和使用寿命。
5. 尺寸电容器的尺寸大小因其电容值和应用场景不同而有所差异。
一般来说,电容值越大的电容器体积也越大。
然而,随着技术的发展,电容器的体积不断减小,容量却不断增加。
这使得电容器在小型化电子设备和集成电路中应用更加广泛。
6. 稳定性电容器的稳定性是指其在工作温度范围内的容量和电阻值保持稳定和准确的能力。
电容器的稳定性受到温度、湿度、振动和工作时间等因素的影响。
一些电容器具有良好的稳定性,可以在复杂和恶劣的环境中长时间稳定工作。
科迈AMF8说明书
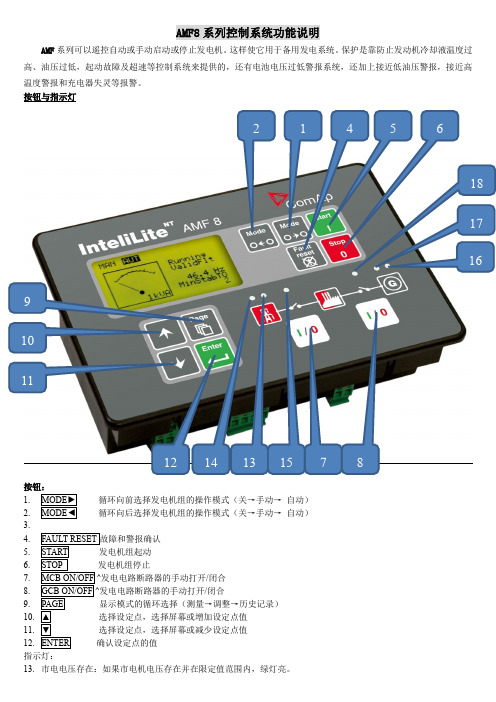
AMF8系列控制系统功能说明AMF 系列可以遥控自动或手动启动或停止发电机。
这样使它用于备用发电系统。
保护是靠防止发动机冷却液温度过高、油压过低,起动故障及超速等控制系统来提供的,还有电池电压过低警报系统,还加上接近低油压警报,接近高温度警报和充电器失灵等报警。
按钮与指示灯按钮:1. 循环向前选择发电机组的操作模式(关→手动→ 自动)2. 循环向后选择发电机组的操作模式(关→手动→ 自动)3.4. 5. 6.7. /闭合 8. /闭合9. 10. 11. 12. 指示灯:13. 市电电压存在:如果市电机电压存在并在限定值范围内,绿灯亮。
2 1 4 5 67 8910111214131518 17 1614.市电故障:当市电发生故障时红色指示灯开始闪亮。
按稳定亮光(如果故障警报仍然存在)或熄灭(如果警报解除)。
15.市电断路器闭合:如果市电断路器闭合,绿灯亮。
当市电断路器的反馈(GCB FEEDBACK)与市电断路器闭合/打开输出(MCB CLOSE/OPEN)不配合,绿灯闪亮。
16.发电电压存在:如果发电机电压存在并在限定值范围内,绿灯亮。
17.发电机组故障:当发电机组发生故障时红色指示灯开始闪亮。
按仍然存在)或熄灭(如果警报解除)。
18.发电机断路器闭合:如果发电机断路器闭合,绿灯亮。
当发电机断路器的反馈(GCB FEEDBACK)与发电机断路器闭合/打开输出(GCB CLOSE/OPEN)不配合,绿灯闪亮。
19.—手动—自动)。
^什么时候使用GCB ON/OFF按钮?在AUT(自动)模式中这些按钮不能使用。
在MAN(手动)模式中使用,但在任何断路器闭合前,电压必须在限定的范围内。
内部保护会反对两个断路器闭合同时进行。
显示菜单有2有用的显示菜单:MEASUREMENT(测量)和ADJUSTMENT(调整)。
不同的屏幕有每个菜单的内容,重复地按怎样看测量数据?1.MEASUREMENT(测量)菜单。
第一章-逆向合成分析ppt课件

1
上课咯
2
有机合成设计
合成路线设计是有机合成的关键
1、有机合成:利用化学反应,将简单的有机化合物制成 比较复杂的有机物的过程。 对于同一目标化合物(Target Molecule,TM)可以有多 条合成路线,不同路线在合成效率上(反应步数、总产 率、反应条件、原料来源、反应时间、中间体和产物纯 度等)存在明显的差别,这些路线都是合理的,但不一 定是适用的,适用的路线须根据实际情况确定。然而, 适用的路线必须来自合理的路线。
对其进行切断; (8)通过共用原子法及在支链处切断,指导多环分子
的切断。
20
官能团的特征对应于特定的反应 合成路线为
21
导向更简单、 易得的前体
切断繁琐
合成路线:
22
合理利用分子的内在对称性或潜在对称性可导 向有效的切断
合成路线
23
碳—杂原子键(C—X)的切断
常见含碳—杂原子键的官能团
24
目标分子的 前体,亚目
标分子
Corey的逆合成分析法
通过切断等操作,从比较 复杂的目标分子推导出简单
易得起始原料的过程。
逆合成分析通常包含 (键的)切断、官能团转变、 官能团添加和(键的)重接 四种基本操作。
10
一) 切断与合成子
碳—碳单键的形成与切断
(1) 由一个碳原子提供两个电子作为共享电子 (2) 每个碳原子贡献一个电子以形成共享的电子对
内酯的切断
合成路线
25
通过共用原子法在支链处切断
26
三.典型化合物的切割
1、芳香族化合物的切割 ⑴烷基芳烃
27
⑵芳香醛
28
(3)取代酚
29
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
C2H5OCH=CH2
O CH3-CH CN
OC2H5 C-CH3 H
LiNR2
O CH3-C CN
OC2H5 C-CH3 H
H+
O
O CH3CO
目标分子
合成子与稳定性:
• 先看下列分子的拆开:
R OH X R
R’
C
R’
C
O
+
X-
+
H+
• 这种拆开方法是否可行,要看X-的稳定性。
• 例如:
R C OH R C O
S R S Li+
• 膦叶立德:
Ph3P-CH2-OCH3
+
n-BuLi
Ph3P
H C OCH3
H + Ph3P=C Li OCH3
• X交换Mg:
C X (a1)
Mg
C MgX (d1)
或
C Mg
C
二)引入杂原子
格氏试剂
(d) (d)
O
RCO3H
(a)
(a)
环氧化
(d2)
O
Br
Br2
(a2)
O α-溴代
O R R' O
O R X R' O O
O R R'
(一)酰基负离子等价物
a) Thioacetals
S S S S BuLi Li S S S S O HgCl2, CdCO3, THF, CH3CN, H2O O C3H7 MeI S S S 1) BuLi CH3 S 2) n-C4H9I S S CH3 S C3H7
为何不用酸
O H
+
HCN
NaOH
OH CH3-CH CN
• 问题:反应机理?
• A用:
OC2H5 -C-CH3 H OH + CH3-CH CN
O CH3-CH CN OC2H5 C-CH3 H
C2H5OCH=CH2
• 问题:反应机理?
• 实际合成步骤:
O H
NaOH
+
HCN
OH CH3-CH CN
O
• 由于 CH3CO- 是实际不存在的合成子,需要从带正电 的结构体通过极性转换,变成带负电的结构体,但如 何处理?
• 处理方法:
O R-C-X
A与B
OA R-C-X B
OA R-C B
+
X+
OA R-C - + B
O
H+
O OA C R B
H3+O
O R C O
• 技术关键:选用什么样的A与B? • 针对本例:B用-CN,即:
质子转移,氰离子离去,得到产物安息香。
反应机理:
• 因此:
CN HO C O
是
的等价物
Example 2:二噻烷碳负离子的形成
• 醛(如乙醛)可以和1,3-丙二硫醇形成二噻烷。
由于硫对碳负离子具有特殊的稳定性,故邻位的
碳有酸性,用正丁基锂在低温四氢呋喃中处理, 得到相应的亲核性碳负离子。该锂化的碳负离子 作为亲核试剂,可以和卤代烃(溴化苄)、其他 羰基化合物(环己酮)以及环氧乙烷衍生物(苯 基环氧乙烷)等合成子发生亲核取代,生成的产 物水解,又得回羰基,因此产物是另一个羰基化 合物。
第七章 极性颠倒 Umpolung
• 极性转换(英文:Umpolung),也称极性
翻转、极性反转、极性颠倒,指有机化学
中官能团极性的改变,是有机合成重要概 念之一。 • 此概念首先由德国化学家Dieter Seebach (迪特尔· 泽巴赫)与美国化学家艾里亚 斯· 詹姆斯· 科里提出,极性转换的英文名称 Umpolung也由德语的Umpolung得来,意为
Ph3P
-HBr
+ C PPh3
磷叶立德
(d1)
• 叶立德(Ylide):指的是一类在相邻原子上有相反电
荷的中性分子。叶立德在有机化学,尤其是有机合成
中有很多应用。通常地,叶立德可以写成以下共振式, 其中一个共振杂化体具有双键:
实际的电子分布取决分子的具体性质。
• 早在1919年 H.施陶丁格等就发现这类特殊结构的 化合物,1954年E.G.维蒂希等提出维蒂希反应, 参与此反应的磷叶立德通常称为维蒂希试剂。 • 叶立德结构具有一个半极性键,碳原子上带有负电 荷,是一个很强的亲核试剂。它与一般碳负离子不 同,能稳定地存在。磷叶立德中的磷原子具有低能 量的3d空轨道,碳上有孤对电子的p轨道,通过d-p 共轭分散了碳上的负电荷,使分子趋于稳定。
方法二:在氧原子上引入稳定化基团
方法三:在 a-位形成活泼的金属盐
三、氨基及其他杂原子的极性颠倒
氨基正离子的合成等效体——偶氮二甲酸酯!
氨基正离子的合成等效体——叠氮化物!
形成α,β-不饱和羰基的有效方法!
例题:
第三节
芳烃和烯烃的极性颠倒
一、芳烃的极性颠倒
1、芳烃的化学极性颠倒法
过渡金属配合物的生成!
极性倒转。
第一节
羰基化合物的极性颠倒
• Example:卤代烷的取代反应
R-X Mg 醚 RMgX RR+
+
Nu
XR-Nu MgX+ R-E 亲电反应 亲核反应
+
E
知识点回顾:
• 格氏试剂:一卤代烷与金属镁在绝对乙醚
(无水、无醇的乙醚)中作用生成有机镁化
合物,产物能溶于乙醚,不需分离即可直接
用于各种合成反应,也称为格利雅试剂。
(CH2)6CO2C(CH3)3
HO
O
(CH2)6CO2C(CH3)3 O O
酰基负离子等价物
b) Nitro compounds
H NO2
O + NO2 NH Me2N C NMe2 or Et3N NO2 O O O NO2 O O O TsOH
O
H NO2
O
O
O
base then acid (Nef reaction) NO
第二节
胺和醇的极性颠倒
一、胺的 a-位极性颠倒
方法一:合成等效体硝基烷的还原!
方法二:在氮原子上引入稳定化基团
亚硝基 酰基 烷氧羰基 或甲脒衍生物
方法三:在 a-碳上引入吸电子基团
方法四:在 a-位形成活泼的金属盐
反应实例:那种策略?
二、羟基的 a-位极性颠倒
方法一:在 a-位引入稳定化负离子
• 又如:
R C OH R R’ C
R’
C2H5
O
+
C2H5-
+
H+
• 一般说来,Et-是一个不稳定的负离子,不能 直接用于和羰基的反应,但通过格氏试剂能 将它稳定下来。
R R’
C
O
+
C2H5MgBr
H3
+O
R R’
C
OH C2H5
• 因此,一个稳定的合成子,可以直接起 反应,而一个不稳定的合成子,就需要 用它的稳定的等价物。
R’
CN
R’
+
CN-
+
H+
• 氰基(CN-)是很稳定的负离子,易与羰基 发生亲核加成反应:
R R’ C O
+
CN-
H+
R R’
C
OH CN
小常识:
氰化氢有剧毒,且挥发性较大(沸点26.5℃), 故在羰基化合物与氰化氢加成时,为了避免直接使用 氰化氢,通常是把无机酸加入醛(酮)和氰化钠水溶
液的混合物中,以便HCN一生成就立即与醛(酮)作用, 但在加酸时应注意控制溶液的pH值,使之始终偏于碱 性(pH约为8),以利于反应的进行。
酚环的极性颠倒——氧化!
抗高血压药物-利血平
2、芳烃的酶或微生物转化
效率:µ g/L/d !
二、烯烃的极性颠倒法
1、烯烃的金属配位——极性颠倒法
2、强亲核试剂对非活化烯烃的加成
3、亲电加成与亲电杂原子环化反应
第四节 其它合成子极性颠倒
• 一)杂原子的交换
• Br交换P:
Br
CH (a1)
羰基极性颠倒的具体应用
• Example 1:安息香缩合反应
• 安息香缩合是羰基极性转换的代表,也是人们最早知道的
极性转换的例子。 • 反应物苯甲醛中的羰基碳原子是亲电性的。首先发生氰离
子对羰基碳的亲核加成,然后质子由碳转移到氧上,形成
一个碳负离子,其中的碳发生了极性转换,是亲核性的。 然后该碳原子亲核进攻另一分子的苯甲醛的亲电性羰基碳,
C2H5 O C2H5 R-Mg-X O CH C2H5 2 5
• 当卤代烷分解成R+与X-时,烷基是正离子,当
它通过格式试剂再分解时,烷基就成了负离
子,这就称为极性转换;
• 同一基团既可成为正离子,也可成为负离子。
• Example:用环己烯酮合成β-乙酰基 环己酮
O CH3C CH3CO O
S
S
相当于
O
酰基负离子的等价物!
• O交换S:
O C H SH SH C S S
• X交换金属Fe:
O O
Fe(CO)42-
C X
C
Fe(CO)4
• 羟基腈:
O C H Ar
CN-
OH Ar CN
• 端炔基
O R C H
HC≡CNa (1)氧化 (2)NaNH2
O R C C
C
(一)酰基负离子等价物
(Z=H, 烷基,芳基,卤素,氰基等 H
(a3)
Z
RSH [O],H+
