元素周期表各原子结构示意图
《原子结构》原子结构与元素周期表课件 图文

年代 1911年
模型
卢瑟福 原子 模型
观点或理论
在原子的中心有一个带正电 荷的核,它的质量几乎等于 原子的全部质量,电子在它 的周围沿着不同的轨道运转, 就像行星环绕太阳运转一样。
年代 1913年
模型
玻尔原子 模型
1926~ 1935年
电子云 模型
观点或理论
电子在原子核外空间的一定 轨道上绕核做高速圆周运动。
(8)内层电子总数是最外层电子数2倍的原子有Li、P。 (9)电子层数与最外层电子数相等的原子有H、Be、Al 。 (10)电子层数是最外层电子数2倍的原子是Li。 (11)最外层电子数是电子层数2倍的原子有He、C、S。 (12)最外层电子数是电子层数3倍的原子是O。
【迁移·应用】 1.(2019·南京师大附中高一检测)下列各原子结构示 意图中所表示的核外电子排布正确的是 ( )
【解析】选D。A原子的M层比B原子的M层少3个电子,B 原子的L层电子数恰为A原子L层电子数的2倍,说明A、B 为第二、第三周期元素;L层最多排8个电子,B原子的L 层电子数恰为A原子L层电子数的2倍,说明B原子的L层 有8个电子,A原子的L层有4个电子,故A是碳原子;A原子 的M层比B原子的M层少3个电子,故B为铝原子。
2.用A+、B-、C2-、D、E、F和G分别表示含有18个电子 的七种微粒(离子或分子),请回答: (1)A元素是________,B元素是________,C元素是 ________(用元素符号表示)。 (2)D是由两种元素组成的双原子分子,其分子式是 ________。
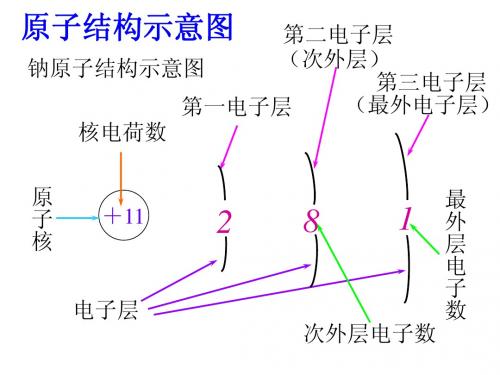
知识点 核外电子的分层排布 【重点释疑】 1.原子核外电子排布规律及其之间的关系
2.原子核外电子排布的表示方法 (1)原子结构示意图。
所有原子结构示意图 号 元素周期表

+101 2 8 18 32 31 8 2 钔 Md +102 2 8 18 32 32 8 2 锘 No +103 2 8 18 32 32 9 2 铹 Lr +104 2 8 18 32 32 10 2 鈩 Rf +105 2 8 18 32 32 11 2 钅杜 Db +106 2 8 18 32 32 12 2 钅喜 Sg +107 2 8 18 32 32 13 2 钅波 Bh +108 2 8 18 32 பைடு நூலகம்2 14 2 钅黑 Hs +109 2 8 18 32 32 15 2 钅麦 Mt +110 2 8 18 32 32 16 2 鐽、Ds +111 2 8 18 32 32 17 2 錀 Rg +112 2 8 18 32 32 18 2 Uub +113 2 8 18 32 32 18 3 Uut +114 2 8 18 32 32 18 4 Uuq +115 2 8 18 32 32 18 5 Uup +116 2 8 18 32 32 18 6 Uuh +117 2 8 18 32 32 18 7 Uus +118 2 8 18 32 32 18 8 Uuo
+67 2 8 18 29 8 2 钬 Ho +68 2 8 18 30 8 2 铒 Er +69 2 8 18 31 8 2 铥 Tm +70 2 8 18 32 8 2 镱 Yb +71 2 8 18 32 9 2 镥 Lu +72 2 8 18 32 10 2 铪 Hf +73 2 8 18 32 11 2 钽 Ta +74 2 8 18 32 12 2 钨 W +75 2 8 18 32 13 2 铼 Re +76 2 8 18 32 14 2 锇 Os +77 2 8 18 32 15 2 铱 Ir +78 2 8 18 32 17 1 铂 Pt +79 2 8 18 32 18 1 金 Au +80 2 8 18 32 18 2 汞 Hg +81 2 8 18 32 18 3 铊 Tl +82 2 8 18 32 18 4 铅 Pb +83 2 8 18 32 18 5 铋 Bi +84 2 8 18 32 18 6 钋 Po +85 2 8 18 32 18 7 砹 At +86 2 8 18 32 18 8 氡 Rn +87 2 8 18 32 18 8 1 钫 Fr +88 2 8 18 32 18 8 2 镭 Ra +89 2 8 18 32 18 9 2 锕 Ac +90 2 8 18 32 18 10 2 钍 Th +91 2 8 18 32 20 9 2 镤 Pa +92 2 8 18 32 21 9 2 铀 U +93 2 8 18 32 22 9 2 镎 Np +94 2 8 18 32 24 8 2 钚 Pu +95 2 8 18 32 25 8 2 镅 Am +96 2 8 18 32 25 9 2 锔 Cm +97 2 8 18 32 27 8 2 锫 Bk +98 2 8 18 32 28 8 2 锎 Cf +99 2 8 18 32 29 8 2 锿 Es +100 2 8 18 32 30 8 2 镄 Fm
【最新】原子序数123456789

原子半径相比( A )
A. 稍大 2021/2/2
B. 稍小
C. 特别大 D. 无法比较 19
4.下列有关元素周期律的叙述,正确的是( A )
A.元素周期律的本质是元素原子核外电子排布呈周期性变化 B.元素周期律的本质是原子半径呈周期性变化 C.元素周期律的本质是元素的性质随原子序数的递增呈周期性变化 D.元素周期律的本质是元素的性质随原子量的递增而呈周期性变化 幻灯片 21
作 1.细读:第三节 元素周期律
业 2.思考:P132习题1~3 3.预习:第四节 元素周期表
2021/2/2
20
元素周期律的内容:随着元素原
子序数的递增,元素性质呈周期性 变化。
元素周期律的实质:元素性质的
周期性变化是元素原子核外电子排 布周期性变化的必然结果。
2021/2/2
21
谢谢听课
2021/2/2
化合价
-4 -3 -2 -1
原子序数 10 11 12 13 14 15 16 17 18
元素名称 氖 钠 镁 铝 硅 磷 硫 氯 氩 主 要 0 +1 +2 +3 +4 +5 +6 +7 0
化合价
-4 -3 -2 -1
2021/2/2
13
三、元素化合价的周期 性变化
随着元素原子序数的递增,元 素主要化合价呈周期性的变化。
2021/2/2
18
【课堂练习】
1.下列元素的原子半径依次减小的是( AB )
A. Na、Mg、Al C. P、Si、Al
B. N、O、F D. C、Si、P
2.下列各组微粒半径(r)之比大于1的是(AB )
A. rCl / rF
第二节 原子结构与元素的性质 元素周期表

问题与思考3:
1 2 3
按电子排布,可把周期表里的元素划分为哪 些区?各区包含哪些元素?
s
d
ⅢB--ⅦB、Ⅷ
p
ds
ⅠB ⅡB
4 ⅠA 5
ⅡA
ⅢA--ⅦA、
6 7
0族
f
镧系、锕系
问题与思考4:
1 2 3
各区元素的价电子构型如何?
s
p
4 ns1-2 5
6
d
(n-1)d1-8ns1-2 (个别例外)
ds
(n-1)d10ns1-2
ns2np1-6
7
f
(n-2)f0-14(n-1)d0-2ns2
问题与思考5:
如何根据原子的价电子构型判断元素在周期表中 位置? 价电子 4s1 3d3 4s2 4d55s1 5d76s2 4s24p5 构型 第四周期 第四周期 第五周期 第六周期 第四周期 ⅦA族 ⅤB族 Ⅷ族 ⅥB族 位置 ⅠA族 位置 第五 第四 第七周 周期 周期 期 ⅡA 族 ⅥA 族 ⅣB 族 5s2 4s2 4p4 6d2 7s2 第六周 第五周 期 期 ⅡB族 ⅠB族 5d10 6s2 4d10 5s1
比较元素金属性强弱的方法
• (1)根据金属活动性顺序表判断。自左至右 金属活动性顺序表 金属性减弱,即失电子能力减弱,如: Zn>Cu。 • (2)根据元素周期表判断。同周期,从左至 比较它们在元素周期表中的位 右金属性减弱。同主族,自上而下金属性增 强。如:Na>Mg>Al ,Na<K。 置
• (3)根据元素的单质与水(或酸)反应置换出 氢的难易程度判断。置换反应越易发生的 单质与水(酸)反应 元素金属性越强。如钾与水比钠与水反应 剧烈,则K>Na(金属性)。 • (4)根据其最高价氧化物对应的水化物—— 氢氧化物碱性强弱的判断。碱性越强,元 最高价氧化物对应的水化物的 素的金属性越强。如: NaOH>Mg(OH)2>Al(OH) 碱性 3(碱性),则 Na>Mg>Al(金属性)。
1-1-1原子核外电子排布
解析
(1)该微粒为中性微粒,即核电荷数等于核外
电子数,为18号元素氩。 (2)该微粒能使溴水褪色,即为还原性微粒,且出现 浑浊,即有难溶性的非金属单质。符合条件的为硫 元素。 (3)该微粒得到一个电子可变成原子,故为19号元素 钾。 (4)该微粒失去一个电子可变成原子,故为17号元素 氯。
( A )
C.a=b+m-n D.a=b-m-n 解析 在原子中,核电荷数等于核外电子数;在
阳离子中,核电荷数减去离子所带电荷数等于核 外电子数;在阴离子中,核电荷数加上离子所带 电荷数等于核外电子数。因为Xm+和Yn-具有相同 的核外电子排布,所以,Xm+和Yn-具有相同的核 外电子数,aXm+的核外电子数等于a-m,bYn-的 核外电子数为:b+n,则:a-m=b+n。
3.在下列所表示的微粒中,得电子能力最强的是 ( B )
解析
四个选项的示意图分别表示碳原子、氟原
子、钠离子、铝离子。钠离子和铝离子都形成最外 电子层为8个电子的稳定结构,则它们很难得到电 子。氟原子比碳原子的核电荷数大,最外层电子数 多,原子半径小,原子核对核外电子的吸引力大, 因此氟原子比碳原子更易得电子。
答案
(1)Ar
(2)S2-
(3)K+
(4)Cl-
8.A、B、C三种元素,其中有一种金属元素,A、 B原子的电子层数相同,B、C原子的最外层电子 数相同。又知这三种元素原子的最外层电子数之 和为17,原子核中的质子数之和为31。试通过计 算确定这三种元素的名称。 解析 设元素A、B原子最外层电子数分别为y和x,
原子结构与元素周期表ppt课件

二、元素周期表的结构
例3 下列关于元素周期表的说法正确的是 A.在元素周期表中,每一纵行就是一个族 B.主族元素都是短周期元素
√C.副族元素都是金属元素
D.元素周期表中每个长周期均包含32种元素
解析 A项,第8、9、10三个纵行为第Ⅷ族; B项,主族元素由短周期元素和长周期元素共同组成。
二、元素周期表的结构
【例题 1】判断正误(正确的打“√”,错误的打“×”)。
(1)碱金属元素原子的次外层电子数都是 8 个
(× )
(2)化合物中碱金属元素的化合价都为+1
(√ )
(3)碱金属元素的原子半径随核电荷数的增大而增大 (√)
(4)碱金属单质的化学性质活泼,易失电子发生还原反应(×)
(5)Li 在空气中加热生成 Li2O2
先熔化成小球,后燃烧,反应剧烈, 火焰呈黄色,生成淡黄色固体
2Na O2 Na 2O2
金属活动性:K > Na
总结 ▶ 相同条件下,碱金属从Li到Cs,与O2反应越来越剧烈,产物越来越复杂,说
明金属越来越活泼。
【实验・探究】
【实验・探究】
(2)钠、钾与水的反应
钾
钠
实验 操作
实验 现象
钾浮于水面;迅速熔化成银 色小球;四处游动;反应剧 烈;有轻微爆炸声并着火燃 烧 ;反应后滴入酚酞;溶 液变红。
质量数(N)
3.核外电子排布
质子数(Z)
(1)电子层:在多电子原子里,把电子运动的 能量不同 的区域简化为 不连续的壳,层 称作电子层。
(2)电子层划分
电子层(n) 1
2
3
4
5
6
7
符号
K LMNO P Q
离核远近
(完整版)元素周期表各原子结构示意图

元素周期表各原子结构示意图第1周期[1] K 氢1[2] He 氦2第2周期[3] Li 锂2 1[4] Be 铍2 2[5] B 硼2 3[6] C 碳2 4[8] O 氧2 6[9] F 氟2 7[10]Ne 氖2 8第3周期[11]Na 钠2 8 1[12]Mg 镁2 8 2[13]Al 铝2 8 3[14]Si 硅2 8 4[15] P 磷2 8 5[16] S 硫2 8 6[17]Cl 氯2 8 7[18]Ar 氩2 8 8第4周期[19]K 钾2 8 8 1[20]Ca 钙2 8 8 2[21]Sc 钪2 8 9 2[22]Ti 钛2 8 10 2[23]V 钒2 8 11 2[24]Cr 铬2 8 13 1[25]Mn 锰2 8 13 2 [26]Fe 铁2 8 14 2[27]Co 钴2 8 15 2[28]Ni 镍2 8 16 2[29]Cu 铜2 8 18 1[30]Zn 锌2 8 18 2[31]Ga 镓2 8 18 3[32]Ge 锗2 8 18 4[33]As 砷2 8 18 5[34]Se 硒2 8 18 6[35]Br 溴2 8 18 7[36]Kr 氪2 8 18 8第5周期[37]Rb 铷2 8 18 8 1[38]Sr 锶2 8 18 8 2[40]Zr 锆2 8 18 10 2[41]Nb 铌2 8 18 12 1[42]Mo 钼2 8 18 13 1[43]Tc 锝2 8 18 13 2[44]Ru 钌2 8 18 15 1[45]Rh 铑2 8 18 16 1[46]Pd 钯2 8 18 18[47]Ag 银2 8 18 18 1[48]Cd 镉2 8 18 18 2[49]In 铟2 8 18 18 3[50]Sn 锡2 8 18 18 4[51]Sb 锑2 8 18 18 5[52]Te 碲2 8 18 18 6[53]I 碘2 8 18 18 7[54]Xe 氙2 8 18 18 8第6周期[55]Cs 铯2 8 18 18 8 1[56]Ba 钡2 8 18 18 8 2[57]La 镧2 8 18 18 9 2[58]Ce 铈2 8 18 19 9 2[59]Pr 镨2 8 18 21 8 2[60]Nd 钕2 8 18 22 8 2[61]Pm 钷2 8 18 23 8 2[62]Sm 钐2 8 18 24 8 2[63]Eu 铕2 8 18 25 8 2[64]Gd 钆2 8 18 25 9 2[65]Tb 铽2 8 18 27 8 2[66]Dy 镝2 8 18 28 8 2[67]Ho 钬2 8 18 29 8 2[68]Er 铒2 8 18 30 8 2[69]Tm 铥2 8 18 31 8 2[70]Yb 镱2 8 18 32 8 2[71]Lu 镥2 8 18 32 9 2[72]Hf 铪2 8 18 32 10 2[73]Ta 钽2 8 18 32 11 2[74]W 钨2 8 18 32 12 2[75]Re 铼2 8 18 32 13 2[76]Os 锇2 8 18 32 14 2[77]Ir 铱2 8 18 32 15 2[78]Pt 铂2 8 18 32 17 1[79]Au 金2 8 18 32 18 1[81]Tl 铊2 8 18 32 18 3[82]Pb 铅2 8 18 32 18 4[83]Bi 铋2 8 18 32 18 5[84]Po 钋2 8 18 32 18 6[85]A 砹2 8 18 32 18 7[86]Rn 氡2 8 18 32 18 8第7周期[87]Pr 钫2 8 18 32 18 8 1[88]Ra 镭2 8 18 32 18 8 2[89]Ac 锕2 8 18 32 18 9 2[90]Th 钍2 8 18 32 18 10 2[91]Pa 镤2 8 18 32 20 9 2[92]U 铀2 8 18 32 21 9 2[93]Np 镎2 8 18 32 22 9 2[94]Pu 钚2 8 18 32 24 8 2[95]Am 镅*2 8 18 32 25 8 2[96]Cm 锔*2 8 18 32 25 9 2[97]Bk 锫*2 8 18 32 27 8 2[98]Cf 锎*2 8 18 32 28 8 2[99]Es 锿*2 8 18 32 29 8 2[100]Fm 镄* 2 8 18 32 30 8 2[101]Md 钔* 2 8 18 32 31 8 2[102]No 锘* 2 8 18 32 32 8 2[103]Lr 铹* 2 8 18 32 32 9 2[104]Rf*[105]Db*[106]Sg*[107]Bh*[108]Hs*[109]Mt*[110]Ds*[111]Rg*[112]Uub*104-112号暂未列出57-71号为镧系元素89-103号为锕系元素红色(深红色)为放射性元素带*号为人造元素。
第一节元素周期表

物质结构、元素周期律 元素周期表
第一节
门捷列夫与元素周期表
第一张元素周期 表是俄国化学家 门捷列夫于1869 年绘制完成的。 他将元素按相对 原子质量由小到 大排列,化学性 质相似的元素放 在一个纵行。
第一章
物质结构、元素周期律
元素周期表
第一节
一、元素周期表的结构
原子序数:依原子核电荷数由小到大的顺序给元素编号,这种 编号叫原子序数。
七个横行为七个周期
周期序数 = 原子电子层数 第1周期 2 种元素 短周期 (3个) (2)周期的分类 第2周期 8 种元素 第3周期 8 种元素 第4周期 18 种元素 第5周期 18 种元素
(若排满也 是32种)
第6周期 32 种元素 不完全周期 第7周期 26 种元素
长周期 (3个)
三长三短一不全
(二)卤族元素
Br2 I2
1、卤素单质的物理性质 递 变 性
颜色
F2 Cl2
状态
熔沸点 密度
相 似 性 都有颜色 熔沸点较低 不易溶于水(除F2) 易溶于有机溶剂
气
浅 → 深 低 →
小 →
→ 液 → 固
Br2
I2
高
大
注意:溴、碘单质在不同溶剂中的颜色 Br2 I2 水溶液 黄(稀)→ 橙色(浓) 深黄(稀)→褐色(浓) 油(CCl4、苯等)溶液 橙红色 紫红色
(2)卤素与水反应
与水反应 F2 Cl2 Br2
剧烈反应,生成氟化氢和氧气 2F2+2H2O=4HF+O2
与水缓慢反应 Cl2+H2O=HCl+HClO 与水反应更弱 Br2+H2O=HBr+HBrO 与水只微弱反应 I2+H2O=HI+HIO
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第1周期各原子核外电子排布情况
[1] K氢核外电子数依次是:1
[2]He氦核外电子数依次是:2
第2周期各原子核外电子排布情况
[3Li锂核外电子数依次是:2 1
[4Be铍核外电子数依次是:2 2
[5] B硼核外电子数依次是:2 3
[6] C碳核外电子数依次是:2 4
[8] O氧核外电子数依次是:2 6
[9] F氟核外电子数依次是:2 7
[10]Ne氖核外电子数依次是:2 8
第3周期各原子核外电子排布情况
[11]Na钠核外电子数依次是:2 8 1
[12]Mg镁核外电子数依次是:2 8 2
[13]Al铝核外电子数依次是:2 8 3
[14]Si硅核外电子数依次是:2 8 4
[15] P磷核外电子数依次是:2 8 5
[16] S硫核外电子数依次是:2 8 6
[17]Cl氯核外电子数依次是:2 8 7
[18]Ar氩核外电子数依次是:2 8 8
第4周期各原子核外电子排布情况
[20]Ca钙核外电子数依次是:2 8 8 2
[21]Sc钪核外电子数依次是:2 8 9 2
[22]Ti钛核外电子数依次是:2 8 10 2
[23]V钒核外电子数依次是:2 8 11 2 *[24]Cr铬核外电子数依次是:2 8 13 1
[25]Mn锰核外电子数依次是:2 8 13 2
[26]Fe铁核外电子数依次是:2 8 14 2
[27]Co钴核外电子数依次是:2 8 15 2
[28]Ni镍核外电子数依次是:2 8 16 2 *[29]Cu铜核外电子数依次是:2 8 18 1
[30]Zn锌核外电子数依次是:2 8 18 2
[31]Ga镓核外电子数依次是:2 8 18 3
[32]Ge锗核外电子数依次是:2 8 18 4
[33]As砷核外电子数依次是:2 8 18 5
[34]Se硒核外电子数依次是:2 8 18 6
[35]Br溴核外电子数依次是:2 8 18 7
[36]Kr氪核外电子数依次是:2 8 18 8 第5周期各原子核外电子排布情况
[37]Rb铷核外电子数依次是:2 8 18 8 1
[38]Sr锶核外电子数依次是:2 8 18 8 2
[40] Zr锆核外电子数依次是:2 8 18 10 2
[41] Nb铌核外电子数依次是:2 8 18 12 1
[42]Mo钼核外电子数依次是:2 8 18 13 1
[43]Tc锝核外电子数依次是:2 8 18 13 2
[44]Ru钌核外电子数依次是:2 8 18 15 1
[45]Rh铑核外电子数依次是:2 8 18 8 16 1
[46]Pd钯核外电子数依次是:2 8 18 18
[47]Ag银核外电子数依次是:2 8 18 18 1
[48]Cd镉核外电子数依次是:2 8 18 18 2
[49]In铟核外电子数依次是:2 8 18 18 3
[50]Sn锡核外电子数依次是:2 8 18 18 4
[51]Sb锑核外电子数依次是:2 8 18 18 5
[52]Te碲核外电子数依次是:2 8 18 18 6
[53]I碘核外电子数依次是:2 8 18 18 7
[54]Xe氙核外电子数依次是:2 8 18 18 8 第6周期各原子核外电子排布情况
[55]铯核外电子数依次是:2 8 18 18 8 1
[56]钡核外电子数依次是:2 8 18 18 8 2
[57]镧核外电子数依次是:2 8 18 18 9 2
[58]铈核外电子数依次是:2 8 18 19 9 2
[60]钕核外电子数依次是:2 8 18 22 8 2
[61]钷核外电子数依次是:2 8 18 23 8 2
[62]钐核外电子数依次是:2 8 18 24 8 2 [63铕核外电子数依次是:2 8 18 25 8 2
[64]钆核外电子数依次是:2 8 18 25 9 2
[65]铽核外电子数依次是:2 8 18 27 8 2
[66]镝核外电子数依次是:2 8 18 28 8 2
[67]钬核外电子数依次是:2 8 18 29 8 2
[68]铒核外电子数依次是:2 8 18 30 8 2
[69]铥核外电子数依次是:2 8 18 31 8 2
[70]镱核外电子数依次是:2 8 18 32 8 2
[71]Lu镥核外电子数依次是:2 8 18 32 9 2
[72]铪核外电子数依次是:2 8 18 32 10 2
[73]钽核外电子数依次是:2 8 18 32 11 2
[74]钨核外电子数依次是:2 8 18 32 12 2
[75]铼核外电子数依次是:2 8 18 32 13 2
[76]锇核外电子数依次是:2 8 18 32 14 2
[77]铱核外电子数依次是:2 8 18 32 15 2
[78]铂核外电子数依次是:2 8 18 32 17 1
[79]金核外电子数依次是:2 8 18 32 18 1
[81]铊核外电子数依次是:2 8 18 32 18 3
[82]铅核外电子数依次是:2 8 18 32 18 4
[83]铋核外电子数依次是:2 8 18 32 18 5
[84]钋核外电子数依次是:2 8 18 3218 6
[85]砹核外电子数依次是:2 8 18 3218 7
[86]Rn氡核外电子数依次是:2 8 18 32 18 8 第7周期各原子核外电子排布情况
[87]钫核外电子数依次是:2 8 18 32 18 8 1
[88]镭核外电子数依次是:2 8 18 32 18 8 2
[89]锕核外电子数依次是:2 8 18 32 18 9 2
[90]钍核外电子数依次是:2 8 18 32 18 10 2
[91]镤核外电子数依次是:2 8 18 32 20 9 2
[92]铀核外电子数依次是:2 8 18 32 21 9 2
[93]镎核外电子数依次是:2 8 18 32 22 9 2
[94]钚核外电子数依次是:2 8 18 32 24 8 2
[95]镅核外电子数依次是:2 8 18 32 25 8 2
[96]锔核外电子数依次是:2 8 18 32 25 9 2
[97]锫核外电子数依次是:2 8 18 32 27 8 2
[98]锎核外电子数依次是:2 8 18 32 28 8 2
[99]锿核外电子数依次是:2 8 18 32 29 8 2
[100]镄核外电子数依次是:2 8 18 32 30 8 2 [101]钔核外电子数依次是:2 8 18 32 31 8 2 [102]锘核外电子数依次是:2 8 18 32 32 8 2 [103]铹核外电子数依次是:2 8 18 32 32 9 2 [104]钅卢核外电子数依次是:2 8 18 32 32 10 2 [105]钅杜核外电子数依次是:2 8 18 32 32 11 2 [106]钅喜核外电子数依次是:
[107]钅波核外电子数依次是:
[108]钅黑核外电子数依次是:
[109]钅麦核外电子数依次是:
[110]核外电子数依次是:
[111]核外电子数依次是:
[112]核外电子数依次是:
[114]核外电子数依次是:。
