《玻璃工艺学》笔记DOC
玻璃工艺学(3篇)

第1篇一、玻璃工艺学的起源玻璃工艺学的起源可以追溯到古代,早在公元前2500年左右,人类就开始了玻璃的制造。
古埃及人最早利用当地的石英砂、石灰石和木炭等原料,通过高温加热制成了一种被称为“古埃及玻璃”的器皿。
随后,玻璃工艺逐渐传播到希腊、罗马等地,形成了独特的玻璃文化。
二、玻璃的原料玻璃的主要原料包括石英砂、石灰石、长石、纯碱和硼砂等。
这些原料在玻璃制造过程中发挥着不同的作用:1. 石英砂:石英砂是玻璃的主要原料,其主要成分是二氧化硅,约占玻璃成分的70%。
石英砂具有良好的耐热性、化学稳定性和透明度。
2. 石灰石:石灰石在玻璃制造中起到稳定剂的作用,可以降低玻璃的熔点和粘度,提高玻璃的透明度和强度。
3. 长石:长石是玻璃的助熔剂,可以降低玻璃的熔点,提高玻璃的化学稳定性。
4. 纯碱:纯碱是玻璃的熔剂,可以降低玻璃的熔点,提高玻璃的透明度和化学稳定性。
5. 硼砂:硼砂在玻璃制造中起到提高玻璃耐热冲击性的作用。
三、玻璃的制造玻璃的制造过程主要包括以下几个步骤:1. 配方:根据玻璃的种类和性能要求,确定原料的配比。
2. 熔融:将配好的原料在高温下熔融,熔融温度一般为1400℃左右。
3. 成形:将熔融的玻璃液通过冷却、拉伸、吹制等方法,使其成为所需形状的玻璃制品。
4. 退火:将成形的玻璃制品在退火炉中加热至一定温度,保持一段时间,以消除内应力,提高玻璃的强度和稳定性。
5. 精加工:对玻璃制品进行切割、磨光、抛光等精加工,以满足不同的使用要求。
四、玻璃的加工玻璃的加工方法主要包括以下几种:1. 切割:使用切割机将玻璃制品切割成所需尺寸。
2. 磨光:使用磨光机对玻璃制品表面进行磨光处理,提高其透明度和光洁度。
3. 抛光:使用抛光机对玻璃制品表面进行抛光处理,使其达到镜面效果。
4. 热处理:通过热处理改变玻璃的物理和化学性能,如提高玻璃的强度、耐热冲击性等。
5. 化学处理:通过化学处理改变玻璃的表面性能,如增加防污、防雾等功能。
玻璃工艺学____第三章_平板玻璃的生产学习要点
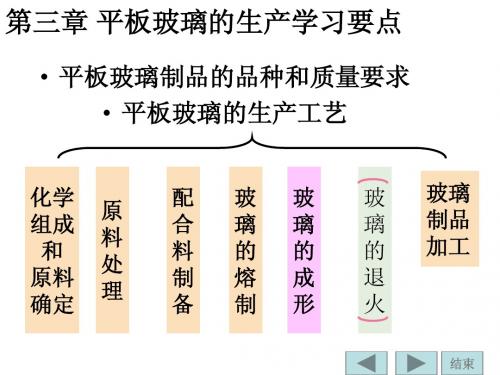
结束
3.4.2浮法生产原理
2浮抛介质( 即锡液)选择条件和作用 1)选择条件: 在1050℃下金属液密度大于玻璃液的密度2500kg/m3, 金属熔点小于600℃,沸点大于1050℃,1000℃左右的 蒸汽压小于13.33Pa; 容易还原,1000℃左右,不与玻璃液发生反应。 以保证玻璃液浮于金属液上金属始终保持单质液态, 对玻璃具有抛光作用, 金属液损耗最小; 满足这些条件的金属有锡、铟和镓,其中锡最便宜且 无毒,高温下与玻璃反应最小,因此采用锡作为浮抛 介质。 2)作用:对玻璃具有浮托、抛光作用
原料车间
配合料 原料处理、配合料制备
坩埚
玻璃液 化合物形成、玻璃液形成、 澄清、均化、冷却
压延机
玻璃板 成形、定形
退火窑
玻璃板 快速加热、保温、 慢冷、快速冷却
冷端
144
冷端部分
玻璃板
无损检测
合格玻璃板
不合格玻璃板
裁切
合格玻璃板 破碎玻璃板
输 送 带
喷粉
合格玻璃板
堆垛、包装
碎玻璃堆场
结束
浮法玻璃成分
SiO2 CaO MgO Al2O3 R2O
71~ 7.7~ 2.9~ 73 9.2 4.0 平拉法玻璃成分 0.1~ 1.6 13.3~14.0
Fe2O3 SO3
0.07~ 0.12 0.2~ 0.3
SiO2 CaO MgO Al2O3 Na2O 72~ 73 9.0~ 9.3 3.0~ 4.2 1.1~ 1.3 13.0~13.2
玻璃池窑系统
玻璃熔制部分 热源供给部分 余热回收部分 排烟供气部分
结束
结构
Hale Waihona Puke 池窑结构 玻璃熔制部分: 余热回收部分(以蓄热室为例): 投料部、熔化部、分隔装置、冷却部 顶碹、侧墙、端墙、隔墙、格子体以及炉条 和成形部 排烟供气部分: 热源供给部分: 交换器、空气通道、煤气通道、支烟道、总 烟道、烟囱、鼓风机、排烟机 燃气小炉或燃油小炉、燃烧设备 物料走向,即物流 工作流程 气体走向,即气流
玻璃工艺学复习资料

玻璃⼯艺学复习资料第⼀章玻璃的定义与结构1、解释转变温度、桥氧、硼反常现象和混合碱效应。
转变温度:使⾮晶态材料发⽣明显结构变化,导致热膨胀系数、⽐热容等性质发⽣突变的温度范围。
⾮桥氧:仅与⼀个成⽹离⼦相键连,⽽不被两个成⽹多⾯体所共的氧离⼦则为⾮桥氧。
桥氧:玻璃⽹络中作为两个成⽹多⾯体所共有顶⾓的氧离⼦,即起“桥梁”作⽤的氧离⼦。
硼反常性:在钠硅酸盐玻璃中加⼊氧化硼时,往往在性质变化曲线中产⽣极⼤值和极⼩值,这现象也称为硼反常性。
混合碱效应:在⼆元碱玻璃中,当玻璃中碱⾦属氧化物的总含量不变,⽤⼀种碱⾦属氧化物逐步取代另⼀种时,玻璃的性质不是呈直线变化,⽽是出现明显的极值。
这⼀效应叫做混合碱效应。
2、玻璃的通性有哪些?各向同性;⽆固定熔点;介稳性;渐变性和可逆性;①.各向同性玻璃态物质的质点总的来说都是⽆规则的,是统计均匀的,因此,它的物理化学性质在任何⽅向都是相同的。
这⼀点与液体类似,液体内部质点排列也是⽆序的,不会在某⼀⽅向上发现与其它⽅向不同的性质。
从这个⾓度来说,玻璃可以近似地看作过冷液。
②.⽆固定熔点玻璃态物质由熔体转变成固体是在⼀定温度区域(软化温度范围)内进⾏的,(从固态到熔融态的转变常常需要经历⼏百度的温度范围),它与结晶态物质不同,没有固定的熔点。
③.介稳性玻璃态物质⼀般是由熔融体过冷⽽得到。
在冷却过程中粘度过急剧增⼤,质点来不及作有规则排列⽽形成晶体,因⽽系统内能尚未处于最低值⽽⽐相应的结晶态物质含有较⾼的能量。
还有⾃发放热转化为内能较低的晶体的倾向。
④.性质变化的渐变性和可逆性玻璃态物质从熔融状态到固体状态的过程是渐变的,其物理、化学性质变化是连续的和可逆的,其中有⼀段温度区域呈塑性,称“转变”或“反常”区域。
3、分别阐述玻璃结构的晶⼦学说和⽆规则⽹络学说内容。
答:(1)玻璃的晶⼦学说揭⽰了玻璃中存在有规则排列区域,即有⼀定的有序区域,这对于玻璃的分相、晶化等本质的理解有重要价值,但初期的晶⼦学说机械地把这些有序区域当作微⼩晶体,并未指出相互之间的联系,因⽽对玻璃结构的理解是初级和不完善的。
玻璃工艺学(第五节章 玻璃熔制及质量控制)

硅酸盐形成过程中的主要规律: ※硅酸盐形成过程中的主要规律: 随着温度的升高,其反应速度也随之提高; 随着温度的升高,其反应速度也随之提高; 当温度不变时,反应速度随时间延长而减慢; 当温度不变时,反应速度随时间延长而减慢; 随反应物浓度的增加,反应速度也相应增加。 随反应物浓度的增加,反应速度也相应增加。
5.1 硅酸盐形成和玻璃的形成
1、硅酸盐形成 一系列物理、化学变化; 一系列物理、化学变化;
1、硅酸盐形成 一系列物理、化学变化; 一系列物理、化学变化; 反应在固体状态下进行,并有大部分气体逸出; 反应在固体状态下进行,并有大部分气体逸出; 这一阶段结束时, 这一阶段结束时,形成硅酸盐和二氧化硅组成的 不透明烧结物; 不透明烧结物; 大多数玻璃在800~1000℃完成。 大多数玻璃在800~1000℃完成。 800 完成
※玻璃形成过程中的主要规律: 玻璃形成过程中的主要规律:
玻璃形成速度与玻璃成分、砂粒大小、 玻璃形成速度与玻璃成分、砂粒大小、熔制温度 玻璃成分 有关。 有关。 ●玻璃成分(沃尔夫(M. Volf)提出 ) 玻璃成分(沃尔夫( Volf)
熔化速度常数τ,表示玻璃相对难熔性的特征值。 熔化速度常数τ,表示玻璃相对难熔性的特征值。
500℃以上 有偏硅酸钠和偏硅酸钙开始生成。 以上, (6) 500℃以上,有偏硅酸钠和偏硅酸钙开始生成。 Na2S+Na2SO4+2SiO2===2Na2SiO3+SO2↑+S CaS+Na2SO4+2SiO2===Na2SiO3+CaSiO3+SO2↑+S 以上反应在700℃~900℃时加剧进行。 以上反应在700℃ 900℃时加剧进行。 700 (7) 575℃左右β-石英转变为α-石英。 575℃左右β 石英转变为α 石英。 740℃ 由于出现Na 低温共熔物, (8) 740℃,由于出现Na2SO4-Na2S低温共熔物,玻璃的形 成过程开始。 成过程开始。 740℃ 880℃ 玻璃的形成过程加速进行。 (9) 740℃~880℃,玻璃的形成过程加速进行。
(完整word版)《玻璃工艺学》第6章玻璃的化学稳定性

118第6章 玻璃的化学稳定性玻璃制品在使用过程中要受到水、酸、碱、盐、气体及各种化学试剂和药液的侵蚀, 玻璃对这些侵蚀的抵抗能力称为玻璃的化学稳定性。
玻璃具有较高的化学稳定性,常用于制造包装容器,盛装食品、药液和各种化学制品。
在实验室以及化学工业的生产过程中,也广泛采用玻璃设备,如玻璃仪器、玻璃管道、耐酸泵、化学反应锅等。
但是,玻璃的化学稳定性在使用中有时还不能满足要求。
例如,普通的窗玻璃在长期承受大气和雨水的侵蚀下,玻璃表面失去光泽,使玻璃变为晦暗,并在表面上出现油脂状薄膜、斑点等受侵蚀的痕迹;光学仪器的各类透镜在使用过程中,因受周围介质的作用,使光学零件蒙上“雾”状膜、聚滴薄膜或白斑等,影响透光性和成象质量,严重时将造成报废;化学仪器因玻璃受侵蚀而影响分析、化验结果;对于安瓿瓶、盐水瓶,在蒸压灭菌及各种气候条件下长期与药液接触,玻璃就会溶解于药液中,甚至出现脱片现象。
因此,对任何玻璃制品,都必须具有符合规定的化学稳定性指标。
玻璃的化学稳定性对玻璃的加工、如磨光、镀银、蚀刻以及玻璃制品的存放都有重要的意义。
玻璃的化学稳定性决定于玻璃的抗蚀能力以及侵蚀介质(水、酸、碱及大气等)的种类和特性。
此外侵蚀时的温度、压力等也有很大的影响。
6。
1玻璃的侵蚀机理玻璃对于不同介质具有不同的抗蚀能力,因此应该对玻璃的耐水性、耐酸性、耐碱性以及耐气体侵蚀性等分别进行研究。
6。
1。
1水对玻璃的侵蚀水对不同成分的玻璃侵蚀情况不同。
硅酸盐玻璃在水中的溶解过程比较复杂,水对玻璃的侵蚀开始于水中的H +离子和玻璃中的Na +离子进行离子交换,其反应为:Si O Na ++H +OH-NaOH交换Si +OH这一交换又引起下列反应:OH Si+32H 2O水化Si OHOHOHHOSi(OH)4+NaOH中和[Si(OH)3O]-Na ++H 2O反应式(6—3)的产物为硅酸钠,其电离度低于NaOH 的电离度.因此这一反应使溶液中Na +离子浓度降低,促使反应(6-2)进行。
《玻璃工艺学》笔记DOC

第一章玻璃的结构与性质第一节玻璃的定义与通性一、玻璃外观:即不同于液体,也不同于固体,透明或半透明,断裂时呈贝壳状。
结构:以硅酸盐为主要成分的无定形物质。
性质:冷却时不析晶,凝固时又硬又脆.狭义:熔融物在冷却过程中不发生结晶的无机物质。
广义:呈现玻璃转变现象的非晶态固体。
【玻璃的定义】玻璃是由熔体过冷所得,随着粘度逐渐增大而固化,具有较大脆性和硬度. 宏观性能类似于固体,微观结构上具有近程有序,远程无序的无定形物质。
结构特征:局部原子具有类似于晶体的有序排列,宏观上原子排列类似于液体无序.即“近程有序,远程无序”二、玻璃的通性1.各向同性2.介稳性3.无固定的熔点4.从熔融态向玻璃态转化时物化性质随温度变化的连续性与可逆性5.物理、化学性质随成分变化的连续性第二节玻璃结构:离子或原子在空间的几何配置以及它们在玻璃中形成的结构形成体一.玻璃结构学说(一)晶子学说1.理论依据:兰德尔1930年提出微晶学说,微晶和无定形两部分组成,有明显的界限。
列别捷夫玻璃在520℃退火时,玻璃折射率变化反常,在500℃之前呈线性分布,在520~ 590之间,突然变小,因为石英在573℃的晶型转变,故推断玻璃中存在高分散石英微晶(晶子)聚集体.2.观点硅酸盐玻璃的结构是由各种不同的硅酸盐和SiO2的微晶体(晶子)所组成的。
晶子是带有晶格极度变形的有序区域,不具有正常晶格构造。
晶子分散在无定形介质中,过渡是逐渐完成的,无明显界线。
3.意义:第一次提出玻璃中存在微不均匀性和近程有序性。
(二)无规则网络学说1.理论依据1932,查哈里阿森硅胶中存在1~10nm的不连续颗粒,图谱中有明显小角散射.玻璃中均匀分布,故结构是连续的、非周期性的.方石英具有清晰的、周期性的衍射峰,说明晶体排列有周期性的.衍射带中主峰位置一致,说明结构单元一致[SiO4],石英玻璃与方石英中的原子间距相等.计算得知玻璃中Si-O间距1.62A,而方石英中为1.60A.2.基本观点:成为玻璃态的物质与相应的晶体结构一样,也是由一个三度空间网络组成,这种网络由离子多面体(四面体或三角体)构筑而成,晶体结构网由多面体无数次有规则、重复构成,而玻璃体结构中多面体缺乏对称性和周期性的重复。
玻璃工艺学(玻璃书籍)

第一节概述1.物质的玻璃态自然界中,物质存在着三种聚集状态,即气态,液态和固态。
固态物质又有两种不同的形式存在,即晶体和非晶体(无定形态)。
玻璃态属于无定形态,其机械性质类似于固体,是具有一定透明度的脆性材料,破碎时往往有贝壳状断面。
但从微观结构看,玻璃态物质中的质点呈近程有序,远程无序,因而又有些象液体。
从状态的角度理解,玻璃是一种介于固体和液体之间的聚集状态。
对于“玻璃”的定义,二十世纪四十年代以来曾有过几种不同的表述。
1945年,美国材料试验学会将玻璃定义为“熔化后,冷却到固化状态而没有析晶的无机产物”。
也有将玻璃定义扩展为“物质(包括有机物,无机物)经过熔融,在降温冷却过程中因粘度增加而形成的具有固体机械性质的无定形物体”。
我国的技术词典中把“玻璃态”定义为;从熔体冷却,在室温下还保持熔体结构的固体物质状态。
其实,在上世纪八十年代,有人提出上述定义‘是多余的限制’。
因为,无机物可以形成玻璃,有机物也可以形成玻璃,显然早期的表述并不合适。
另外,经过熔融可以形成玻璃,不经过熔融也可以形成玻璃,例如,经过气相沉积,溅射可得到非晶态材料,采用溶胶-凝胶法也可以得到非晶态材料,可见后期的表述也并不妥当。
现代科学技术的发展已使玻璃的含义有了很大的扩展。
因此,有人把具有下述四个通性的物质不论其化学性质如何,均称为玻璃。
这四个通性是;(1)各相同性。
玻璃的物理性质,如热膨胀系数,导热系数,导电性,折射率等在各个方向都是一致的。
表明物质内部质点的随机分布和宏观的均匀状态。
(2)介稳性。
熔体冷却成玻璃体时并没有处于能量最低的状态,仍然有自发转变为晶体的倾向,因而,从热力学的观点看,处于介稳状态。
但常温下玻璃的粘度非常大,自发转变为晶体的速度非常慢,所以,从动力学的观点看,它又是非常稳定的。
(3)固态和熔融态间转化的渐变性和可逆性。
玻璃态物质由熔体转变为固体是在一定温度区间(转化温度范围)进行的,性质变化过程是连续的和可逆的,它与结晶态物质不同,没有固定的熔点。
《玻璃工艺学》第12章玻璃的熔制

第12章玻璃的熔制12.1 玻璃的熔制过程熔制是玻璃生产中重要的工序之一,它是配合料经过高温加热形成均匀的、无气泡的、并符合成形要求的玻璃液的过程。
玻璃制品的大部分缺陷主要在熔制过程中产生的,玻璃熔制过程进行的好坏与产品的产量、质量、合格率、生产成本、燃料消耗和池窑寿命都有密切关系,因此进行合理的熔制,是使整个生产过程得以顺利进行并生产出优质玻璃制品的重要保证。
玻璃的熔制是一个非常复杂的过程,它包括一系列物理的、化学的、物理化学的现象和反应,这些现象和反应的结果使各种原料的机械混合物变成了复杂的熔融物即玻璃液。
为了尽可能缩短熔制过程和获得优质玻璃,必须充分了解玻璃熔制过程中所发生的变化和进行熔制所需要的条件,从而寻求一些合适的工艺过程和制定合理的熔制制度。
各种配合料在加热形成玻璃过程中有许多物理的、化学的和物理化学的现象是基本相同的,其主要变化如表12-1所示:表12-1配合料在加热形成玻璃过程中的变化序号物理变化过程化学变化过程物理化学变化过程1 配合料加热固相反应生成低熔混合物2 吸附水的排除盐类分解各组分间相互溶解3 个别组分的熔化水化物的分解玻璃和炉气介质间的相互作用4 多晶转变化学结合水的排除玻璃和耐火材料之间的相互作用5 个别组分的挥发各组分相互作用并形成硅酸盐的反应玻璃熔制过程大致上可分为五个阶段,即硅酸盐形成、玻璃形成、澄清、均化和冷却成形等。
现将这五个阶段的特点分述如下:(1) 硅酸盐形成阶段硅酸盐生成反应在很大程度上是在固体状态下进行的。
料粉的各组分发生一系列的物理变化和化学变化,粉料中的主要固相反应完成,大量气体物质逸出。
这一阶段结束时,配合料变成由硅酸盐和二氧化硅组成的不透明烧结物。
大多数玻璃这个阶段在800~900°C时完成。
(2) 玻璃形成阶段由于继续加热,烧结物开始熔融,低熔混合物首先开始熔化、同时硅酸盐与剩余的二氧化硅相互熔解,烧结物变成了透明体,这时已没有未起反应的配合料,但在玻璃中还存在着大量的气泡和条纹,化学组成和性质尚未均匀一致,普通玻璃在这个阶段的温度约为1200~1250°C之间。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第一章玻璃的结构与性质第一节玻璃的定义与通性一、玻璃外观 :即不同于液体 ,也不同于固体 ,透明或半透明 ,断裂时呈贝壳状。
结构 :以硅酸盐为主要成分的无定形物质。
性质 :冷却时不析晶 ,凝固时又硬又脆 .狭义 :熔融物在冷却过程中不发生结晶的无机物质。
广义 :呈现玻璃转变现象的非晶态固体。
【玻璃的定义】玻璃是由熔体过冷所得 ,随着粘度逐渐增大而固化,具有较大脆性和硬度 . 宏观性能类似于固体 ,微观结构上具有近程有序 ,远程无序的无定形物质。
结构特征:局部原子具有类似于晶体的有序排列,宏观上原子排列类似于液体无序.即“近程有序 ,远程无序”二、玻璃的通性1.各向同性2.介稳性3.无固定的熔点4.从熔融态向玻璃态转化时物化性质随温度变化的连续性与可逆性5.物理、化学性质随成分变化的连续性第二节玻璃结构:离子或原子在空间的几何配置以及它们在玻璃中形成的结构形成体一.玻璃结构学说(一)晶子学说1.理论依据:兰德尔 1930 年提出微晶学说,微晶和无定形两部分组成,有明显的界限。
列别捷夫玻璃在 520C退火时,玻璃折射率变化反常,在500C之前呈线性分布,在520~ 590之间,突然变小,因为石英在573C的晶型转变,故推断玻璃中存在高分散石英微晶(晶子)聚集体.2.观点硅酸盐玻璃的结构是由各种不同的硅酸盐和SiO2的微晶体(晶子)所组成的。
晶子是带有晶格极度变形的有序区域 ,不具有正常晶格构造。
晶子分散在无定形介质中 ,过渡是逐渐完成的 ,无明显界线。
3.意义:第一次提出玻璃中存在微不均匀性和近程有序性。
(二)无规则网络学说1.理论依据1932, 查哈里阿森硅胶中存在 1~10nm 的不连续颗粒 ,图谱中有明显小角散射 .玻璃中均匀分布 ,故结构是连续的、非周期性的 . 方石英具有清晰的、周期性的衍射峰,说明晶体排列有周期性的.衍射带中主峰位置一致,说明结构单元一致[SiO4],石英玻璃与方石英中的原子间距相等•计算得知玻璃中Si-O间距1.62A,而方石英中为1.60A.2.基本观点:成为玻璃态的物质与相应的晶体结构一样 ,也是由一个三度空间网络组成 ,这种网络由离子多面体(四面体或三角体)构筑而成,晶体结构网由多面体无数次有规则、重复构成,而玻璃体结构中多面体缺乏对称性和周期性的重复。
3.意义:提出玻璃结构的连续性、统计均匀性与无序性【总结】晶子学说强调了玻璃结构的近程有序性,微不均匀性,即玻璃中存在一定的有序区域,这对于玻璃的分相,晶化等本质的理解提出了依据。
无规则网络学说说明了玻璃结构的连续性,统计均匀性与无序性,可以解释玻璃的各向同性,内部性质均匀性和玻璃性质变化的连续性。
玻璃是几对矛盾的统一体。
二. 硅酸盐玻璃结构键距晶体S—O 1.61A 玻璃体S—O 1.62A 结构疏松键角晶体S—O 144 °玻璃体S—O 120-180 °远程无序,近程有序Si的配位数为4,与4个O形成4个b键。
O/Si=2所有氧均为桥氧,[SiO4]中所有顶角共有,网络较完整,具有机械强度高,透紫外性能好,热膨胀系数低,化稳好•石英玻璃特性:高软化、高粘度、膨胀系数小、机械强度高、化稳性好、透紫外、红外线好结构开放高压透气d=2.1~2.2 g/cm3R+, R 2+对石英玻璃结构的影响:降低玻璃粘度,玻璃的熔制温度.但热膨胀系数上升,机械强度,透紫外性能,化稳下降。
R 2+对二元F2O-SiC2系统玻璃结构的影响:降低玻璃的熔制温度,提高化稳性.三. 硼酸盐玻璃结构键距晶体 B-O 1.36A 密度2.56玻璃体 B-O 1.38A 密度1.24 键强B— O 119KCal/mol Si—O106KCal/molB的配位数是3 B2O3玻璃结构模型(1)[BO3 ]或硼氧环构成层状结构,层间以范德华力或二键相连(2)键角可有较大改变(3)结构随温度升高向链状变化性质:软化点低(450度),化稳性差,热膨胀系数高,因而没有实用价值。
【问题】硼玻璃键强大于石英玻璃,但其性能较石英玻璃弱?[BO3]三角体的三个顶角共有.硼玻璃结构可以看作[BO3]三角体无序连接而组成向两度空间发展的网络,属于层状结构,尽管 B-O键强>Si-O键强,但因为B2O3结构中除了同一层内存在较强的B-O键外,层与层之间由较弱的范德华力连在一起的,故性能较差.硼反常现象:在硼玻璃中加入碱金属或碱土金属氧化物后,提供的自由氧使结构中的[BO3]三角体转变为[BO4]四面体,使硼玻璃从原来的两度空间的层状结构部分转变为三度空间的架状结构,加强了网络完整性,使玻璃的各项性能有所改善.这种现象叫硼反常现象.【问题】请解释在钠硼玻璃中热膨胀系数随Na2O的加入而出现极小值的原因?在钠硼玻璃中加入碱金属氧化物后,其提供的自由氧使结构中的[BO3]三角体转变为[BO4]四面体,使硼玻璃从原来的两度空间的层状结构部分转变为三度空间的架状结构,加强了网络完整性,使玻璃的热膨胀系数降低.但随着碱金属氧化物的过量加入,过量的阳离子由于对网络中的桥氧的外极化增强而破坏了这种网络结构使[BO4]部分转变为[BO3],而使热膨胀系数增加,从而出现极小值。
硼--铝反常现象:钠硼铝硅玻璃中,当玻璃中不存在B2O3时,SQ能使折射率、密度上升;当玻璃中存在B2O3时,用AI2O3代替SiQ,随着B2O3含量的不同出现不同的趋势。
四. 磷酸盐玻璃结构1基本结构单位[PO4]P是5价离子,故[PO4]中有一个键是双键,无法与其它四面体产生键合,最多只与三个四面体连接,层状结构,层间为范德华力,导致磷酸盐玻璃的软化温度及化稳性较低、粘度小、吸湿性强无实用价值。
2引入一定量的 AI2O3或B2O3,将形成[AI(P)04]或[B(P)04]组团,使P2O5玻璃中的层状或链状结构转变为架状结构 ,导致性能改善。
3 磷酸盐玻璃常用于制造光学玻璃,透紫外线玻璃,吸热玻璃和耐酸玻璃等。
极易析晶、化稳性差、易挥发,成本高。
【玻璃结构中阳离子的分类】根据单键能的大小,将氧化物分成三类 :1)网络形成体:F-0键是离子键与共价键的混合键;单键强度>336kJ;配位多面体[F04]或 [F03]以顶角相连。
B203,Si02,Ge02,P205,As2032)网络外体 :M-0 键为离子键;单键强度 <252kJ; Li20,Na20,K20,Ca0,Ba0,Sr03)网络中间体:1-0键具有一定的共价性,主要为离子性;单键强度252-336kJ;配位数一般为6,但夺取游离氧后配位数变为 4,参加网络形成。
Be0,Mg0,Zn0,AI203, Ti02 含有两种以上中间体氧化物时,当游离氧不足时,[Be04] [AI04] [Ga04] [B04] [Ti04][Zn04]第三节玻璃的性质一. 玻璃熔体的工艺性质1•粘度:面积为S的两个平行液层,以一定的速度梯度 dv/dx移动时需克服的摩擦力阻力 f.粘度与温度的关系玻璃的料性:对于组成不同的玻璃,粘度—温度曲线形状相似,但随温度变化,粘度变化速率不同,粘度随温度变化快的玻璃为短性玻璃 B (快凝玻璃);粘度随温度变化慢的玻璃为长性玻璃A (慢凝玻璃) 粘度与组成的关系引入网络形成体易使粘度增加( Si02,AI203,Zr02)碱金属氧化物O/Si 较低时(咼硅):n K2O-SiO2> n Na2O-SiO2> n LiO2-SiO2O/Si 较咼时(咼碱) n LiO2-SiO2>n Na2O-SiO2> n K2O-SiO22.表面张力:指玻璃与另一相接触的相分界面上在恒温,恒容下增加一个单位表面时所做的功2 -2单位是N/m或J/m .硅酸盐熔体的表面张力为 (220-380) x 10- N/m,比水的大3-4倍. 随温度的升咼而下降Al2Q,CaO,MgO增加表面张力B203,P205,K20,Pb0 加入量较大时降低表面张力。
C2O、V2O、M02O、WO3较少时降低表面张力Na2SiF6,Na3AIF6,Na2SO4,NaC显著降低玻璃的表面张力,有助于玻璃的澄清与均化意义:熔制过程中决定了玻璃熔体中气泡的长大与排除;浮法玻璃生产基于玻璃液和熔融锡液表面张力相互作用和重力作用 ;制品的圆口、火抛光等借助表面张力的作用。
二. 固体玻璃的性质1.密度—单位体积的质量影响因素:(1)成分在硅酸盐,硼酸盐,磷酸盐玻璃中引入 R2O或RO时丄i+,Mg2+等半径小的阳离子填充空隙,使结构紧密度增加;而K+,Ba2+等半径大的使结构网络扩张,使结构紧密度下降.( 2 )配位数: V[BO4]<V[SiO4]<V[AIO4](3)温度:T 升咼,密度减小(4)热历史:d退火玻璃〉d淬火玻璃2.热膨胀系数意义(5.8-150)X 10-7/c与组成的关系网络外体:使网络断裂,断网是主要的,使系数增大。
阳离子和氧离子之间的吸引力 f=2Z/a2 f愈小,a系数越大。
网络形成体:增强网络,系数减小。
网络中间体:足够游离氧,使系数下降。
3.玻璃的电学性质钠硼硅等硅酸盐玻璃具有离子导电性钠铁硼硅 ,钒磷 ,硫属玻璃具有半导体性,属于电子导电。
卤化物 ,硫化物玻璃具有快离子导电性质。
硅酸盐玻璃中 ,碱金属氧化物浓度越高 ,结构疏松 ,电导率越大。
【中和效应(双碱效应、混合碱效应) 】在二元碱玻璃中,如果一种碱性氧化物被另一种碱性氧化物逐渐取代,电阻率不呈直线变化,但当两种碱金属的摩尔比相等时,电阻率出现极大值,这种现象为中和效应。
压制效应:当在玻璃中用碱土金属代替碱金属氧化物时,由于带有较多的电荷,使其在玻璃结构中较难迁移,导致其电导率下降,电阻率上升,这种效应为压制效应。
4.玻璃的化学稳定性:玻璃抵抗气体、水、酸、碱、盐或各种化学试剂侵蚀的能力侵蚀剂种类( 1 )破坏网络外体,形成保护膜( 2 )不仅破坏网络外体还破坏网络骨架,不形成保护膜。
( 3)高温气体与 SiO2 反应, Si 沉积于玻璃表面,如钠光灯。
①水对玻璃表面的侵蚀机理理论上:反应继续下去,硅原子周围四个桥氧全部成为OH-,反应产物Si(OH)4将周围水分子极化,定向吸附在周围,成为Si(OH)4? nH2O—硅酸凝胶,形成一层薄膜,具有较强的抗水和抗酸性能,减慢侵蚀速度。
实际上:H+代替Na+,半径小,玻璃结构疏松化;H2O腐蚀网络,结构疏松。
②酸对玻璃的侵蚀浓酸的侵蚀低于弱酸:玻璃被水侵蚀后生成的金属氢氧化物,受到酸的中和一方面加速离子交换反应,使玻璃加快失重;另一方面降低PH值,使Si(OH)4溶解度下降,降低失重。
当 R2O 含量较多时,置换反应速度快,以置换和水化为主,前一种作用主要的,反应更快;当SiC2含量较多时,置换反应速度慢,以中和和破坏骨架为主,后一种作用主要,反应更慢。
