06第六章 不稳定碳负离子
4.碳正离子与碳负离子

有机化学基本理论主讲人:史达清4. 碳正离子与碳负离子碳正离子、碳负离子是有机化学中非常重要的两类活性中间体,我们有必要掌握这两类活性中间体的结构、生成方法及影响稳定性的因素。
(1)碳正离子碳正离子是指碳原子带有正电荷的三价化合物,对碳正离子的研究是最早且最深入的,被称为物理有机化学的基础,许多有机反应历程的研究概念和方法都起始于碳正离子的研究工作。
(a)碳正离子的结构碳正离子的中心碳原子是sp2 杂化的平面型结构,正电荷在p 轨道中:例外:下面的几个实例是例外,这是由于它们都不能形成空的p 轨道形式,如乙烯正离子,乙炔正离子是线型结构,有一个空的sp 杂化轨道,苯基正离子C6H5+则有一个空的sp2杂化轨道,但它们都很难生成,因为空轨道与π 体系相互垂直,正电荷得不到分散。
(b)碳正离子的生成方法离解是形成碳正离子的一个主要方法,离解时,与碳原子相连的基团带着一对对子离去。
苯磺酸根离子和卤离子是常用的较好的离去基团。
卤代物中的卤离子还可以在Ag+ 或Lewis 酸存在下脱去而生成碳正离子。
例如:醇一般是在酸作用下,将不容易离去的羟基转变成易离去的水离去,可以形成碳正离子:伯胺一般先用亚硝酸重氮化得到重氮盐,再脱氮得到碳正离子:如果生成的碳正离子具有芳香性,那么这些碳正离子就比较容易生成。
例如:另一类产生碳正离子的方法是质子或其它带正电荷的原子团或Lewis 酸对不饱和体系的加成。
例如:(c)碳正离子的稳定性凡是能够使碳正离子的正电荷得到分散的,则碳正离子比较稳定;相反,如果使碳正离子的正电荷集中,则碳正离子更不稳定。
其影响因素主要有:(i) 诱导效应给电子的诱导效应(+I)使碳正离子稳定;而吸引电子的诱导效应(-I),使碳正离子不稳定。
例如:(ii) 共轭效应给电子的共轭效应(+C)使碳正离子稳定;而吸电子的共轭效应(-C)使碳正离子不稳定。
例如:(iii) 空间效应由于碳正离子是平面型结构,如果正电荷在桥头碳原子上,由于桥的刚性结构,难以形成平面型,所以该碳正离子的稳定性比较差,例如:1-氯双环[2.2.1]庚烷的乙醇解速度比叔丁基氯慢1013倍。
碳负离子简介
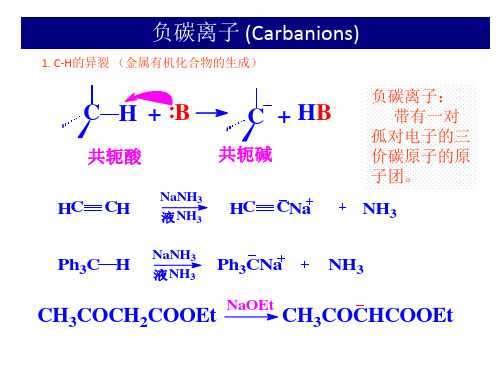
HC
C
> CH2 CH
-I, +I
> CH3CH2
2) 诱导效应
3) 共轭效应
Ph3C->Ph2CH->PhCH2-
4. 芳香性导致的稳定性
5.由相邻杂原子导致的稳定性
如:鎓内盐
• 鎓内盐 (ylid) 是指一种化合物,再其分子 内含有碳负离子,和碳负离子相邻的杂 原子带正电荷,这些杂原子为P、N、S、 As、Sb、Se等
• 许多内鎓盐可以结晶离析,并广泛用于有机合 成中。而普通的碳负离子不能离析出来,因为 对水和氧极其敏感。 • 鎓内盐在有机合成中应用最广的是磷、硫叶立 德,磷叶立德与羰基化合物反应合成烯就是著 名的Wittig反应
6. 邻位π键的影响
还有其他的一些基团,如:NO2, C=O, -SO2-, CN, SO 等,也可以稳定C-离子。诱导与共轭效应均有。
稳定能力:NO2 > C=O > -SO2- ~ CN
Ph Ph Ph Ph
P
+
-
CH2
Ph Ph
P
CH2
• 磷鎓内盐的X光结晶结构研究表明,碳为 平面结构,即为sp2杂化。
• 鎓内盐较为稳定:与碳负离子相邻的带正电荷 的杂原子基团,使碳负离子稳定性明显增大。 2p(C) 与3d (P), 4d(As)或5d(Sb)空轨道重叠 • 碳原子2p轨道的未共用电子对进入d空轨道,负 电荷分散,从而使碳负离子稳定。
CH3COCHCOOEt
2. 负离子对双键的加成
HC
CH
OCH3
CH CH OCH3
HOCH3
CH2 CH OCH3
负碳离子的结构
06 第六章 烯烃

3
C 2 H 5 OH
CH 3 CHCHCH F
3
+ CH 3 CH 2 C H
F
CH
2
CH 3 CH
CHCH
3
CH 3 CH 2 CH
CH 2
(主)
中间体:碳负离子
碳负离子稳定性: CH 3 >
RCH
2
Hofmann烯 >
R 2 CH
>
R 3C
19
3. E2(双分子消去)
以正丙基溴为例:
3
E tOK,E tOH 70℃
H C CH
3
H C CH
3
3
例:顺-4-叔丁基溴环己烷和反-4-叔丁基溴环己烷发生消去反 应得到同一产物,但顺-4-叔丁基溴环己烷的反应速度为 后者的500倍,为什么?
t- B u Br
(CH 3 ) 3 COK (CH 3 ) 3 COH
t- B u
(CH 3 ) 3 COK (CH 3 ) 3 COH
倾向于发生SN2亲核取代反应。
例: CH 3 CH 2 Br
C 2 H 5 ONa C 2 H 5 OH
CH 3 CH 2 OCH 99%
2 CH 3
+
CH
2
CH
2
1%
注意:①.当卤代烷结构复杂,可能发生消去反应。
R Br
+ C 2H 5 O
C 2 H 5 OH
C 2 H 5 Br
取代产物 + 消去产物 99 1
CH 3 CH 2 Br
NaNH
2
CH 2
CH 2
CH 3 (CH 2 )15 CH 2 CH 2 Br
[化学]06 碳氢键
![[化学]06 碳氢键](https://img.taocdn.com/s3/m/3d974e0a5727a5e9846a6115.png)
高级烷烃的溴代反应
在光、热和自由基引发剂的作用下,烷烃也可以与溴发生较缓 慢的溴代反应。溴的反应活性比氯低,因而在与不同类型的氢原子 发生取代反应时,显示出更高的位置选择性。
(CH3)3CH + Br2
日光 127 oC
(CH3)3CBr + (CH3)2CHCH2Br
>99 %
<1 %
一般说来,进攻试剂的活性越高,其选择性就越低。
CH2=CHCH2CH3 + Cl2 hu
CH2=CHCHClCH3
这是因为 a 位上的自由基可以与 p 键共轭,有特别的稳定性, 几乎是唯一产物。
H H
烯丙基
a
H H
苄基
N-溴代琥珀酰亚胺(NBS)是实验室制备 a-溴代烃的常用试剂。 在过氧化苯甲酰或偶氮二异丁腈等自由基引发剂作用下,NBS 可以 与许多含 a-H 的烯烃和芳烃发生溴代反应。例如:
O
H+
R CH3
OH
Br2
R CH2
O
+ HBr R CH2Br
酸催化下的,醛酮的 a-卤代反应:
COCH3
+ Br2
cat. AlCl3 Et2O, 0oC
COCH2Br 90%
O CH3
SO2Cl2, CCl4 r.t. 2 h
O Cl CH3
85%
在碱性条件下,醛、酮可迅速地与卤素作用生成卤代醛、酮。 碱的作用是促进碳负离子的形成。
O 碱
RCCH2R'
O -
RC CHR'
碳负离子 carbanion
O-
RC=CHR' 烯醇负离子
enolate
第六章 有机反应活性中间体

RC
CR'
RX + R'2CuLi
R-R' + R'Cu + LiX
23
(3)羧基化和脱羧反应
羧化:
O O
RMgI+ O
C
O
H
OMgI
R
R
OH
O
O
CH3Li + O C O
物质量的比 1 : 1
H
OLi
H3C
R
OH
脱羧:
CH3COONa
-CO2 NaOH 400℃
CH3 + CO2 H+ CH4
当羧基的邻位 有拉电子基时, 可以在较低温 度下脱羧.
稳定的 自由基
O
( iii) 键的离解能 自由基是由共价键均裂产生的, 键 的离解能越大, 产生的自由基越不稳定,容易二聚生 成原来化合物。键的裂解能小的键如含有-O-O-, C-N=N-C 等弱键的化合物, 所产生的自由基比较 稳定。
30
常见自由基按稳定性排序:
(C6H5)3C > (C6H5)2CH > C6H5CH2 > CH2=C H CH2 > (CH3)3C > CH3 CHCH2CH3 >
- OH -
+ N2
(5)质子或其他带正电的原子团与不饱和键加成。
+ R+ (CH 3)3C=CH 2 + H+
CH 3
R (CH 3)3C+-CH 3 CH3CH-CH 2CH3
13
+ H+
6. 碳正离子的反应
1. 与带有电子的亲核体结合:取代反应(SN1) R+ + Nu- RNu
有机合成化学:第六章 缩合反应
第六章 缩合反应
上例是由于选择不同的起始原料,而选择不同的合成路线,使 产品成本大大降低。如果没有很好的路线选择时,可以通过优化 反应条件,提高产物的收率,降低成本。从产品收率上讲,能提 高1-5%。我们可能认为没什么意义,可对企业讲,产品成本会降 低2-8%左右。如果一个产品产值上亿时,可估算一下其价值了。 所以,一个化工产品刚上市时价格较高,随着生产时间延长,价 格逐渐降低,很大可能是由于生产工艺和生产条件的改变所致。
-CO2
CH3CH CH2CO2H
H3C
O O O
60~76%
CH3NO2 + H3CCH
C H
CO2C2H5
NaOC2H5 CH3CH CH2CO2C2H5
55%
CH2NO2
第六章 缩合反应 CH3
CN
PhCH CO2C2H5 + H2C
C H
CN
KOH 83%
CN
PhC CH2CH2CN CO2C2H5
LDA
H3C
CH3
第六章 缩合反应
羰基化合物烷基化最大负反应是O-烷基化产物。如:
副产物
第六章 缩合反应
LDA CH3(CH2)3CO2CH3 BrCH2CH
CH2
CH3CH2CH2CH CO2CH3 CH2CH CH2
LDA
CH2CH3
C2H5Br CH3CH2Байду номын сангаас CO2CH3
可以分步引入
90%
5. Knoevenagel反应:
这类反应的特点是一个亚甲基上连接两个吸电子基团,使
得其氢活性明显提高,反应较易进行。一般使用弱碱 (有机胺)
碳负离子主要内容

(C2H5O)3P + RCH2Br
O Et (EtO)2P CH2R BrO (EtO)2P-CH2R
-EtBr
NaH
O (EtO)2P-CHR
O (EtO)2P CHR
魏悌息-霍纳尔反应
魏悌息-霍纳尔试剂与醛、酮反应,制备烯烃, 这一反应称为魏悌息(Wittig, G.) -霍纳尔(Horner, L.) 反应。(比魏悌息反应容易进行)
O CH3 C CH2 H + CH2O + HN
- -
R R'
H
+
O CH3-C-CH2-CH2N
R R'
机理:
R
+
CH2=O
H
CH2=OH
R'
NH
R R'
N-CH2OH H
H+转移
R R'
N-CH2-OH2
-H2O
R N=CH2 R'
活化的C=N
O CH3C-CH2 H
O H CH3-C=CH2
Mechanism of Favorskii Rearrangement
H O C C
O C C
RO C C C
Cl ROC ROH
O C C C
O
Cl
Cl
C
RO
RO C C
-
C
O
RO ROH C C
O C H
For asymmetric cycloprapanone, the stable anion form dominantly O RO OPhCH CH2COOR RO stable carbon anion Ph Ph
有机化学第06章 芳烃

第六章芳烃在有机化学发展初期,曾把从天然树脂、香精油中得到的一类性质上和脂肪族化合物明显不同,具有高度的不饱和性(C/H高),且具有特殊的稳定性和芳香气味的有机化合物称为芳香族化合物,仅由碳氢两种元素组成的芳香族化合物称为芳香烃,简称芳烃。
因当时发现的这些芳香族化合物经递降后最终得到苯,故人们把苯及其衍生物称为芳香族化合物。
随着有机化学的不断发展,又发现了一些非苯构造的环状烃,它们与苯及其衍生物的性质相似,成环原子间的键长也趋于平均化,性质上表现为易发生取代反应,不易发生加成反应,不易被氧化,它们的质子与苯的质子相似,在核磁共振谱中显示相似的化学位移。
这些特性统称为芳香性。
后经研究发现,具有芳香性的化合物在结构上都符合休克尔规则。
所以近代有机化学把结构上符合休克尔规则,性质上具有芳香性的化合物称为芳香族化合物。
芳烃不一定具有“香”味。
根据是否含有以及所含苯环的数目和联结方式不同,芳烃又可分为如下三类:(1)单环芳烃:分子中只含有一个苯环结构,如苯、甲苯、苯乙烯等。
CH3CH CH2(2)多环芳烃:分子中含有两个或两个以上的苯环结构,如联苯、萘、蒽等。
(3)非苯芳烃:分子中不含苯环结构,但含有结构和性质与苯环相似的芳环,并具有芳香族化合物的共同特性。
如环戊二烯负离子,环庚三烯正离子等。
+(一) 单环芳烃最简单的单环芳烃是苯,其分子式为C6H6。
现代物理方法测得苯的结构为:苯分子的六个碳原子和六个氢原子都在同一平面上,六个碳原子构成正六边形,C-C键长0.140nm,C-H 键长为0.108nm,键角∠CCH及∠CCC均为120º。
(缺图)图6-1 苯分子环状结构及π电子云分布图(1)价键理论对苯结构的处理杂化轨道理论认为苯环中碳原子为sp2杂化状态,三个sp2杂化轨道分别与另外两个碳原子的sp2杂化轨道形成C-Cσ键以及与一个氢原子的s轨道形成C-Hσ键,而没有杂化的p轨道互相平行且垂直于σ键所在平面,它们侧面互相重叠形成闭合大π键(图6-1)共扼体系。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
有机铝试剂的制备:
1、由卤烃和金属铝作用
此法是制备烷基铝最常用的方法
王鹏
6.4 有机铝试剂
2、烯烃与氢化铝作用
:
A1H3太贵,可用H2 + A1代替,如:
3、卤化铝与RMgX作用:
王鹏
6.4 有机铝试剂
有机铝试剂的应用:
烷基铝化学性质活泼,其中C-A1键可以与C=C
C≡C及-CO- 等加成:
实例:环戊二烯基锂制备的实验操作:
先制备苯基锂:
接真空线 的氮气口
溴苯
注意:溴苯加入时 要缓慢滴加,维持 回流状态
无水乙醚为溶剂, 锂片剪碎即可
磁子
磁力搅拌器
王鹏
6.2 有机锂化合物
钢管转移:
为防止过量锂片 引起副反应,应 通过钢管将活泼 的苯基锂转移出 来再滴加环戊二 烯
王鹏
6.2 有机锂化合物
3、钠-金属交换: 得到其他金属化合物后与钠混合,可以得到有机钠 惰性 R-Na + M R-M+ Na 溶剂
王鹏
6.1 有机钠化合物
钠砂的制备:
隔绝空气,在惰性溶剂中加入擦好的钠块,升温至 钠熔化,高速搅拌使其分散,同时降温,直至钠固 化为止 隔绝空气下将惰性溶剂置换为反应溶剂,即可进行 下一步反应
也可以采用镁-氢交换制备
性质:
良好的亲核试剂,活性稍差于锂试剂 与醛酮加成制醇 与羧酸衍生物制备醇、醛酮等
王鹏
6.4 有机铝试剂
有机铝试剂是含C-Al键的化合物
按铝所连基团的状况可分为:R3A1、R2A1Z、
RA1Z2三类,
Z可以是H、F、Cl、Br、I、OR、SR、NH2、NHR、 NR2、PR2等。应用最广泛的是烷基铝及其卤化物
1. 与二氧化碳作用 2. 与碳碳双键加成 3. 与醛酮加成
烃基化和酰基化反应 与金属卤化物作用生成铜锂试剂 烯烃聚合反应的催化剂
王鹏
6.2 有机锂化合物
1、锂交换反应:
有机锂和烃作用,烃中的氢被Li取代 :
烃基锂与卤烷中卤素的交换反应:
对含影响RMgX 形成的基团(-CO-、-COOH ) 的分子具有特殊意义
王鹏
6.2 有机锂化合物
2、烃基化反应与酰基化反应,类似于有机钠
3、生成铜锂试剂:
R2CuLi与α、β-不饱和羰基化合物反应, R可选择 性地加在β碳上:
王鹏
6.3 格氏试剂
有机镁试剂也称作格氏试剂,其碳负离子
具有优良的亲核性及一定的碱性,对空气 较稳定,对水敏感 制备:
通常卤代烃与镁粉在THF或乙醚中制备
对不饱和键的亲核加成
对卤代烃的烃基化反应 金属-其他原子的交换反应
王鹏
1、在惰性溶剂中由卤代烷与金属锂作用
反应必须在无氧无水的条件下进行,否则会有副反 应发生。
王鹏
6.2 有机锂化合物
2、锂氢交换反应
活泼的有机锂制备较稳定的有机锂,常用的有甲基 锂、丁基锂、苯基锂等,其中丁基锂已经商品化 n-C4H9Li t-C4H9Li
3、锂卤素交换反应
王鹏
ห้องสมุดไป่ตู้
6.2 有机锂化合物
第六章 金属有机化合物
不稳定的碳负离子
王鹏 山东科技大学化学与材料工程学院
金属有机化合物是重要的强碱,也是特殊
的碳负离子。
金属有机化合物:含C-M键的有机物。金属有
机化合物中碳负离子十分活泼,对空气、水不 稳定,因此也称为不稳定碳负离子 常见的金属有机化合物中的金属包括Li、Na、 Mg、Cu、Zn、稀土金属等 K > Na > Li > Mg > Al > Zn > Cu > Hg
有机钠化合物的应用:
1、烃基化反应
王鹏
6.1 有机钠化合物
2、烃基化反应
3、加成反应
类似于格氏试剂的反应
有机钠试剂在合成茂环时具有特殊的反应
活性,其他方面的合成则较少使用
王鹏
6.2 有机锂化合物
有机锂化合物是最常用的碱金属有机
化合物,也是活泼的有机金属化合物
一、制法:
本章重点介绍有机钠、锂、镁试剂和铜锂试剂
王鹏
6.1 有机钠化合物
金属钠和钾十分活泼,形成C-M键时离子键
为主,近乎盐类,制备较为困难。有机钠 制备常常使用钠砂 有机钠的分类:
烷基、烯基和芳基钠:无色不溶于烷烃的固体,
可以裂解醚类 苄基型、酮基型和强酸性烃基的钠化合物:有 颜色的可溶性固体,对醚类稳定 芳香负离子、炔基、醇钠负离子等钠盐:无色, 可溶性固体,对醚稳定的强碱
A1R3可作为烯烃聚合的催化剂,A1R3与TiC14
组成的催化剂称Ziegler-Nata催化剂
王鹏
6.4 有机铝试剂
定向聚合的过程:
王鹏
总结
有机金属化合物非常活泼,一般需要在惰
性气氛中保护,以免高活性带来副反应 合成主要有直接合成和交换合成两类 有机金属化合物中的碳负离子也称为不稳 定碳负离子,是活泼的亲核试剂,容易发 生下列反应:
王鹏
6.1 有机钠化合物
有机钠的颜色:
红色
有机钠化合物的制备:
蓝紫色
1、活泼氢化合物直接与钠砂反应 钠砂 无色 遇氧变深红色
王鹏
6.1 有机钠化合物
2、卤代物与钠的反应: 四十年代Motton发现使用钠砂代替钠块,氯代物可 以不发生Wurtz反应而生成有机钠 高速 R-Cl + 2Na 搅拌 R-Na + NaCl
滴加环戊二烯:
接真空线 的氮气口
环戊二烯 冰水浴中滴加环戊 二烯,发生锂氢交 换直到溴苯颜色退 去变为白色为止 溴苯
磁力搅拌器
磁子
王鹏
6.2 有机锂化合物
有机锂化合物的性质:有机锂的性质与
RMgX相似,但比RMgX更活泼,有其特殊 性质
对其他化合物的锂交换反应
对不饱和键的加成反应:
