高等有机碳正离子与碳负离子
4.碳正离子与碳负离子

有机化学基本理论主讲人:史达清4. 碳正离子与碳负离子碳正离子、碳负离子是有机化学中非常重要的两类活性中间体,我们有必要掌握这两类活性中间体的结构、生成方法及影响稳定性的因素。
(1)碳正离子碳正离子是指碳原子带有正电荷的三价化合物,对碳正离子的研究是最早且最深入的,被称为物理有机化学的基础,许多有机反应历程的研究概念和方法都起始于碳正离子的研究工作。
(a)碳正离子的结构碳正离子的中心碳原子是sp2 杂化的平面型结构,正电荷在p 轨道中:例外:下面的几个实例是例外,这是由于它们都不能形成空的p 轨道形式,如乙烯正离子,乙炔正离子是线型结构,有一个空的sp 杂化轨道,苯基正离子C6H5+则有一个空的sp2杂化轨道,但它们都很难生成,因为空轨道与π 体系相互垂直,正电荷得不到分散。
(b)碳正离子的生成方法离解是形成碳正离子的一个主要方法,离解时,与碳原子相连的基团带着一对对子离去。
苯磺酸根离子和卤离子是常用的较好的离去基团。
卤代物中的卤离子还可以在Ag+ 或Lewis 酸存在下脱去而生成碳正离子。
例如:醇一般是在酸作用下,将不容易离去的羟基转变成易离去的水离去,可以形成碳正离子:伯胺一般先用亚硝酸重氮化得到重氮盐,再脱氮得到碳正离子:如果生成的碳正离子具有芳香性,那么这些碳正离子就比较容易生成。
例如:另一类产生碳正离子的方法是质子或其它带正电荷的原子团或Lewis 酸对不饱和体系的加成。
例如:(c)碳正离子的稳定性凡是能够使碳正离子的正电荷得到分散的,则碳正离子比较稳定;相反,如果使碳正离子的正电荷集中,则碳正离子更不稳定。
其影响因素主要有:(i) 诱导效应给电子的诱导效应(+I)使碳正离子稳定;而吸引电子的诱导效应(-I),使碳正离子不稳定。
例如:(ii) 共轭效应给电子的共轭效应(+C)使碳正离子稳定;而吸电子的共轭效应(-C)使碳正离子不稳定。
例如:(iii) 空间效应由于碳正离子是平面型结构,如果正电荷在桥头碳原子上,由于桥的刚性结构,难以形成平面型,所以该碳正离子的稳定性比较差,例如:1-氯双环[2.2.1]庚烷的乙醇解速度比叔丁基氯慢1013倍。
高等有机化学 第02节:碳负离子的重排
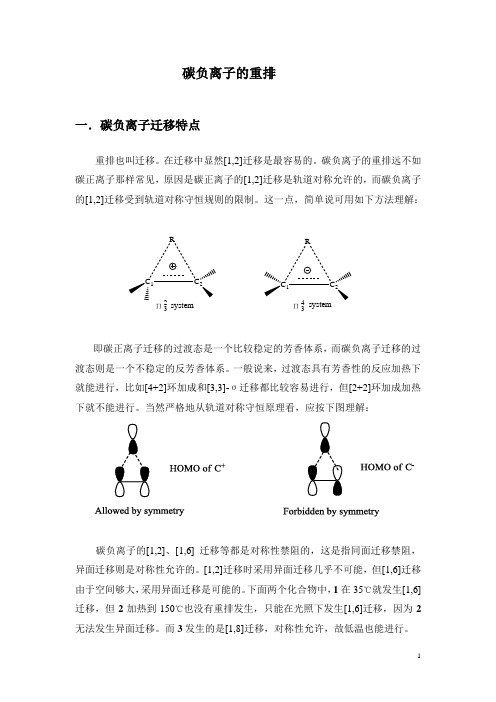
碳负离子的重排一.碳负离子迁移特点重排也叫迁移。
在迁移中显然[1,2]迁移是最容易的。
碳负离子的重排远不如碳正离子那样常见,原因是碳正离子的[1,2]迁移是轨道对称允许的,而碳负离子的[1,2]迁移受到轨道对称守恒规则的限制。
这一点,简单说可用如下方法理解:C 1CRC 1CRΠ32Π34systemsystem即碳正离子迁移的过渡态是一个比较稳定的芳香体系,而碳负离子迁移的过渡态则是一个不稳定的反芳香体系。
一般说来,过渡态具有芳香性的反应加热下就能进行,比如[4+2]环加成和[3,3]-σ迁移都比较容易进行,但[2+2]环加成加热下就不能进行。
当然严格地从轨道对称守恒原理看,应按下图理解:碳负离子的[1,2]、[1,6] 迁移等都是对称性禁阻的,这是指同面迁移禁阻,异面迁移则是对称性允许的。
[1,2]迁移时采用异面迁移几乎不可能,但[1,6]迁移由于空间够大,采用异面迁移是可能的。
下面两个化合物中,1在35℃就发生[1,6]迁移,但2加热到150℃也没有重排发生,只能在光照下发生[1,6]迁移,因为2无法发生异面迁移。
而3发生的是[1,8]迁移,对称性允许,故低温也能进行。
二.重排机理1.加成-消除机理饱和的烃基负离子基本不发生[1,2]迁移,但是不饱和的烃基负离子可以发生[1,2]迁移,如下面的高烯丙基负离子重排。
由于轨道对称性的限制,这种迁移不可能是协同反应,实验表明这种迁移遵循加成-消除机理。
例如:(符号的表示)芳基也能在碳负离子中发生[1,2]迁移,不过比乙烯基困难一些。
在格氏试剂中不能迁移,在锂试剂中可以缓慢重排,在钾和铯试剂中可以迅速发生[1,2]迁移,但一般要求在迁移源要留下至少一个芳基来稳定得到的负离子。
多个芳基基团竞争重排时,能使中间体负离子更加离域的芳基优先迁移,例如下例中对二苯基的迁移绝对优先于间二苯基。
当然,如果重排的中间体是自由基而不是碳负离子,那么对二苯基的重排照样比间二苯基快,所以(7)式结果还不能证明苯基重排的中间体是碳负离子。
大学有机化学知识点总结与归纳

大学有机化学知识点总结与归纳大学有机化学知识点总结与归纳1.酸性比较α-H存在于羰基的α-C上(这是句废话)它的酸性由旁边的吸电子基团的强弱决定一般的,相邻基团的吸电子效果越强其酸性越强相反则越弱如果连接了硝基之类的效果就相当不错了。
在强碱性环境的条件下可以类似于酸的电离一样从分子上解离被强碱捕获其母体分子形成了碳负离子碳负离子作为富电子基团作为亲核试剂具有很强的亲核活性对高度极化的基团的正电中心进行进攻常见的是羰基碳溶剂的碱性强可以促进这类反应的正反应方向进行可以促进脱质子嘛!比较弱的可以用氢氧化钾(这个太弱了很少用)也可以用乙醇钠LDA之类的强碱。
2.反应活性有很多有机化学反应,反应时对于不同的烷基或者比如卤代反应对于不同的卤代烃有不同的活性,那么活性的不同是由于什么引起的呢?其实化学反应就是电性相反的原子或者基团重新组合,因此,表面上看不同的,烃基或者卤素原子活性不同,其实就是电子云的疏密不一样,电负性也是这个原因。
比如卤代烃的反应活性R3H-x>R2CH-X>R-CH2-X而醚的碳氧键断裂(就是酸和醚反应先形成佯盐然后发生亲电取代反应)醚键断裂顺序刚好相反,因为有些是亲电的反应,要求电子云密度大的,活性高。
有些是亲核的,要求电子云密度小。
是由烷基或卤代基的给电子或吸电子能力不同引起的。
不同的机理,活性刚好是相反的因为烷基给电子而卤代基吸电子。
3.碳正离子碳正离子,也称作碳阳离子,是含有正电碳的活性中间体,通常碳为sp2杂化,与三个基团结合,留下一对垂直于平面的p轨道。
碳正离子在有机化学中具有很重要的地位,如SN1反应即经由碳正离子中间体。
一般具有能稳定正电荷的基团的碳正离子具有较高的稳定性。
一般而言,三级碳正离子的稳定性大于二级碳正离子;二级碳正离子大于一级碳正离子。
反应中间体涉及碳正离子者通常会发生重排,例如SN1反应及E1反应等。
重排的种类则有氢阴离子迁移(Hydrideshift)与甲基迁移(Methylshift)两种。
高等有机第五章-活泼中间体
CH3 Ph CH O
Ph
CHOH
三、自由基
自由基反应往往与溶剂极性无关,反应常常容易在气相进行,酸碱 催化也不起作用。自由基反应常常对含氧、氮、硫等化合物非常敏 感,因为这些化合物可与活泼自由基反应形成不活泼自由基而阻止 反应,这些特点有助于反应机理的判断。
24
1、检测
电子顺磁共振 (EPR:Electron paramagnetic resonance) 自由基的特点是具有未成对电子的顺磁物质,未偶电子在磁场中 有两种可能的能态,这两种能态的能量差DE随外磁场强度而增加:
O O Cu2+ O O HOAc OAc OAc CH2OAc
第五章
有机反应中的活泼中间体
一、碳正离子
1、碳正离子的结构
R1
溶剂解
R1
R1
+
R2 R3
Cl Solvent
R2 R3
S S 外消旋体
R2 R3
碳正离子结构:sp2(平面)或sp3(快速翻转角锥型) 桥头卤素不活泼 可解释为双环体 系不能形成平面 的碳正离子。
HO
1
Ag+/H2O 100℃
X
溶剂解 (CH3)3CX
DE=hv=gbH g光谱分裂因子, b 波尔磁子,H磁场强度 当外加能量符合上述关系即发生能量吸收,产生磁能级间跃迁。 2、稳定性 叔 > 仲 > 伯 > CH3
R自由基的稳定性顺序与R-H键解离能顺序相反。 当可能存在共振离域时,自由基稳定性增加。苄基和烯丙基自由 基稳定性大于烷基自由基,但仍为瞬间存在。
19
(2)诱导效应 碳负离子的邻近有吸电子基团可增加其稳定性。 碱
R3N CH3
碳正离子、碳负离子、自由基参与的化学反应 王竹青 29号 应化09-2

碳正离子、碳负离子、自由基参与的化学反应应用化学09-2班 王竹青 29号一 碳正离子参加的反应含有一个外层只有 6 个电子的碳原子作为中心碳原子的正离子。
常见的碳正离子如下:(一)碳正离子的形成一般有三种方法产生碳正离子。
1 .由反应物直接生成 :RXRX与碳原子直接相连的原子或原子团带着一对成键电子裂解,产生碳正离子。
极性溶剂、Lewis 酸常有促进效果。
1.1 X=H 。
烃很少自动失去氢负离子,只有在强亲电试剂如Lewis 酸或其它稳定正离子的因素存在下才能发生这一反应。
CHCH 3CH 3H 3C3C CH 3CH 3H 3C+HAlCl 31.2 X=F 、Cl 、Br 或I 。
这是SN1异裂反应。
Lewis酸可加速这种电离作用。
CClCH 3CH 3H 3CAlCl 3C CH 3CH 3H 3C+HAlCl 4CH 3CH 3CH 2(CH 3)3C1.3 X=OTs 酯类衍生物。
OTs 是一个很好的离去基团,这类酯很易 解离。
1.4 X=OCOZ ,其中Z= Cl 、Br 或I ,其推动力是由于形成二氧化碳。
氯亚磺酸酯,X=OSOCl 也属于这一类。
其推动力是由于排除SO2。
COSOClRR R3C RRR+Cl+SO 21.5 X=H2O 或ROH 。
断裂是由醚ROR 中氧原子的质子化引起的。
1.6 X= N 2。
亚硝酸和伯胺的反应生成的重氮离子很容易分解成碳正离子,推动力是由于生成了氮气。
1.7 X=CO 。
当相应的正离子稳定的时候,某些羧酸先质子化,然后脱去羰基。
C CH 3CH 3H 3CAlCl 3C CH 3CH 3H 3C+OTs -+C OCOClR RRC R RR+Cl -CO2+OR'RH OR'RR +R'OH+N 2H +N 2+COH 2OCOH 2O++CO 1.8 X=CO2。
羧酸氧化脱羧,生成碳正离子和CO2。
RCOOAgBr 2R+Br+AgBr+CO 22 质子或其它阳离子与不饱和体系加成质子或其它阳离子与不饱和体系加成,留下的临碳原子带正电。
高等有机化学课件第六章

CH2 CH3CH CH CH3
(2)插入反应 卡宾可以插入到碳与其他原子所形成的单键中,如
C-H、C-Cl、O-H,但不能插入C-C中。
CCl4 + CH2:
CH2Cl CH2Cl C CH2Cl
CH2Cl
CH3OH + CH2:
CH3CH2OH + CH3OCH3
二、乃春 乃春有称氮烯、氮宾,与卡宾类似,是NH 及其衍
咪唑类卡宾已合成
2、卡宾的产生 (1)α-消除反应
NaOH R2CHCl
R2C: +
HCl
Cl3CH NaOH CH2: + HCl
(2)重氮盐或烯酮分解
CH3 N N
CH2: + N2
CH3 C O
CH2: + CO
3、卡宾的反应 (1)加成反应 单线态为典型的顺式加成,三线态则生成混合产物
CH3CH=CHCH3 + CH2:
二、自由基的产生
1、共价键受热均裂 气相或非极性溶剂中均裂
过氧化物分解 偶氮化合物分解
2、共价键光分解 气相、液相被光照均分解,光照是特定能量的转移,
具有一定的专一性,副反应少。
第三节 双自由基
一、卡宾 卡宾有称碳烯、碳宾,是CH2: 及其衍生物的总称。
1、卡宾的电子构型 最简单的卡宾是亚甲基 CH2: 它以单线态和三线
态存在。 单线态卡宾接近于sp2杂化,有空的p轨道和填
充一对电子的sp2轨道。(既亲电又亲核) 三线态卡宾接近sp杂化,两条p轨道中,各填充
一个单电子。(双自由基) 根据洪特规则:三线态卡宾比单线态卡宾稳定
当亚甲基上有给电子基团时,单线态比三线态稳定
高等有机第四章有机化学反应中间体

2014-12-28
18
5 .伯胺与 HNO2 作用,先生成重氮离子,然后失去 N2形成碳正离子。 R-NH2 → R-N2+ → R+ + N2↑ (二)亲电试剂与重键加成 1.烯烃酸催化水合
C C + H+ C CH
2.羧基化合物的氧质子化
R C R O + H
+
R R C OH
2014-12-28
31
(四)空间效应
不饱和键与碳负离子的电子对共轭,则碳负离子必 然成为平面构型,以利于 P 轨道的最大重叠;若结构上 或空间上因受阻碍达不到最大重叠,则相应碳负离子的 稳定性就小。
1 O H H O O H O
1,3-环己二酮 可与NaOH液反应
双环[2.2.2]辛-2,6-二酮 不能与NaOH水液反应,
(一)S特性效应(杂化效应)
S轨道比相应的 P 轨道离原子核较近,故原子核对S 轨 道中的电子吸引力比相应P轨道的大。这种差别也反映在 杂化轨道中。
轨道吸电子能力: SP > SP2 > SP3 碳负离子稳定性: CH≡C- > -CH=CH2 > -CH2-CH3 这种影响是由于碳原子杂化轨道中S成分不同造成的, 称S特性效应,又叫杂化效应。
CH3NO2
CH2NO2
2014-12-28
34
2 . 碱性条件下脱羧(C-C键异裂)
CN C2H5 C COOH C6H5 碱 CN C2H5 C C6H5
(二)亲核试剂与重键加成(略)
四.碳负离子的反应
(一)对重键的加成
2014-12-28
35
1. 对羰基的加成
C O + R-MgX R C OMgX H3O R C OH
高等有机化学第四章有机反应中间体解析

正电荷分散程度大
共轭体系的数目越多,正碳离子越稳定:
CH2 CH 3C > CH2 CH 2CH > CH2 CHCH2
当共轭体系上连有取代基时,供电子基团使正碳离子 稳定性增加;吸电子基团使其稳定性减弱:
CH3
CH2 >
CH2 > O2N
CH2
环丙甲基正离子比苄基正离子还稳定:
3C >
2CH > CH2 >
含有带负电荷的三价碳原子的原子团。 是最早被确认的活性中间体
1、碳负离子的结构
两种构型: 未共用电子对占据p轨道
未共用电子对占据sp3杂化轨道
有利构型!
桥头碳负离子 角锥结构可以快速翻转,不具有手性
三元环碳负离子难于翻转 得到构型保持的氘代产物
当碳负离子与相邻的不饱和体系共轭时,平面结 构变为有利结构
CH2
环丙甲基正离子的结构:
C
其结果是使正电荷分散
CH2
空的 p 轨道与弯曲轨道的交盖
随着环丙基的数目增多,
CH2
CH2
正碳离子稳定性提高。
直接与杂原子相连的碳正离子结构:
氧上未共有电子对所 占 p 轨道 与中心碳原子上的空的 p轨道 侧面交盖,未共有电子对离域, 正电荷分散。
CH3 O CH2
CH3O CH2
HC CH
NaNH3 液 NH3
HC CNa
NH3
Ph3C H
NaNH3 液 NH3
Ph3CNa
NH3
CH3COCH2COOEt NaOEt CH3COCHCOOEt
常用的碱 ■ 有机锂试剂:n-BuLi, PhLi, MeLi ■ KOBut ■ LDA
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Z: O,C,S,N
C C
HCl
H
C C
Cl
C O
C OH
C OH
91
18
3) 由其它正离子转化而生成
NH 2
NaNO 3 HCl
N2
N2
H
H Ph3CSbF6 SbF6
91
19
4) 在超酸中制备C正离子溶液 比100%的H2SO4的酸性更强的酸-超酸 (Super acid) 常见的超酸 与100%H2SO4的酸性比较 1000倍 103倍 1016倍
3
C
>
2 CH
>
CH2
>
CH2
环丙甲基正离子的结构:
C
CH2 CH2 CH2
91
中心碳原子上的空的 p 轨道与环丙基中的弯曲 轨道进行侧面交盖,其 结果是使正电荷分散。
空的 p 轨道与弯曲轨道的交盖
随着环丙基的数目增多, 正碳离子稳定性提高。
10
NC + stable + CN 极性效应-场效应
金刚烷C+
Advanced Organic Chemistry Lecture 3 Xufeng Lin
Sept., 2013
91
1
Reactive Intermediates
Carbocations,Carbanions, Free radicals, Carbenes, and Nitrenes (Part I)
CH3 CH3-C-CH2Br CH3 _ Br CH3 + CH3-C-CH2 CH3 。+ 1 C CH3 CH3-C-CH2CH3
+
C2H5OH
CH3 CH3-C-CH2CH3 OC2H5
。 + 3 C
It is a general rule that the more concentrated any charge is, the less stable the species bearing it will be.
44
非经典正碳离子类型
1) π键参与的非经典正碳离子 反-7-原冰片烯基对甲苯磺酸酯,在乙酸中的溶剂解的速度, 构型保持,而且比相应的饱和化合物,速度快 1011倍。
TsO H
AcO
AcOH -TsO Ts = CH3 SO2
H
+
7
1 3
5 4 2
45
2电子3中心体系
91
2)σ键参与的非经典正碳离子
பைடு நூலகம்
91 J. Org. Chem. 2005, 70, 3263-3266
35
91
36
Delocalization Delocalization
+
+ + +
Simple conjugation
Homoconjugation
+
+
+
Hyperconjugation/ conjugation
37
91
Delocalization Delocalization
RF + SbF5
Me3CH FSO3H-SbF5
R SbF
+
-
Me3C+ SbF5FSO3- + H2
91 22
Cl The formation of carbocation is difficult
SbF6stable below-50oC
91
23
离解
(CH3)3C-Br
slow
(CH3)3C
28
J. Org. Chem. 2001, 66, 1109-1114
91
29
Multicenter Bonding in Carbocations
?
91
30
J. Phys. Chem. A 2006, 110, 3785-3789
91 31
J. Phys. Chem. A 2006, 110, 3785-3789
三苯甲基正离子利用核磁共振谱证明为螺旋浆结构
C
+
还有少数情况例外,如在炔基或苯基正离子, 正电荷不可能处于p 轨道
91
5
溶剂效应
• 溶剂的极性-溶剂化效应使碳正离子稳定
need 82KJ/mol H2O (CH3)3C-Br need 820 KJ/mol gas phase
+
(CH3)3C
+ Br -
91
Org. Lett., 2012, 14, 2674
40
Carbocation-Forming Reactions in Dimethyl Sulfoxide
91
41
J. Org. Chem., 2003, 68 (3), pp 1117
Nonclassical cation 非经典碳正离子
91
6
Direct Observation of the Ionization Step in Solvolysis Reactions • J. Am. Chem. Soc., 2008, 130 (10), pp 3012–3022
91
7
诱导效应-共轭效应
烯丙型正碳离子:
CH2 CH CH2 CH2 CH CH2
91
11
习题
• 二甲基环戊二烯在浓硫酸中形成的碳正离 子在1H NMR 上只见到三组峰,分别是6 个甲基氢、4个亚甲基氢和一个烯键氢, 试画出该碳正离子的共振结构
H3C
CH3
91
12
H3C
+ CH3
H3C
+ CH3
H3C
+ CH3
烯丙基C+
91
13
芳构化效应
• 具有芳香性Hückel规则∏电子 4n+2的环状C+稳定性 大 Br H
基础有机是否碰到?
91 43
非经典正碳离子的结构
+ +
Br + C 溴鎓离子 C
由于Π、σ键邻基参与而形成非经典碳正离子 配位数可以为5个
H H
H *
H
H *
+
R
+
R
H
当有一个基团存在时倾向于以经典形式存在 若R为苯基时由于苄基正离子来自苯环的稳定化而形成经典正离子 91 若R为难离去基团时大多数情况下为经典的C正离子形式存在
91
15
但对下列碳正离子的生成,由于几何形状的限 制,空间效应的影响,张力较大,稳定性较差。
91
16
正碳离子的生成
1) 直接离子化
RX
Ph CH Cl Ph
H
R
通过化学键的异裂 X 而产生。
Ph2CH
Cl
R OH
ROH2
BF3
R
H2O
CH3COF
CH3CO
BF4
91
17
2) 对不饱和键的加成
C Z H C ZH
91 32
R
C O
酰基阳离子
91
R
C O
33
CH3 H3C C O CH3
H3C H3C H3C
CH3 C O CH3
They are especially stable and are easily formed in 96% H2SO4.
91
34
Isolation and X-ray Structures of Labile Benzoic- and Acetic-Acidium Carbocations
The structure of simple unsubstituted carbanions is not known with certainty since they have not been isolated, but it seems likely that the central carbon is sp3 hybridized, with the unshared pair occupying one apex of the tetrahedron.
连接于C+的原子团对C+稳定能力的大小
R2N>RO>Ar>RCH=CHR>R>H
91
25
91
26
91
27
Intramolecular Hydride Migration in a Substituted 9-Fluorenyl Carbocation
J. Org. Chem. 2001, 66, 1109-1114 91
91
21
Since simple alkyl cations are not stable in ordinary strongacid solutions, the study of this species was greatly facilitated by the discovery that many of them could be kept indefinitely in stable solutions in mixtures of fluorosulfuric acid and antimony pentafluoride. Such mixture, usually dissolved in SO2 or SO2ClF, are among the strongest solutions known and are often called superacids.
91 47
5 进攻C1 5 6 1 + 4 3 HOAc 2 进攻C2 6 6
