高等有机化学 第02节:碳负离子的重排
2有机化学中的重排反应(上课使用)总结精品PPT课件

R C O NR N C O H 2 O R 2 NH
氮烯
异氰酸酯
氮转移一对电子与羰基成 键的时刻氮上缺电子。 紧接着R带着一对电子填补上来。
⑴霍夫曼(Hofmann)重排
酰胺与溴和碱的水溶液作用,放出CO2, 生成少一个碳 原子的胺, 称为霍夫曼重排(降解).
RCONH2 + Br2 + NaOH
RCOCHN2 + HCl
-重氮甲酮
⑵.阿恩特-埃斯特尔特(Arudt-Eistert) 反应
即,从羧酸经重氮甲酮生成高一级羧酸的方法。 (其中包含了Wolff重排。)
4. 缺电子氮重排(C→N)
• R-N:氮烯(乃春Nitrene)与卡宾类似,只是以N原子代换C原子。
可由叠氮分解得到,也可由N-卤代酰胺经-消去HX得到。 • N 原子参加的缺电子重排的基本模式:
1899 年,Baeyer 和Villiger 首次报道了利用过硫酸作氧化剂能 将环酮(如薄荷酮、香芹酮(樟脑)转化成相应的内酯,这就是 历史上最早的Baeyer-Villiger 氧化反应。现在Baeyer-Villiger 氧 化反应已成为酮或环酮转化成酯或内酯的统称。
常用的过氧酸有:H2SO5、MeCO3H、PhCO3H、HCO3H和 CF3CO3H等。现在文献报道的Baeyer-Villiger 氧化反应大多用 双氧水作为氧化剂,因双氧水还原后生成清洁的水,尽管双氧 水具有强腐蚀性,但用双氧水的拜尔-维立格反应仍不失为一 种既安全又符合现代社会绿色环保要求的好方法。
C H 3
H
H
P hC C O T s△H 3 C C C P h
C H 3 C H 3
C H 3 C H 3
苯的迁移速度为甲基的3000倍
高等有机化学 第02节:碳负离子的重排
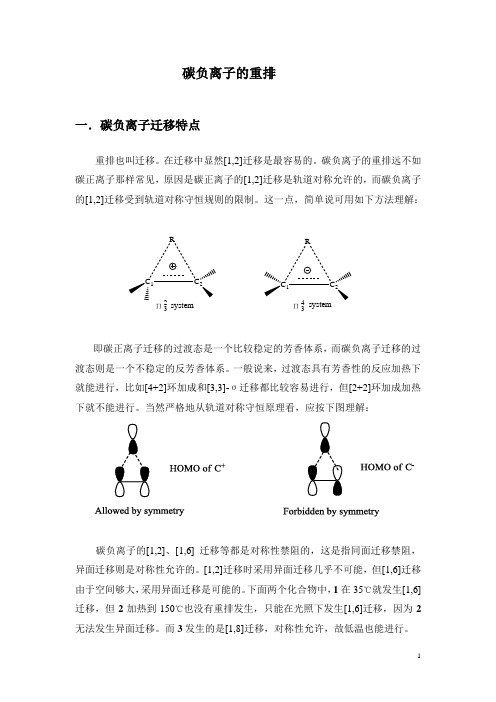
碳负离子的重排一.碳负离子迁移特点重排也叫迁移。
在迁移中显然[1,2]迁移是最容易的。
碳负离子的重排远不如碳正离子那样常见,原因是碳正离子的[1,2]迁移是轨道对称允许的,而碳负离子的[1,2]迁移受到轨道对称守恒规则的限制。
这一点,简单说可用如下方法理解:C 1CRC 1CRΠ32Π34systemsystem即碳正离子迁移的过渡态是一个比较稳定的芳香体系,而碳负离子迁移的过渡态则是一个不稳定的反芳香体系。
一般说来,过渡态具有芳香性的反应加热下就能进行,比如[4+2]环加成和[3,3]-σ迁移都比较容易进行,但[2+2]环加成加热下就不能进行。
当然严格地从轨道对称守恒原理看,应按下图理解:碳负离子的[1,2]、[1,6] 迁移等都是对称性禁阻的,这是指同面迁移禁阻,异面迁移则是对称性允许的。
[1,2]迁移时采用异面迁移几乎不可能,但[1,6]迁移由于空间够大,采用异面迁移是可能的。
下面两个化合物中,1在35℃就发生[1,6]迁移,但2加热到150℃也没有重排发生,只能在光照下发生[1,6]迁移,因为2无法发生异面迁移。
而3发生的是[1,8]迁移,对称性允许,故低温也能进行。
二.重排机理1.加成-消除机理饱和的烃基负离子基本不发生[1,2]迁移,但是不饱和的烃基负离子可以发生[1,2]迁移,如下面的高烯丙基负离子重排。
由于轨道对称性的限制,这种迁移不可能是协同反应,实验表明这种迁移遵循加成-消除机理。
例如:(符号的表示)芳基也能在碳负离子中发生[1,2]迁移,不过比乙烯基困难一些。
在格氏试剂中不能迁移,在锂试剂中可以缓慢重排,在钾和铯试剂中可以迅速发生[1,2]迁移,但一般要求在迁移源要留下至少一个芳基来稳定得到的负离子。
多个芳基基团竞争重排时,能使中间体负离子更加离域的芳基优先迁移,例如下例中对二苯基的迁移绝对优先于间二苯基。
当然,如果重排的中间体是自由基而不是碳负离子,那么对二苯基的重排照样比间二苯基快,所以(7)式结果还不能证明苯基重排的中间体是碳负离子。
碳正离子重排规则

碳正离子重排规则碳正离子重排规则一、背景介绍碳正离子重排是有机化学中的一种重要反应,指在特定条件下,碳正离子通过内部重排而生成另一种稳定的碳正离子。
该反应通常发生在芳香族化合物、环戊烷衍生物和环己烷衍生物等化合物中。
二、基本原理在有机化学中,许多反应都涉及到碳正离子的生成和转移。
当一个分子中的某个原子失去一个电子时,就会形成一个带正电荷的离子,称为正离子。
如果这个正离子中心是碳原子,则称为碳正离子。
在特定条件下,碳正离子可以通过内部重排而形成更加稳定的结构。
这种内部重排过程通常涉及到氢迁移、异构化和断键重新组合等步骤。
三、基本规则1. 氢迁移原则:氢原子往往会向那些电负性更大的位置迁移,以使得整个分子更加稳定。
2. 异构化原则:异构体间能量差别越小,则异构化越容易发生。
3. 断键重新组合原则:断键重新组合通常会形成更加稳定的化合物。
四、具体例子1. 化合物的结构影响重排反应的类型和速率。
对于芳香族化合物,重排反应通常发生在那些对位和邻位上。
而对于环戊烷衍生物和环己烷衍生物等非芳香族化合物,重排反应通常发生在分子内部。
2. 典型的碳正离子重排反应包括:Wagner-Meerwein重排、Pinacol-Pinacolone重排、Beckmann重排等。
五、注意事项1. 碳正离子重排反应通常需要一定的温度和催化剂才能进行。
2. 在进行碳正离子重排反应时,需要注意控制温度和反应时间,以避免产生副反应或不完全转化。
3. 碳正离子重排反应中产生的中间体往往具有较高的活性,需要及时处理以避免不必要的危险。
六、总结碳正离子重排是有机化学中一种非常有用的反应,可以用于合成各种复杂分子。
在进行该类反应时,需要掌握基本原理和规则,并注意安全操作。
第二节亲电重排

该文档贡献者很忙什么也没留下
第六章 重排反应
第一节 亲核重排 第二节亲电重排 第三节 芳烃重排
第二节亲电重排
碳负离子采取何种构型,与中心碳原子所连的基 团有关。 简单的烷基负离子和环烷基负离子是sp3杂化。 碳负离子与发生共轭作用的不饱和基团连接,则 碳负离子以sp2杂化。通过共轭使负电荷分散。 例:烯丙基碳负离子和苄基碳负离子sp2杂化。 对于sp3杂化的稳定性:
C (C F 3 ) 3 > C F 3 > C H 3 > R C H 2 > R 2 C H > R 3 C
第二节亲电重排 2-1 Wittig 重排 2 2 2-2 Favorsky 重排 2-3 Stevens重排
2-1 Wittig 重排
在醇溶液中,醚与强碱如烷基锂、苯基钾、 氨基钠等作用,醚分子中的烃基发生位移得 到醇的反应称Wittig 重排。
O HO
O C OH
2-3 Stevens重排
含有β氢的季铵碱或季铵盐在碱性的条件下会发生 E2消除反应,得到(Hoffmann消除)形成双键碳 上取代基较少的烯烃
CH3 I + N OH N CH3 CH3 OH CH3 + N OH CH3
CH3 CH3
CH3
2-3 Stevens重排
如果季铵盐不具有β氢,而且α位有吸电子基存在, α氢受到季铵基及吸电子基的双重影响,酸性提高, 与强碱作用会脱去α氢生成叶立德(Ylid,具有 Y+—C—结构化合物称叶立德)叶立德氮上的烃 基会进行1,2重排,结果生成叔胺,这一反应称 Stevens重排。
O Cl R1 CH C C R4 R2 R3
RONa
Cl
O C R1 C R2 C R R3
(优选)碳负离子反应ppt讲解

羰基化合物切断:
O
OH
R
O
OH
+ R
O OH R
OM 烯醇负离子
O
O
B
常用碱的性能:
强亲质子和亲核能力的碱:HO- , CH3O-, C2H5O-, RS-, CN-等。
强亲质子弱亲核能力的碱:H- , NH2-。 具有强亲质子和相当弱亲核性的碱:Et2N- ,C6H5N- ,
Me3Si-N-。
例 醛、酯的α-H烷基化时,不能用OH-去脱 质子。如用OH-时则:醛发生醇醛缩合:
(优选)第一章碳负离子反应 ppt讲解
1.1 基本原理
1.1.1碳负离子的形成
碳负离子:是以一个带有负电荷的三价碳为中心原 子的中间体,是有机化学反应中常见的活性中间
体。如甲基负离子
、烯丙基负离子
苄基负离子
、三苯甲基负离子
制备:金属有机化合物 异裂
RLi,RMgX,RC CNa
碳负离子是有机分子中的碳氢键失去质子后 所形成的共轭碱 :
OH CC
H NCC
H NO2 C
强碱
O CC
强碱 NCC
强碱
NO2 C
O CC
NCC O NC O
1.1.2碳负离子的形成条件
从结构上讲,至少含有一个氢的碳原子的邻位要有 一个活化基团,一些带有双键或三键的吸电子基 团 C O 、—NO2、—SO3H、—CN、—C≡CH等 都是活化基团。活化基团有两个作用:
化下,丁二酸酯或α-羟基取代的丁二酸酯却能和酮
羰基反应(Stobbe反应),机理:
EtO2C
CH2CH2 CO2Et
EtO EtOH
EtO2C
CH CH2 COOEt
《碳负离子》PPT课件

碳负离子从广义上可理解是一种强的路易斯碱,
如表所示: 烃类(RH ⇌ R-+H+)的电离常数pKa
10.2 碳负离子的轨道 CH4 Hf=-8.777KCAL/MOL CH3-Hf=57.7237KCAL/M
10.3 碳负离子的构造与稳定性
碳负离子有两种比较符合情理的构造:(1)一个 平面的sp2杂化构型(A),和(2)一个角锥型的sp3杂 化构型(B)。
〔一〕构造 1.〔共振〕平面构型的碳负离子
从烷烃得到的最简单的碳负离子是角锥形的。其构造类 似于氨和胺。与胺相似,简单的负碳离子通过中心碳原子的再 杂化其角锥形可以翻转,导致两个互变异构形式之间的平衡, 如以下图所示。由于这种迅速的相互转变,故不能拆开成对映 体。
例:从由金属-卤素置换制备光学活性2-辛基锂的研 究得到了证明。这个锂化合物和CO2在-70C作用, 给予20%光学活性(亦即60%保持构型不变,40%发 生构型转化),但是在0C给予外消旋混合物。
《碳负离子》PPT课件
本课件PPT仅供大家学习使用 学习完请自行删除,谢谢! 本课件PPT仅供大家学习使用 学习完请自行删除,谢谢! 本课件PPT仅供大家学习使用 学习完请自行删除,谢谢! 本课件PPT仅供大家学习使用 学习完请自行删除,谢谢!
第十章 碳负离子
10.1 碳负离子的定义
碳负离子 (carbanion)是带有负电荷的碳离子。 是有机合成反响中一类重要的活性中间体。碳负离子 极其活泼,除很少数情况外,至今尚未别离成功。然 而大量实验事实已证明了它的存在。碳负离子具有一 对孤对电子,占有sp3杂化轨道,形成四面体构造, 这种构造往往发生迅速的构型转化,如R3C-(R为烃 基):
由于同烯醇化物容易回转为酮式化合物,因而考 虑可能它不只是环丙醇的负离子,而且具有真正的烯 醇的性质。
有机化学中的重排反应

有机化学中的重排反应重排反应是有机化学中一类重要的反应类型,它指的是在分子内,原子的连接方式发生改变,形成不同的同分异构体或结构异构体的化学反应。
重排反应在有机化学领域具有广泛的应用和重要的理论意义。
本文将介绍几种常见的有机化学重排反应及其机理和应用。
一、Wagner-Meerwein重排反应Wagner-Meerwein重排反应是一类重要的碳正离子重排反应,它指的是烷基或芳基正离子的骨架发生重新排列的反应。
该反应的机理是通过重排步骤使得碳正离子的位置发生变化。
例如,烷基正离子在重排反应中可以通过氢的迁移、碳骨架的迁移或者亲电自由基的捕获等方式形成不同位置的同分异构体。
Wagner-Meerwein重排反应在合成有机化合物中有着广泛的应用,可以用于构建碳骨架、生成复杂的天然产物分子以及合成药物等领域。
二、Claisen重排反应Claisen重排反应是一类重要的氧化重排反应,它经常用于合成酮或醛类化合物。
该反应是通过氧的迁移和碳骨架的重排来转化一个氧杂环底物或氧杂环中间体到另一个化合物。
Claisen重排反应在有机合成中得到了广泛的应用。
通过选择合适的底物和条件,可以有效地实现各种氧杂环化合物的合成和转化。
三、Hofmann重排反应Hofmann重排反应是一种氮杂杂环化合物的重排反应,它可以将一些含有氮杂杂环的底物转化为相应的醇、酮或醛化合物。
该反应的机理是通过化学键的断裂和重组来完成的。
Hofmann重排反应在有机合成中具有重要的应用,可以实现对氮杂杂环底物的立体和功能改变。
同时,该反应也是许多天然产物的合成关键步骤之一。
四、Beckmann重排反应Beckmann重排反应是一种重要的氮杂环重排反应,它将氮杂杂环化合物转化为酸中的相应醛或酮类化合物。
该反应的机理是通过氮杂杂环中氧原子的迁移和化学键的重组来实现的。
Beckmann重排反应在有机合成中得到了广泛的应用,可以用于合成酮和醛类化合物,为药物和天然产物的合成提供了重要的方法。
高等有机化学 教案 ylide负碳离子

高等有机化学教案ylide负碳离子第一章:Ylide负碳离子的基本概念1.1 Ylide负碳离子的定义解释Ylide负碳离子的概念强调其作为一种重要的有机化学中间体的作用1.2 Ylide负碳离子的结构与性质描述Ylide负碳离子的分子结构探讨其电子排布和稳定性分析其与碳正离子的区别与联系1.3 Ylide负碳离子的制备方法介绍实验室中常用的Ylide负碳离子制备方法探讨各种方法的优缺点和适用范围第二章:Ylide负碳离子的反应性2.1 加成反应介绍Ylide负碳离子的加成反应特点分析不同类型的加成反应及其应用2.2 消除反应探讨Ylide负碳离子的消除反应机制描述不同类型的消除反应及其应用2.3 重排反应解释Ylide负碳离子的重排反应现象探讨不同类型的重排反应及其应用第三章:Ylide负碳离子的合成应用3.1 合成方法的选择分析不同Ylide负碳离子合成方法的适用性强调选择合适合成方法的重要性3.2 合成策略的设计介绍设计Ylide负碳离子合成策略的方法强调考虑反应条件、底物结构和产物的要求3.3 实际应用案例分析分析具体的Ylide负碳离子合成应用案例强调实际应用中的关键因素和经验教训第四章:Ylide负碳离子的结构分析4.1 核磁共振谱分析介绍Ylide负碳离子核磁共振谱的特点分析不同Ylide负碳离子的核磁共振谱差异4.2 质谱分析解释Ylide负碳离子质谱分析的原理描述不同Ylide负碳离子的质谱特征4.3 红外光谱分析探讨Ylide负碳离子红外光谱的特点分析不同Ylide负碳离子的红外光谱差异第五章:Ylide负碳离子的实验技术5.1 实验操作技巧介绍实验室中进行Ylide负碳离子反应的操作技巧强调安全操作和实验注意事项5.2 实验设备与仪器描述实验室中常用的Ylide负碳离子反应设备与仪器解释各种设备与仪器的工作原理和应用范围5.3 实验数据分析与处理介绍实验数据分析与处理的方法强调正确处理实验数据的重要性第六章:Ylide负碳离子的立体化学6.1 立体化学的基本概念解释立体化学的基本原理和概念强调Ylide负碳离子在立体化学中的重要性6.2 Ylide负碳离子的立体化学控制探讨Ylide负碳离子的立体化学控制方法分析不同立体化学控制方法的适用性和效果6.3 立体化学在Ylide负碳离子反应中的应用介绍立体化学在Ylide负碳离子反应中的应用实例强调立体化学在合成中的应用和意义第七章:Ylide负碳离子的生物活性与应用7.1 Ylide负碳离子的生物活性研究探讨Ylide负碳离子在生物体内的活性及其作用机制分析不同Ylide负碳离子的生物活性差异7.2 Ylide负碳离子的药物应用介绍Ylide负碳离子在药物合成中的应用实例强调其在药物研发中的重要性和潜力7.3 Ylide负碳离子的其他应用探讨Ylide负碳离子在其他领域的应用实例强调其多样性和广泛性第八章:Ylide负碳离子的绿色合成方法8.1 绿色合成的概念与原则解释绿色合成的基本概念和原则强调Ylide负碳离子合成中绿色方法的重要性8.2 Ylide负碳离子的绿色合成方法介绍Ylide负碳离子的绿色合成方法实例强调绿色合成方法在环境保护中的应用和意义8.3 绿色合成方法的评估与优化探讨绿色合成方法的评估指标和方法强调优化绿色合成方法的重要性第九章:Ylide负碳离子的研究进展与展望9.1 Ylide负碳离子的研究进展回顾Ylide负碳离子研究领域的发展历程介绍近年来Ylide负碳离子的研究新进展9.2 挑战与机遇分析Ylide负碳离子研究中面临的挑战和问题探讨解决这些挑战的方法和途径9.3 未来展望展望Ylide负碳离子研究的未来发展趋势强调其对有机化学和相关领域的重要影响第十章:Ylide负碳离子的实验操作指南10.1 实验操作流程详细描述Ylide负碳离子实验操作的流程和步骤强调实验操作中的注意事项和安全性要求10.2 实验技巧与troubleshooting介绍实验过程中常用的技巧和操作要点分析可能出现的问题和解决方法强调正确处理和分析实验数据的重要性重点和难点解析一、Ylide负碳离子的基本概念:理解Ylide负碳离子的定义及其在有机化学中的重要性是学习的基础。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
碳负离子的重排一.碳负离子迁移特点重排也叫迁移。
在迁移中显然[1,2]迁移是最容易的。
碳负离子的重排远不如碳正离子那样常见,原因是碳正离子的[1,2]迁移是轨道对称允许的,而碳负离子的[1,2]迁移受到轨道对称守恒规则的限制。
这一点,简单说可用如下方法理解:C 1CRC 1CRΠ32Π34systemsystem即碳正离子迁移的过渡态是一个比较稳定的芳香体系,而碳负离子迁移的过渡态则是一个不稳定的反芳香体系。
一般说来,过渡态具有芳香性的反应加热下就能进行,比如[4+2]环加成和[3,3]-σ迁移都比较容易进行,但[2+2]环加成加热下就不能进行。
当然严格地从轨道对称守恒原理看,应按下图理解:碳负离子的[1,2]、[1,6] 迁移等都是对称性禁阻的,这是指同面迁移禁阻,异面迁移则是对称性允许的。
[1,2]迁移时采用异面迁移几乎不可能,但[1,6]迁移由于空间够大,采用异面迁移是可能的。
下面两个化合物中,1在35℃就发生[1,6]迁移,但2加热到150℃也没有重排发生,只能在光照下发生[1,6]迁移,因为2无法发生异面迁移。
而3发生的是[1,8]迁移,对称性允许,故低温也能进行。
二.重排机理1.加成-消除机理饱和的烃基负离子基本不发生[1,2]迁移,但是不饱和的烃基负离子可以发生[1,2]迁移,如下面的高烯丙基负离子重排。
由于轨道对称性的限制,这种迁移不可能是协同反应,实验表明这种迁移遵循加成-消除机理。
例如:(符号的表示)芳基也能在碳负离子中发生[1,2]迁移,不过比乙烯基困难一些。
在格氏试剂中不能迁移,在锂试剂中可以缓慢重排,在钾和铯试剂中可以迅速发生[1,2]迁移,但一般要求在迁移源要留下至少一个芳基来稳定得到的负离子。
多个芳基基团竞争重排时,能使中间体负离子更加离域的芳基优先迁移,例如下例中对二苯基的迁移绝对优先于间二苯基。
当然,如果重排的中间体是自由基而不是碳负离子,那么对二苯基的重排照样比间二苯基快,所以(7)式结果还不能证明苯基重排的中间体是碳负离子。
不过(8)式中苯基的迁移能力优先于对甲苯基,表明苯基的迁移中间体是碳负离子。
如果中间体是自由基,则由于对甲苯基对自由基的稳定能力大于苯基,则对甲苯基应优先迁移。
虽然大部分苯基的迁移遵循加成-消去机理,但例外的情况总是有的。
(9)式显然是一个消除-加成的机理。
之所以发生这样进行,是因为消除后能得到一个稳定的产物二苯乙烯和一个稳定的中间体苄基负离子,而按照加成-消去进行得到的中间体负离子不如苄基负离子稳定。
而苄基负离子之所以能和二苯乙烯加成(一般负离子不能和烯烃加成,为什么?),是因为加成后得到的负离子比苄基负离子更加稳定。
既然高烯丙基负离子中的碳负离子可以与C=C双键加成形成三元环,这种进攻当然是亲核进攻,那么把C=C双键改为C=O双键,则这种重排显然要快得多,事实的确如此,见下一页的反应式(10)。
反应(10)是一个酮的碳负离子的重排。
要想形成碳负离子,当然要先拔掉H离子。
要形成类似高烯丙基负离子的重排,酮就要拔掉β碳上的H离子。
但众所周知,酮的α碳上H离子酸性大大高于β碳上的H离子,所以一般情况下酮的碳负离子重排几乎不可能发生。
茨尼酮能发生重排,是因为它虽有α氢,但这个H拔掉后形成的负离子无法与羰基共轭(桥头不能形成双键),所以这个α氢实际上没有酸性,强碱首先拔掉的是β氢,形成的负离子可以通过进攻羰基而得到稳定化。
所以酮负离子重排的前提是酮必须没有活泼α氢。
没有α氢的二叔丁基酮可以在强碱下发生碳负离子重排,见反应(11)。
如果位置合适,甚至γ氢也可以拔掉进行负碳离子重排。
碳负离子的加成-消除机理能进行的化必须有一个前提,即分子内必须有一个不饱和基团,否则第一步的加成无法进行,这个不饱和基团可以是乙烯基、芳基或者羰基,对于羰基的场合必须要求羰基没有活泼α氢。
这种机理和碳正离子重排很不相同,不过有一点是一样的,那就是:重排是可逆的,重排动力都是为了形成更稳定的中间体。
2.自由基机理(Wittig 重排)对于α位含有杂原子的碳负离子来说,发生[1,2]重排在能量上是有利的,因为重排后负电荷位于电负性很大的杂原子上(通常是O原子)。
当这种碳负离子不含有不饱和基团,或者不饱和基团位置不合适时,肯定不能按照消除-加成机理进行重排,实验证明此时按照自由基机理进行重排。
机理如下:其中,丁基自由基可以由甲基自由基和丁基负离子反应得到,这是一个正向有利的平衡反应。
根据这种机理,烯丙基负离子发生Wittig重排时,会有[1,2]重排和[1,4]重排两种产物,这是由自由基共振造成的。
3.协同反应机理([2,3]-Wittig 重排)在Wittig 重排中,如果反应物是烯丙基醚(与反应式14不同,碳负离子位置不同),则容易发生[2,3]-Wittig 重排,而按Wittig 重排发生的[1,2]迁移则是副产物。
例如:[2,3]-Wittig 重排 [1,2]迁移[2,3]-Wittig 重排从表面上看就不属于碳负离子的[1,2]迁移,不存在对称性禁阻的问题,可以按协同反应机理进行。
实际上,[2,3]-Wittig 重排的本质和常见的Cope 重排及[3,3]-σ迁移是一样的,它们的过渡态是等电子体系,只不过是用碳负离子的两个电子代替双键的两个电子而已。
在(16)式的[2,3]-Wittig 重排中碳负离子的构型会进行完全翻转,产物构型是唯一的,说明[2,3]-Wittig 重排的确是协同反应。
(16)式还能说明一点,即协同的亲电取代反应也是背后进攻,构型反转的,这与协同的亲核取代(S N 2)反应是一样的。
C O R3RLiROR2CH=CH 2(16)(15)中[1,2]迁移产物当然是对称性禁阻的,所以是非协同反应,它的生成机理就是上一节讨论的自由基机理,此处不再讨论。
由于自由基机理在高温下容易进行,所以温度升高时,[1,2]迁移产物的确增加了。
三.叶立德重排分子中具有相反电荷的两个原子相互链接成键,叫做叶立德(ylide )。
多数情况下,带负电荷的原子是碳,所以叶立德的重排也属于碳负离子重排,叫做Stevens 重排。
但是带正电荷的原子决不能是碳,只能是没有空轨道的N 、S 等原子;P 原子也不行,因为P 的空3p 轨道可以和碳负离子成π键而稳定,这就是Wittig 试剂, Wittig 试剂不发生Stevens 重排。
在叶立德重排中,正电荷原子没有空轨道,不能像碳正离子那样发生重排,所以叶立德的重排实际上和碳负离子的重排没有本质上的区别。
不过叶立德重排后会变成一个中性分子,比原来的叶立德稳定得多,所以叶立德重排在能量上十分有利,是放热反应。
叶立德重排一般遵循先分裂再结合的自由基机理,所以会有共振产物和分子内交叉产物,而且实验上发现Stevens 重排活化熵是很大的正值,这与预期相吻合。
例如:C 6H 5CH 2N CH 3CH3CH 2=CH 2(CH 3)2N CH CH=CH 2CH 2C 6H 5(CH 3)2NCH=CH CH 2CH 2C 6H 5+(17)CH 3SCH2C 6H 56H 5OCH 3SCH CC 6H 5CH 2C 6H 5O+CH 3S CH CC 6H 5OCH 3SCH CC 6H 5O +C 6H 5CH 2-CH 2C 6H 5(18)同碳负离子一样,叶立德也能发生协同的[2,3]-σ迁移,只不过名字改成Sommelet-Hauser 重排。
Sommelet-Hauser 重排由于是协同的,通常都比非协同的Stevens 重排快,是优先进行的重排,例如:S(19)四.分子内取代反应引起的重排1.Favorskii重排:α-卤代酮或环氧酮在碱催化下烷基从羰基迁移到α-碳的反应叫做Favorskii重排。
如下面例子:O50%25%(20)该反应机理由Loftfield提出如下:这个机理有如下一些证据支持:(1)环丙酮中间体的存在。
环丙酮是一个非常活泼的酮,原因是羰基碳角张力非常大。
羰基碳是sp2杂化,键角要求是120°,而三元环实际键角在60°左右,差距太大,所以羰基有强烈的加成倾向,因为加成后C 原子变为sp 3杂化,要求的键角变成109.5°,则要求与现实之间差距变小,稍微稳定。
如果环丙酮带上两个位阻大的取代基来妨碍亲核试剂的进攻,则这样的环丙酮可以稍微稳定,从而能分离得到。
下面这个α-卤代酮在与NaOH 的反应中确实分离得到了2,3-二叔丁基环丙酮。
(CH 3)3CCH 2CCHC(CH 3)3ONaOHO(H 3C)3CC(CH 3)3(22)(2) 立体化学证据。
在下面这两个例子中,α碳的构型都发生了反转。
CCH 3O3NaOCH 3ether3COCH 33(23)CCH 33NaOCH 3etherCOCH 3O33(24)23242526反应的立体化学变化过程如下所示:在上述过程中,当甲氧基负离子进攻环丙酮时,总是断裂b 键而不断裂a 键,原因是取代基少的负离子更加稳定。
当用醚作溶剂时,23几乎全部生成25,表明速率决定步骤是S N 2反应。
不过实验发现,若使用溶剂化能力强的甲醇做溶剂,则无论以23还是24做原料,反应后都得到25和26的混合物,表明此时速率决定步骤可能是S N 1反应。
原因是溶剂化能力强的时候,碳负离子(即烯醇负离子)被溶剂化,亲核能力下降,同时Cl离子先离去后,形成的碳正离子因溶剂化而稳定,所以此时发生分子内S N1反应可能性大大增加。
2.准Favorskii重排:Favorskii重排的起始步骤是酮的α-氢被碱拔掉,然后发生分子内亲核取代。
但是实验发现有些酮没有α-氢,或者α-氢根本没有酸性(不能被烯醇的α-氢没有酸性),但这些酮也能发生Favorskii重排,只不过速度比较慢而已,于是把这种重排叫做准Favorskii重排或半Favorskii重排。
有些酮,虽然α-氢有酸性,但是不能像Favorskii重排那样形成三元环,如(27)式,那么这样的酮也按准Favorskii重排机理进行反应。
如下面这些例子:3. Ramburg-Backlund反应:α卤代砜在碱作用下,连在砜上的两个烷基以双键相连,最后得到烯烃的反应。
反应机理如下:机理中最后一步反应消除SO2的反应当然是SO2和烯烃加成反应的逆反应。
凡是既含有空轨道又含有孤对电子的体系都可以和烯烃加成形成三元环,如卡宾、Br鎓离子和SO2等,由于这种加成是可逆的,所以三元环的砜容易消除SO2得到烯烃。
不过CO不能与烯烃加成,因为形成的环丙酮太不稳定(角张力大)。
4. Neber重排:N上带有离去基团的亚胺在强碱作用下N原子发生迁移形成一个α-氨基酮的反应。
