碳正离子重排规律
正碳离子重排

正碳离子重排
正碳离子重排是一种有机化学反应,它是指在高温下,由于碳离子的重排和迁移,形成新的化合物。
这种重排反应在有机合成中具有广泛的应用。
正碳离子重排反应的机理比较复杂,但可以归纳为以下几个步骤:
1. 发生质子化:在反应物中加入质子,使其变成正离子。
2. 发生断裂:正离子中的C-C键发生断裂,形成碳离子。
3. 发生迁移:碳离子向相邻的原子迁移,形成更稳定的结构。
4. 发生再次合成:经过多次迁移后,碳离子重新与其他原子结合形成新的分子。
正碳离子重排反应可以分为两类:1,2-重排和1,3-重排。
其中1,2-重排是指相邻两个C-C键发生断裂和迁移;而1,3-重排则是指相隔三个C-C键发生断裂和迁移。
这两种类型的反应都具有很高的选择性和效率。
在有机合成中,正碳离子重排反应常用于合成含有环状结构的化合物。
例如,在制备萜类化合物时,常使用正碳离子重排反应来构建环状结构。
此外,正碳离子重排反应还可以用于合成含有多个官能团的复杂
有机分子。
总之,正碳离子重排反应是一种重要的有机化学反应,在有机合成中
具有广泛的应用。
深入理解其机理和特点,将有助于开发新的合成方
法和化合物。
碳正离子重排规则

碳正离子重排规则碳正离子重排规则一、背景介绍碳正离子重排是有机化学中的一种重要反应,指在特定条件下,碳正离子通过内部重排而生成另一种稳定的碳正离子。
该反应通常发生在芳香族化合物、环戊烷衍生物和环己烷衍生物等化合物中。
二、基本原理在有机化学中,许多反应都涉及到碳正离子的生成和转移。
当一个分子中的某个原子失去一个电子时,就会形成一个带正电荷的离子,称为正离子。
如果这个正离子中心是碳原子,则称为碳正离子。
在特定条件下,碳正离子可以通过内部重排而形成更加稳定的结构。
这种内部重排过程通常涉及到氢迁移、异构化和断键重新组合等步骤。
三、基本规则1. 氢迁移原则:氢原子往往会向那些电负性更大的位置迁移,以使得整个分子更加稳定。
2. 异构化原则:异构体间能量差别越小,则异构化越容易发生。
3. 断键重新组合原则:断键重新组合通常会形成更加稳定的化合物。
四、具体例子1. 化合物的结构影响重排反应的类型和速率。
对于芳香族化合物,重排反应通常发生在那些对位和邻位上。
而对于环戊烷衍生物和环己烷衍生物等非芳香族化合物,重排反应通常发生在分子内部。
2. 典型的碳正离子重排反应包括:Wagner-Meerwein重排、Pinacol-Pinacolone重排、Beckmann重排等。
五、注意事项1. 碳正离子重排反应通常需要一定的温度和催化剂才能进行。
2. 在进行碳正离子重排反应时,需要注意控制温度和反应时间,以避免产生副反应或不完全转化。
3. 碳正离子重排反应中产生的中间体往往具有较高的活性,需要及时处理以避免不必要的危险。
六、总结碳正离子重排是有机化学中一种非常有用的反应,可以用于合成各种复杂分子。
在进行该类反应时,需要掌握基本原理和规则,并注意安全操作。
碳正离子

有机活性中间体——碳正离子的研究一、碳正离子的生成在有机化学反应中碳正离子可以通过不同的方法产生,主要有以下三种。
1、直接离子化[1]在化合物的离解过程中,以共价键的异裂方式产生碳正离子。
最常见的为卤代烃的异裂,在离解过程中,与碳原子相连的卤原子带着一对电子离去,产生碳正离子。
R —X →R + +X - 在这个反应中,极性溶剂的溶剂化作用是生成碳正离子的重要条件。
反应是可逆的,反应生成难溶物或用SbF 5作为Lewis 酸生成稳定SbF 6一, 会使反应向右进行,有利于碳正离子的生成。
R —Br+ Ag +→R ++ AgBr ; R —F+SbF5→R ++SbF 6-。
但是醇、醚、酰卤在酸或Lewis 酸的催化下也可以离解为碳正离子。
R 一0H → R +-OH 2→R ++H 20 ; CH 3COF+BF 3-→CH 3CO ++BF 4-利用超强酸可以从非极性化合物如烷烃中,夺取负氢离子而生成碳正离子。
(CH 3)3CH + SbF 5·FSO 3H →(CH 3)3C ++ SbF 5·FSO 3-+H 2 2、间接离子化[2]主要由其它正离子对中性分子加成而产生的碳正离子,最常见的为烯烃的亲电加成反应和芳环上的亲电取代反应。
CCH;+NO223、其它生成的途径由其它较容易获得的碳正离子转换成较稳定的难以获得的碳正离子。
常见的有重氮基正离子脱N 2而生成碳正离子。
RN R +N2 ;N 2+N2二、碳正离子的结构碳正离子带有正电荷,其结构是由其本身所决定的,碳正离子的中心碳原子为三价,价电子层仅有六个电子,根据杂化轨道理论,其构型有两种可能:一种是中心碳原子处于sp 3杂化状态下的角锥构型,另一种是中心碳原子处于sp 2杂化状态下的平面构型(见下图)。
SP3杂化角锥构型 SP2杂化平面构型在这两种构型中,以平面构型比较稳定,这一方面是由于平面构型中与碳原子相连的三个基团相距最远,空间位阻最小;另一方面是sp2杂化的s成份较多,电子更靠近于原子核,也更为稳定;再一方面空的P轨道伸展于平面两侧,便于溶剂化。
碳正离子重排规律

有机化学中重排反应有机化学中重排反应很早就被人们发现,研究并加以利用。
第一次被Wohler 发现的,由无机化合物合成有机化合物,从而掀开有机化学神秘面纱的反应—加热氰酸铵而得到尿素,今天也被化学家归入重排反应的范畴。
一般地,在进攻试剂作用或者介质的影响下,有机分子发生原子或原子团的转移和电子云密度重新分布,或者重键位置改变,环的扩大或缩小,碳架发生了改变,等等,这样的反应称为是重排反应。
按照反应的机理,重排反应通常可分为亲核反应、亲电反应、自由基反应和周环反应四大类。
也有按照不同的标准,分成分子内重排和分子间重排,光学活性改变和不改变的重排反应,等等。
一、亲核重排重排反应中以亲核重排为最多,而亲核重排中又以1, 2 重排为最常见。
(一 )亲核 1,2 重排的一般规律1.亲核 1, 2 重排的三个步骤:离去基团离去,1,2 基团迁移,亲核试剂进攻2.发生亲核1,2 重排的条件(1)转变成更稳定的正离子(在非环系统中,有时也从较稳定的离子重排成较不稳定的离子)(2)转变成稳定的中性化合物(3)减小基团间的拥挤程度,减小环的张力等立体因素。
(4)进行重排的立体化学条件:带正电荷碳的空p 轨道和相邻的C- Z 键以及α碳和β碳应共平面或接近共平面(5)重排产物在产物中所占的比例不仅和正电荷的结果有关,而且和反应介质中存在的亲核试剂的亲核能力有关3.迁移基团的迁移能力(1)多由试验方法来确定基团的固有迁移能力(2)与迁移后正离子的稳定性有关(3)邻位协助作用(4)立体因素4.亲核 1, 2 重排的立体化学:(1)迁移基:构象基本保持,没有发现过构型反转,有时有部分消旋(2)迁移终点:取决于离去及离去和迁移基进行迁移的相对时机5.记忆效应:后一次重排好像和第一次重排有关,中间体似乎记住了前一次重排过程(二 ) 亲核重排主要包括基团向碳正离子迁移,基团向羰基碳原子迁移,基团向碳烯碳原子下面就这迁移,基团向缺电子氮原子转移,基团向缺电氧原子的迁移,芳香族亲核重排,六种迁移作简要介绍:1.基团向碳正离子迁移:(1)Wagner-Meerwein 重排:烃基或氢的1,2 移位,于是醇重排成烯(2)片那醇重排:邻二醇在酸催化下会重排成醛和酮(3) Demyanov 重排, Tiffeneau-Demyanov 扩环以及有关反应(4)二烯酮 -酚重排: 4, 4-二取代环己二烯酮经酸处理重排成3, 4- 二取代酚的反应(5)醛酮同系物的合成:醛或酮和重氮甲烷作用生成高一级的同系物(6)烯丙基重排:烯丙基系统中双键发生位移的反应2.基团向羰基碳原子迁移:(1) Benzil-Benzilic Acid重排:α-二酮经强碱处理会发生重排,生成α-羟基乙酸盐(2)酸催化下醛酮的重排:在烃基的交换后,醛重排成酮,酮则重排成另一种酮3.基团向碳烯碳原子迁移:(1)Arndt-Eistert 合成和 Wolff 重排:由羧酸经酰卤,重氮酮合成高一级同系物的方法(2) 其他的碳烯重排反应,主要是1,2 氢迁移生成烯4.基团向缺电子氮原子转移:(1)Beckmann 重排:醛肟或酮肟重排成酰胺(2)Hoffmann重排:氮上无取代基酰胺经溴及碱处理,脱羰生成伯胺(3)Curtius 重排:酰基叠氮热分解生成异氰酸酯(4)Schmidt 重排:酸、醛和酮在酸催化下和叠氮酸反应,生成胺、酰胺等的反应(5)Lossen(6)Neber重排:异羟肟酸及O-酰基衍生物经类似重排:肟酮的磺酸酯在乙醇钾处理后水解生成Hoffmann 的重排生成少一个碳的胺α-氨基酮5.基团向缺电氧原子的迁移:(1) 氢过氧化物的重排:氢过氧化物在酸催化下,O-O键断裂,同时烃基从碳原子迁移到氧原子上(2)Baeyer-Villiger重排:酮在酸催化下与过酸作用,在分子中插入氧生成酯的反应6.芳香族亲核重排:(1)芳羟胺重排( Bamberger 重排):经硫酸处理重排成氨基酚(2)Sommelet-Hauser 重排:苄基季胺盐经氨基钠等强碱处理重排成邻位取代的苄基叔胺二、自由基重排反应1.1, 2 迁移:比正离子重排反应少得多,主要发生在:(1)某些双自由基的 1, 2-烷基和氢(2)烯基(迁移的乙烯基若是环的一部分,则发生重排)2.非 1, 2 迁移:多发生1,5 迁移3.Barton 反应:处于羟基δ位上的甲基氧化成醛基的反应4 三、亲电重排第一步是在亲核试剂作用下,离去基脱离形成富电中心,离去基以氢及金属原子居多;第二步是迁移基团留下一对成键电子,以正离子的形式向富电中心迁移,结果是形成新的富电中心。
有机化学重排反应-总结
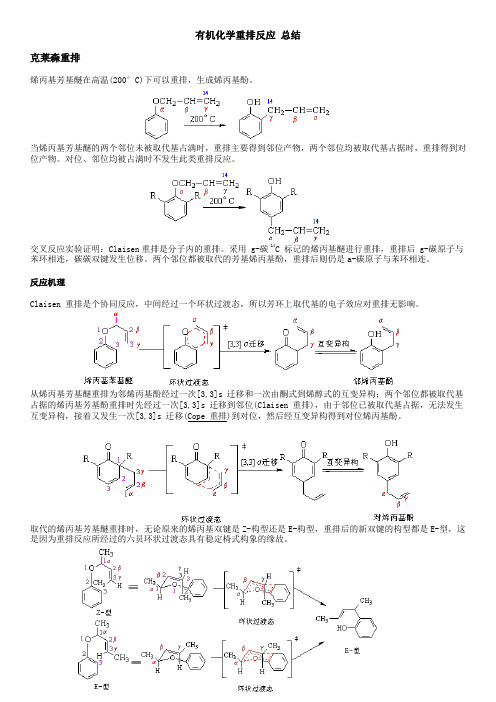
有机化学重排反应总结克莱森重排烯丙基芳基醚在高温(200°C)下可以重排,生成烯丙基酚。
当烯丙基芳基醚的两个邻位未被取代基占满时,重排主要得到邻位产物,两个邻位均被取代基占据时,重排得到对位产物。
对位、邻位均被占满时不发生此类重排反应。
交叉反应实验证明:Claisen重排是分子内的重排。
采用 g-碳 14C 标记的烯丙基醚进行重排,重排后 g-碳原子与苯环相连,碳碳双键发生位移。
两个邻位都被取代的芳基烯丙基酚,重排后则仍是a-碳原子与苯环相连。
反应机理Claisen 重排是个协同反应,中间经过一个环状过渡态,所以芳环上取代基的电子效应对重排无影响。
从烯丙基芳基醚重排为邻烯丙基酚经过一次[3,3]s 迁移和一次由酮式到烯醇式的互变异构;两个邻位都被取代基占据的烯丙基芳基酚重排时先经过一次[3,3]s 迁移到邻位(Claisen 重排),由于邻位已被取代基占据,无法发生互变异构,接着又发生一次[3,3]s 迁移(Cope 重排)到对位,然后经互变异构得到对位烯丙基酚。
取代的烯丙基芳基醚重排时,无论原来的烯丙基双键是Z-构型还是E-构型,重排后的新双键的构型都是E-型,这是因为重排反应所经过的六员环状过渡态具有稳定椅式构象的缘故。
Claisen 重排具有普遍性,在醚类化合物中,如果存在烯丙氧基与碳碳相连的结构,就有可能发生Claisen 重排。
2.Beckmann贝克曼重排肟在酸如硫酸、多聚磷酸以及能产生强酸的五氯化磷、三氯化磷、苯磺酰氯、亚硫酰氯等作用下发生重排,生成相应的取代酰胺,如环己酮肟在硫酸作用下重排生成己内酰胺:反应机理在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。
迁移基团如果是手性碳原子,则在迁移前后其构型不变,例如:3.Bamberger,E.重排苯基羟胺〔N-羟基苯胺〕和稀硫酸一起加热发生重排成对-氨基苯酚:在H2SO4-C2H5OH(或CH3OH)中重排生成对-乙氧基〔或甲氧基〕苯胺:其他芳基羟胺,它的环上的o-p位上未被取代者会起类似的重排。
有机化学中常见涉及碳正离子中间体的重排反应及其特征探讨

肄
I CH 3
H
子, 然后脱去一分 子水 , 形成一个 叔碳正离子 中间体 , 叔碳 正离
H
,
子重排 后以更稳定 的羰基正 离子 的形式存 在 , 同时这 样 的羰 基 正 离子容易脱去质子, 最 后得到重排 产物。 如下 图所示 :
』
C H
R 一 一 CH 3
何供 电子 的共轭 效 应 , 如p 一叮 r 共轭 和超共 轭效 应等 , 都能使 碳
正离子 的稳 定性提高 。 丙醇重 排后 的碳 正离子还 是原来 的伯碳 正离子, 稳定性没有提 高, 所 以这样 的碳 正离子不会发 生重排 ,
稳定 的碳 正离子 中间体 , 这个 碳 正离子 经重 排后得 到较 稳定 的
碳 正离子 中间体 , 最后 经S 2 反应 或E 反应 后 得到相 应 的重排 产物 , 如下图所示 :
2 一 甲基一 1 一 丙醇和 2 , 2 一 二甲基一 4 一 甲基 戊醇 , 初 步形成 的分别是
伯碳 正 离子, 仲碳 正 离子 、 经 重 排后分 别生 成了更稳 定 的叔碳
有机 匕 学中常见涉及碳正离子中间体的 重排反应及其特征探讨
口 广西 师 范 大学 潘 英 明 刘 锦 玲
【 摘 要】 阐述有机化学中常见涉及碳正离子中间体的重排
— — — — -
。
c
反应 , 通过 对简单 醇重排反应 的分析, 总结出经过 碳正 离子 中间
体 的 亲核 重排 反 应 的 特征 。
丙 醇与2 一 甲基一 1 一 丙醇 和2 , 2 . 二甲一 4 一 甲基戊 醇反应 的区别 : 2 ~
【 中图分类号】G 【 文献标识码】 A 【 文章编号】 0 4 5 0 — 9 8 8 9 ( 2 ( ) 1 3 ) 1 2 C 一 0 1 4 6 — 0 3
碳正离子重排规律
有机化学中重排反应有机化学中重排反应很早就被人们发现,研究并加以利用。
第一次被Wohler发现的,由无机化合物合成有机化合物,从而掀开有机化学神秘面纱的反应—加热氰酸铵而得到尿素,今天也被化学家归入重排反应的范畴。
一般地,在进攻试剂作用或者介质的影响下,有机分子发生原子或原子团的转移和电子云密度重新分布,或者重键位置改变,环的扩大或缩小,碳架发生了改变,等等,这样的反应称为是重排反应。
按照反应的机理,重排反应通常可分为亲核反应、亲电反应、自由基反应和周环反应四大类。
也有按照不同的标准,分成分子内重排和分子间重排,光学活性改变和不改变的重排反应,等等。
一、亲核重排重排反应中以亲核重排为最多,而亲核重排中又以1,2重排为最常见。
(一)亲核1,2重排的一般规律1.亲核1,2重排的三个步骤:离去基团离去,1,2基团迁移,亲核试剂进攻2.发生亲核1,2重排的条件(1)转变成更稳定的正离子(在非环系统中,有时也从较稳定的离子重排成较不稳定的离子)(2)转变成稳定的中性化合物(3)减小基团间的拥挤程度,减小环的张力等立体因素。
(4)进行重排的立体化学条件:带正电荷碳的空p轨道和相邻的C-Z键以及α碳和β碳应共平面或接近共平面(5)重排产物在产物中所占的比例不仅和正电荷的结果有关,而且和反应介质中存在的亲核试剂的亲核能力有关3.迁移基团的迁移能力(1)多由试验方法来确定基团的固有迁移能力(2)与迁移后正离子的稳定性有关(3)邻位协助作用(4)立体因素4.亲核1,2重排的立体化学:(1)迁移基:构象基本保持,没有发现过构型反转,有时有部分消旋(2)迁移终点:取决于离去及离去和迁移基进行迁移的相对时机5.记忆效应:后一次重排好像和第一次重排有关,中间体似乎记住了前一次重排过程(二) 亲核重排主要包括基团向碳正离子迁移,基团向羰基碳原子迁移,基团向碳烯碳原子迁移,基团向缺电子氮原子转移,基团向缺电氧原子的迁移,芳香族亲核重排,下面就这六种迁移作简要介绍:1.基团向碳正离子迁移:(1)Wagner-Meerwein重排:烃基或氢的1,2移位,于是醇重排成烯(2)片那醇重排:邻二醇在酸催化下会重排成醛和酮(3)Demyanov重排,Tiffeneau-Demyanov扩环以及有关反应(4)二烯酮-酚重排:4,4-二取代环己二烯酮经酸处理重排成3,4-二取代酚的反应(5)醛酮同系物的合成:醛或酮和重氮甲烷作用生成高一级的同系物(6)烯丙基重排:烯丙基系统中双键发生位移的反应2.基团向羰基碳原子迁移:(1) Benzil-Benzilic Acid重排:α-二酮经强碱处理会发生重排,生成α-羟基乙酸盐(2) 酸催化下醛酮的重排:在烃基的交换后,醛重排成酮,酮则重排成另一种酮3.基团向碳烯碳原子迁移:(1) Arndt-Eistert合成和Wolff重排:由羧酸经酰卤,重氮酮合成高一级同系物的方法(2) 其他的碳烯重排反应,主要是1,2氢迁移生成烯4.基团向缺电子氮原子转移:(1)Beckmann重排:醛肟或酮肟重排成酰胺(2)Hoffmann重排:氮上无取代基酰胺经溴及碱处理,脱羰生成伯胺(3)Curtius重排:酰基叠氮热分解生成异氰酸酯(4)Schmidt重排:酸、醛和酮在酸催化下和叠氮酸反应,生成胺、酰胺等的反应(5)Lossen重排:异羟肟酸及O-酰基衍生物经类似Hoffmann的重排生成少一个碳的胺(6)Neber重排:肟酮的磺酸酯在乙醇钾处理后水解生成α-氨基酮5.基团向缺电氧原子的迁移:(1)氢过氧化物的重排:氢过氧化物在酸催化下,O-O键断裂,同时烃基从碳原子迁移到氧原子上(2)Baeyer-Villiger重排:酮在酸催化下与过酸作用,在分子中插入氧生成酯的反应6.芳香族亲核重排:(1)芳羟胺重排(Bamberger重排):经硫酸处理重排成氨基酚(2)Sommelet-Hauser重排:苄基季胺盐经氨基钠等强碱处理重排成邻位取代的苄基叔胺二、自由基重排反应1.1,2迁移:比正离子重排反应少得多,主要发生在:(1)某些双自由基的1,2-烷基和氢(2)烯基(迁移的乙烯基若是环的一部分,则发生重排)2.非1,2迁移:多发生1,5迁移3.Barton反应:处于羟基δ位上的甲基氧化成醛基的反应4三、亲电重排第一步是在亲核试剂作用下,离去基脱离形成富电中心,离去基以氢及金属原子居多;第二步是迁移基团留下一对成键电子,以正离子的形式向富电中心迁移,重排结果是形成新的富电中心。
碳正离子重排机理
碳正离子重排机理
碳正离子重排是一种重要的有机化学反应,它是指在一定条件下,一个带正电荷的碳离子可以在分子内部的其他碳原子之间发生迁移,
从而形成另一个带正电荷的碳离子。
碳正离子重排发生的机理非常复杂,但可以大致分为两步。
首先
是原始碳离子在分子中游离,并被其他分子中的电子吸引形成新的碳
正离子;然后是新的碳正离子在分子内部进行重排,从而形成更为稳
定的结构。
在具体的反应过程中,碳正离子重排的具体机理取决于反应物的
结构和条件。
例如,对于一些简单的分子,碳正离子可以在分子内部
的两个相邻碳原子之间发生迁移;而对于一些较复杂的分子,轻微的
结构变化都可导致重排产物的不同。
不同的条件也会对碳正离子的重排产生巨大影响,例如温度、溶剂、氧化还原剂等,这些因素可能会影响分子中其他原子的位置或状态,从而影响迁移反应的发生过程和产物的形成。
总之,碳正离子重排反应是一种重要的有机化学反应,它在合成
有机化合物和研究有机分子性质方面具有重要的意义。
对其机制和条
件的了解有助于探索更多的化学反应路径,提高合成反应的效率和选
择性。
有机化学中常见涉及碳正离子中问体的重排反应及其特征探讨
有机化学中常见涉及碳正离子中问体的重排反应及其特征探讨【摘要】阐述有机化学中常见涉及碳正离子中间体的重排反应,通过对简单醇重排反应的分析,总结出经过碳正离子中间体的亲核重排反应的特征。
【关键词】碳正离子中间体重排反应有机化学特征在有机化学中,碳正离子的重排反应有重要的作用,但是因为其涉及的反应广泛,在有机化学的学习中人们很难通过单纯的记忆系统地掌握全部的反应。
通过对比总结碳正离子重排反应的规律特征,可以加深人们对此类反应的理解和认识,从而更好地进行有机化学的学习和研究。
一、有机化学中常见涉及碳正离子中间体的重排反应(一)Wanger-Meerwein重排1.一元醇的重排机理本质。
在醇分子中,羟基上的氧原子电负性很强,有两对孤对电子,在酸性条件下,这个氧原子上的孤对电子会从溶液中夺取一个质子H+,形成钅羊盐,此时,氧原子连有两个氢原子,碳氧键极性增加,碳氧键断裂,氧原子得到了碳原子上的一个电子,以水分子的形式被脱去,剩下一个不稳定的碳正离子中间体,这个碳正离子经重排后得到较稳定的碳正离子中间体,最后经SN2反应或E1反应后得到相应的重排产物,如下图所示:2.一元醇重排在反应中的应用。
以3,3-二甲基-2-丁醇为原料制备烯烃为例,反应历程如下:3.对比分析一元醇在稀硫酸条件下的脱水反应特征。
比较丙醇与2-甲基-1-丙醇和2,2-二甲-4-甲基戊醇反应的区别:2-甲基-1-丙醇和2,2-二甲基-4-甲基戊醇在稀硫酸的作用下,反应得到的是重排产物;而丙醇在稀硫酸的作用下,形成的碳正离子,没有经历重排过程即生成了产物。
由此得到的结论是:不是所有的醇,在稀硫酸的作用下,反应都经历碳正离子重排的过程。
那么,究竟是什么样的一元醇反应要经历重排过程呢?物质的存在与其自身的稳定性有很大的关系,重排后得到的碳正离子越稳定,重排性越大。
在碳正离子中,带正电荷的碳离子核外只有7个电子,是一个缺电子的基团,这样的离子不满足八隅体规则,稳定性很低,但是与其相连的烃基通过超共轭效应,对碳正离子具有供电子的能力(如甲基),从而降低其缺电子的性质,提高了碳正离子的稳定性。
c正离子重排
c正离子重排
碳正离子的重排是如下:
碳正离子可能发生重排反应,从不太稳定的结构,以同样稳定或较稳定的人与速率常数超过10/秒。
这一事实复杂的合成途径许多化合物。
例如,当3-戊醇中加热用HCl水溶液中,最初形成的3-戊基碳正离子重新排列到3-戊基和2-戊基的统计混合物。
这些阳离子与氯离子反应,产生约1/3 3-氯戊烷和2/3 -2-氯戊烷。
相关性质:
稳定性通常用的数量增加的烷基键合到电荷轴承碳。
叔碳阳离子是更稳定(并形成更容易)比仲碳阳离子,因为它们是由稳定的超共轭。
主要碳正离子是非常不稳定的。
因此,反应如Sñ1反应和E1的消除反应通常不如果将形成伯碳正发生。
然而,双重键合有离子化的碳的碳可以稳定离子通过共振。
这些阳离子作为烯丙基阳离子,CH2= CH-CH2,和苄基阳离子,C6ħ5-CH2,比大多数其他碳阳离子更稳定。
能形成烯丙基或苄carbeniums分子是特别反应性的。
碳鎓离子,也可通过稳定的杂原子。
