高中化学各类有机物之间的相互转化关系(精选.)
高三有机化学中有机物间相互转化关系图全解
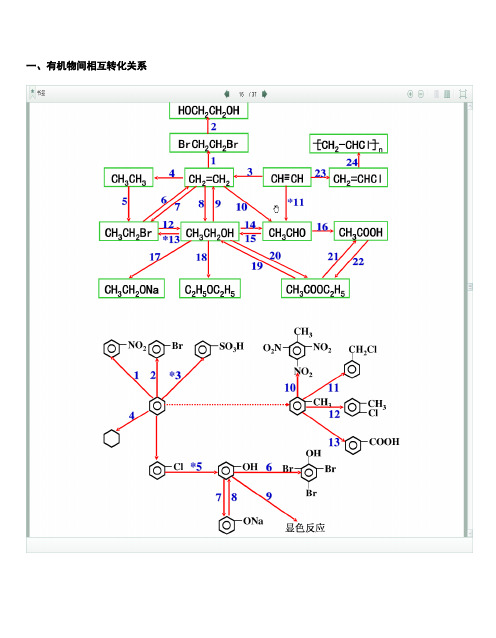
一、有机物间相互转化关系二、能与溴水发生化学反应而使溴水褪色或变色的物质1、有机物:⑴ 不饱和烃(烯烃、炔烃、二烯烃等)⑵ 不饱和烃的衍生物(烯醇、烯醛、烯酸、烯酯、油酸、油酸酯等) ⑶ 石油产品(裂化气、裂解气、裂化汽油等)⑷ 含醛基的化合物(醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖等) ⑸ 天然橡胶(聚异戊二烯)2、无机物:⑴ -2价的S (硫化氢及硫化物)⑵ + 4价的S (二氧化硫、亚硫酸及亚硫酸盐) ⑶ + 2价的Fe6FeSO 4 + 3Br 2 = 2Fe 2(SO 4)3 + 2FeBr 36FeCl 2 + 3Br 2 = 4FeCl 3 + 2FeBr 32FeI 2 + 3Br 2 = 2FeBr 3 + 2I 2⑷ Zn 、Mg 等单质 如 ⑸ -1价的I (氢碘酸及碘化物)变色 ⑹ NaOH 等强碱、Na 2CO 3和AgNO 3等盐 Br 2 + H 2O = HBr + HBrO2HBr + Na 2CO 3 = 2NaBr + CO 2↑+ H 2O HBrO + Na 2CO 3 = NaBrO + NaHCO 3三、能萃取溴而使溴水褪色的物质上层变无色的(ρ>1):卤代烃(CCl 4、氯仿、溴苯等)、CS 2等;下层变无色的(ρ<1):直馏汽油、煤焦油、苯及苯的同系物、低级酯、液态环烷烃、液态饱和烃(如己烷等)等 四、能使酸性高锰酸钾溶液褪色的物质1、有机物:⑴ 不饱和烃(烯烃、炔烃、二烯烃等)⑵ 不饱和烃的衍生物(烯醇、烯醛、烯酸、烯酯、油酸、油酸酯等) ⑶ 石油产品(裂化气、裂解气、裂化汽油等) ⑷ 醇类物质(乙醇等)⑸ 含醛基的化合物(醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖等) ⑹ 天然橡胶(聚异戊二烯) ⑺ 苯的同系物变色 Mg + Br 2 === MgBr 2 (其中亦有Mg 与H +、Mg 与HBrO 的反应)△2、无机物:⑴ 氢卤酸及卤化物(氢溴酸、氢碘酸、浓盐酸、溴化物、碘化物) ⑵ + 2价的Fe (亚铁盐及氢氧化亚铁) ⑶ -2价的S (硫化氢及硫化物)⑷ + 4价的S (二氧化硫、亚硫酸及亚硫酸盐) ⑸ 双氧水(H 2O 2)五、常见的各类有机物的官能团,结构特点及主要化学性质(1) 烷烃A) 官能团:无 ;通式:C n H 2n +2;代表物:CH 4B) 结构特点:键角为109°28′,空间正四面体分子。
高三有机化学中有机物间相互转化关系图

一、有机物间相互转化关系二、能与溴水发生化学反应而使溴水褪色或变色的物质1、有机物:⑴ 不饱和烃(烯烃、炔烃、二烯烃等)⑵ 不饱和烃的衍生物(烯醇、烯醛、烯酸、烯酯、油酸、油酸酯等) ⑶ 石油产品(裂化气、裂解气、裂化汽油等)⑷ 含醛基的化合物(醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖等) ⑸ 天然橡胶(聚异戊二烯)2、无机物:⑴ -2价的S (硫化氢及硫化物)⑵ + 4价的S (二氧化硫、亚硫酸及亚硫酸盐) ⑶ + 2价的Fe6FeSO 4 + 3Br 2 = 2Fe 2(SO 4)3 + 2FeBr 36FeCl 2 + 3Br 2 = 4FeCl 3 + 2FeBr 32FeI 2 + 3Br 2 = 2FeBr 3 + 2I 2⑷ Zn 、Mg 等单质 如 ⑸ -1价的I (氢碘酸及碘化物)变色 ⑹ NaOH 等强碱、Na 2CO 3和AgNO 3等盐 Br 2 + H 2O = HBr + HBrO2HBr + Na 2CO 3 = 2NaBr + CO 2↑+ H 2O HBrO + Na 2CO 3 = NaBrO + NaHCO 3三、能萃取溴而使溴水褪色的物质上层变无色的(ρ>1):卤代烃(CCl 4、氯仿、溴苯等)、CS 2等;下层变无色的(ρ<1):直馏汽油、煤焦油、苯及苯的同系物、低级酯、液态环烷烃、液态饱和烃(如己烷等)等 四、能使酸性高锰酸钾溶液褪色的物质1、有机物:⑴ 不饱和烃(烯烃、炔烃、二烯烃等)⑵ 不饱和烃的衍生物(烯醇、烯醛、烯酸、烯酯、油酸、油酸酯等) ⑶ 石油产品(裂化气、裂解气、裂化汽油等) ⑷ 醇类物质(乙醇等)⑸ 含醛基的化合物(醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖等) ⑹ 天然橡胶(聚异戊二烯) ⑺ 苯的同系物变色 Mg + Br 2 === MgBr 2 (其中亦有Mg 与H +、Mg 与HBrO 的反应)△2、无机物:⑴ 氢卤酸及卤化物(氢溴酸、氢碘酸、浓盐酸、溴化物、碘化物) ⑵ + 2价的Fe (亚铁盐及氢氧化亚铁) ⑶ -2价的S (硫化氢及硫化物)⑷ + 4价的S (二氧化硫、亚硫酸及亚硫酸盐) ⑸ 双氧水(H 2O 2)五、常见的各类有机物的官能团,结构特点及主要化学性质(1) 烷烃A) 官能团:无 ;通式:C n H 2n +2;代表物:CH 4B) 结构特点:键角为109°28′,空间正四面体分子。
有机物间的转化关系
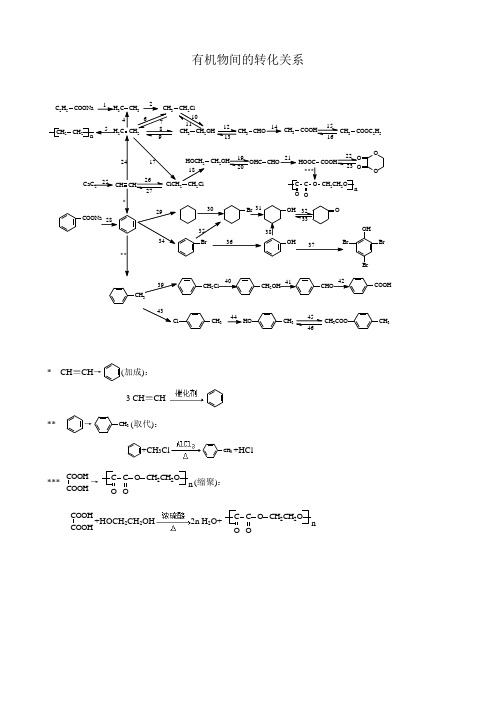
有机物间的转化关系CH 3ClCH 3HOCH 3CH 3COO 44* CH ≡CH →(加成): 3 CH ≡CH**→CH 3(取代):+CH 3ClCH 3+HCl***COOHCOOH→C C O O OCH 2CH 2O n (缩聚):COOHCOOH+HOCH 2CH 2OH 2n H 2O+C C O O OCH 2CH 2O n1.C 2H 5COONa →CH 3CH 3(脱羧):C 2H 5COONa+NaOH CH 3CH 3↑+Na 2CO 32.CH 3CH 3→CH 3CH 2Cl(取代): CH 3CH 3+Cl 2CH 3CH 2Cl+HCl 4.CH 2=CH 2→CH 3CH 3(加成):CH 2=CH 2+H 2CH 3CH 35.CH 2=CH 2→CH 2CH 2n(加聚):n CH 2=CH 2 CH 2CH 2n6.CH 2=CH 2→CH 3CH 2Cl(加成):CH 2=CH 2+HCl CH 3CH 2Cl7. CH 3CH 2Cl →CH 2=CH 2(消去):CH 3CH 2Cl CH 2=CH 2+HCl8. CH 2=CH 2→CH 3CH 2OH(加成):CH 2=CH 2+H 2O CH 3CH 2OH9. CH 3CH 2OH →CH 2=CH 2(消去):CH 3CH 2OH CH 2=CH 2↑+H 2O10. CH 3CH 2Cl →CH 3CH 2OH(取代):CH 3CH 2Cl+NaOH CH 3CH 2OH +NaCl 11. CH 3CH 2OH →CH 3CH 2Cl(取代): CH 3CH 2OH+HCl CH 3CH 2Cl+H 2O12. CH 3CH 2OH →CH 3CHO(氧化):2CH 3CH 2OH+O 22CH 3CHO+2H 2OCH 3CH 2OH+CuOCu+CH 3CHO+H 2O13. CH 3CHO →CH 3CH 2OH(加成、还原):CH 3CHO+H 2CH 3CH 2OH14. CH 3CHO →CH 3COOH(氧化): 2CH 3CHO+O 22CH 3COOHCH 3CHO+2[Ag(NH 3)]++2OH - CH 3COO -+NH 4++3NH 3+H 2OCH 3CHO+2Cu(OH)2CH 3COOH+Cu 2O+2H 2OCH 3CHO+Br 2+H 2O →CH 3COOH+2HBr15.CH 3COOH →CH 3COOC 2H 5(酯化):CH 3COOH+HOC 2H 5H 2O+CH 3COOC 2H 516. CH 3COOC 2H 5→CH 3COOH(水解):H 2O+CH 3COOC 2H 5 CH 3COOH+HOC 2H 5NaOH+CH 3COOC 2H 5CH 3COONa+HOC 2H 517.CH 2=CH 2→ClCH 2CH 2Cl(加成):CH 2=CH 2+Cl 2→ClCH 2CH 2Cl 18. ClCH 2CH 2Cl →HOCH 2CH 2OH(水解):ClCH 2CH 2Cl+2NaOH 2NaCl+HOCH 2CH 2OH19. HOCH 2CH 2OH →OHCCHO(氧化):HOCH 2CH 2OH+O 22H 2O+OHCCHO 20. OHCCHO →HOCH 2CH 2OH(还原):OHCCHO+2H 2HOCH 2CH 2OH21. OHCCHO →HOOCCOOH(氧化):OHCCHO+4Cu(OH)2HOOCCOOH+2Cu 2O+4H 2O22. COOH COOH →OO O O(酯化):COOH COOH +HO CH 22HO 2H 2O+OOOO23.OO O O→COOH (水解):OOOO+2H 2OCOOH +HO CH 2CH 2HO 24.CH ≡CH →CH 2=CH 2(加成):CH ≡CH+H 2CH 2=CH 225.CaC 2→CH ≡CH(水解): CaC 2+2H 2O →Ca(OH)2+CH ≡CH ↑ 26. CH ≡CH →ClCH 2CH 2Cl(加成): CH ≡CH+2HCl ClCH 2CH 2Cl 27. ClCH 2CH 2Cl →CH ≡CH(水解):ClCH 2CH 2ClCH ≡CH+2HCl28.COONa→(脱羧):COONa+NaOH Na 2CO 3+29.→(加成):+3H 230. →Br(取代):+Br 2Br+HBr31.Br→OH(水解):Br+NaOH →OH+NaBr32.OH→O(氧化):2OH+O 22O+2H 2O33.O→OH(还原):O+H 2OH34.→Br(取代):+Br 2Br+HBr35.Br→Br(加成):Br+3H 2Br36.Br→OH(水解):Br+H 2OOH+HBr37.OH→BrOHBr(取代):OH+3Br 2→BrOHBr↓+3HBr38.OH→OH(加成):OH+3H 2OH39.CH 3→CH 2Cl (取代):CH 3+Cl 2CH 2Cl +HCl40.CH 2Cl→CH 2OH(水解):CH 2Cl+NaOH →CH 2OH+NaCl41.CH 2OH→CHO(氧化): 2CH 2OH+O 22CHO+2H 2O42.CHO→COOH(氧化):CHO+2Cu(OH)2COOH+Cu 2O+2H 2O43.CH 3→CH 3Cl (取代):CH 3+Cl 2CH 3Cl+HCl44. CH 3Cl→CH 3HO (水解):CH 3Cl+H 2OCH 3HO+HCl45. CH 3HO→CH 3CH 3COO (酯化):CH 3COOH+CH 3HO H 2O+CH 3CH 3COO46. CH 3CH 3COO →CH 3HO (水解):CH 3CH 3COO +H 2O CH 3COOH+CH 3HO。
高中高三有机化学中有机物间相互转化关系图.docx

一、有机物间相互转化关系二、能与澳水发生化学反应而使澳水褪色或变色的物质1、有机物:(1)不饱和姪(烯炷、烘桂、二烯姪等)(2)不饱和坯的衍生物(烯醇、烯醛、烯酸、烯酯、油酸、油酸酯等)(3)石油产品(裂化气、裂解气、裂化汽油等)(4)含醛基的化合物(醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖等)(5)天然橡胶(聚异戊二烯)2、无机物:(1)一2价的S (硫化氢及硫化物)(2)+4价的S (二氧化硫、亚硫酸及亚硫酸盐)(3)+ 2 价的Fe6FeSO4 4- 3Br2 = 2Fe2(SO4)3 + 2FeBrrj6FeCl + 3Br 二4FeCl + 2FeBr L 变色2FeI + 3Br = 2FeBr + 21 ' J2 23 2 △(4)Zn、Mg等单质女fl Mg + Br 2 === MgBr 2 (其中亦有Mg与H + . Mg与HBrO的反应)(5)-1价的I (氢碘酸及碘化物)变色(6)NaOH 等强碱、N32CO3 和AgNO 3 等盐Br2 + H2O = HBr + HBrO2HBr + Na2COs = 2NaBr + CO2 t + H2OHBrO + Na2CO3 = NaBrO + NaHCOs三、能萃取澳而使澳水褪色的物质上层变无色的(P >1):卤代桂(CC14、氯仿、澳苯等)、CS2等;下层变无色的(p VI):直徭汽油、煤焦油、苯及苯的同系物、低级酯、液态环烷桂、液态饱和桂(如己烷等)等四、能使酸性高镭酸钾溶液褪色的物质1、有机物:(1)不饱和桂(烯坯、块桂、二烯坯等)(2)不饱和桂的衍生物(烯醇、烯醛、烯酸、烯酯、油酸、油酸酯等)(3)石油产品(裂化气、裂解气、裂化汽油等)(4)醇类物质(乙醇等)(5)含醛基的化合物(醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖等)(6)天然橡胶(聚异戊二烯)(7)苯的同系物2、无机物:(1)酸及化物(漠酸、碘酸、酸、漠化物、碘化物) ⑵+ 2价的Fe (及氧化)(3) -2价的S (硫化及硫化物)⑷+ 4价的S (二氧化硫、硫酸及硫酸) ⑸双氧水(H2O2)五、常的各有机物的官能,构特点及主要化学性(1)A ) 官能:无;通式:CnH2n+2;代表物:CH4B )构特点:角109° 28, z 空正四面体分子。
各类有机物之间的转化关系

NO2
OH
乙炔
SO 3H
OH
Br
Br
Br
CH3Cl
CHO
CH3
COOH
Cl
OH
苯甲酸苯甲酯
CH2=CH2 CH2Cl-CH2Cl
三、乙二醇线
环状的乙二 CH2OH-CH2OH OHC-CHO HOOC-COOH 聚乙二酸 乙二醇酯 酸乙二酯
CH2=CH2 CH3-CHO
四、有机玻璃线
①CH3MgCl ②H2O HCN CH3-CHOHCH3
八、聚己二酸乙二醇酯线
CH≡ CH CH2=CH2 CH2=CH-C ≡ CH CH2=CH-CH=CH2 环己烯 己二酸 CH2OH-CH2OH
乙 二 醇 酯
聚 己 二 酸
已知: 已知: 醛或酮与HCN的加成反应; 的加成反应; ①醛或酮与 的加成反应 腈的水解规律 规律。 ②腈的水解规律。 以苯为唯一的有机原料, 以苯为唯一的有机原料,合成
CH3-CO-CH3
2-甲基-2-羟 甲基- - 甲基 基丙腈 2-甲基丙烯酸 甲基丙烯酸 有机玻璃
2-甲基-2-羟 甲基- - 甲基 基丙酸 2-甲基丙烯酸甲酯 甲基丙烯酸甲酯
五、聚乳酸线
CH3-CHOHCH3 CH3-CHCl-CH2Cl CH3-CO-CHO CH3-CH=CH2 = CH3-CHOH-CH2OH CH3-CO-COOH 环状酯 CH3-CHOH-COOH 聚乳酸
六、涤纶线
对二甲苯
对苯二 氯甲烷
对苯二 甲醇
对 苯 二 甲 醇 酯 涤 纶
聚 对 苯 二 甲 酸
对苯二甲醛
对苯二甲酸 二醇
1,2-二氯 烷 二氯
七、丁苯橡胶线
高三有机化学中有机物间相互转化关系图解析
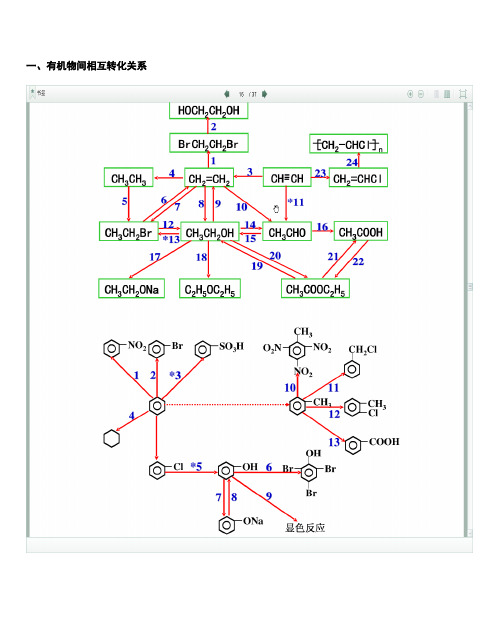
一、有机物间相互转化关系二、能与溴水发生化学反应而使溴水褪色或变色的物质1、有机物:⑴ 不饱和烃(烯烃、炔烃、二烯烃等)⑵ 不饱和烃的衍生物(烯醇、烯醛、烯酸、烯酯、油酸、油酸酯等) ⑶ 石油产品(裂化气、裂解气、裂化汽油等)⑷ 含醛基的化合物(醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖等) ⑸ 天然橡胶(聚异戊二烯)2、无机物:⑴ -2价的S (硫化氢及硫化物)⑵ + 4价的S (二氧化硫、亚硫酸及亚硫酸盐) ⑶ + 2价的Fe6FeSO 4 + 3Br 2 = 2Fe 2(SO 4)3 + 2FeBr 36FeCl 2 + 3Br 2 = 4FeCl 3 + 2FeBr 32FeI 2 + 3Br 2 = 2FeBr 3 + 2I 2⑷ Zn 、Mg 等单质 如 ⑸ -1价的I (氢碘酸及碘化物)变色 ⑹ NaOH 等强碱、Na 2CO 3和AgNO 3等盐 Br 2 + H 2O = HBr + HBrO2HBr + Na 2CO 3 = 2NaBr + CO 2↑+ H 2O HBrO + Na 2CO 3 = NaBrO + NaHCO 3三、能萃取溴而使溴水褪色的物质上层变无色的(ρ>1):卤代烃(CCl 4、氯仿、溴苯等)、CS 2等;下层变无色的(ρ<1):直馏汽油、煤焦油、苯及苯的同系物、低级酯、液态环烷烃、液态饱和烃(如己烷等)等 四、能使酸性高锰酸钾溶液褪色的物质1、有机物:⑴ 不饱和烃(烯烃、炔烃、二烯烃等)⑵ 不饱和烃的衍生物(烯醇、烯醛、烯酸、烯酯、油酸、油酸酯等) ⑶ 石油产品(裂化气、裂解气、裂化汽油等) ⑷ 醇类物质(乙醇等)⑸ 含醛基的化合物(醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖等) ⑹ 天然橡胶(聚异戊二烯) ⑺ 苯的同系物变色 Mg + Br 2 === MgBr 2 (其中亦有Mg 与H +、Mg 与HBrO 的反应)△2、无机物:⑴ 氢卤酸及卤化物(氢溴酸、氢碘酸、浓盐酸、溴化物、碘化物) ⑵ + 2价的Fe (亚铁盐及氢氧化亚铁) ⑶ -2价的S (硫化氢及硫化物)⑷ + 4价的S (二氧化硫、亚硫酸及亚硫酸盐) ⑸ 双氧水(H 2O 2)五、常见的各类有机物的官能团,结构特点及主要化学性质(1) 烷烃A) 官能团:无 ;通式:C n H 2n +2;代表物:CH 4B) 结构特点:键角为109°28′,空间正四面体分子。
高考化学 第十一章 本章重要有机物之间的转化关系
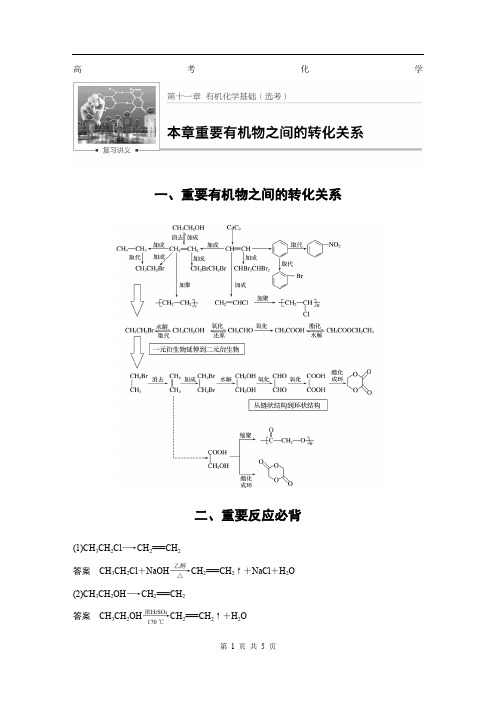
高考化学一、重要有机物之间的转化关系二、重要反应必背(1)CH 3CH 2Cl ―→CH 2===CH 2答案 CH 3CH 2Cl +NaOH ――→乙醇△CH 2===CH 2↑+NaCl +H 2O (2)CH 3CH 2OH ―→CH 2===CH 2答案 CH 3CH 2OH ―――→浓H 2SO 4170 ℃CH 2===CH 2↑+H 2O(3)CH 3CH 2OH ―→CH 3CHO答案 2CH 3CH 2OH +O 2――→Cu △2CH 3CHO +2H 2O (4)CH 3CH 2OH 和CH 3COOH 生成乙酸乙酯答案 CH 3COOH +CH 3CH 2OH浓H 2SO 4△CH 3COOC 2H 5+H 2O(5)OHC —CHO ―→HOOC —COOH答案 OHC —CHO +O 2――→催化剂△HOOC —COOH (6)乙二醇和乙二酸生成聚酯答案 n HOCH 2—CH 2OH +n HOOC —COOH 一定条件(7)乙醛和银氨溶液的反应答案 CH 3CHO +2Ag(NH 3)2OH ――→△CH 3COONH 4+2Ag ↓+3NH 3+H 2O(8)乙醛和新制Cu(OH)2悬浊液的反应答案 CH 3CHO +2Cu(OH)2+NaOH ――→△CH 3COONa +Cu 2O ↓+3H 2O(9)答案 +2NaCl +2H 2O(10)答案(11) 和饱和溴水的反应答案(12) 和溴蒸气(光照)的反应答案(13)OH 和HCHO 的反应答案+(n -1)H 2O(14)酯在碱性条件的水解(以乙酸乙酯在NaOH 溶液中为例)答案 CH 3COOC 2H 5+NaOH ――→△CH 3COONa +C 2H 5OH(15)+NaOH ――→△答案 +2NaOH ――→△CH 3COONa ++H 2O三、有机物的检验辨析1.卤代烃中卤素的检验取样,滴入NaOH 溶液,加热至分层现象消失,冷却后加入稀硝酸酸化,再滴入AgNO 3溶液,观察沉淀的颜色,确定是何种卤素。
高三有机化学中有机物间相互转化关系图

一、有机物间相互转化关系二、能与溴水发生化学反应而使溴水褪色或变色的物质1、有机物:⑴ 不饱和烃(烯烃、炔烃、二烯烃等)⑵ 不饱和烃的衍生物(烯醇、烯醛、烯酸、烯酯、油酸、油酸酯等) ⑶ 石油产品(裂化气、裂解气、裂化汽油等)⑷ 含醛基的化合物(醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖等) ⑸ 天然橡胶(聚异戊二烯)2、无机物:⑴ -2价的S (硫化氢及硫化物)⑵ + 4价的S (二氧化硫、亚硫酸及亚硫酸盐) ⑶ + 2价的Fe6FeSO 4 + 3Br 2 = 2Fe 2(SO 4)3 + 2FeBr 36FeCl 2 + 3Br 2 = 4FeCl 3 + 2FeBr 32FeI 2 + 3Br 2 = 2FeBr 3 + 2I 2⑷ Zn 、Mg 等单质 如 ⑸ -1价的I (氢碘酸及碘化物)变色 ⑹ NaOH 等强碱、Na 2CO 3和AgNO 3等盐 Br 2 + H 2O = HBr + HBrO2HBr + Na 2CO 3 = 2NaBr + CO 2↑+ H 2O HBrO + Na 2CO 3 = NaBrO + NaHCO 3三、能萃取溴而使溴水褪色的物质上层变无色的(ρ>1):卤代烃(CCl 4、氯仿、溴苯等)、CS 2等;下层变无色的(ρ<1):直馏汽油、煤焦油、苯及苯的同系物、低级酯、液态环烷烃、液态饱和烃(如己烷等)等 四、能使酸性高锰酸钾溶液褪色的物质1、有机物:⑴ 不饱和烃(烯烃、炔烃、二烯烃等)⑵ 不饱和烃的衍生物(烯醇、烯醛、烯酸、烯酯、油酸、油酸酯等) ⑶ 石油产品(裂化气、裂解气、裂化汽油等) ⑷ 醇类物质(乙醇等)⑸ 含醛基的化合物(醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖等) ⑹ 天然橡胶(聚异戊二烯) ⑺ 苯的同系物变色 Mg + Br 2 === MgBr 2 (其中亦有Mg 与H +、Mg 与HBrO 的反应)△2、无机物:⑴ 氢卤酸及卤化物(氢溴酸、氢碘酸、浓盐酸、溴化物、碘化物) ⑵ + 2价的Fe (亚铁盐及氢氧化亚铁) ⑶ -2价的S (硫化氢及硫化物)⑷ + 4价的S (二氧化硫、亚硫酸及亚硫酸盐) ⑸ 双氧水(H 2O 2)五、常见的各类有机物的官能团,结构特点及主要化学性质(1) 烷烃A) 官能团:无 ;通式:C n H 2n +2;代表物:CH 4B) 结构特点:键角为109°28′,空间正四面体分子。
