大学化学分子结构练习习题带答案.docx
分子结构练习20题

分子结构练习20题1、下列分子中,两个相邻共价键的夹角最小的是:A、BF3B、HS2C、NH3OD、H2正确答案:B2、下列分子和离子中,中心原子成键轨道不是sp2杂化的是:-A、NO3B、HCHOC、BF3D、NH3正确答案:D3、下列化合物中,极性最大的是:A、CS2B、HS2C、SO3D、SnCl4正确答案:B4、下列分子中,偶极矩不等于零的是:A、BeCl2B、BF3C、NF3D、CO2正确答案:C5、下列液态物质中只需克服色散力就能使之沸腾的是:A、HO2B、COC、HFD、Xe正确答案:D6、下列各组离子中,离子的极化力最强的是:A、K+、Li+B、Ca2+、Mg2+C、Fe3+、Ti4+D、Sc3+、Y3+正确答案:C7、下列物质熔点变化顺序中,不正确的是:A、NaF>NaCl>NaBr>NaIB、NaCl<MgCl 2<AlCl 3<SiCl 4C、LiF>NaCl>KBr>CsID、Al 2O 3>MgO>CaO>BaO正确答案:B8、下列原子轨道的n 相同,且各有一个自旋方式相反的不成对电子,则沿X 轴方向可形成π键的是:A、P X -P XB、P X -PyC、Py-P ZD、Pz-Pz正确答案:D9、下列分子或离子中,具有反磁性的是:A、O 2B、O 2-C、O 2+D、O 22-正确答案:D10、按分子轨道理论,下列稳定性排列正确的是:A、O 2>O 2+>O 22-B、O 2+>O 2>O 22-C、O 22->O 2>O 2+D、O 2+>O 22->O 2正确答案:B11、下列分子或离子中,中心原子的价层电子对几何构型为四面体,而分子(离子)的空间构型为V 字形的是:A、NH 4+B、SO 2C、ICl 2-D、OF 2正确答案:D12、几何形状是平面三角形的分子或离子是:A、SO 3B、SO 32-C、CH 3-D、PH 3正确答案:A13、下列分子中偶极矩大于零的是:A、BF 3B、PF 3C、SiF 4D、PF 5正确答案:B14、根据VSEPR 理论,BrF 3分子的几何构型为:A、平面三角形B、三角锥形C、三角双锥形D、T 字形正确答案:D15、下列分子中,离域π键类型为П33的是:A、O 3B、SO 3C、NO 2D、HNO 3正确答案:C16、下列晶格能大小顺序中正确的是:A、CaO>KCl>MgO>NaClB、NaCl>KCl>RbCl>SrOC、MgO>RbCl>SrO>BaOD、MgO>NaCl>KCl>RbCl正确答案:D17、在下列各种含氢化合物中,有氢键的是:A、CHF 3B、C 2H 6C、C 6H 6D、HCOOHE、CH 4正确答案:D18、在石墨晶体中,层与层之间的结合力是:A、金属键B、共价键C、范德华力D、大π键正确答案:C19、下列关于O 22-和O 2-的性质的说法中,不正确的是:A、两种离子都比O 2分子稳定性小B、O 22-的键长比O 2-键长短C、O 22-是反磁性的,而O 2-是顺磁性的D、O 22-的键能比O 2-的键能小正确答案:B20、若中心原子采用sp 3d 杂化轨道成键的分子,其空间构型可能是:A、三角双锥形B、变形四面体C、直线形D、以上三种均有可能正确答案:D。
《无机化学》第九章分子结构课后习题参考答案

第九章分子结构课后习题参考答案2解:(1)Hg 原子的价电子构型是:5d 106s 2因中心原子Hg 采用sp 杂化,则分子为直线形。
(2)因中心原子Si 采用sp 3杂化,则分子构型为正四面体(3)因中心原子B 采用sp 2杂化,则分子构型为平面三角形(4)因中心原子N 采用sp 3杂化,有一对孤对占据杂化轨道,所以分子构型为三角锥形(5)因中心原子N 采用sp 2杂化,有一对孤对占据杂化轨道,所以分子构型为V 形(6)因中心原子Si 采用sp 3d 2杂化,所以分子构型为正八面体3解:(1)42414=⨯+=VP ,σ键数为4,无孤对电子对,则价电子对空间构型和分子空间构型相同,均为正四面体。
用杂化轨道理论说明:因分子中共有四对成键,则需提供四条杂化轨道,所以Si 采用sp 3杂化形成四条sp 3杂化轨道供四对成键电子占据,分子构型为正四面体。
(2)224=+=VP ,σ键数为2,无孤对电子对,则价电子对空间构型和分子空间构型相同,均为直线形。
杂化轨道理论:(3)32133⨯+=VP ,σ键数为3,无孤对电子对,则价电子对空间构型和分子空间构型相同,均为平面三角形。
用杂化轨道理论说明:因分子中共有三对成键,则需提供三条杂化轨道,所以B 采用sp 2杂化形成三条sp 2杂化轨道供三对成键电子占据,分子构型为平面三角形。
(4)42135=⨯+=VP ,σ键数为3,有1对孤对电子对,则价电子对空间构型为四面体,而扣除孤对电子占据的位置,分子空间构型为三角锥形。
杂化轨道理论:(5)42126=⨯+=VP ,σ键数为2,有2对孤对电子对,则价电子对空间构型为四面体,而扣除孤对电子占据的位置,分子空间构型为V 形。
杂化轨道理论:(6)326=+=VP ,σ键数为2,有1对孤对电子对,则价电子对空间构型为平面三角形,而扣除孤对电子占据的位置,分子空间构型为V 形。
杂化轨道理论:4解:(1)521127=+⨯+=VP ,σ键数为2,有3对孤对电子存在,其价电子对空间构型为三角双锥,扣除孤电子对所占据的位置,其离子几何构型为直线形。
分子结构答案

分子结构——答案1.下列分子中只含键的为()。
A、HCN;B、H2O;C、CO;D、N2;E、C2H4解答或答案:B。
2.下列化合物中分子极性最大的是()A、CCl4;B、C2H5OH;C、I2;D、H2O;E、H2S解答或答案:D3.下列化合物=0的是()A、H2O;B、NH3;C、BF3;D、CH3Cl;E、HCl解答或答案:C4.在下列分子或离子中,没有孤对电子的是()。
A、H2O;B、NH3;C、H2S;D、NH4+;E、OH-5.乙醇和水之间的作用力为()。
A、色散力;B、取向力和诱导力;C、色散力和诱导力;D、取向力、诱导力和色散力;E、除D所述之外还有氢键解答或答案:E6.惰性气体在低温下能够被液化的原因在于()。
A、单原子分子有一定的体积;B、单原子分子有一定的质量;C、单原子分子间有相互作用;D、单原子分子在低温下形成氢键;E、原子是由带正电荷的核和带负电荷的电子组成的解答或答案:C7.下列说法中正确的是()。
A、p轨道之间以“肩并肩”重叠可形成键;B、p轨道之间以“头碰头”重叠可形成键;C、s轨道和p轨道“头碰头”重叠可形成键;D、s轨道和p轨道“头碰头”重叠可形成键;E、共价键是两个原子轨道“头碰头”重叠形成解答或答案:C8.甲烷(CH4)分子中,碳原子所采用的杂化方式为()。
A、sp;B、sp2;C、sp3;D、dsp2;E、spd2解答或答案:C9.下列各分子之间仅存在着色散力的是()。
A、甲醇和水;B、溴化氢和氯化氢;C、氮气和水;D、乙醇和水;E、苯和四氯化碳解答或答案:B10.下列分子中极性最小的是()。
A、NaF;B、HF;C、HCl;D、HBr;E、HI解答或答案:E11.下列分子中存在氢键的是()。
A、HF;B、CH4;C、HI;D、CCl4;E、CO2解答或答案:A12.下列化合物中,能形成分子内氢键的是()。
A、C O O HO H;B、CH3F;C、COOHHO;D、H2O;E、PH3解答或答案:A13.NH3分子中N原子采取不等性sp3杂化,分子在空间的构型为()。
分子结构及其性质+Word版含答案
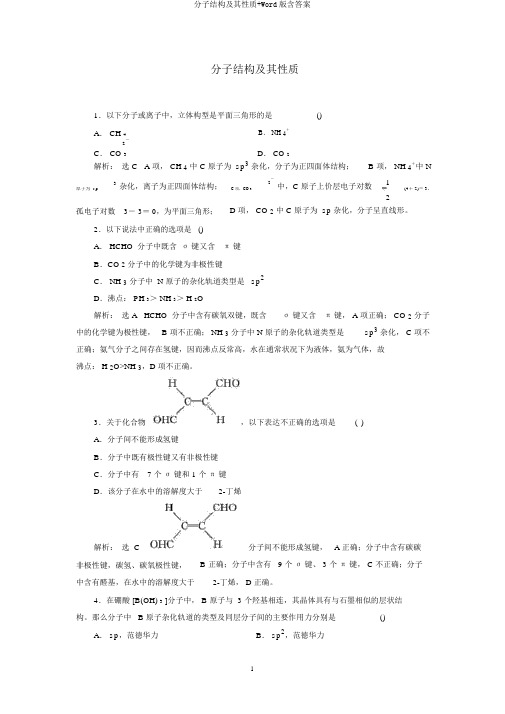
分子结构及其性质1.以下分子或离子中,立体构型是平面三角形的是()A. CH 4B. NH 4+2-D. CO 2C. CO 3解析:选 C A 项, CH 4中 C 原子为 sp3杂化,分子为正四面体结构; B 项, NH 4+中 N3杂化,离子为正四面体结构;2-中,C 原子上价层电子对数1原子为 sp C 项,CO 3(4+ 2)= 3,2孤电子对数3- 3= 0,为平面三角形; D 项, CO 2中 C 原子为 sp杂化,分子呈直线形。
2.以下说法中正确的选项是 ()A. HCHO 分子中既含σ键又含π键B.CO 2分子中的化学键为非极性键C. NH 3分子中 N 原子的杂化轨道类型是 sp2D.沸点: PH 3> NH 3> H 2O解析:选 A HCHO 分子中含有碳氧双键,既含σ键又含π键, A 项正确; CO 2分子中的化学键为极性键, B 项不正确; NH 3分子中 N 原子的杂化轨道类型是sp3杂化, C 项不正确;氨气分子之间存在氢键,因而沸点反常高,水在通常状况下为液体,氨为气体,故沸点: H 2O>NH 3,D 项不正确。
3.关于化合物,以下表达不正确的选项是()A.分子间不能形成氢键B.分子中既有极性键又有非极性键C.分子中有7 个σ键和 1 个π键D.该分子在水中的溶解度大于2-丁烯解析:选 C分子间不能形成氢键, A 正确;分子中含有碳碳非极性键,碳氢、碳氧极性键, B 正确;分子中含有 9 个σ键、 3 个π键, C 不正确;分子中含有醛基,在水中的溶解度大于2-丁烯, D 正确。
4.在硼酸 [B(OH) 3 ]分子中, B 原子与 3 个羟基相连,其晶体具有与石墨相似的层状结构。
那么分子中 B 原子杂化轨道的类型及同层分子间的主要作用力分别是() A. sp,范德华力B. sp2,范德华力23C . sp ,氢键D . sp ,氢键解析: 选 C 由石墨的晶体结构知C 原子为 sp 2 杂化,故 B 原子也为 sp 2 杂化,但由于B(OH) 3 中 B 原子与 3 个羟基相连, 羟基间能形成氢键, 故同层分子间的主要作用力为氢键。
10 分子结构习题解答0.

10分子结构45451.答案:DB BABBDDC2.在下列各题的横线处填上正确的文字,符号或数值(1)极性分子间的取向力由__偶极作用_产生,诱导力由__诱导偶极作用__产生。
色散力由瞬时偶极作用产生。
一般分子间力多以色散力为主。
(2)分子中的电子在分子轨道中的排布应遵循_能量最低原理_、Pauli 不相容原理、Hund 规则三规则。
对 2p 轨道来说是__2___重简并的。
(3)HI 分子间的作用力有_色散力、取向力和诱导力_,其中主要的作用力是色散力。
(4)在HF 分子中,分子轨道的类型有__3σ__、____1π____和____4σ____轨道。
通常_____1π___轨道与相应的原子轨道能量相等或相近。
(5)SO 2的极化率比O 3的____大____,C 3H 8比C 2H 6的极化率_____大___。
(6)A 、B 两元素同属第三周期,A 单质在常温下为气体,B 元素的原子序数比A 少3,A 、B 两元素形成的常见化合物分子式为__SiCl 4___,其中心原子采用的杂化轨道是__sp 3__,分子的空间构型为__正四面体_形,A 、B 原子间成键所用的轨道是_sp 3-p__。
(7)根据价层电子对互斥理论,确定下列分子或离子的几何形状:SO 42-为__正四面体形__,PO 43-为_正四面体形_,XeO 4为_正四面体形_,XeO 3为___三角锥形___。
(8)按照杂化轨道理论,原子轨道发生等性杂化时,原子轨道的形状、_大小、伸展方向等_都发生改变。
形成的杂化轨道能量(或成键能力)相等。
(9)SCl 2的空间构型为_角形_,中心原子采用__不等性sp 3__杂化方式,有__2___对孤对电子,分子偶极矩__不等于_零。
(10)对于下列分子的有关性质:A.NH 3分子的空间构型;B.CH 4分子中H-C-H 的键角;C.O 2分子的磁性;D.H 2O 分子的极性;可以用杂化轨道理论予以说明的有__A B D_,不能用杂化轨道理论说明的有_C _。
(完整版)第四章分子结构习题及答案

第四章分子结构习题1。
是非判断题1-1化学键是相邻原子与原子(或离子与离子)之间的强烈相互作用。
1—2 50Sn2+是18+2电子构型,50Sn4+是18电子构型。
1-3 Al3+,Ba2+,Si(IV)的电子构型都属于8电子构型.1-4具有未成对电子的两个原子相互接近时可以形成稳定的共价键.1—5原子形成共价键的数目等于基态原子的未成对电子数。
1-6σ键的特点是原子轨道沿键轴方向重叠,重叠部分沿键轴呈圆柱形对称。
1-7一般来说,σ键的键能比π键键能小。
1—8 s电子与s电子配对形成的键一定是σ键,p电子与p电子配对形成的键一定为π键.1—9两个σ键组成一个双键.1-10键的强度与键长无关。
1-11所有非金属元素之间形成的化合物都不是离子化合物。
1—12μ=0的分子,其化学键一定是非极性键.1—13共价键具有饱和性的原因在于每个原子提供一定数目的自旋方向相反的未成对电子。
1—14原子核外有几个未成对电子,就能形成几个共价键。
1-15共价键类型可以分为σ键和π键,π键的键能小于σ键的键能,因此π键的稳定性弱于σ键. 1—16烷烃分子中C-H键的键能为413 KJ·mol -1,因此提供413KJ·mol -1的能量能使甲烷和乙烷分子中C-H键断裂。
1-17沿键轴方向的s轨道和p轨道进行重叠可形成π键。
1-18原子轨道相互重叠应满足最大重叠原理,所以沿键轴以“头碰头”方式才能成键。
1—19原子轨道之所以要发生杂化是因为能增大成键能力。
1—20 sp3杂化是,s轨道的主量子数和p轨道的主量子数可以是不同的,也可以是相同的。
1-21 1个s轨道和3个p轨道,形成1个sp3杂化轨道.1-22在sp,sp2,sp3杂化中,杂化轨道的成键能力随s轨道成分增多而增强。
1-23发生轨道杂化的原子轨道可以具有成对电子。
1-24原子轨道发生杂化,若轨道上有孤对电子存在,这类杂化是不等性的。
1-25 NH3和H2O分子中的中心原子都是发生sp3杂化,但氧原子的2对孤对电子占据2 个杂化轨道而产生更大的斥力,使O—H键键角大于氨分之中N—H键键角。
分子结构 习题答案

第二章分子结构习题答案(总9页)--本页仅作为文档封面,使用时请直接删除即可----内页可以根据需求调整合适字体及大小--2、结合Cl 2的形成,说明共价键形成的条件。
共价键为什么有饱和性共价键形成的条件:原子中必须有单电子,而且成单电子的自旋方向必须相反。
共价键有饱和性是因为:一个原子的一个成单电子只能与另一个成单电子配对,形成一个共价单键。
一个原子有几个成单电子便与几个自旋相反的成单电子配对成键。
电子配对后,便不再具有成单电子了,若再有单电子与之靠近,也不能成键了。
例如:每一个Cl 原子有一个带有单电子的p 轨道,相互以头碰头的形式重叠可以形成共价单键,且只能形成一个单键。
3、画出下列化合物分子的结构式并指出何者是键,何者是键,何者是配位键。
H H H Ζ?δδσσσP N I I I Ζ?δδσσσN N N H H H H σσσσσ 膦PH 3, 三碘化氮NI 3 肼N 2H 4(N —H 单键)c C c H H H H σσσσσπ N N N O O o O H σσσσσππππ ,乙烯, 四氧化二氮(有双键)。
4.PCl 3的空间构型是三角锥形,键角略小于10928,SiCl 4是四面体形,键角为10928,试用杂化轨道理论加以说明。
杂化轨道理论认为,在形成PCl 3分子时,磷原子的一个3s 轨道和三个 3p 轨道采取sp 3杂化。
在四个sp 3杂化轨道中,有一个杂化轨道被一对孤电子对所占据,剩下的三个杂化轨道为三个成单电子占据,占据一个sp 3杂化轨道的一对孤电子对,由于它不参加成键作用,电子云较密集于磷原子的周围,因此孤电子对对成键电子所占据的杂化轨道有排斥作用,为不等性杂化,所以键角略小于109°28′。
而在SiCl 4分子中,为等性杂化,没有不参加成键的孤电子对,四个杂化轨道都为四个成单电子占据,不存在孤电子对对成键电子对所占据杂化轨道的排斥作用,所以键角为109°28′。
分子结构练习及参考答案

专题9 分子结构一、选择题:1.下列物质种,含有非极性共价键的离子化合物是()A、Na2O2B、NaOHC、H2O2D、MgCl22.下列物质中,含有极性共价键的是()(1)N2(2)H2O (3)CCl4(4)Na2O2(5)NaOH (6)Na2OA、(1)(2)(3) B.(4)(5)(6)C、(2)(3)(5)D(2)(4)(6)3.A原子的L电子层比B原子的L电子层少3个电子,B原子核外的电子总数比A原子电子总数多5个,则A、B可能形成( )A、离子化合物B2A3B、离子化合物B3A2 C.共价化合物B3A2D、共价化合物BA24、根据“相似相溶”的规律,下列溶剂可以用来从溴水中萃取溴的是()(1)酒精(2)CCl4(3)液氨(4)苯(5)直馏汽油A、(1)(2)(4)(5)B、(2)(4)(5)C、(1)(3)(5)D、(1)(3)(4)5.下列各组物质中,化学键类型相同,分子的极性也相同的是()A SO2和CH4B、CO2和CCl4C、SO2和CO2D、NH3和CCl46.含有极性键的非极性分子是()(1)SO2(键角119ο)(2)CS2(直线型)(3)CCl4(4)NH3(5)CH2Cl2(6)BF3(平面正三角形)A、(2)(3)(4)B、(1)(4)(6)C、(2)(3)(6)D、(2)(3)(5)7.关于化学键的叙述,正确的是()A.离子化合物可能含共价键B.共价化合物可能含离子键C.离子化合物中只含离子键D.共价化合物中不含离子键8.下列分子中所含原子都满足最外层8电子结构的是()A、光气(COCl2) B.六氟化硫C、二氟化氙D、三氟化硼9.下列分子的结构中,原子的最外层电子不能满足8电子稳定结构的是()A、CO2B、PCl3C、CCl4D、NO210.下列各分子中所有原子都满足最外层8电子结构的是()A、BeCl2B、PCl3 C、PCl5 D、N211.下列性质中,可以证明某化合物内一定存在离子键的是()A、可溶于水B、具有较高的熔点C、水溶液可以导电D、熔融状态能导电12、最近科学家研制的一种新分子,它具有空心的类似于足球的结构,分子式为C60,下列说法正确的是()A、C60是一种新型的化合物B、C60和石墨都是碳的同素异形体C、C60中含有离子键D、C60的相对分子质量是720二、填空题:13、写出下列物质的电子式:(1)Cl2____________(2)N2_____________(3)HCl_______________(4)NH3_______________ (5)H2O___________(6)H2O2___________(7)CO2____________(8)CH4________________ (9)PCl3____________(10)NaCl____________(11)MgCl2__________(12)Na2S____________ (13)NaOH___________(14)Na2O2__________(15)NH4Cl__________(16)甲基_____________ 17)羟基__________(18)醛基___________(19)乙烯_________(20)乙炔______________ (21)甲酸_______________14、用电子式表示下列物质的形成过程:(1)H2_____________________________________(2)HCl_______________________________ (3)H2S____________________________________(4)NH3______________________________ (5)KCl____________________________________(6)CaCl2_____________________________ (7)K2S___________________________________(8)BaCl2_____________________________________________ 15、化合物A是一种不稳定的物质,它的分子组成可用O x F y表示,10Ml氧气和10Ml氟气(同温同压)下,试回答:(1)A的化学式______________,理由______________________________(2)已知A分子中,x个氧原子呈-O-O-键状排列,每一根短线代表_________,A的电子式为____________,A分子的结构式为______________________。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1. 离子晶体中的化学键都 是离子键。
( )1. 错分子含有配位键。
()2. 对3. 所有分子的共价键都具有饱和性与方向性,而离子键没有饱和性与方向性。
( )3. 错4. 中心原子所形成的杂化轨道数等于参加杂化的原子轨道数。
( )4. 对5. 原子轨道发生杂化后可以增强成键能力。
() 5. 对6. 杂化轨道具有能量相等、空间伸展方向一定的特征。
()6. 对7. 凡 是 中 心 原 子 采 取 sp 3杂 化 轨 道 成 键 的 分 子, 其 空 间 构 型 都 是 正 四面体。
( )7. 错8. 在任何情况下,每一个2杂化轨道所含的、 p 成分均相同。
()8. 错sps9. 由分子轨道理论可推知O2-、O 2- 都比 O2稳 定。
()9. 错210. 按照分子轨道理论,N+和N -的键级相等。
()10. 对2211. 色散力存在于一切分子之间。
()11. 对12. 弱极性分子之间的分子间力均以色散力为主。
() 12. 对13. 氢键只存在于NH 3、H 2O 、HF 的分子之间,其它分子间不存在氢键。
()13. 错14. 根据价层电子对互斥理论,分子或离子的空间构型取决于中心原子的价层电子对数。
()14.对15. 对 AB m 型 分 子 ( 或 离 子 ) 来 说, 当 中 心 原 子 A 的 价 电 子 对 数 为 m 时, 分 子 的 空 间 构 型 与 电 子 对 在空间的构型一致。
()15. 对16. AsF 5 是三角双锥形分子。
()16. 错17. SO2- 、 ClO -、PO 3-的空间构型相同。
()17. 对 44418.下列化合物中既有离子键又有共价键和配位键的是()。
(A) KF ;(B) H SO ;(C) CuCl2; (D) NHNO 。
244319. 关于离子键的本性,下列叙述中正确的是()。
(A) 主 要是由于原子 轨道的 重叠; (B) 由一个原子 提供成对共用 电子;(C)两个离子之间瞬时偶极的相互作用;(D)正、负离子之间的静电吸引为主的作用力。
20. 下列各组卤化物中, 离子 键成分大小顺序正确的是()。
(A) CsF > RbCl > KBr > NaI; (B) CsF > RbBr > KCl > NaF ;(C) RbBr > CsI > NaF > KCl;(D) KCl > NaF > CsI > RbBr。
21. 下列关于氢分子形成的叙述中,正确的是1()。
(A)两个具有电子自旋方式相反的氢原子互相接近时,原子轨道重叠,核间电子云密度增大而形成氢分子; (B) 任何氢原子相互接近时,都可形成H 2分子;(C) 两 个 具 有电子自 旋方式相同的氢原子互相 越靠近,越 易形成H 2分子;(D)两 个 具 有电子自旋方式相反的氢原子接近 时,核间电 子云密度减小, 能形成稳定的H 2分子.22. 按 照 价 键理论(VB 法),共价键之所以存在?和?键,是 因 为()。
(A) 仅是自旋方向相反的两个成单电子配对成键的结果; (B) 仅是原子轨道最大程度重叠的结果;(C) 自旋方向相反的两个成单电子原子轨道最大程度重叠的结果;(D)正、负电荷吸引排斥作用达到平衡的结果。
23. 下列叙述中,不能表示?键特点的是()。
(A) 原子轨道沿键轴方向重叠,重叠部分沿键轴方向成“圆柱形”对称;(B) 两原子核之间的电子云密度最大;(C) 键的强度通常比?键大;(D)键的长度通常比?键长。
24. 两 个 原 子 的 下列 原 子 轨 道 垂 直 x 轴 方 向 重 叠 能 有 效 地形 成 ? 键 的 是((A) p y - p y ; (B)p x - p x ; (C) p y - p z ; (D) s - p z 。
)。
25. 按 照 价 键 理 论, HCl 分 子 中共 价 键 是 由( )。
(A) H 原 子 的 1 s 轨 道 与 Cl 原 子 的 3 p x 轨 道 沿 x 轴 方 向 重 叠 而 成;(B) H 原 子 的 1 s (C) H 原 子 的 1 s(D) H 原 子 的 1 s轨 道 与 Cl 原 子 的 3 个 p 轨 道 重 叠 而 成;轨 道 与 Cl原 子 的 3 s 轨 道 重 叠 而 成;轨 道 与 Cl原 子 的 2 p x 轨 道 沿 x 轴 方 向 重 叠 而 成。
26. 下列键参数能用来说明分子几何 形状的是( )。
(A)键 矩;(B)键长和键角;(C)键 能;(D)键级。
27. 下列化学键中键能最大者是()。
(A)N-H; (B)O-H; (C)F-H;(D)H-H。
28. 下 列 过 程 的 ? r H 等 于 HI 键 能 的 是( )。
(A) 2HI (g)→ H 2 (g) + I2 (g) ; (B) HI (g)→12 H 2 (g) + 12 I 2 (g) ;(C) HI (g) → H (g) + I (g) ; (D) HI (g) → H +(g) + I -29. 在HO 、HS 、CH 、CO 分 子中, 键角由大到小 的顺2 2 4 2(A)H 2O>H 2S>CH 4 >CO 2; (B)CH 4 >H 2O>H 2S>CO 2;(g) 。
序, 正 确的是()。
(C)CO 2>H 2S>H 2O>CH 4;(D)CO2>CH 4>H 2O>H 2S 。
30. 下列有关分子特性中, 能用杂化轨道理论解释的是()。
(A)分子中的三 电 子 键;(B)分子的空间几何构型;(C)分子中键的极性;(D) 分子中化学键的类型。
31.下 列 有 关 sp 3 不等性杂化轨道的叙述中正确的是( )。
(A) 它 是 由 一 个 s 轨 道 和 一 个 3 p 轨 道 杂 化 而 成; (B) 它 是 由 一 个 1 s 轨 道 和 三个 3 p 轨 道 杂 化 而 成;(C) sp 3 不 等 性 杂 化 轨 道 所 含 s 成 分 不 相 等, p 成 分 也 不 相 等;(D)sp 3 杂 化 轨 道 可 以 形 成 ? 键 或 ? 键。
32. 下列关于杂化轨道的叙述中正确的是()。
(A)凡 是 中 心 原 子 采 用 sp 3杂 化 轨 道 成 键 的 分 子 , 都 具 有 正 四 面 体 的 空 间 构 型;(B)sp 2 杂 化 轨 道 是 由 同 一 原 子 的 1个 ns 轨 道 和 2 个 np 轨 道 混 合 组 成 的 三 个新 的 原子 轨 道;(C)凡 AB 3 型 分 子, 中 心 原 子 都 采 用 sp 3杂 化 轨 道 成 键;(D) CH 4 分 子 中 的 sp 3杂 化 轨 道 是 由 H 原 子 的 1 s 原子 轨 道 和 碳 原 子 3 个 p 轨 道 混 合 组 成 的。
33. SiF 4 分 子 中 Si 原 子 的 成 键 杂 化 轨 道应 是( )。
(A) sp ; (B)233sp ; (C) sp ; (D) sp 不 等 性。
34. 若 BCl3分子中B 原子采用 sp 2杂 化 轨 道 成 键, 则 BCl 3 的空间几何构型是( )。
(A)平面三角形;(B)直线形;(C)四 面体形; (D)平面正方形。
35. 若 HgI2分 子 中 Hg 原 子 采 用sp 杂 化 轨道成键, 则 HgI 2 分子的空间构型为( )。
(A)直 线形; (B)平面 正方形;36. 下列各组分子中,中心原子均采取(A) CH 4、 CCl 4; ( B) CCl 4、 SiF 4; (C) BCl(C)平 面 三 角 形; (D)四面体。
sp 3 杂 化 方 式, 且分子的空间构型不同的是()。
、H O ; (D) H2O 、NH 。
32337. 下 列 分 子 的空间构型为三角锥形的是()。
(A) PCl 3;(B) BI3;(C) H 2Se ; (D) SiH4。
38. 同 核 双 原子分子中,两 个 原 子 的 能 级 相 近 的 p 轨 道 可 能 组 成 的 分 子 轨 道 数 是()。
(A)2 ;(B)3;(C) 4 ; (D) 6 。
39. 下列有关分子轨道理论和杂化轨道理论的叙述中,正确的是()。
(A)分子轨道理论的基础是量子力学,杂化 轨道理论则与量子力学无关;(B) 分子轨道理论认为分子中的电子属于整个分子,杂化轨道理论则认为成键电子仅在成键轨道中运动;(C) 分子轨道理论要求有原子轨道叠加,杂化轨道理论则无此要求;(D) 分子轨道理论可解释分子的键型,杂化轨道理论则不能解释。
40. 对于一个反键分子轨道,下列叙述中正确的是()。
(A)它不能有电子占有;(B)它的能级比所在分子中所有成键分子轨道的能级都高;(C)它的能级比相应的原子轨道能级高;(D)有电子进入反键轨道就不能形成有一定稳定性的分子。
41. 氧 原子具有顺磁性可归 因 于()。
(A)沸点极低;(B)与铁易化合;(C)有三电子?键; (D) 键级为2。
42.下列同核双原子分子具 有顺磁性的是()。
(A) B 2; (B) C2; (C) N 2; (D) F 2。
43. 按照分子轨道理论,N +中电子占有的能量最高的轨道是()。
2(A) ? 2p ; (B) ?2p * ; (C) ? 2p ;(D) ? 2p * 。
44. C 2-的分子轨道排布式正确的是()。
(A)KK (? 2s )2 (? 2s * ) 2 (? 2 p )4(? 2*) 1; (B) KK (? 2s ) 2 (? 2s * ) 2(? 2p ) 4(? 2 ) 1;pp(C) KK(?2s )2 (? 2s *) 2 (? 2 ) 4(? 2 * )1; (D) KK (? 2s ) 2 (? 2s * ) 2(? 2 p ) 2(? 2 p ) 3。
pp45. 根据分子轨道理论,下列分子或离子不可能存在的是(〕。
(A) B2;(B) He2 +;(C) Be 2;(D) O22+。
46.下列各组 (A) O 2、Li分 子 均2; (B) C为第二周期元2、 N 2;(C) B素的同核双原子分子,其中都2、O 2; (D) C 2、 F 2。
有未成对电子的是()。
47. 表征分子极性的参数是()。
(A) 键 长; (B)键 角; (C) 组成分子的各元素的电负性; (D) 偶极矩。
48. 已 知 CO 2 的 偶 极矩为零,对于CO 2 分子的下列叙述中错误的是( )。
(A) CO 2 中 存 在极性共价 键; (B) CO 2 是结构对称的直线形分子; (C) CO 2 中 仅 有非极性共价 键;(D) CO 2 是非极性分子。
