口服固体制剂多品种共线生产评估2
固体制剂车间多品种共线风险评估报告才

固体制剂车间多品种共线风险评估报告编号:1.概述固体制剂车间G1生产线和G2生产线于2013年10月建成,分别用于中药和西药的生产,其中G1生产线用于丸剂和中药片剂的生产,G2生产线用于胶囊剂和西药片剂的生产,目前只对三个剂型的6个品种进行共线风险评估(增加品种后再进行多品种共线生产的风险评估评估)。
厂房、设施、生产设备根据所生产药品特性、工艺流程及相应洁净度级别要求合理设计;配套了相应的GMP文件软件系统;具备了防止污染与交叉污染的措施。
对生产线的各个关键操作环节进行同步监控。
通过对拟认证的三黄片、氯芬黄敏片、通便灵胶囊、大山楂丸、舒肝健胃丸、麦味地黄丸6个品种的公用设施、设备生产产品的药理、毒理、适应症、处方成分的分析;厂房设施、设备清洁(清洁方法和残留水平)、防止混淆(物料、产品)人为差错(工艺不一同使用的模具、筛网不同等)等项目进行评估,以此确定多品种公用设备的可行性。
1.1 共线产品特性信息1.1.1 G1生产线共线生产品种信息1.2 共线产品的预定用途信息1.2.1 G1生产线共线产品的预定用途信息1.3共线产品工艺步骤信息1.3.1 G1生产线共线产品共用设备信息:★表示产品生产使用设备精选精选1.3.2G2 生产线共线产品工艺步骤信息精选精选精选精选2.风险评估小组及职责2.1风险评估小组2.2职责3.风险评估标准本次质量风险评估使用失败模式影响分析(FMEA)工具,识别潜在的失败模式,对风险的严重程度、发生几率和发现的可能性评分,采用5分制原则进行评估。
3.1失败发生的严重程度(S)3.2失败发生的几率(O)3.3损害发现的可能性(D)3.4风险评价准则:风险优先级( RPN=S×O×D )4.风险评估:识别、分析和评价潜在的风险本项工作计划开始时间 **年**月**日计划完成时间 **年**月**日确定可能的失败模式范围,列出每一个失败模式的潜在结果,对每一个失败模式给出严重性(S)分数。
【风险管理】多品种共线生产风险评估报告-固体
8
铝塑包装机
不锈钢
9
不锈钢
共线生产的全部品种规格均为普通药品,彼此间不存在相互反应或配伍禁忌;
共线车间具备了防止污染和交叉污染的措施,包括有完善的防止差错、防止污染和交叉污染的软件体系;
生产操作人员和管理人员都具备相应的技术经验和技能,经过培训合格上岗。
二、风险评估标准
风险系数
分数
水平
定义
严重性
确定
基本确定,每次均会发生。
7
极高
必然的问题,几乎每次都发生。
5
高
反复出现的问题,通常会发生。
3
中
偶尔出现的问题,有时会发生。
1
低
不太可能出现的问题,或很少发生。
检测度
(D)
5
不可能
不可能检测到。
4
极低
问题总是检测不到,没有可行的检测手段,可认为是无法检测到的。
3
低
问题有时能被检测到,但是更倾向于检测不到。
高
不可接受,或需要整改
纯化水
经过验证符合生产要求
低
可接受风险
消毒剂
经过验证符合生产要求
低
可接受风险
丝光毛巾
经过验证符合生产要求
低
可接受风险
清洁用手套
经过验证符合生产要求
低
可接受风险
法
相应管理及操作文件
针对各岗位,已制定了相关岗位操作规程、设备使用操作文件、清洁操作文件、维护保养操作等文件,文件下发前对从事本岗位的人员都进行了培训。
一、概述
公司生产的口服固体制剂品种有***品种共****个规格,配备了先进的符合最新GMP要求的生产设备,配套了完善的GMP文件软件系统,对生产线的各个关键操作环节进行同步监控。
口服液体制剂多品种共线生产风险评估报告

口服液体制剂车间多品种共线生产风险评估报告1 概述:本公司的口服液体制剂包括糖浆剂、煎膏剂、酊剂三个剂型共12个品种。
根据生产任务的不同,每个生产工序配备了符合GMP要求的生产设备。
配料有2 套生产设施、设备,灌装机2台,内外包装线有2条生产线。
其中酊剂有独立的一套配料、灌装、灯检、内外包装线;煎膏剂与糖浆剂共用一套配料、灌装、内外包装线。
3个剂型产品共用厂房有称量间、洁净走道及中间站、洁具清洗存放间、人流、物流通道;生产设施有纯化水系统、压缩空气、空调净化系统等设施。
每台(套)设备产品批量生产计划完成以后,才转而生产另一种产品。
口服液体制剂车间常年生产3个品种,工艺成熟,质量稳定,不存在相互反应及配伍禁忌。
2 目的:对口服液体制剂车间多品种共线生产进行风险评估,通过风险识别、风险评估及风险控制,制定纠正和预防措施,从而降低或避免这些潜在风险在执行过程中可能造成的危害,并持续地改进风险降低措施,保证产品质量,避免交叉污染。
3 范围:口服液体制剂车间多品种共线生产。
4 引用资料4.1 《药品生产质量管理规范》(2010版)4.2 公司制定的《质量风险管理规程》。
5 成立风险评估管理小组:风险评估前,公司质量管理部、工程部及口服液体制剂车间管理人员及岗位主要人员共同组建成立“口服液体制剂车间多品种共线风险评估管理小组”。
由质量保证部担任组长、口服液体制剂车间主任担任副组长,正式启动风险管理程序。
风险评估小组成员6 风险分析活动流程:6.1活动流程图6.2 现状调查:收集口服液体制剂多品种共线的相关信息,包括生产品种简介、厂房及设备布局、设备基本信息、岗位关键工艺控制项目及监控参数,各岗位人员配备及资质情况等。
6.3 风险识别:根据口服液体制剂生产线多品种共线实际情况,从人、机、物、法、环五个方面分析,分析多品种共线程序可能出现的失效模式,同时对每一项进行分析编号。
6.4 风险分析:针对潜在的失效模式进行分析,通过失效的潜在后果、失效的潜在因素、现阶段减轻风险的措施进行分析,对严重程度、发生可能性、可检测性进行评分,计算其RPN 值。
GMP制剂车间多品种共用风险评估报告

编号:GMPJL023版本:第2版×××制药有限公司综合制剂车间厂房、设施及设备多品种共用风险评估报告(二〇二〇年度)二〇二〇年十一月二十六日发布二〇二〇年十一月二十六日实施×××制药有限公司质量部组织起草实施×××制药有限公司质量受权人批准风险评估组织与实施该风险评估工作由技术质量部负责组织,生产部、动力设备部及QC检验室有关人员参与实施。
风险评估小组成员报告起草报告审核报告批准目录1主题内容与适用范围 (4)2相关文件 (4)3术语和定义 (4)3.1质量风险管理 (4)3.2风险评估 (4)3.3风险 (4)3.4可能性 (4)3.5可测定性 (4)3.6严重性 (4)3.7产品生命周期 (5)4目标和原则 (5)5概述 (5)6风险分析方法与评估内容 (6)6.1风险评估工具 (6)6.2风险评估 (9)7风险分析评估报告附件 (19)综合制剂车间厂房、设施及设备多品种共用风险评估报告1主题内容与适用范围本报告通过对公司综合制剂车间厂房、设施和设备多品种共线生产的安全性进行风险分析、沟通和控制,降低高风险点至可接受范围。
本报告适用于公司综合制剂车间厂房、设施和设备的风险控制管理。
有关激素类药品生产的风险评估见《关于激素类药品生产的风险评估报告》。
2相关文件《药品生产质量管理规范(2010版)》《质量风险管理程序》QM/BJH13-0023术语和定义3.1质量风险管理是对药品整个生命周期进行质量风险的识别、评估、控制、沟通、回顾的系统过程,运用时可采用前瞻或回顾的方式。
3.2风险评估使用定量或定性测量工具将估计的风险与给定的风险标准进行比较以确定风险的严重性。
3.3风险危害出现的可能性和严重性的组合(Risk。
R)。
3.4可能性有害事件发生的频率或可能性(Probability of Occurrence,P)。
多产品共线生产质量风险评估

多产品共线生产质量风险评估1.前言我公司固体制剂生产车间,根据国家药品生产质量管理规范(2010版)及可生产品种特性、工艺流程及相应法律制度级别要求,对厂房、生产设施盒设备进行了合理设计选型和布局,设计多品种多规格共线生产,依据2010版GMP第四十六条(为降低污染和交叉污染的风险,厂房、生产设施和设备应当根据所生产药品的特性、工艺流程及相应洁净度级别要求合理设计、布局和使用,并符合要求)规定,本着对生产安全和有效性进行风险评估,以期对其生产安全风险能正确认识并采取降低安全风险意见的控制措施,使生产质量及风险降低到可以接受的水平。
2.风险评估的目的2.1评估厂房、生产设施和设备多产品共用的可行性。
2.2提出降低预防污染与交叉污染措施设施过程中可能发生质量风险的措施。
2.3根据风险评估的结果确定验证活动的范围和深度。
3.范围4.评估流程4.1列出公司在共线生产采取的防止污染与交叉污染、防止混淆与差错的措施;4.2对各项措施进行风险等级评估:本次进行风险评估所用的方法遵循FEMA技术(失效模式与影响分析);4.3提出预防质量风险发生的措施,以及根据风险评估的结果确定的验证活动范围及深度。
5.风险分级6.共线产品信息序号药品名称剂型规格备注7.共线的可行性7.1共线生产的全部个品种规格均不是特殊性质的药品,如高致敏性药品(如青霉素类)或生物制品(如卡介苗或其他用活性微生物制备而成的药品)或(β-内酰胺结构类药品、性激素类避孕药品,或某些激素类、细胞类毒素、高活性化学药品);7.2共线车间具备了防止污染和交叉污染的措施,包括:7.2.1车间各生产工序在生产结束、更换品种、规格或批号前,应彻底清理及检查生产场所,每次设备检修或房间清场失效后也应清场,操作间内无前次产品的遗留物,设备无油垢。
7.2.2顶面、地面、回风口、水池、地漏、操作台、容器架,洁具架。
消防栓外表,中间控制所用仪器仪表等无积灰。
7.2.3使用的工具、容器、衡器清洁无异物,无前次产品的遗留物。
口服固体制剂多品种共线生产评估2

编号:FX—GX-002固体制剂车间多品种共线生产风险评估报告上海XX药业有限公司一、概述固体制剂车间G1生产线和G2生产线于2014年10月建成,厂房、设施、生产设备根据所生产药品特性、工艺流程及相应洁净度级别要求合理设计;配套了相应的GMP文件软件系统;具备了防止污染与交叉污染的措施.对生产线的各个关键操作环节进行同步监控。
公司生产的口服固体制剂拥有批准文号的产品共15个品种、18个规格,一个医院制剂品种;剂型包括片剂、颗粒剂.其中化学药品制剂为10个品种、12个规格,中药制剂5个品种、6个规格,一个医院制剂为中药制剂(颗粒剂),通过对15个品种的公用设施、设备生产产品的药理、毒理、适应症、处方成分的分析;厂房设施、设备清洁(清洁方法和残留水平)、防止混淆(物料、产品)人为差错(工艺不一同使用的模具、筛网不同等)等项目进行评估1。
1 共线产品特性信息1.1。
1 共线产品的预定用途信息及分析分析:从以上预定用途看,除亚叶酸钙与复方磺胺甲噁唑中的叶酸拮抗剂可能会存在服用后体内的相互作用,虽无文献说明微量残留体内相互作用,为安全起见,该两个产品确定不共线生产,分别在一、二车间生产。
氨酚伪麻片(I)与去痛片中的苯巴比妥有相互作用,为安全起见,该两个产品确定不共线生产,分别在一、二车间生产;其他各产品给药途径一致,无配伍禁忌和体内相互拮抗作用,在确定残留符合一定限度下(限度按世界卫生组织的有关规定,在产品清洁验证中对残留进行验证)可共线生产。
1。
1。
2共线产品各产品种类,主要有效成分及溶解性列表及分析分析:从产品活性成分,除复方磺胺甲噁唑片、去痛片、乙酰螺旋霉素片、三黄片水溶解性极差外,其他可溶解,共线生产清洁验证对不溶性成分就行残留测定,评估无影响方可共线生产.分析小结:以上16个品种规格均不是特殊性质的药品,如高致敏性药品(如青霉素类)或生物制品(如卡介苗或其他用活性微生物制备而成的药品)或β—内酰胺结构类药品、性激素类避孕药品,或某些激素类、细胞毒性类、高活性化学药品;除亚叶酸钙片与复方磺胺甲噁唑可能存在体内相互作用外,都无配伍禁忌和相互作用,中药产品不存在十八畏,十八反药材,故除亚叶酸钙片与复方磺胺甲恶唑片分线生产外,其他产品从药品的预定用途,特性等方面可共线生产,其风险可接受。
固体制剂车间多品种共线生产风险评估分析报告

固体制剂车间多品种共线生产风险评估分析报告固体制剂车间多品种共线生产是指在同一个车间生产多个不同种类的固体制剂产品,这种生产方式具有一定的经济效益,能够提高车间的生产效率和利用率。
然而,与此同时,也存在一定的风险和挑战。
本报告将对固体制剂车间多品种共线生产的风险进行评估和分析。
一、生产计划调度风险:固体制剂车间多品种共线生产需要进行精细的生产计划调度,确保各个产品之间的交替生产能够顺利进行。
如果生产计划调度不合理或者规划不准确,容易导致生产过程中的物料交叉污染、生产线停机、产能利用率低等问题。
二、质量控制风险:不同品种的固体制剂产品具有不同的配方和生产工艺要求,对原料的质量控制和生产过程的监控要求较高。
如果质量控制不到位,容易导致产品的质量不稳定,甚至出现质量偏差和问题药品。
三、设备兼容性风险:固体制剂车间多品种共线生产需要合理配置设备和设施,确保设备的兼容性和适应性。
如果设备不兼容或者不能满足生产多品种的要求,容易导致设备故障、停机时间长、生产效率低等问题。
四、人员操作风险:固体制剂车间多品种共线生产需要员工具备一定的技能和经验,能够熟练操作各种设备和生产工艺。
如果人员操作不规范或者不到位,容易导致操作失误、产品质量问题和安全事故。
五、库存管理风险:固体制剂车间多品种共线生产涉及多个产品的原料采购和库存管理,需要合理规划和管理原料的采购、储存和使用。
如果库存管理不到位,容易导致原料过期、浪费和不合格原料的使用。
针对以上风险,可以采取以下措施进行风险的防控和管理:一、建立科学合理的生产计划调度系统,确保生产计划的准确性和及时性,避免生产过程中的交叉污染和生产线停机。
二、建立严格的质量控制体系,加强对原料的质量检验和生产过程的监控,确保产品质量的稳定性和可靠性。
三、选择适合多品种共线生产的设备和设施,确保设备的兼容性和适应性,减少设备故障和停机时间。
四、进行员工技能培训和素质提升,提高员工的操作技能和安全意识,减少人员操作失误和安全事故的发生。
新版GMP口服固体制剂多品种共线生产风险评估报告
编号:固体制剂车间多品种共线生产风险评估报告起草部门及职务责任人签名起草日期审核部门及职务责任人签名审核日期批准人责任人签名批准日期******药业股份有限公司一、概述公司生产的口服固体制剂品种有***品种共****个规格,配备了先进的符合最新GMP要求的生产设备,配套了完善的GMP文件软件系统,对生产线的各个关键操作环节进行同步监控。
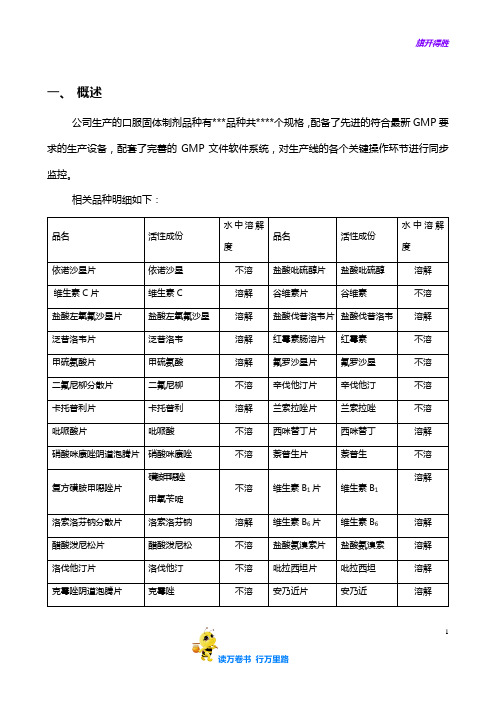
相关品种明细如下:品名活性成份水中溶解度品名活性成份水中溶解度依诺沙星片依诺沙星不溶盐酸吡硫醇片盐酸吡硫醇溶解维生素C片维生素C 溶解谷维素片谷维素不溶盐酸左氧氟沙星片盐酸左氧氟沙星溶解盐酸伐昔洛韦片盐酸伐昔洛韦溶解泛昔洛韦片泛昔洛韦溶解红霉素肠溶片红霉素不溶甲硫氨酸片甲硫氨酸溶解氟罗沙星片氟罗沙星不溶二氟尼柳分散片二氟尼柳不溶辛伐他汀片辛伐他汀不溶卡托普利片卡托普利溶解兰索拉唑片兰索拉唑不溶吡哌酸片吡哌酸不溶西咪替丁片西咪替丁溶解硝酸咪康唑阴道泡腾片硝酸咪康唑不溶萘普生片萘普生不溶复方磺胺甲噁唑片磺胺甲噁唑甲氧苄啶不溶维生素B1片维生素B1溶解洛索洛芬钠分散片洛索洛芬钠溶解维生素B6片维生素B6溶解醋酸泼尼松片醋酸泼尼松不溶盐酸氨溴索片盐酸氨溴索溶解洛伐他汀片洛伐他汀不溶吡拉西坦片吡拉西坦溶解克霉唑阴道泡腾片克霉唑不溶安乃近片安乃近溶解泮托拉唑钠肠溶片泮托拉唑钠溶解阿昔洛韦片阿昔洛韦不溶盐酸索他洛尔片盐酸索他洛尔溶解巴洛沙星片巴洛沙星不溶具体的设备明细如下:序号设备名称型号规格材质设备编号生产厂家1 粉碎机不锈钢2 振动粉筛机不锈钢3 摇摆式颗粒机不锈钢4 高速混合制粒机不锈钢5 三维运动混合机不锈钢6 旋转式压片机不锈钢7 高效包衣锅不锈钢8 铝塑包装机不锈钢9 不锈钢共线生产的全部品种规格均为普通药品,彼此间不存在相互反应或配伍禁忌;共线车间具备了防止污染和交叉污染的措施,包括有完善的防止差错、防止污染和交叉污染的软件体系;生产操作人员和管理人员都具备相应的技术经验和技能,经过培训合格上岗。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
编号:FX-GX-002固体制剂车间多品种共线生产风险评估报告上海XX药业有限公司一、概述固体制剂车间G1生产线和G2生产线于2014年10月建成,厂房、设施、生产设备根据所生产药品特性、工艺流程及相应洁净度级别要求合理设计;配套了相应的GMP文件软件系统;具备了防止污染与交叉污染的措施。
对生产线的各个关键操作环节进行同步监控。
公司生产的口服固体制剂拥有批准文号的产品共15个品种、18个规格,一个医院制剂品种;剂型包括片剂、颗粒剂。
其中化学药品制剂为10个品种、12个规格,中药制剂5个品种、6个规格,一个医院制剂为中药制剂(颗粒剂),通过对15个品种的公用设施、设备生产产品的药理、毒理、适应症、处方成分的分析;厂房设施、设备清洁(清洁方法和残留水平)、防止混淆(物料、产品)人为差错(工艺不一同使用的模具、筛网不同等)等项目进行评估1.1 共线产品特性信息1.1.1 共线产品的预定用途信息及分析分析:从以上预定用途看,除亚叶酸钙与复方磺胺甲噁唑中的叶酸拮抗剂可能会存在服用后体内的相互作用,虽无文献说明微量残留体内相互作用,为安全起见,该两个产品确定不共线生产,分别在一、二车间生产。
氨酚伪麻片(I)与去痛片中的苯巴比妥有相互作用,为安全起见,该两个产品确定不共线生产,分别在一、二车间生产;其他各产品给药途径一致,无配伍禁忌和体内相互拮抗作用,在确定残留符合一定限度下(限度按世界卫生组织的有关规定,在产品清洁验证中对残留进行验证)可共线生产。
1.1.2共线产品各产品种类,主要有效成分及溶解性列表及分析分析:从产品活性成分,除复方磺胺甲噁唑片、去痛片、乙酰螺旋霉素片、三黄片水溶解性极差外,其他可溶解,共线生产清洁验证对不溶性成分就行残留测定,评估无影响方可共线生产。
分析小结:以上16个品种规格均不是特殊性质的药品,如高致敏性药品(如青霉素类)或生物制品(如卡介苗或其他用活性微生物制备而成的药品)或β-内酰胺结构类药品、性激素类避孕药品,或某些激素类、细胞毒性类、高活性化学药品;除亚叶酸钙片与复方磺胺甲噁唑可能存在体内相互作用外,都无配伍禁忌和相互作用,中药产品不存在十八畏,十八反药材,故除亚叶酸钙片与复方磺胺甲恶唑片分线生产外,其他产品从药品的预定用途,特性等方面可共线生产,其风险可接受。
1.2设施设备、生产工艺步骤信息及分析1.2.1公司厂房、公用设施、设备及防污染与交叉污染情况说明本公司制剂生产厂房—综合车间,车间为封闭式厂房,室内墙和吊顶采用表面光滑、易清洗的彩钢板防火材料,内设的两条生产线,分别为口服固体制剂一车间和口服固体制剂二车间,所有产品均为口服固体制剂。
空调系统两条生产线,共有6条HVAC系统,相互独立的送风系统初、中效过滤器采用联袋式无纺布过滤袋。
回风与进风混合开初效前,用止回阀防止新风倒灌,在空调箱中,新风和回风一起经初级过滤后,经温湿度调节,最后经中效过滤后,由风管送至每个房间独立的高效送风口,为生产区提供净化空气。
产尘大的操作间单独排放。
新风风口位于综合车间南侧,排风位于厂房西侧,中效过滤排放;各生产线、空调系统互不干扰。
纯化水系统采用一级反渗透+二级反渗透,产水量为2吨/小时。
原水经砂滤、活性炭过滤、保安过滤、一级反渗透、二级反渗透后进入贮罐。
贮罐中的纯化水再经紫外灯消毒后送入循环管道,循环管道分别分为制剂支路、中药提取支路。
贮罐和循环管道均采用内壁抛光的304不锈钢,贮罐的通气口安装0.22μm的疏水性除菌滤器。
纯化水储罐和输送管道定期用臭氧消毒,炭滤器定期用巴氏消毒。
压缩空气为采用:空气→螺杆空压机→储气罐→油水分离器→冷干机→常规保护过滤器→精密过滤器→各压缩空气使用岗位→0.22聚四氟过滤→使用点。
进入洁净车间的管道采用304不锈钢。
车间工艺流程布局基本合理,人流、物流分开,生产工序按工艺要求划分为一般生产区、十万级洁净区各自有相应的更衣室、卫生通道、缓冲区。
为了防止药品的交叉污染和混淆,车间每一操作间及生产用设备、容器均有能够指明正在生产的产品或物料的名称、批号及数量等的状态标志。
生产用的设备、容器、用具等用后均立即按规定进行清洁。
各生产操作严格依照公司管理规定和岗位操作法执行,有防止物料混淆、交叉污染的检查和措施。
车间生产采用的是阶段性生产,一个品种生产结束清场合格后才生产另外的品种,避免了混淆的发生。
车间按生产区域环境、个人、设备工具、物料的卫生要求,建立有清洁卫生制度及清洁规程,定期检查并记录。
质量管理部派专职QA到车间代表质量管理部行使质量监督管理的职权,对药品生产的全过程实行质量监控,各工序对进入工序的原辅料、进入下道工序的中间产品、半成品进行质量监督,管理监督层次清晰,能够保证生产产品质量。
品、半成品进行质量监督,管理监督层次清晰,能够保证生产产品质量。
分析:厂房,空调净化系统,纯化水循环分配,压缩空气分配以及车间人流,物流,标识标记,质量监督,清场制度,卫生管理等对多品种共线生产带来的风险可接受,无相互污染的风险。
1.2.2具体的设备明细如下分析:以上设备全部制定清洁标准操作规范,关键设备(与药物直接接触的设备)需进行清洁验证,保证设备能有效清洁才可共线使用。
1.2.3拟共线产品共同使用设备信息1.2.3.1,口服固体制剂一车间够用设备信息及分析分析:(1)一车间拟共线生产品种中主要为化学药片剂产品,存在大量共用设备,尤其是制粒、整粒、混合、压片设备,为了降低风险,每引入一个共线品种,必须进行清洁验证,并进行残留限度测定,确保上批活性物质残留量在安全限度之下。
(2)对难清洁的烘盘垫布,布质过渡袋,过滤袋,专品专用方可共线生产。
1.2.3.1,口服固体制剂二车间够用设备信息及分析分析:(1)二车间拟共线生产品种中除亚叶酸钙片、去痛片外主要为中药片剂产品,存在大量共用设备,尤其是制粒、整粒、混合、压片设备,为了降低风险,每引入一个共线品种,必须进行清洁验证,并进行残留限度测定,确保上批活性物质残留量在安全限度之下。
(2)中药产品清洁验证需要进行对有效成分进行分析,挑选活性大,难清洁,测定稳定的成分进行残留分析后,确保安全。
(3)对难清洁的烘盘垫布,布质过渡袋,过滤袋,专品专用方可共线生产。
1.2.4共线产品工艺步骤信息 1.2.4.1片剂生产工艺流程图说明: 阴影框内环境区域D 级洁净区。
分析:片剂生产工艺药品及直接接触内包材料暴露环境都为D级洁净区,其工艺流程基本相同,其洁净区共线生产能够满足工艺要求。
1.2.4.2颗粒剂生产工艺流程图说明:阴影框内环境区域D级洁净区。
分析:颗粒剂生产工艺药品及直接接触内包材料暴露环境都为D级洁净区,其工艺流程基本相同,其洁净区共线生产能够满足工艺要求。
二、风险评估标准风险等级评估方法(FMEA)说明进行风险评估所用的方法遵循FMEA 技术(失效模式与影响分析),它包括以下几点:2.1 风险确认:可能影响产品质量、产量、工艺操作或数据完整性的风险。
2.2 风险判定:包括评估先前确认风险的后果,其基础建立在严重程度、可能性及可检测性上。
2.3 风险评估标准RPN:总风险=S×P×D三、评估风险点确定3.1风险分析根据产品生产工艺,我们对车间生产可能出现的导致产品质量风险进行分析,认为多品种共线产品引起的交叉污染主要存在可以从以下几个方面分析:1、多品种共用生产厂房情况:厂房从设计上易于清洁、维护、保养;符合药品生产要求2、工艺布局、人流、物流情况:工艺布局设计合理;人流、物流分开,各操作区域能得到有效控制。
3、共用设备清洁不彻底,及清洁的有效性:①粉碎机、振荡筛:单独原料或辅料进行粉碎,物料标识清楚,清场后方可进行下个产品操作,收集袋单品专用,不存在混淆风险,但因清洁不彻底风险较大。
②:称量:分别按指令称量原辅料。
在称量过程可能存在交叉污染的风险③混合制粒:不同产品共用设备,因清洁不彻底风险较大。
其最难清洁的筛网采用专品专用。
④干燥整粒总混:不同产品共用设备,因清洁不彻底风险较大。
干燥用垫布、过滤袋采用专品专用。
⑤压片:压片冲模专品专用,料斗、轨道、专盘产品共用,因清洁不彻底风险较大。
⑥包衣:贮液桶、管路、喷浆产品共用,但为包衣材料,无活性物质,风险较小,包衣用锅体、出料口等因清洁不彻底风险较大。
⑦内包:铝塑包装机虽全部用于包衣片铝塑,活性物质包裹在包衣材料里,但存在碎片,破片,因清洁不彻底也风险较大。
⑧颗粒包装:不同产品共用设备,因清洁不彻底风险较大。
⑨包装:包装生产线能有效隔离,QA清场检查,产生混淆的风险可以接受。
4、物料暴露状态:从物料在贮存、使用、加工过程中产尘大的房间保持相对负压,其洁净空气只送不回,单独排放,物料暴露可能产生污染与交叉污染的风险较小。
四、风险评估及整改措施1 / 11 / 11 / 11 / 11 / 1口服固体制剂多品种共线生产评估2五、结论我公司共线生产的全部品种规格均为普通药品,彼此间不存在相互反应、配伍禁忌,我公司全部产品中无中药十八畏十八反药材共线,无毒性药材;需通过清洁验证证明共线生产时上一品种活性物质残留对下批产品无危害中药产品需对共线提取进行风险评估,确定风险,控制风险共线车间具备了防止污染和交叉污染的措施,包括有完善的防止差错、防止污染和交叉污染的软件体系;生产操作人员和管理人员都具备相应的技术经验和技能,经过培训合格上岗。
通过人、机、料、法、环几方面的质量风险点排查,确定了固体制剂车间共线生产中存在的风险,对风险点进行评估并采取风险消减措施后,风险值均在可接受范围内,在验证时需对清洗工艺的清洗效果及设备的性能等项目进行验证,按照风险消减措施执行,确保风险被有效消减,验证结束后针对风险消减措施实施情况对各风险点进行再评估。
综上所述,我司口服固体制剂多品种共线生产的风险在可接受限度内。
