初中化学方程式大全(按单元)
(完整版)初中化学方程式大全列表

初中化学方程式大全列表1、镁在空气中焚烧:2Mg + O2点燃 2MgO2、铁在氧气中焚烧:3Fe + 2O2点燃 Fe3O43、铝在空气中焚烧:4Al + 3O2点燃 2Al2O34、氢气在空气中焚烧:2H2 + O2点燃 2H2O5、红磷在空气中焚烧:4P + 5O2点燃 2P2O56、硫粉在空气中焚烧:S+O2点燃 SO27、碳在氧气中充足焚烧: C + O2点燃CO28、碳在氧气中不充足焚烧:2C + O2点燃2CO9、二氧化碳经过灼热碳层: C + CO2高温2CO10 、一氧化碳在氧气中焚烧:2CO + O2点燃2CO211、二氧化碳和水反响(二氧化碳通入紫色石蕊试液):CO2 + H2O === H2CO312 、生石灰溶于水:CaO + H2O === Ca(OH)213 、无水硫酸铜作干燥剂:CuSO4 + 5H2O ==== CuSO4?5H2O14 、钠在氯气中焚烧:2Na + Cl2 点燃2NaCl分解反响15、实验室用双氧水制氧气:2H2O2 MnO2 2H2O+ O2 ↑16、加热高锰酸钾: 2KMnO4 加热 K2MnO4 + MnO2 + O2 ↑17、水在直流电的作用下分解:2H2O 通电 2H2 ↑+ O2 ↑18、碳酸不稳固而分解:H2CO3 === H2O + CO2↑19、高温煅烧石灰石(二氧化碳工业制法):CaCO3 高温 CaO + CO2 ↑置换反响20、铁和硫酸铜溶液反响: Fe + CuSO4 == FeSO4 + Cu21、锌和稀硫酸反响(实验室制氢气): Zn + H2SO4 == ZnSO4 + H2↑22、镁和稀盐酸反响:Mg+ 2HCl === MgCl2 + H2↑23、氢气复原氧化铜:H2 + CuO加热 Cu + H2O24、木炭复原氧化铜:C+ 2CuO高温 2Cu + CO2↑25、甲烷在空气中焚烧:CH4 + 2O2点燃 CO2 + 2H2O26、水蒸气经过灼热碳层:H2O+C高温 H2+CO27、焦炭复原氧化铁:3C+ 2Fe2O3高温 4Fe + 3CO2 ↑其余28、氢氧化钠溶液与硫酸铜溶液反响:2NaOH + CuSO4 == Cu(OH)2↓+ Na2SO429、甲烷在空气中焚烧:CH4 + 2O2点燃 CO2 + 2H2O30、酒精在空气中焚烧:C2H5OH + 3O2点燃 2CO2 + 3H2O31、一氧化碳复原氧化铜:CO+ CuO加热 Cu + CO232、一氧化碳复原氧化铁:3CO+ Fe2O3高温 2Fe + 3CO233、二氧化碳经过澄清石灰水(查验二氧化碳): Ca(OH)2 + CO2 ==== CaCO3↓+ H2O34、氢氧化钠和二氧化碳反响(除掉二氧化碳): 2NaOH + CO2 ==== Na2CO3 + H2O35、石灰石(或大理石)与稀盐酸反响(二氧化碳的实验室制法):CaCO3 + 2HCl === CaCl2 +H2O+CO2 ↑36、碳酸钠与浓盐酸反响(泡沫灭火器的原理) : Na2CO3 + 2HCl === 2NaCl + H2O + CO2↑一.物质与氧气的反响:(1 )单质与氧气的反响:1.镁在空气中焚烧: 2Mg + O2 点燃 2MgO2.铁在氧气中焚烧:3Fe + 2O2点燃 Fe3O43.铜在空气中受热:2Cu + O2 加热 2CuO4.铝在空气中焚烧:4Al + 3O2点燃 2Al2O35.氢气中空气中焚烧:2H2 + O2点燃 2H2O6.红磷在空气中焚烧:4P + 5O2点燃 2P2O57.硫粉在空气中焚烧:S+O2点燃 SO28.碳在氧气中充足焚烧: C + O2点燃 CO29. 碳在氧气中不充足焚烧: 2C + O2点燃 2CO(2 )化合物与氧气的反响:10.一氧化碳在氧气中焚烧:2CO + O2点燃 2CO211.甲烷在空气中焚烧:CH4 + 2O2点燃 CO2 + 2H2O12.酒精在空气中焚烧:C2H5OH + 3O2点燃 2CO2 + 3H2O二.几个分解反响:13.水在直流电的作用下分解:2H2O通电 2H2 ↑+ O2 ↑14.加热碱式碳酸铜: Cu2(OH)2CO3加热 2CuO + H2O + CO2↑15.加热氯酸钾(有少许的二氧化锰): 2KClO3 ==== 2KCl + 3O2↑16.加热高锰酸钾: 2KMnO4加热 K2MnO4 + MnO2 + O2 ↑17.碳酸不稳固而分解:H2CO3 === H2O + CO2 ↑18.高温煅烧石灰石: CaCO3 高温 CaO + CO2 ↑三.几个氧化复原反响:19.氢气复原氧化铜: H2 + CuO 加热 Cu + H2O20.木炭复原氧化铜: C+ 2CuO 高温 2Cu + CO2 ↑21.焦炭复原氧化铁: 3C+ 2Fe2O3 高温 4Fe + 3CO2 ↑22.焦炭复原四氧化三铁:2C+ Fe3O4高温 3Fe + 2CO2 ↑23.一氧化碳复原氧化铜:CO+ CuO加热 Cu + CO224.一氧化碳复原氧化铁:3CO+ Fe2O3 高温 2Fe + 3CO225.一氧化碳复原四氧化三铁:4CO+ Fe3O4高温 3Fe + 4CO2四.单质、氧化物、酸、碱、盐的互相关系(1 )金属单质 + 酸 --------盐 + 氢气(置换反响)26.锌和稀硫酸 Zn + H2SO4 = ZnSO4 + H2↑27.铁和稀硫酸 Fe + H2SO4 = FeSO4 + H2↑28.镁和稀硫酸 Mg + H2SO4 = MgSO4 + H2↑29.铝和稀硫酸 2Al +3H2SO4 = Al2(SO4)3 +3H2↑30.锌和稀盐酸 Zn + 2HCl === ZnCl2 + H2↑31.铁和稀盐酸 Fe + 2HCl === FeCl2 + H2↑32.镁和稀盐酸 Mg+ 2HCl === MgCl2 + H2↑33.铝和稀盐酸 2Al + 6HCl == 2AlCl3 + 3H2↑(2 )金属单质 + 盐(溶液) ------- 另一种金属+ 另一种盐34.铁和硫酸铜溶液反响: Fe + CuSO4 === FeSO4 + Cu35.锌和硫酸铜溶液反响: Zn + CuSO4 === ZnSO4 + Cu36.铜和硝酸汞溶液反响: Cu + Hg(NO3)2 === Cu(NO3)2 + Hg(3)碱性氧化物 +酸 -------- 盐 + 水37.氧化铁和稀盐酸反响: Fe2O3 + 6HCl === 2FeCl3 + 3H2O38.氧化铁和稀硫酸反响: Fe2O3 + 3H2SO4 === Fe2(SO4)3 + 3H2O39.氧化铜和稀盐酸反响: CuO + 2HCl ==== CuCl2 + H2O40.氧化铜和稀硫酸反响: CuO + H2SO4 ==== CuSO4 + H2O41.氧化镁和稀硫酸反响: MgO + H2SO4 ==== MgSO4 + H2O42.氧化钙和稀盐酸反响: CaO + 2HCl ==== CaCl2 + H2O(4)酸性氧化物 +碱 -------- 盐 + 水43.苛性钠裸露在空气中变质: 2NaOH + CO2 ==== Na2CO3 + H2O44.苛性钠汲取二氧化硫气体:2NaOH + SO2 ==== Na2SO3 + H2O 45.苛性钠汲取三氧化硫气体:2NaOH + SO3 ==== Na2SO4 + H2O 46.消石灰放在空气中变质:Ca(OH)2 + CO2 ==== CaCO3↓+ H2O 47. 消石灰汲取二氧化硫:Ca(OH)2 + SO2 ==== CaSO3↓+ H2O(5)酸 + 碱 -------- 盐 + 水48 .盐酸和烧碱起反响:HCl + NaOH ==== NaCl +H2O49. 盐酸和氢氧化钾反响:HCl + KOH ==== KCl +H2O50 .盐酸和氢氧化铜反响:2HCl + Cu(OH)2 ==== CuCl2 + 2H2O51.盐酸和氢氧化钙反响: 2HCl + Ca(OH)2 ==== CaCl2 + 2H2O52.盐酸和氢氧化铁反响: 3HCl + Fe(OH)3 ==== FeCl3 + 3H2O53.氢氧化铝药物治疗胃酸过多: 3HCl + Al(OH)3 ==== AlCl3 + 3H2O54.硫酸和烧碱反响: H2SO4 + 2NaOH ==== Na2SO4 + 2H2O55.硫酸和氢氧化钾反响: H2SO4 + 2KOH ==== K2SO4 + 2H2O56.硫酸和氢氧化铜反响: H2SO4 + Cu(OH)2 ==== CuSO4 + 2H2O57.硫酸和氢氧化铁反响: 3H2SO4 + 2Fe(OH)3==== Fe2(SO4)3 + 6H2O58.硝酸和烧碱反响: HNO3+ NaOH ==== NaNO3 +H2O(6)酸 + 盐 -------- 另一种酸 + 另一种盐59.大理石与稀盐酸反响: CaCO3 + 2HCl === CaCl2 + H2O + CO2↑60.碳酸钠与稀盐酸反响 : Na2CO3 + 2HCl === 2NaCl + H2O + CO2↑61.碳酸镁与稀盐酸反响 : MgCO3 + 2HCl === MgCl2 + H2O + CO2↑62.盐酸和硝酸银溶液反响: HCl + AgNO3 === AgCl ↓+ HNO363.硫酸和碳酸钠反响: Na2CO3 + H2SO4 === Na2SO4 + H2O + CO2↑64.硫酸和氯化钡溶液反响: H2SO4 + BaCl2 ==== BaSO4↓+ 2HCl(7)碱 + 盐 -------- 另一种碱 + 另一种盐65 .氢氧化钠与硫酸铜:2NaOH + CuSO4 ==== Cu(OH)2↓+ Na2SO466 .氢氧化钠与氯化铁:3NaOH + FeCl3 ==== Fe(OH)3↓+ 3NaCl67 .氢氧化钠与氯化镁:2NaOH + MgCl2 ==== Mg(OH)2↓+ 2NaCl68. 氢氧化钠与氯化铜:2NaOH + CuCl2 ==== Cu(OH)2↓+ 2NaCl69. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 === CaCO3↓+ 2NaOH(8)盐 + 盐 ----- 两种新盐70.氯化钠溶液和硝酸银溶液: NaCl + AgNO3 ==== AgCl ↓+ NaNO371.硫酸钠和氯化钡:Na2SO4 + BaCl2 ==== BaSO4↓+ 2NaCl五.其余反响:72.二氧化碳溶解于水:CO2 + H2O === H2CO373.生石灰溶于水: CaO + H2O === Ca(OH)274.氧化钠溶于水: Na2O + H2O ==== 2NaOH75.三氧化硫溶于水: SO3 + H2O ==== H2SO476.硫酸铜晶体受热分解: CuSO4?5H2O 加热 CuSO4 + 5H2O77.无水硫酸铜作干燥剂: CuSO4 + 5H2O ==== CuSO4?5H2化学方程式反响现象应用2Mg+O2 点燃或 2MgO 强烈焚烧 .刺眼白光 . 生成白色固体 .放热 . 产生大批白烟白色信号弹2Hg+O2 点燃或 2HgO 银白液体、生成红色固体拉瓦锡实验2Cu+O2 点燃或2CuO 红色金属变成黑色固体4Al+3O2 点燃或2Al2O3银白金属变成白色固体3Fe+2O2 点燃 Fe3O4强烈焚烧、火星四射、生成黑色固体、放热4Fe + 3O2 高温 2Fe2O3 C+O2点燃 CO2 强烈焚烧、白光、放热、使石灰水变污浊S+O2点燃 SO2强烈焚烧、放热、刺激味气体、空气中淡蓝色火焰.氧气中蓝紫色火焰2H2+O2点燃 2H2O淡蓝火焰、放热、生成使无水CuSO4 变蓝的液体(水)高能燃料4P+5O2点燃 2P2O5强烈焚烧、大批白烟、放热、生成白色固体证明空气中氧气含量CH4+2O2 点燃 2H2O+CO2蓝色火焰、放热、生成使石灰水变污浊气体和使无水CuSO4 变蓝的液体(水)甲烷和天然气的焚烧2C2H2+5O2 点燃 2H2O+4CO2 蓝色火焰、放热、黑烟、生成使石灰水变污浊气体和使无水CuSO4 变蓝的液体(水)氧炔焰、焊接切割金属2KClO3MnO22KCl +3O2↑生成使带火星的木条复燃的气体实验室制备氧气2KMnO4K2MnO4+MnO2+O2 ↑紫色变成黑色、生成使带火星木条复燃的气体实验室制备氧气2HgO2Hg+O2 ↑红色变成银白、生成使带火星木条复燃的气体拉瓦锡实验2H2O 通电 2H2 ↑+O2 ↑水通电分解为氢气和氧气电解水Cu2(OH)2CO32CuO+H2O+CO2 ↑绿色变黑色、试管壁有液体、使石灰水变污浊气体铜绿加热NH4HCO3 NH3 ↑+ H2O +CO2 ↑白色固体消逝、管壁有液体、使石灰水变污浊气体碳酸氢铵长久裸露空气中会消逝Zn+H2SO4=ZnSO4+H2 ↑有大批气泡产生、锌粒渐渐溶解实验室制备氢气Fe+H2SO4=FeSO4+H2 ↑有大批气泡产生、金属颗粒渐渐溶解Mg+H2SO4 =MgSO4+H2 ↑有大批气泡产生、金属颗粒渐渐溶解2Al+3H2SO4=Al2(SO4)3+3H2 ↑有大批气泡产生、金属颗粒渐渐溶解Fe2O3+3H22Fe+3H2O红色渐渐变成银白色、试管壁有液体冶炼金属、利用氢气的还原性Fe3O4+4H23Fe+4H2O黑色渐渐变成银白色、试管壁有液体冶炼金属、利用氢气的还原性WO3+3H2W +3H2O冶炼金属钨、利用氢气的复原性MoO3+3H2Mo +3H2O冶炼金属钼、利用氢气的复原性2Na+Cl2或点燃 2NaCl 强烈焚烧、黄色火焰离子化合物的形成、H2+Cl2点燃或光照 2HCl点燃苍白色火焰、瓶口白雾共价化合物的形成、制备盐酸CuSO4+2NaOH=Cu(OH)2↓+Na2SO4蓝色积淀生成、上部为澄清溶液质量守恒定律实验2C +O2 点燃 2CO 煤炉中常有反响、空气污染物之一、煤气中毒原由2C O+O2 点燃 2CO2 蓝色火焰煤气焚烧C + CuO高温 2Cu+ CO2 ↑黑色渐渐变成红色、产生使澄清石灰水变污浊的气体冶炼金属2Fe2O3+3C高温 4Fe+ 3CO2 ↑冶炼金属Fe3O4+2C高温 3Fe + 2CO2 ↑冶炼金属C+CO2高温 2COCO2 + H2O = H2CO3碳酸使石蕊变红证明碳酸的酸性H2CO3CO2 ↑+ H2O石蕊红色褪去Ca(OH)2+CO2= CaCO3↓+ H2O 澄清石灰水变污浊应用 CO2 查验和石灰浆粉刷墙壁CaCO3+H2O+CO2 = Ca(HCO3)2白色积淀渐渐溶解溶洞的形成,石头的风化Ca(HCO3)2CaCO3 ↓+H2O+CO2 ↑白色积淀、产生使澄清石灰水变污浊的气体水垢形成. 钟乳石的形成2NaHCO3Na2CO3+H2O+CO2↑产生使澄清石灰水变污浊的气体小苏打蒸馒头CaCO3高温 CaO+ CO2 ↑工业制备二氧化碳和生石灰CaCO3+2HCl=CaCl2+ H2O+CO2↑固体渐渐溶解、有使澄清石灰水变污浊的气体实验室制备二氧化碳、除水垢Na2CO3+H2SO4=Na2SO4+H2O+CO2↑固体渐渐溶解、有使澄清石灰水变污浊的气体泡沫灭火器原理Na2CO3+2HCl=2NaCl+H2O+CO2 ↑固体渐渐溶解、有使澄清石灰水变污浊的气体泡沫灭火器原理MgCO3+2HCl=MgCl2+H2O+CO2↑ 固体渐渐溶解、有使澄清石灰水变污浊的气体CuO +CO Cu + CO2黑色渐渐变红色,产生使澄清石灰水变污浊的气体冶炼金属Fe2O3+3CO高温 2Fe+3CO2冶炼金属原理Fe3O4+4CO高温 3Fe+4CO2冶炼金属原理WO3+3CO高温 W+3CO2冶炼金属原理CH3COOH+NaOH=CH3COONa+H2O2CH3OH+3O2点燃 2CO2+4H2OC2H5OH+3O2点燃 2CO2+3H2O蓝色火焰、产生使石灰水变污浊的气体、放热酒精的燃烧Fe+CuSO4=Cu+FeSO4银白色金属表面覆盖一层红色物质湿法炼铜、镀铜Mg+FeSO4= Fe+ MgSO4溶液由浅绿色变成无色Cu+Hg(NO3)2=Hg+ Cu (NO3)2Cu+2AgNO3=2Ag+ Cu(NO3)2红色金属表面覆盖一层银白色物质镀银Zn+CuSO4= Cu+ZnSO4青白色金属表面覆盖一层红色物质镀铜Fe2O3+6HCl=2FeCl3+3H2O铁锈溶解、溶液呈黄色铁器除锈Al2O3+6HCl=2AlCl3+3H2O白色固体溶解Na2O+2HCl=2NaCl+H2O白色固体溶解CuO+2HCl=CuCl2+H2O黑色固体溶解、溶液呈蓝色ZnO+2HCl=ZnCl2+ H2O白色固体溶解MgO+2HCl=MgCl2+ H2O白色固体溶解CaO+2HCl=CaCl2+ H2O白色固体溶解NaOH+HCl=NaCl+ H2O白色固体溶解Cu(OH)2+2HCl=CuCl2+2H2O蓝色固体溶解Mg(OH)2+2HCl=MgCl2+2H2O白色固体溶解Al(OH)3+3HCl=AlCl3+3H2O白色固体溶解胃舒平治疗胃酸过多Fe(OH)3+3HCl=FeCl3+3H2O红褐色积淀溶解、溶液呈黄色Ca(OH)2+2HCl=CaCl2+2H2OHCl+AgNO3= AgCl ↓+HNO3生成白色积淀、不溶解于稀硝酸查验 Cl —的原理Fe2O3+3H2SO4= Fe2(SO4)3+3H2O铁锈溶解、溶液呈黄色铁器除锈Al2O3+3H2SO4= Al2(SO4)3+3H2O白色固体溶解CuO+H2SO4=CuSO4+H2O黑色固体溶解、溶液呈蓝色ZnO+H2SO4=ZnSO4+H2O白色固体溶解MgO+H2SO4=MgSO4+H2O白色固体溶解2NaOH+H2SO4=Na2SO4+2H2OCu(OH)2+H2SO4=CuSO4+2H2O蓝色固体溶解Ca(OH)2+H2SO4=CaSO4+2H2OMg(OH)2+H2SO4=MgSO4+2H2O白色固体溶解2Al(OH)3+3H2SO4=Al2(SO4)3+3H2O白色固体溶解2Fe(OH)3+3H2SO4=Fe2(SO4)3+3H2O红褐色积淀溶解、溶液呈黄色Ba(OH)2+ H2SO4=BaSO4↓+2H2O生成白色积淀、不溶解于稀硝酸查验 SO42 —的原理BaCl2+ H2SO4=BaSO4 ↓+2HCl 生成白色积淀、不溶解于稀硝酸查验 SO42 —的原理Ba(NO3)2+H2SO4=BaSO4↓+2HNO3生成白色积淀、不溶解于稀硝酸查验 SO42 —的原理Na2O+2HNO3=2NaNO3+H2O白色固体溶解CuO+2HNO3=Cu(NO3)2+H2O黑色固体溶解、溶液呈蓝色ZnO+2HNO3=Zn(NO3)2+ H2O白色固体溶解MgO+2HNO3=Mg(NO3)2+ H2O白色固体溶解CaO+2HNO3=Ca(NO3)2+ H2O白色固体溶解NaOH+HNO3=NaNO3+ H2OCu(OH)2+2HNO3=Cu(NO3)2+2H2O蓝色固体溶解Mg(OH)2+2HNO3=Mg(NO3)2+2H2O白色固体溶解Al(OH)3+3HNO3=Al(NO3)3+3H2O白色固体溶解Ca(OH)2+2HNO3=Ca(NO3)2+2H2OFe(OH)3+3HNO3=Fe(NO3)3+3H2O红褐色积淀溶解、溶液呈黄色3NaOH + H3PO4=3H2O + Na3PO42NaOH+CO2=Na2CO3+ H2O汲取 CO、 O2、H2 中的 CO2 、2NaOH+SO2=Na2SO3+ H2O 2NaOH+SO3=Na2SO4+ H2O办理硫酸工厂的尾气(SO2 )FeCl3+3NaOH=Fe(OH)3↓+3NaCl溶液黄色褪去、有红褐色积淀生成AlCl3+3NaOH=Al(OH)3↓+3NaCl有白色积淀生成MgCl2+2NaOH = Mg(OH)2↓+2NaClCuCl2+2NaOH = Cu(OH)2↓+2NaCl溶液蓝色褪去、有蓝色积淀生成CaO+ H2O = Ca(OH)2白色块状固体变成粉末、生石灰制备石灰浆Ca(OH)2+SO2=CaSO3↓+ H2O有白色积淀生成初中一般不用Ca(OH)2+Na2CO3=CaCO3↓+2NaOH有白色积淀生成工业制烧碱、实验室制少许烧碱Ba(OH)2+Na2CO3=BaCO3↓+2NaOH有白色积淀生成Ca(OH)2+K2CO3=CaCO3↓+2KOH有白色积淀生成CuSO4+5H2O= CuSO4?H2O蓝色晶体变成白色粉末CuSO4?H2OCuSO4+5H2O白色粉末变成蓝色查验物质中能否含有水AgNO3+NaCl = AgCl ↓+Na NO3白色不溶解于稀硝酸的积淀(其余氯化物近似反响)应用于查验溶液中的氯离子BaCl2 + Na2SO4 = BaSO4↓+2NaCl白色不溶解于稀硝酸的积淀(其余硫酸盐近似反响)应用于查验硫酸根离子CaCl2+Na2CO3= CaCO3↓+2NaCl有白色积淀生成MgCl2+Ba(OH)2=BaCl2+Mg(OH)2↓有白色积淀生成CaCO3+2HCl=CaCl2+H2O+CO2↑MgCO3+2HCl= MgCl2+H2O+ CO2↑NH4NO3+NaOH=NaNO3+NH3↑+H2O生成使润湿石蕊试纸变蓝色的气体应用于查验溶液中的铵根离子NH4Cl+ KOH= KCl+NH3↑+H2O生成使润湿石蕊试纸变蓝色的气体。
初三化学方程式大全

初三化学方程式大全+Na2SO42、石灰石与盐酸反应 CaCO3 +2HCl=CaCl2+H2O+CO2↑第二单元我们周围的空气一、氧气性质3、碳在氧气中燃烧 C+O2点燃CO24、硫在氧气中燃烧 S+O2点燃SO25、红磷在空气中燃烧 4P+5O2点燃2P2O56、铁丝在氧气中燃烧 3Fe+2O2点燃Fe3O47、镁带在空气中燃烧 2Mg+O2点燃2MgO二、制取氧气:8、双氧水制氧气 2H2O2 2H2O+O2↑9、氯酸钾制氧气 2KClO3 2KCl+3O2 ↑10、高锰酸钾制取氧气 2KMnO4 Δ K2MnO4+MnO2+O2↑11、氧化汞分解 2HgO Δ 2Hg + O2↑12、电解水 2H2O通电2H2↑+O2↑第三单元自然界的水一、氢气性质13、氢气燃烧(爆炸) 2H2+O2点燃2H2O14、氢气还原氧化铜: H2+CuOΔCu+H2O氢气还可以还原Fe3O4、ZnO、WO3等金属氧化物二、氢气的实验室制法:锌粒与稀硫酸或稀盐酸反应15、锌粒与稀盐酸反应 Zn+2HCl=ZnCl2+H2↑16、锌粒与稀硫酸反应 Zn+H2SO4=ZnSO4+H2↑第五单元化学方程式17、铁与硫酸铜溶液反应Fe + CuSO4 = Cu + FeSO418、碳酸钠与盐酸反应 Na2CO3+2HCl=2NaCl+H2O + CO2↑返回目录》>化学方程式(三):反应现象及应用初中化学方程式反应现象及应用:化学实验除杂质第一,要知道除杂质的原则,除掉杂质的同时,不能生成新的杂质。
第二,要背得物质的溶解性表,这样才能很好、很快的找到形成沉淀的离子例如氢氧化钠忠混有碳酸钠,阴离子不同,而碳酸根与很多的阳离子都能形成沉淀,常用的可以是氢氧化钙。
这样,反应后就将碳酸钠除掉,生成了氢氧化钠,也不生成新的杂质。
将混合物中的几种物质分开而分别得到较纯净的物质,这种方法叫做混合物的分离。
将物质中混有的杂质除去而获得纯净物质,叫提纯或除杂。
九年级化学各单元化学方程式汇总

化学方程式是描述化学反应的符号式表示方法,可以表示反应物和生成物之间的关系。
九年级化学主要包括酸碱中和、金属与非金属的反应、氧化与还原反应、浓度溶液的配制和稀释等单元。
以下是九年级化学各单元的化学方程式汇总。
一、酸碱中和反应1.酸和碱的中和反应HCl(aq) + NaOH(aq) → NaCl(aq) + H2O(l)H2SO4(aq) + 2NaOH(aq) → Na2SO4(aq) + 2H2O(l)2.酸性氧化物和碱性氧化物的反应SO2(g) + 2NaOH(aq) → Na2SO3(aq) + H2O(l)CO2(g) + 2NaOH(aq) → Na2CO3(aq) + H2O(l)二、金属与非金属的反应1.金属与酸的反应2HCl(aq) + Zn(s) → ZnCl2(aq) + H2(g)2HNO3(aq) + 3Cu(s) → 3Cu(NO3)2(aq) + 2NO(g) + H2O(l)2.金属与非金属氧化物的反应Cu(s) + 2AgNO3(aq) → Cu(NO3)2(aq) + 2Ag(s)Ca(s) + 2H2O(l) → Ca(OH)2(aq) + H2(g)三、氧化与还原反应1.金属的氧化反应2Mg(s)+O2(g)→2MgO(s)4Al(s)+3O2(g)→2Al2O3(s)2.金属的还原反应2Ag2O(s)→4Ag(s)+O2(g)CuO(s)+H2(g)→Cu(s)+H2O(l)四、浓度溶液的配制和稀释1.溶质的质量计算C1V1=C2V22.液体体积和浓度的计算C=n/V3.溶质溶解效应的计算m1V1+m2V2=(m1+m2)V'以上几个单元的化学方程式只是其中的一部分,涵盖了九年级化学的主要内容。
通过学习这些方程式,我们可以理解化学反应的基本原理和变化过程,掌握化学方程式的书写和计算方法。
同时,需要注意的是,化学方程式在实际应用中还有很多其他的变化和反应方式,不同的实验条件和反应物也会影响方程式的形式和系数。
初中常见的化学方程式(全)

初中常见的化学方程式汇总一、化合反应: A+B →AB1. 镁在空气中燃烧: 2Mg + O 2 点燃====== 2MgO(白) (现象:2. 铁在氧气中燃烧: 3Fe + 2O 2 点燃====== Fe 3O 4(黑)3. 铝在空气中燃烧: 4Al + 3O 2 点燃====== 2Al 2O 3(白)4. 氢气中空气中燃烧: 2H 2 + O 2 点燃====== 2H 2O5. 红磷在空气中燃烧: 4P + 5O 2 点燃====== 2P 2O 5(白)6. 硫粉在空气中燃烧: S + O 2 点燃====== SO 27. 碳在氧气中充分燃烧: C + O 2 点燃====== CO 28. 碳在氧气中不充分燃烧: 2C + O 2 点燃====== 2CO9. 铜在空气中受热: 2Cu (紫红) + O 2 加热====== 2CuO(黑色)10. 一氧化碳在氧气中燃烧:2CO + O 2 点燃====== 2CO 211. 二氧化碳溶解于水: CO 2 + H 2O === H 2CO 312. 二氧化硫溶于水: SO 2 + H 2O ==== H 2SO 3(亚硫酸)13. 三氧化硫溶于水: SO 3 + H 2O ==== H 2SO 4(硫酸)14. 生石灰溶于水: CaO + H 2O ==== Ca(OH)215. 氧化钠溶于水: Na 2O + H 2O ==== 2NaOH16. 无水硫酸铜作干燥剂: CuSO 4 (白)+ 5H 2O ==== CuSO 4·5H 2O(蓝)17. 二氧化碳通过炽热的炭层:CO 2 + C 高温====== 2CO 二.几个分解反应:AB →A+B18. 水在直流电的作用下分解: 2H 2O 通电====== 2H 2↑+ O 2 ↑19. 双氧水分解: 2H 2O 2 2MnO ====== 2H 2O+ O 2 ↑20. 加热氯酸钾(有二氧化锰):2KClO 3 (白)2O M n 加热====== 2KCl(白) + 3O 2 ↑ 21. 加热高锰酸钾: 2KMnO 4 (紫黑)加热====== K 2MnO 4 + MnO 2 (黑)+ O 2↑22. 碳酸不稳定而分解: H 2CO 3 加热====== H 2O + CO 2↑23. CaCO 3 高温====== CaO + CO 2↑24. Cu(OH)2 加热====== CuO + H 2O25. 2Fe(OH)3 加热====== Fe 2O 3 + 3H 2O26. 硫酸铜晶体受热分解: CuSO 4·5H 2O 加热====== CuSO 4 + 5H 2O 三.置换反应:A+BC →AC+B(还原剂C 、H 2与金属氧化物的反应)27. 氢气还原氧化铜:H2 + CuO加热======Cu + H2O28. 氢气还原氧化铁:3H2+ Fe2O3(红)加热======2Fe(粉末、黑) + 3 H2O29. 木炭还原氧化铜:C+ 2CuO高温======2Cu + CO2↑30. 焦炭还原氧化铁:3C+ 2Fe2O3高温======4Fe + 3CO2↑31.高温32. 244233. 锌和稀盐酸反应:Zn + 2HCl === ZnCl2 + H2↑34. 铁和稀硫酸反应:Fe + H2SO4 === FeSO4(浅绿色) + H2↑(FeSO4--硫酸亚铁)35. 铁和稀盐酸反应:Fe + 2HCl === FeCl2(浅绿色) + H2↑(FeCl2--氯化亚铁)36. 镁和稀盐酸反应:Mg + 2HCl === MgCl2 + H2↑37. 镁和稀硫酸反应:Mg + H2SO4 === MgSO4 + H2↑38. 铝和稀硫酸反应:2Al + 3H2SO4 === Al2(SO4)3 + 3H2↑39. 铝和稀盐酸反应:2Al + 6HCl === 2AlCl()40. 铁和硫酸铜溶液反应:Fe + CuSO4(蓝441. 锌和硫酸铜溶液反应:Zn + CuSO4 ===== ZnSO4 + Cu42. 铜和硝酸汞溶液反应:Cu + Hg(NO3)2 === Cu(NO3)2 + Hg43. 铜和硝酸银溶液反应:Cu +2 AgNO3 ==== Cu(NO3)2 +2 Ag→(44. 233245. 氧化铁和稀硫酸反应:Fe2O3 + 3H2SO4 === Fe2(SO4)3(黄色) + 3H2O46. 氧化铜和稀盐酸反应:CuO + 2HCl ====== CuCl2 + H2O47. 氧化铜和稀硫酸反应:CuO + H2SO4 ===== CuSO4 + H2O48. 氧化镁和稀硫酸反应:MgO + H2SO4 ===== MgSO4 + H2O49.()50. 251. 盐酸和氢氧化钾反应:HCl + KOH ===== KCl +H2O52. 盐酸和氢氧化铜反应:2HCl + Cu(OH)2 ==== CuCl2 + 2H2O53. 盐酸和氢氧化钙反应:2HCl + Ca(OH)2 ==== CaCl2 + 2H2O54. 盐酸和氢氧化铁反应:3HCl + Fe(OH)3 ==== FeCl3 (黄色)+ 3H2O55. 氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3 ==== AlCl3 + 3H2O56. 硫酸和烧碱反应:H2SO4 + 2NaOH ==== Na2SO4 + 2H2O57. 硫酸和氢氧化钾反应:H2SO4 + 2KOH ===== K2SO4 + 2H2O58. 硫酸和氢氧化铜反应:H2SO4 + Cu(OH)2 ===== CuSO4 + 2H2O59. 硫酸和氢氧化铁反应:3H2SO4 + 2Fe(OH)3==== Fe2(SO4)3 + 6H2O60.()61. 322262. 碳酸钠与稀盐酸反应:2HCl +Na2CO3=== 2NaCl + H2O + CO2↑63. 碳酸镁与稀盐酸反应:2HCl +MgCO3=== MgCl2 + H2O + CO2↑64. 盐酸和硝酸银溶液反应:HCl + AgNO3 === HNO3+AgCl↓ (白色、不溶于稀硝酸)65. 硫酸和碳酸钠反应:H2SO4 +Na2CO3 === Na2SO4 + H2O + CO2↑66. 硫酸和氯化钡溶液反应:H2SO4 + BaCl2 == 2HCl+BaSO4↓ (白色、不溶于稀硝酸) (碱+盐()67. 424268. 氢氧化钠与氯化铁:3NaOH + FeCl3 ==== 3NaCl +Fe(OH)3↓(红褐色沉淀)69. 氢氧化钠与氯化镁:2NaOH + MgCl2 ==== Mg(OH)2↓(白) + 2NaCl70. 氢氧化钠与氯化铜:2NaOH + CuCl2 ==== Cu(OH)2↓(蓝)+ 2NaCl71. 氢氧化钙与碳酸钠:Ca(OH)2 + Na2CO3 === CaCO3↓(白)+ 2NaOH72. 氢氧化钠与氯化铵:NaOH + NH4Cl 微热NaCl + NH3↑ +H2O73. 氢氧化钙与氯化铵:Ca(OH)2 + 2NH4微热CaCl 2+ 2NH3↑ + 2H2O74. 氢氧化钾与硫酸铵:2KOH + (NH4)2SO微热K2SO4 + 2NH3↑ + 2H2O(()75. 3376. 硫酸钠和氯化钡:Na2SO4 + BaCl2 ==== BaSO4↓ + 2NaCl76. 碳酸钠和氯化钙:Na2CO3 + CaCl2 ==== CaCO3↓+ 2NaCl五.其它反应:77. 甲烷在空气中燃烧:CH4 + 2O2点燃======CO2 + 2H2O78. 酒精(乙醇)在空气中燃烧:C2H5OH + 3O2点燃======2CO2 + 3H2O79. 甲醇在空气中燃烧:2CH3OH + 3O2点燃======2CO2 + 4H2O80. 一氧化碳还原氧化铜:CO+ CuO加热======Cu + CO281. 一氧化碳还原氧化铁:3CO+ Fe2O3高温======2Fe + 3CO282. 一氧化碳还原四氧化三铁:4CO+ Fe3O4高温======3Fe + 4CO283. 3CO+ WO 加热2()83. 223 + H2O84. 苛性钠吸收二氧化硫气体:2NaOH + SO2 ===== Na2SO3 + H2O85. 苛性钠吸收三氧化硫气体:2NaOH + SO3 ===== Na2SO4 + H2O86. 熟石灰放在空气中变质:Ca(OH)2 + CO2 ==== CaCO3↓+ H2O87. 消石灰吸收二氧化硫:Ca(OH)2 + SO2 ==== CaSO3 + H2O。
初中化学方程式大全
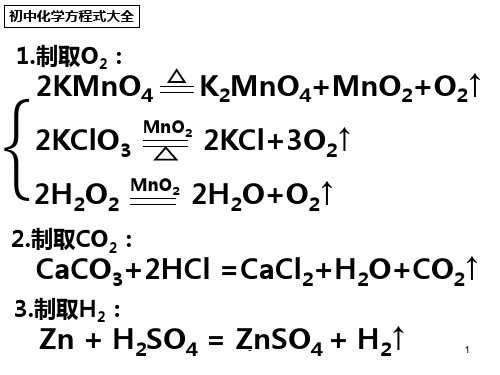
等等。。。
-
13
15、碱与铵盐反应: Ca(OH)2+2NH4Cl =CaCl2+2NH3↑+2H2O
Ca(OH)2+2NH4NO3=Ca(NO3)2+2NH3↑+2H2O
Ca(OH)2+(NH4)2SO4 =CaSO4+2NH3↑+2H2O Ca(OH)2+(NH4)2CO3 =CaCO3+2NH3↑+2H2O
7、还原反应:(C、CO、H2具有还原性)
Fe2O3+3CO 高温 2Fe +3CO2 (炼铁原理)
2Fe2O3+3C 高温 4Fe +3CO2 Fe2O3+3H2 高温 2Fe +3H2O
CuO+CO △ Cu +CO2 CuO+H2 △ Cu +H2O
2CuO+C 高温 2Cu +CO2 (两种黑色固体反
-
7
活泼金属与稀盐酸或稀硫酸的反应:
Mg+2HCl =MgCl2+H2↑
Zn+2HCl =ZnCl2+H2↑ Fe+2HCl =FeCl2+H2↑ 2Al+6HCl =2AlCl3+3H2↑ Mg+H2SO4 =MgSO4 +H2↑ Zn+H2SO4 =ZnSO4 +H2↑ Fe+H2SO4 =FeSO4 +H2↑ 2Al+3H2SO4 =Al-2(SO4)3+3H2↑ 8
-பைடு நூலகம்
10
初中化学方程式大全(按单元)

初中化学方程式一、氧气的性质:(1)单质与氧气的反应:(化合反应)1。
镁在空气中燃烧:2Mg + O2点燃2MgO2.铁在氧气中燃烧:3Fe + 2O2点燃Fe3O43.铜在空气中受热:2Cu + O22CuO4.铝在空气中燃烧:4Al + 3O2点燃2Al2O35.氢气中空气中燃烧:2H2 + O2点燃2H2O6.红磷在空气中燃烧(研究空气组成的实验):4P + 5O2点燃2P2O5 7。
硫粉在空气中燃烧:S + O2点燃SO28。
碳在氧气中充分燃烧:C + O2点燃CO2(2)化合物与氧气的反应:10。
一氧化碳在氧气中燃烧:2CO + O2点燃2CO211.甲烷在空气中燃烧:CH4 + 2O2点燃CO2 + 2H2O12.酒精在空气中燃烧:C2H5OH + 3O2点燃2CO2 + 3H2O(3)氧气的来源:13。
玻义耳研究空气的成分实验2HgO Hg+ O2 ↑14。
加热高锰酸钾:2KMnO4K2MnO4+ MnO2+ O2↑(实验制氧气)15。
过氧化氢在二氧化锰作催化剂条件下分解反应:2H2O2MnO22H2O+ O2 ↑(实验室制氧气原理2)MnO22KCl+16加热氯酸钾(二氧化锰):二、自然界中的水:17。
水在直流电作用下分解(研究水的组成实验):2H2O 通电 2H2↑+ O2 ↑18. 生石灰溶于水:CaO + H2O === Ca(OH)219. 二氧化碳可溶于水:H2O + CO2=== H2CO3三、质量守恒定律:20。
镁在空气中燃烧:2Mg + O2点燃 2MgO21。
铁和硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu22. 氢气还原氧化铜:H2 + CuO Cu + H2O四、碳和碳的氧化物:(1)碳的化学性质23。
碳在氧气中充分燃烧:C + O2点燃CO224.碳在氧气中不充分燃烧:2C + O2点燃2CO25。
木炭还原氧化铜:C+ 2CuO 高温2Cu + CO2↑26。
初中化学化学方程式总结(单元顺序)

化学方程式总结第二单元我们周围的空气1. 汞和氧气反应:2Hg+O22HgO2. 红磷燃烧:4P+5O22P2O53. 木炭燃烧:C+O2CO24. 硫粉燃烧:S+O2SO25. 铁丝在氧气中燃烧:3Fe+2O2Fe3O46. 镁条燃烧:2Mg+O22MgO7. 铝条燃烧:4Al+3O22Al2O38. 铜与氧气反应:2Cu+O22CuO9. 高锰酸钾制取氧气:2KMnO4K2MnO4+MnO2+O2↑10. 过氧化氢制取氧气:2H2O22H2O+O2↑11. 氯酸钾制取氧气:2KClO32KCl+3O2↑第三单元物质构成的奥秘1. 氯化氢气体与氨气反应:第四单元自然界的水1. 电解水:2H2O2H2↑+O2↑2. 氢气燃烧:2H2+O22H2O第五单元化学方程式1. 铁与硫酸铜反应:Fe+CuSO4==FeSO4+Cu第六单元碳与碳的氧化物1. 木炭完全燃烧:C+O2CO22. 木炭不完全燃烧:2C+O22CO3. 一氧化碳燃烧:2CO+O22CO24. 木炭与二氧化碳高温还原:C+CO22CO5. 木炭还原氧化铜:C+2CuO2Cu+CO2↑6. 木炭还原氧化铁:3C+2Fe2O34Fe+3CO2↑7. 木炭还原氧化铝:3C+2Al2O34Al+3CO2↑8. 氢气还原氧化铜:H2+CuO Cu+H2O9. 氢气还原氧化铁:Fe2O3+3H22Fe+3H2O10. 氢气还原氧化铝:Al2O3+3H22Al+3H2O11. 一氧化碳还原氧化铜:CuO + CO Cu +CO212. 一氧化碳还原氧化铁:3CO+Fe2O32Fe+3CO213. 一氧化碳还原氧化铝:3CO+Al2O32Al+3CO214. 澄清石灰石检验二氧化碳:Ca(OH)2+CO2==CaCO3↓+H2O15. 实验室制取二氧化碳:CaCO3+2HCl==CaCl2+H2O+CO2↑16. 二氧化碳使湿润的紫色石蕊纸花变红:CO2+H2O==H2CO317. 碳酸受热分解:H2CO3H2O+CO2↑第七单元燃料及其应用1. 甲烷完全燃烧:CH4+2O2CO2+2H2O2. 乙醇(酒精)完全燃烧:C2H5OH+3O22CO2+3H2O3. 水煤气的制取:H2O+C H2+CO4. 生石灰遇水放热:CaO+H2O==Ca(OH)25. 酸雨的形成:①二氧化硫与水反应:SO2+H2O==H2SO3②三氧化硫与水反应:SO3+H2O==H2SO4第八单元金属与金属材料1. 镁与盐酸反应:Mg+2HCl==MgCl2+H2↑2. 铝与盐酸反应:2Al+6HCl==2AlCl3+3H2↑3. 铁与硫酸反应:Fe+H2SO4==FeSO4+H2↑4. 锌与硫酸反应:Zn+H2SO4==ZnSO4+H2↑5. 氧化铜与硫酸反应:CuO+H2SO4==CuSO4+H2O6. 氧化铝与硫酸反应:Al2O3+3H2SO4==Al2(SO4)3+3H2O7. 氧化铁与盐酸反应:Fe2O3+6HCl==2FeCl3+3H2O8. 四氧化三铁与盐酸反应:Fe3O4+8HCl==2FeCl3 + FeCl2 +4H2O9. 铁与硫酸铜溶液反应:Fe+CuSO4==FeSO4+Cu10. 铜与硝酸银溶液反应:Cu+2AgNO3==2Ag+Cu(NO3)211. 铁粉与氯化铁溶液反应(化合反应):Fe + 2FeCl3 == 3FeCl212. 铜粉与氯化铁溶液反应:Cu + 2FeCl3 == CuCl2 + 2FeCl213. 氢气还原氧化亚铁:H2+FeO Fe+H2O14. 一氧化碳还原四氧化三铁:4CO+Fe3O43Fe+4CO2第九单元溶液略第十单元酸与碱1. 盐酸与氢氧化钠溶液反应:NaOH+ HCl == NaCl+H2O2. 硫酸与氢氧化钡溶液反应:Ba(OH)2+H2SO4==BaSO4↓+2H2O3. 硝酸与氢氧化钙溶液反应:Ca(OH)2+2HNO3==Ca(NO3)2+2H2O4. 石灰石与稀盐酸反应制取二氧化碳:CaCO3+2HCl==CaCl2+H2O+CO2↑5. 纯碱与稀硫酸反应:Na2CO3+H2SO4==Na2SO4+H2O+CO2↑6. 碳酸钡沉淀溶解于稀硝酸:BaCO3+2HNO3==Ba(NO3)2+H2O+CO2↑7. 氢氧化钠吸收二氧化碳:2NaOH+CO2==Na2CO3+H2O8. 氢氧化钠吸收二氧化硫:2NaOH+SO2==Na2SO3+H2O9. 氢氧化钠吸收三氧化硫:2NaOH+SO3==Na2SO4+H2O9. 石灰乳与二氧化碳反应:Ca(OH)2+CO2==CaCO3↓+H2O10. 氢氧化钠溶液与氯化铜溶液反应:2NaOH+CuCl2==Cu(OH)2↓+2NaCl11. 氢氧化钡与硫酸亚铁溶液反应:Ba(OH)2+FeSO4==Fe(OH)2↓+BaSO4↓12. 氢氧化钾溶液与硝酸铁溶液反应:3KOH+Fe(NO3)3==Fe(OH)3↓+3KNO313. 碳酸钠溶液不断通二氧化碳析出晶体:Na2CO3+H2O+CO2==2NaHCO314. 碳酸氢钠受热分解:2NaHCO3Na2CO3+H2O+CO2↑15. 碳酸钠溶液与盐酸反应:Na2CO3+2HCl==2NaCl+H2O+CO2↑15. 碳酸钠溶液与熟石灰反应:Na2CO3+Ca(OH)2==CaCO3↓+2NaOH16. 碳酸氢钠溶液与盐酸反应:NaHCO3 + HCl== NaCl + H2O + CO2↑17. 生理盐水与硝酸银溶液反应:NaCl+AgNO3==AgCl ↓+ NaNO318. 工业上制取二氧化碳:CaCO3CaO+CO2↑19. 氨气与水反应:NH3+H2O==NH3·H2O20. 氨水受热分解:NH3·H2O NH3↑+H2O21. 氯化铵加熟石灰研磨:2NH4Cl+Ca(OH)2==CaCl2+2H2O+2NH3↑22. 波尔多液的制取:CuSO4+Ca(OH)2==Cu(OH)2↓+CaSO4其他:1. “百炼成钢”:C + O2CO22. “曾青得铁化为铜”:Fe+CuSO4==FeSO4+Cu3. 澄清石灰水通入二氧化碳变浑浊后,继续通二氧化碳,沉淀消失:CaCO3 + H2O + CO2 == Ca(HCO3)24. 难溶性碱受热分解:Cu(OH)2CuO+H2OFe(OH)3Fe2O3+H2O Fe(OH)2FeO+H2O(隔绝空气)5. 氢氧化铝药物治疗胃酸过多:Al(OH)3+3HCl==AlCl3+3H2O6. 无水硫酸铜检验水的生成:CuSO4+5H2O==CuSO4·5H2O(蓝)7. 氯化氢与氨气反应:HCl+NH3==NH4Cl(白烟)8. 铜绿受热分解:Cu2(OH)2CO32CuO+H2O+CO2↑9. 碳酸氢铵受热分解:NH4HCO3NH3↑+H2O+CO2↑。
初中化学方程式总结(第1-6章)

化学方程式(第1—6章)实验室制取氧气 文字表达式 高锰酸钾−−→−加热锰酸钾 + 二氧化锰 + 氧气 化学方程式4O 2KMn ∆42O Mn K +2O Mn + ↑2O 文字表达式氯化钾 + 氧气 化学方程式 3O 2KCl ∆2MnO KCl 2 + ↑23O文字表达式 过氧化氢−−−→−二氧化锰水 + 氧气 化学方程式 22O 2H 2MnO O 22H +↑2O木炭燃烧 文字表达式 碳 + 氧气−−→−点燃 二氧化碳 化学方程式 C + 2O 点燃 2CO硫燃烧 文字表达式 硫 + 氧气−−→−点燃 二氧化硫 化学方程式 S + 2O 点燃 2SO镁燃烧 文字表达式 镁 + 氧气−−→−点燃 氧化镁 化学方程式 Mg 2 + 2O 点燃 2MgO实验现象 发出耀眼的白光,放热,生成白色粉末状固体。
红磷燃烧 文字表达式 磷 + 氧气−−→−点燃 五氧化二磷 化学方程式 P 4 + 25O 点燃 52O 2P 铁丝在空气中不燃烧。
铁丝在纯氧中燃烧 文字表达式 铁 + 氧气−−→−点燃 四氧化三铁 化学方程式 Fe 3 + 22O 点燃 43O Fe实验现象 剧烈燃烧,火星四射,放热,生成黑色固体。
铜和氧气反应 文字表达式 铜 + 氧气−−→−加热 氧化铜 化学方程式 Cu 2 + 2O ∆ 2CuO实验现象 红色固体逐渐变成黑色。
汞和氧气反应 文字表达式 汞 + 氧气−−→−加热 氧化汞 化学方程式 Hg 2 + 2O ∆ 2HgO电解水 文字表达式 水 −−→−通电 氢气 + 氧气化学方程式 O H 22 通电 ↑22H + ↑2O 氢气燃烧 文字表达式水氧气氢气点燃−−→−+ 化学方程式 O H O H 22222点燃+实验室制取氢气 药品 锌和稀硫酸 反应原理: 化学方程式↑+=+2442H ZnSO SO H Zn C CO CO 2之间的反应,写出化学方程式(碳三角,煤炉反应)① 碳充分燃烧22CO O C 点燃+ ②碳不充分燃烧 CO O C 222点燃+ ③ CO 燃烧 2222CO O CO 点燃+ ④ 碳还原CO 2 CO CO C 22高温+氢气还原氧化铜 文字表达式水铜氧化铜氢气加热+−−→−+ 化学方程式O H C CuO H 22u +∆+ CO 还原氧化铜 文字表达式 二氧化碳铜氧化铜一氧化碳加热+−−→−+化学方程式2u u CO C O C CO +∆+ 碳还原氧化铜 文字表达式二氧化碳铜氧化铜碳高温+−−→−+ 化学方程式 ↑++2u 2u 2CO C O C C 高温实验室制取二氧化碳 药品 大理石(或石灰石)和稀盐酸石灰石或大理石的主要成分 碳酸钙(CaCO 3) 稀盐酸 HCl 气体的水溶液反应原理:化学方程式 ↑++=+22232CO O H CaCl HCl CaCO发生装置 固液常温型收集装置 向上排空气法 ,如何验满: 将燃着的木条放在集气瓶口,若熄灭,则已满。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
初中化学方程式
一、氧气的性质:
(1)单质与氧气的反应:(化合反应)
1.镁在空气中燃烧:2Mg + O2点燃2MgO
2.铁在氧气中燃烧:3Fe + 2O2点燃Fe3O4
3.铜在空气中受热:2Cu + O22CuO
4.铝在空气中燃烧:4Al + 3O2点燃2Al2O3
5.氢气中空气中燃烧:2H2 + O2点燃2H2O
6.红磷在空气中燃烧(研究空气组成的实验):4P + 5O2点燃2P2O5
7.硫粉在空气中燃烧:S + O2点燃SO2
8.碳在氧气中充分燃烧:C + O2点燃CO2
(2)化合物与氧气的反应:
10.一氧化碳在氧气中燃烧:2CO + O2点燃2CO2
11.甲烷在空气中燃烧:CH4 + 2O2点燃CO2 + 2H2O
12.酒精在空气中燃烧:C2H5OH + 3O2点燃2CO2 + 3H2O
(3)氧气的来源:
13. 玻义耳研究空气的成分实验2HgO Hg+ O2 ↑
14. 加热高锰酸钾:2KMnO4K2MnO4 + MnO2 + O2↑(实验制氧气)
15. 过氧化氢在二氧化锰作催化剂条件下分解反应:2H2O2MnO22H2O+ O2 ↑
(实验室制氧气原理2)
MnO22KCl+
16加热氯酸钾(二氧化锰):
二、自然界中的水:
17. 水在直流电作用下分解(研究水的组成实验):2H2O 通电 2H2↑+ O2 ↑
18. 生石灰溶于水:CaO + H2O === Ca(OH)2
19. 二氧化碳可溶于水:H2O + CO2=== H2CO3
三、质量守恒定律:
20. 镁在空气中燃烧:2Mg + O2点燃 2MgO
21. 铁和硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu
22. 氢气还原氧化铜:H2 + CuO Cu + H2O
四、碳和碳的氧化物:
(1)碳的化学性质
23. 碳在氧气中充分燃烧:C + O2点燃CO2
24.碳在氧气中不充分燃烧:2C + O2点燃2CO
25. 木炭还原氧化铜:C+ 2CuO 高温2Cu + CO2↑
26. 焦炭还原氧化铁:3C+ 2Fe2O3高温4Fe + 3CO2↑
(2)煤炉中发生的三个反应:(几个化合反应)
27.煤炉的底层:C + O2点燃 CO2
28.煤炉的中层:CO2 + C高温2CO
29.煤炉的上部蓝色火焰的产生:2CO + O2点燃 2CO2
(3)二氧化碳的制法与性质:
30.大理石与稀盐酸反应(实验室制二氧化碳):
CaCO3 + 2HCl === CaCl2 + H2O + CO2↑31.碳酸不稳定而分解:H2CO3 === H2O + CO2↑
32.二氧化碳可溶于水:H2O + CO2=== H2CO3
33.高温煅烧石灰石(工业制二氧化碳):CaCO3高温CaO + CO2↑34.石灰水与二氧化碳反应(鉴别二氧化碳):
Ca(OH)2 + CO2 ==== CaCO3↓+ H2O
(4)一氧化碳的性质:
35.一氧化碳还原氧化铜:CO+ CuO Cu + CO2
36.一氧化碳的可燃性:2CO + O2点燃2CO2
其它反应:
37.碳酸钠与稀盐酸反应(灭火器的原理):
Na2CO3 + 2HCl === 2NaCl + H2O + CO2↑五、燃料及其利用:
38.甲烷在空气中燃烧:CH4 + 2O2点燃CO2 + 2H2O 39.酒精在空气中燃烧:C2H5OH + 3O2点燃2CO2 + 3H2O 40.氢气中空气中燃烧:2H2 + O2点燃2H2O
六、金属
(1)金属单质 + 氧气-------- 金属氧化物(化合反应)41.镁在空气中燃烧:2Mg + O2点燃2MgO
42.铁在氧气中燃烧:3Fe + 2O2点燃Fe3O4
43. 铜在空气中受热:2Cu + O22CuO
44. 铝在空气中形成氧化膜:4Al + 3O2 = 2Al2O3
(2)金属单质 + 酸 -------- 盐 + 氢气(置换反应)
45.锌和稀硫酸(实验室制氢气)Zn + H2SO4 = ZnSO4 + H2↑
46.铁和稀硫酸Fe + H2SO4 = FeSO4 + H2↑
47.镁和稀硫酸Mg + H2SO4 = MgSO4 + H2↑
48.铝和稀硫酸2Al +3H2SO4 = Al2(SO4)3 +3H2↑
49.锌和稀盐酸Zn + 2HCl=== ZnCl2 + H2↑
50.铁和稀盐酸Fe + 2HCl=== FeCl2 + H2↑
51.镁和稀盐酸Mg+ 2HCl=== MgCl2 + H2↑
52. 铝和稀盐酸2Al + 6HCl == 2AlCl3 + 3H2↑
(3)金属单质 + 盐(溶液) ------- 新金属 + 新盐(置换反应)53.铁和硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu
54.铝和硫酸铜溶液反应:2Al +3 CuSO4 === Al2(SO4)3 + 3Cu
55.铜和硝酸汞溶液反应:Cu + AgNO3 === Cu(NO3)2 + Ag
(3)金属铁的治炼原理:
56.3CO+ 2Fe2O3高温4Fe + 3CO2↑
七、酸、碱、盐
1、酸的化学性质
(1)酸 + 金属-------- 盐 + 氢气(见上)
(2)酸 + 金属氧化物-------- 盐 + 水(复分解反应)
57. 氧化铁和稀盐酸反应(除铁锈):Fe2O3 + 6HCl === 2FeCl3+
3H2O
58.氧化铁和稀硫酸反应(除铁锈):Fe2O3 + 3H2SO4 === Fe2(SO4)3 +
3H2O
59. 氧化铜和稀盐酸反应:CuO + 2HCl ==== CuCl2 + H2O
60.氧化铜和稀硫酸反应:CuO + H2SO4 ==== CuSO4 + H2O
(3)酸 + 碱 -------- 盐 + 水(中和反应)
61. 盐酸和烧碱起反应:HCl + NaOH ==== NaCl +H2O
62. 盐酸和氢氧化钙反应:2HCl + Ca(OH)2 ==== CaCl2 + 2H2O
63. 氢氧化铝药物治疗胃酸过多:3HCl + Al(OH)3==== AlCl3
+____
64. 硫酸和烧碱反应:H2SO4 + 2NaOH ==== Na2SO4 + 2H2O
(4)酸 + 盐 -------- 另一种酸 + 另一种盐(复分解反应)
65.大理石与稀盐酸反应:CaCO3 + 2HCl === CaCl2 + H2O +____ 66.碳酸钠与稀盐酸: Na2CO3 + 2HCl === 2NaCl + H2O + CO2↑67.碳酸氢钠与稀盐酸:NaHCO3 + HCl=== NaCl + H2O + CO2↑68. 硫酸和氯化钡溶液反应:H2SO4 + BaCl2==== BaSO4↓+
2HCl
2、碱的化学性质
(1)碱 + 非金属氧化物 -------- 盐 + 水(复分解反应)
69.苛性钠暴露在空气中变质:2NaOH + CO2 ==== Na2CO3 + H2O 70.苛性钠吸收二氧化硫气体:2NaOH + SO2 ==== Na2SO3 + H2O 71.苛性钠吸收三氧化硫气体:2NaOH + SO3 ==== Na2SO4 + H2O 72.消石灰放在空气中变质:Ca(OH)2+ CO2==== CaCO3↓+ H2O
73. 消石灰吸收二氧化硫:Ca(OH)2 + SO2 ==== CaSO3↓+ H2O (2)碱 + 酸-------- 盐 + 水(中和反应,方程式见上)
(3)碱 + 盐 -------- 另一种碱 + 另一种盐(复分解反应)
74. 氢氧化钙与碳酸钠:Ca(OH)2+ Na2CO3=== CaCO3↓+
2NaOH
3、盐的化学性质
(1)盐(溶液)+ 金属单质------- 另一种金属 + 另一种盐(复分解反应)75. 铁和硫酸铜溶液反应:Fe + CuSO4 === FeSO4 + Cu
(2)盐 + 酸-------- 另一种酸 + 另一种盐(复分解反应)
76.碳酸钠与稀盐酸: Na2CO3 + 2HCl === 2NaCl + H2O + CO2↑碳酸氢钠与稀盐酸:NaHCO3 + HCl=== NaCl + H2O + CO2↑(3)盐 + 碱 -------- 另一种碱 + 另一种盐(复分解反应)
77. 氢氧化钙与碳酸钠:Ca(OH)2+ Na2CO3=== CaCO3↓+
2NaOH
(4)盐 + 盐 ----- 两种新盐(复分解反应)
78.氯化钠溶液和硝酸银溶液:NaCl + AgNO3==== AgCl↓+ NaNO3
79.硫酸钠和氯化钡:Na2SO4 + BaCl2 ==== BaSO4↓ + 2NaCl (找出化学式中原子数目最多的化学式,使其化学计量数为“1”,逐步确定各反应物与生成物的计量数,确保反应前后各元素数量不变,若是分数再进行通分去掉分
母,保证最后得到最简整数比)。
