化学反应中的热量 (2)
化学反应中的能量变化

反应物的总能量高 放 热 反 应
生成物的总能量高 吸 热 反 应 反应物的总能量低
生成物的总能量低
3、化学反应中热量变化的原因:
放热反应: 反应物的总能量>生成物的总能量 吸热反应: 反应物的总能量<生成物的总能量
二、热化学方程式
1、定义:表明反应所放出或吸收的热量的化学 方程式。
例1、2H2(g) + O2(g) = 2H2O(l); △H=- 571.6 kJ/mol 表示: (1)反应物和生成物的种类; (2)反应中各物质的物质的量比和质量比; (3)反应中放出或吸收的热量。 每2mol 氢气与1mol 氧气反 应生成2mol 水,放热571.6 千焦。
2-2-2 燃料燃烧释放的热量
一、燃料燃烧释放的热量 表2-4 几种燃料的热值
物质
热值 /kJ/g
天然气 石油
煤炭
氢气
甲醇
约56
约48量相同的不同燃料,完全燃烧后 放出的热量不相等?燃料燃烧中释放的能量从何 而来?
1、化学反应热效应的实质 拆开化学键:吸收热量; 形成化学键:放出热量。 吸热反应 吸热 > 放热 当 放热反应 吸热 < 放热 [ 交流与讨论 ] 计算 2H2+O2=2H2O 反应中的能量 变化.
(2)H2(g) + 1/2O2(g) = H2O(l) △H =- 286 kJ/mol
[思考2]为什么聚集状态不同,热量值不同? (1)2H2(g) + O2(g) = 2H2O(l);△H =- 572kJ/mol
(2)2H2(g) + O2(g) = 2H2O(g);△H =- 484 kJ/mol
活动与探究 【实验 1】向一支试管中放入用砂纸打磨光亮的 镁条,加入5mL2mol/L盐酸,用手触摸试管外壁, 有什么感觉? 【实验2】在100mL小烧杯中加入约20g经研磨的 氢氧化钠晶体 [Ba(OH)2· 8H2O] ,然后加入约 10g 氯化铵晶体,用玻璃棒搅拌,使之充分混合。用 手触摸烧杯外壁,反应混合物的温度有什么变化?
化学反应中的能量变化焓与热量的计算

化学反应中的能量变化焓与热量的计算在化学反应中,能量变化是一个重要的物理量,用来描述反应中的能量转化情况。
能量变化可以通过焓来表示,而热量则是能量的一种体现方式。
本文将介绍如何计算化学反应中的能量变化焓以及相应的热量。
1. 反应焓的定义与表达式在化学反应中,焓(enthalpy)是描述系统热力学性质的一个重要参量。
化学反应中的焓变化(ΔH)定义为反应前后系统的焓差,即产物的焓减去反应物的焓。
ΔH = H(产物) - H(反应物)焓可以通过热容(C)和温度(T)来计算,其中热容表示单位温度变化时系统吸收或释放的热量。
2. 焓变的计算方法化学反应的焓变可以根据反应物和产物的反应焓进行计算。
相应的计算方法有两种:(1) 根据物质的化学计量比来计算焓变。
这种方法通过将反应物和产物的焓乘以化学计量比来计算反应的焓变。
例如,对于化学反应:aA + bB → cC + dD焓变可以表示为:ΔH = cH(C) + dH(D) - aH(A) - bH(B)(2) 使用热化学方程式计算焓变。
这种方法通过已知的热化学方程式和相应的焓值来计算焓变。
例如,对于形成反应(formation reaction):C(graphite) + O2(g) → CO2(g)可以使用已知的焓值来计算焓变。
假设已知的焓为:ΔH(C(graphite)) = 0 kJ/molΔH(O2(g)) = 0 kJ/molΔH(CO2(g)) = -393.5 kJ/mol则焓变为:ΔH = ΔH(CO2(g)) - [ΔH(C(graphite)) + ΔH(O2(g))]3. 热量的计算热量是能量的一种体现方式,在化学反应中热量的计算可以通过焓变来得到。
根据热力学第一定律,能量守恒,热量的计算可以使用以下公式:q = ΔH其中,q表示热量,ΔH表示焓变。
热量的单位通常使用焦耳(J)或千焦(kJ)。
在实际应用中,常使用摩尔焓变和摩尔热量来计算热量。
第一单元化学反应中的热效应 (2)

活动4 书写下列反应的热化学方程式
① 1molCaCO3吸收178.5kJ的热量, 完全分解生成1molCaO和1molCO2 ② 8g甲烷气体在空气中充分燃烧,得到CO2和液态水,放出445kJ的热量 ③ 偏二甲肼(C2H8N2)和N2O4是一种双组分火箭推进剂。已知6.0g液态
偏二甲肼与足量的液态N2O4完全反应生成N2(g)、CO2(g)、H2O(g), 放出225.0kJ的热量。
热量的数据如何获得-?-实验测量是一种重要方法
以下反应的热量数据能否通过实验测量得到?
① C(石墨)+O2(g) = CO2(g) Δ H1= -393.5kJ·mol-1 ② CO(g)+1/2O2(g) = CO2(g) Δ H2= -283.0kJ·mol-1 ③ C(石墨)+1/2O2(g) = CO (g) ΔH3= ?
温暖热烈
Mg+ 2HCl=MgCl2 + H2↑
冰爽醒脑
Ba(OH)2·8H2O + 2NH4Cl=BaCl2 + 2NH3↑+ 10H2O
一、认识化学反应中的热量变化
化学反应
放热反应:放出热量的化学反应 吸热反应:吸收热量的化学反应
活动1 回忆常见的放热反应和吸热反应
所有燃烧反应
常
酸碱中和反应
---难以通过实验测量
科学家研究热化学的历史进程
热化学的开创者
设计第一台 简易冰量热计
重大贡献者
研究测定大量 反应的热效应
18世纪
19世纪中
重要贡献者
精确测定一系列 有机物的燃烧热
经典化学 热力学
19世纪末
拉瓦锡拥护热质说 盖斯提出盖斯定律 贝特洛发明一种弹式量热计
高考化学二轮复习 专题13 化学反应中的热效应(含解析)
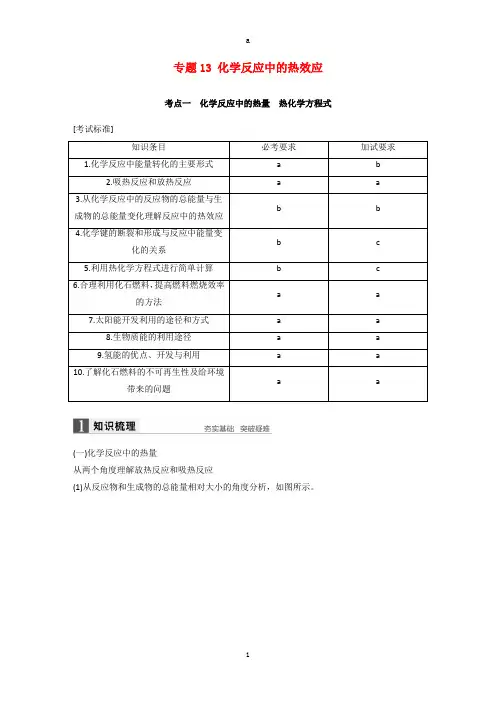
专题13 化学反应中的热效应考点一化学反应中的热量热化学方程式[考试标准]知识条目必考要求加试要求1.化学反应中能量转化的主要形式a b2.吸热反应和放热反应a a3.从化学反应中的反应物的总能量与生b b成物的总能量变化理解反应中的热效应4.化学键的断裂和形成与反应中能量变b c化的关系5.利用热化学方程式进行简单计算b c6.合理利用化石燃料,提高燃料燃烧效率a a的方法7.太阳能开发利用的途径和方式a a8.生物质能的利用途径a a9.氢能的优点、开发与利用a a10.了解化石燃料的不可再生性及给环境a a带来的问题(一)化学反应中的热量从两个角度理解放热反应和吸热反应(1)从反应物和生成物的总能量相对大小的角度分析,如图所示。
(2)从反应热的量化参数——键能的角度分析(3)记忆常见的放热反应和吸热反应放热反应:①可燃物的燃烧;②酸碱中和反应;③大多数化合反应;④金属跟酸的置换反应;⑤物质的缓慢氧化等。
吸热反应:①大多数分解反应;②盐类的水解和弱电解质的电离;③Ba(OH)2·8H2O与NH4Cl 反应;④碳和水蒸气、C和CO2的反应等。
(二)热化学方程式的书写1.注明反应条件反应热与测定条件(温度、压强等)有关。
绝大多数反应是在25 ℃、101 kPa下进行的,可不注明。
2.注明物质状态常用s、l、g、aq分别表示固体、液体、气体、溶液。
3.注意符号单位ΔH应包括“+”或“-”(“+”可省略)、数字和单位(kJ·mol-1)。
4.注意守恒关系(1)原子守恒和得失电子守恒;(2)能量守恒。
5.区别于普通方程式一般不标注“↑”、“↓”以及“点燃”、“加热”等。
6.注意热化学方程式的化学计量数热化学方程式中各物质化学式前面的化学计量数仅表示该物质的物质的量,可以是整数,也可以是分数。
且化学计量数必须与ΔH 相对应,如果化学计量数加倍,则ΔH 也要加倍。
正误辨析正误判断,正确的打“√”,错误的打“×” (1)物质发生化学变化都伴有能量的变化(√) (2)放热反应不需要加热就能发生,吸热反应不加热不能发生 (×) (3)伴有能量变化的物质变化都是化学变化 (×) (4)化学反应中的能量变化不是单一的(√) (5)化学键断裂要吸收热量,也必定发生化学变化(×) (6)书写热化学方程式时,任何情况下都没必要注明反应条件 (×) (7)C(石墨,s)===C(金刚石,s) ΔH >0说明石墨比金刚石稳定(√)(8)已知:500 ℃、30 MPa 下,N 2(g)+3H 2(g)高温高压催化剂2NH 3(g) ΔH =-92.4 kJ·mol -1,将1.5 mol H 2和过量的N 2在此条件下充分反应,放出热量46.2 kJ(×)题组一 全面认识化学反应中的能量变化1.(2016·浙江乐清市芙蓉中学高一5月月考)下列反应属于吸热反应的是( ) A .稀硫酸与氢氧化钾溶液反应 B .碳与二氧化碳的反应 C .锌与稀硫酸的反应 D .生石灰变成熟石灰的反应 答案 B2.(2016·宁波市北仑中学高一期中)图为反应2H 2(g)+O 2(g)===2H 2O(g)的能量变化示意图。
化学反应中的热量

吸热反应一定需要加热吗?不一定
氯化铵晶体和氢氧化钡反应是吸热反应,但不需 加热
放热反应一定不要加热吗? 不一定
燃烧是放热反应,但需要加热到着火点
1、下列说法中正确的是
总能量
B、吸热反应一定要加热 C、放热反应不需要加热
(
)
A、放热反应的反应物总能量高于生成物的
D、焦炭在高温下与水蒸气的反应是吸热反应
化学必修2
专题2.化学反应与能量转化
第二单元
化学反应中的热量
化学反应中的热量变化
化学能转化为光能、 热能
结论:
化学反应伴随 着能量的变化
镁条的燃烧 电能转化为化学能
化学能转化为热能
闪电时产生氮氧化物
2
活动与探究
实 验 实验现象 结论
1、用镊子取2段镁条放 试管外壁 放出热量 入试管中,加入约2mL 发热 稀盐酸; 2、在塑料袋中加入适 量氯化铵晶体和氢氧化 钡晶体,充分混合
所以化学反 应中总伴随 着能量的变 化
反应热△H
=反应物断键吸收的总能量+生成物成键放出的总能量
放热反应: △H <0
吸热反应:△H>0
热
化
学
方
程
式
(1)定义:用来表明反应所放出或吸 收的热量的化学方程式。
(2)意义:不仅表明了化学反应中的物质变化,
也表明了化学反应中的热量变化。
1、标明聚集状态(g:气体、l液体、s:固体)
发冷
吸收热量
1、放热反应
2、吸热反应 ⑴定义:吸收热量的化学 反应。 ⑵原因:反应物的总能量 <生成物总能量
⑴定义:有热量放出的化 学反应。 ⑵原因:反应物的总能量 >生成物总能量
化学反应中热量变化

二、反应热
1、定义:化学反应过程中放出或吸收 的热量 2、符号:△H
3、放热反应:△H为“-”或△H<0
吸热反应:△H为“+” 或△H>0 4、单位:kJ/mol
?
疑问
为什么有的反应放出热量,而有的 反应吸收热量?
水能、化学能变化对比示意图
• 图1将水由低处抽向高处需提供能量
都需要。 它与只消只放需耗由热略的反、微能应吸 加量物热用的无就于总关能断能,引量
⑤ 怎样高效、清洁地体利燃用料煤以炭雾?状喷出,以增 ⑥ 怎样提高固体和液大体燃燃料料与的空燃气烧的效接率触?面
高效清洁利用煤炭的重要途径 煤的气化(水煤气或干馏煤气)
将焦炭在高温下与水蒸气反应,则得到CO和H2
C(s) + H2O(g)
高温 CO(g) +
H煤2(g的) 液化
练习:简要说明使煤炉中的煤充
分燃烧所应采取的措施。
打打打开开炉炉门
燃烧时要有足 够多的空气
门
在在开煤煤炉饼门饼上上打打孔孔或或将将煤做煤成做煤成块煤块
燃料与空气 要有足够大
巩固练习
1、下列燃料中不属于化石燃料的是 ( ) A、煤 B、石油 C、水煤气 D、天然气
2、下列燃料的燃烧,不会污染空气的是 ( ) A、无铅汽油 B、含铅汽油 C、煤 D、氢气
△H:表示反应体系所含化学能的变化量
化 反应物 学 能
高
放出能量 放热反应
△H为“”
生成物 低
反应过程
△H:表示反应体系所含化学能的变化量
化 学 能
反应物
生成物 高 吸收能量 吸热反应
△H为“+” 低
反应过程
化学键与化学反应中的能量变化
化学反应中的能量变化与热量
化学反应中的能量变化与热量化学反应是指原子、离子或分子之间发生的变化,产生新的物质和能量的过程。
在化学反应中,能量会发生变化,这种变化可以通过热量的转移来衡量。
本文将探讨化学反应中的能量变化与热量。
一、能量变化的概念能量是物质存在的一种形式,可以存在于不同的形式,例如热能、化学能、机械能等。
在化学反应中,化学键的形成和断裂导致了能量的吸收或释放,从而引起能量的变化。
能量的变化可以用化学反应的焓变(ΔH)来表示。
二、化学反应中的热量变化热量是指物体的内部能量的传递,它是一种能量的形式。
在化学反应中,热量的变化可以通过测定反应物和产物之间的温度变化来确定。
当化学反应释放热量时,温度将升高;反之,吸收热量时,温度将降低。
三、化学反应的热量变化与焓变焓变表示化学反应过程中的热量变化,可以是吸热反应(ΔH>0)或放热反应(ΔH<0)。
吸热反应是指反应过程中吸收了热量,而放热反应则是指反应过程中释放了热量。
化学反应的焓变取决于反应物和产物之间的化学键的形成和断裂。
在化学键形成的过程中,需要输入能量;而在化学键断裂的过程中,会释放能量。
因此,化学反应的焓变可以通过化学键的能量差来计算。
四、热化学方程式热化学方程式是用来表示化学反应过程中的热量变化的方程式。
它通常采用以下形式:反应物1 + 反应物2 + ... → 产物1 + 产物2 + ... + 热量热量的符号(正负号)表示了反应过程中的放热或吸热特性。
例如,当热量为正时,表示反应为吸热反应;而热量为负时,表示反应为放热反应。
五、化学反应中的能量变化与热化学方程式的应用热化学方程式可以用来预测化学反应的热量变化。
通过实验测定反应物和产物的物质的量,以及温度的变化,可以计算出焓变。
这些数据可用于热化学方程式中的热量值。
利用热化学方程式,可以计算出化学反应的焓变,从而了解反应过程中的能量变化。
这对于理解化学反应的热力学性质非常重要,也对于工业生产和能源利用有着重要的意义。
化学反应中的热量变化
1molH2分子中 的化学键断裂时需 吸收436.4kJ的能量 吸收 的能量
1molCl2分子中的化学键 断裂时需吸收242.7kJ的能量 断裂时需吸收 的能量
2molHCl分子中的化学键形成时要释 分子中的化学键形成时要释 放431.8kJ/mol×2mol=863.6kJ的能量 × 的能量
向一支试管中放入用砂纸打磨光亮 的镁条,加入5 mol/L盐酸 盐酸, 的镁条,加入5 mL 2 mol/L盐酸,用 手触摸试管外壁,有什么感觉? 手触摸试管外壁,有什么感觉? Mg+2HCl=MgCl2+H2
实验2 氢氧化钡 实验2 氢氧化钡与氯化铵反应 向小烧杯中加入约20g氢氧化钡晶体 烧杯中加入约2 再加入约10 10g 【 Ba(OH)2·8H2O 】 ,再加入约 10 g 氯化铵 晶体,用玻璃棒搅拌,使之充分混合, 晶体,用玻璃棒搅拌,使之充分混合, 用手触摸烧杯外壁, 感觉反应混合物的 用手触摸烧杯外壁, 感觉反应混合物的 温度有何变化? 温度有何变化?
Ba(OH)2· 8H2O + 2NH4Cl=BaCl2 +2NH3 +10H2O =
判断下列说法是否正确: 判断下列说法是否正确:
①浓硫酸稀释后温度升高,为放热反应 浓硫酸稀释后温度升高, ②硝酸铵晶体加入水中温度降低,为吸热反应 硝酸铵晶体加入水中温度降低, ③金属钠加入水后温度升高,为放热反应 金属钠加入水后温度升高,
思考: 思考:下列热化学方程式书写正确的是 C
A.2SO2 + O2 ==== 2SO3 △H=-196.6 kJ/mol . - B.H2(g)+1/2O2(g)=== H2O (g) △H=-241.8 kJ . - C.2H2(g)+O2(g) === 2H2O(l) △H=-571.6 kJ/mol . - D.C(s) + O2(g) === CO2(g) △H= +393.5 kJ/mol .
化学反应中的热量
归纳总结 类型 比较 定义
形成原因
与化学键的 关系
放热反应
吸热反应
放出热量的反应
吸收热量的反应
反应物具有的总能量大于 反应物具有的总能量小于生成
生成物具有的总能量
物具有的总能量
生成物分子成键时释放的总 生成物分子成键时释放的总能
能量大于反应物分子断键时 量小于反应物分子断键时吸收
吸收的总能量
的总能量
(1)镁条的燃烧
放热反应
(2)高温煅烧石灰石 吸热反应
(3)氧化钙与水的反应 放热反应
(4)盐酸和氢氧化钠溶液反应 放热反应
2.常见的吸热反应、放热反应
大多分解反应
燃料的燃烧 放 热 中和反应
吸 氢氧化钡晶体与氯化铵 热 反应
反 金属与水或酸 反
应
应
大多数化合反应
问题2 氢氧化钡晶体与氯化铵反应 不需要加热,中和反应不需要加
2、化学反应中能量变化与化学键的关系 问题7:1molH2和1molCl2反应生成2molHCl,这个反应 是放热反应还是吸热反应?
化学反应的H实2质+C:l旧2=化2学HC键l的断裂△和H新?化学键的形成。
断开化学键会吸收能量,形成化学键会放出能量。 ①化学反应过程
②化学反应中能量变化的原因
从微观角度分析
24g C 完全燃烧产生的热量为787.2kJ
课堂小结
化学反应中的能量变化
化学反应中的热量变化 放热反应和吸热反应
热化学方程式
三、化学反应中能量变化的主要原因
1、化学反应中能量变化与物质能量的关系
我们用△H来表示反应放出或吸收的热量,负值表示一定 条件下该反应为放热,正值表示一定条件下该反应为吸热。
化学反应中的能量变化知识点及例题解析
考点3化学反应中的能量变化一、反应热1、化学反应过程中放出或吸收的热量,通常叫做反应热。
反应热用符号ΔH表示,单位一般采用kJ/mol。
当ΔH为负值为放热反应;当ΔH为正值为吸热反应。
测量反应热的仪器叫做量热计。
2、燃烧热:在101kPa时,1mol物质完全燃烧生成稳定的氧化物时放出的热量,叫做该物质的燃烧热。
3、中和热:在稀溶液中,酸跟碱发生中和反应生成1molH2O,这时的反应热叫做中和热。
中学阶段主要讨论强酸和强碱的反应。
二、热化学方程式1、书写热反应方程式应注意的问题:(1)由于反应热的数值与反应的温度和压强有关,因此必须注明,不注明的是指101kPa和25℃时的数据。
(2)物质的聚集状态不同,反应热的数值不同,因此要注明物质的聚集状态。
(3)热化学方程式中的化学计量数为相应物质的物质的量,它可以是整数,也可以是分数。
2、书写热化学方程式的一般步骤(1)依据有关信息写出注明聚集状态的化学方程式,并配平。
(2)根据化学方程式中各物质的化学计量数计算相应的反应热的数值。
(3)如果为放热反应ΔH为负值,如果为吸热反应则ΔH为正值。
并写在第一步所得方程式的后面,中间用“;”隔开。
(4)如果题目另有要求,如反应燃料燃烧热的热化学方程式和有关中和热的热化学方程式,可将热化学方程式的化学计量数变换成分数。
三、中和热的测定1、测定前的准备工作(1)选择精密温度计(精确到0.10C),并进行校对(本实验温度要求精确到0.10C)。
(2)使用温度计要轻拿轻声放。
刚刚测量高温的温度计不可立即用水冲洗,以免破裂。
(3)测量溶液的温度应将温度计悬挂起来,使水银球处于溶液中间,不要靠在烧杯壁上或插到烧杯底部。
不可将温度计当搅拌棒使用。
2、要想提高中和热测定的准确性,实验时应注意的问题(1)作为量热器的仪器装置,其保温隔热的效果一定要好。
因此可用保温杯来做。
如果按教材中的方法做,一定要使小烧杯杯口与大烧杯杯口相平,这样可以减少热量损失。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
表示的是什么呢?
表示:0.5molC与0.5molO2完全反应生成 0.5mo热lC化O2气学体方,程放式出中的各热物量质为前1的96化.8学kJ计。量数
4 可以是整数或分数,不表示分子个数, 只表示物质的量。
3、热化学方程式 观察以下热化学反应方程式,你发现了什么? 2H2(g) + O2(g)==2H2O(g) △H=-483.6 kJ/mol 2H2(g) + O2(g)== 2H2O(l) △H=-571.6 kJ/mol
定义:表明反应放出或吸收的热量的化学方程式
H2(g) + Cl2(g)==2HCl(g) △H = - 184.5kJ/mol 1 要标明反应物和生成物的状态,用g、l、s
分别代表气态、液态、固态。
反应热
2 用△H标明恒压条件下反应放出或吸收的热 量,放热为负,吸热为正,单位是kJ/mol。
3 反应温度、压强不同其△H 也不同,中学 阶段指的是标准状况。
写出热反应方程式
在一定温度下,1molCO气体与1mol 水蒸气在催化剂存在下完全反应,生成CO2 气体和氢气,放出41kJ。
CO(g)+H2O(g) =CO2(g)+H2(g) △H = -41 kJ·mol-1
书写热化学方程式 需要注意哪些问题?
讨论
• 依据实验数据,写出下列反应的热化学方程式。 (1)1mol N2 (g)与适量 H2(g)发生反应,生
受温度。
发热
有热量放出
实验二:氢氧化钡固体 与氯化铵固体反应,用 手触摸塑料袋,感受温 度。
温度降低
氢氧化钡固体 与氯化铵固体 反应需要吸收 热量
2、吸热反应和放热反应
化学上把有热量放出的化学反应叫做放热反应。 氢气在氧气中燃烧是放热反应 化学上把吸收热量的化学反应叫做吸热反应。 水分解成氢气和氧气是吸热反应
5 同种物质聚集状态不同,能量不同
2H2(g) + O2(g)== 2H2O(l) △H=-571.6 kJ/mol H2(g) +1/2O2(g)== H2O(l) △H=-285.8 kJ/mol
6 △H 的值与计量数成正比。
问题解决:
下列热化学方程式书写正确的是
C
A.2SO2 + O2 ==== 2SO3 △H=- 196.6 kJ/mol B.H2(g)+O2(g)=== H2O (g) △H=- 241.8 kJ C.2H2(g)+O2(g) === 2H2O(l) △H=- 571.6 kJ/mol D.C(s) + O2(g) === CO2(g) △H= + 393.5 kJ/mol
键能
已知:断开1mol H2中的H-H键需要吸收 436.4kJ的能量,断开1molCl2中的Cl-Cl 键需要吸收242.7kJ的能量,生成
1molHCl中的H-Cl键需要放出431.8kJ的
能量。试说明H2 +Cl2 = 2HCl是吸热反应 还是放热反应?
E
吸收436.4 kJ (H2) 2H + 2Cl
放出436.4 kJ (H2) 放出242.7 kJ(Cl2)
△H =184.5 kJ 2HCl
是不是所有的吸热反应 都需要加热,而放热反 应不需要加热呢?
在一支试管中放入几小块镁片,把试管放入盛有25°C的饱和石灰 水的烧杯中,用胶头滴管滴5ml盐酸于试管中。试回答下列问题 : (1)实验中观察到的现象是
镁片逐渐融解,有大量。气泡产生,烧杯中有固体析出
(2)产生上述现象的
原因是
镁与盐酸反应放出氢气,该反应为放热反应,
常见的放热反应和吸热反应
ห้องสมุดไป่ตู้
放热反应
吸热反应
所有燃料的燃烧 金属与酸
大多数化合反应
酸碱中和反应
铵盐与碱的反应
大多数分解反应
以H2、C为还原剂的氧化还 原反应
判断下列反应是放热反应还是吸热反应
⑴镁条的燃烧
放热反应
⑵高温煅烧石灰石
吸热反应
⑶氧化钙与水的反应
放热反应
⑷盐酸与氢氧化钠溶液反应 放热反应
思考:
Ca(OH)2的溶解度随温度的升高反而减小, 析出固体使溶。液变浑浊。
(3)写出有关反应的离子方程式: Mg+2H。+=Mg2++H2↑
(4)由实验推知:镁片和盐酸的总能量
(>填“>”﹑“<”
或“=”)MgCl2溶液与H2的总能量。
。
如何表示反应中 放出或者吸收的 热量呢?
热化学方程式
3、热化学方程式
知识回顾
1、吸热反应和放热反应 2、热化学方程式
思考:
我们知道在化学反应中存 在着热量吸收和放出,那么反应 中为什么有热量变化?其主要原 因是什么?
从微观角度分析
吸热反应:
> 断开化学键所吸收 的能量 形成化学键所放出的能量
放热反应:
< 断开化学键所吸收 的能量 形成化学键所放出的能
量
问题解决
吸收242.7 kJ(Cl2)
放出2×431.8 kJ
= 863.6 kJ
H2 + Cl2
放出 热量
? 2HCl △H =184.5 kJ
(注:1mol H2和1mol Cl2反应)
反应历程
放热反应的逆反应一定是吸热反应吗?
如:2HCl = H2 + Cl2是吸热反应吗?
E
吸收2×431.8 kJ 2H + 2Cl = 863.6 kJ
1.化学反应中能量的转化
热能 电能 光能
化学能
镁条的燃烧
说 一 说
闪电时产生氮氧化物
石油气的燃烧
高温冶炼铁
原电池放电 2
研究发现,化学反应伴随着能量 的变化。许多化学反应的能量变化主要 表现为热量的放出或吸收
演示实验
实验方案
实验现象
结论
实验一:镁条与盐酸反
应,用手触摸试管,感 试管外壁 镁与盐酸反应
成NH3(g),放出92.2kJ热量。 (2)1mol Cu(s)与适量 O2(g)发生反应,生成
CuO(s),放出157kJ热量。
(1)N2(g)+3H2(g) = 2NH3(g) △H = -92.2 kJ·mol-1
(2) Cu(s)+1/2O2(g) = CuO(g) ∆H=-157kJ·mol-1
意义: 不仅表明了化学反应中物质变化,也表明 了化学反应中的能量变化
CaCO3(S) =CaO(S) +CO2(g) △H = +178.5kJ/mol 表示:1molCaCO3完全分解生成CaO和CO2气体 ,吸收的热量为178.5kJ。
1/2C(S) +1/2O2(S) =1/2CO2(g) △H = -
