近几年高考化学平衡试题考查特点汇编
2024年高考化学真题模拟题专项汇编__10水溶液中的离子平衡含解析

专题10 水溶液中的离子平衡2024年高考真题1.【2024年7月浙江选考】下列物质在熔融状态下不导电...的是( )A .B .C .D .【答案】C【解析】A.NaOH属于离子化合物,其在熔融状态下能电离成自由移动的Na+和OH-,故其在熔融状态下能导电,A不符合题意;B.CaCl2属于离子化合物,其在熔融状态下能电离成自由移动的Ca2+和Cl-,故其在熔融状态下能导电,B不符合题意;C.HCl是共价化合物,其在熔融状态下不能电离成离子,故其在熔融状态下不导电,C符合题意;D.K2SO4属于离子化合物,其在熔融状态下能电离成自由移动的K+和SO,故其在熔融状态下能导电,D不符合题意。
综上所述,本题答案为C。
2.【2024年7月浙江选考】水溶液呈酸性的是( )A .B .C .D .【答案】B【解析】A.NaCl是强酸强碱盐,其不能水解,故其水溶液呈中性,A不符合题意;B.NaHSO4是强酸的酸式盐,其属于强电解质,其在水溶液中的电离方程式为NaHSO4=Na++H++SO,故其水溶液呈酸性,B符合题意;C.HCOONa属于强碱弱酸盐,其在水溶液中可以完全电离,其电离产生的HCOO-可以发生水解,其水解的离子方程式为HCOO-+H2O⇌HCOOH+OH-,故其水溶液呈碱性,C不符合题意;D.NaHCO3是强碱弱酸盐,既能发生电离又能发生水解,但其水解程度大于电离程度,故其水溶液呈碱性,D不符合题意。
综上所述,本题答案为B。
3.【2024年新课标】以酚酞为指示剂,用0.1000 mol·L−1的NaOH溶液滴定20.00 mL未知浓度的二元酸H2A溶液。
溶液中,pH 、分布系数随滴加NaOH溶液体积V NaOH的改变关系如图所示。
[比如A2−的分布系数:]下列叙述正确的是A.曲线①代表,曲线②代表B.H2A溶液的浓度为0.2000 mol·L−1C.HA−的电离常数K a=1.0×10−2D.滴定终点时,溶液中【答案】C【解析】【分析】依据图像,曲线①代表的粒子的分布系数随着NaOH的滴入渐渐减小,曲线②代表的粒子的分布系数随着NaOH的滴入渐渐增大,粒子的分布系数只有1个交点;当加入40mLNaOH溶液时,溶液的pH在中性发生突变,且曲线②代表的粒子达到最大值接近1;没有加入NaOH时,pH约为1,说明H2A第一步完全电离,其次步部分电离,曲线①代表δ(HA-),曲线②代表δ(A2-),依据反应2NaOH+H2A=Na2A+2H2O,c(H2A)==0.1000mol/L,据此分析作答。
2009-2013年高考化学试题分类汇编:化学反应速率和化学平衡
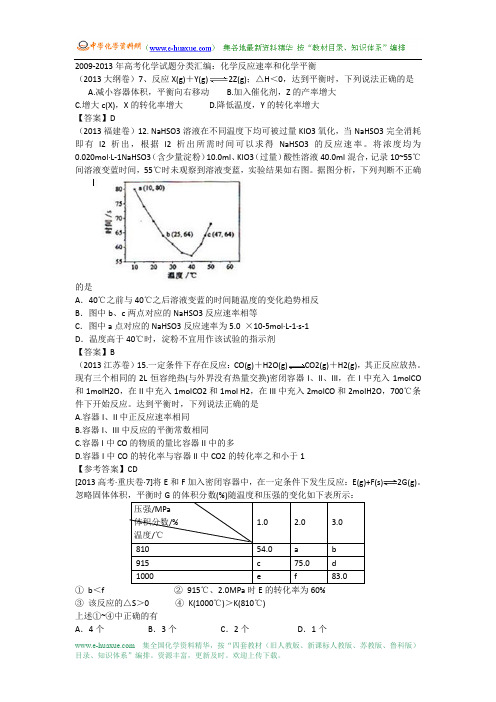
2009-2013年高考化学试题分类汇编:化学反应速率和化学平衡(2013大纲卷)7、反应X(g)+Y(g)2Z(g);△H<0,达到平衡时,下列说法正确的是A.减小容器体积,平衡向右移动B.加入催化剂,Z的产率增大C.增大c(X),X的转化率增大D.降低温度,Y的转化率增大【答案】D(2013福建卷)12. NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,根据I2析出所需时间可以求得NaHSO3的反应速率。
将浓度均为0.020mol·L-1NaHSO3(含少量淀粉)10.0ml、KIO3(过量)酸性溶液40.0ml混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如右图。
据图分析,下列判断不正确的是A.40℃之前与40℃之后溶液变蓝的时间随温度的变化趋势相反B.图中b、c两点对应的NaHSO3反应速率相等C.图中a点对应的NaHSO3反应速率为5.0 ×10-5mol·L-1·s-1D.温度高于40℃时,淀粉不宜用作该试验的指示剂【答案】B(2013江苏卷)15.一定条件下存在反应:CO(g)+H2O(g)CO2(g)+H2(g),其正反应放热。
现有三个相同的2L恒容绝热(与外界没有热量交换)密闭容器I、II、III,在I中充入1molCO 和1molH2O,在II中充入1molCO2和1mol H2,在III中充入2molCO和2molH2O,700℃条件下开始反应。
达到平衡时,下列说法正确的是A.容器I、II中正反应速率相同B.容器I、III中反应的平衡常数相同C.容器I中CO的物质的量比容器II中的多D.容器I中CO的转化率与容器II中CO2的转化率之和小于1【参考答案】CD。
[2013高考∙重庆卷∙7]将E和F加入密闭容器中,在一定条件下发生反应:忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示:①b<f③该反应的△S>0 ④K(1000℃)>K(810℃)上述①~④中正确的有A.4个B.3个C.2个D.1个答案:A【解析】同温下,增大压强,平衡逆向进行,平衡时G的体积分数变小,故可知c>75.0>54.0>a>b,利用c>75.0>54.0可知同压下,升温平衡正向移动,即正反应为吸热反应,从而可知f>75.0,所以①正确;在915℃、2M Pa下,设E的起始量为amol,转化率为x,则平衡时G的量为2ax,由题意得2ax/(a-ax+2ax)=75%,解得x=0.6,②正确;该题是气体体积增大的反应,因此为熵增反应,③正确;结合前面分析知升温平衡正向移动,则平衡常数增大,④正确,故正确答案为:A。
化学平衡高考试题分析与备考建议

词·清平乐禁庭春昼,莺羽披新绣。
百草巧求花下斗,只赌珠玑满斗。
日晚却理残妆,御前闲舞霓裳。
谁道腰肢窈窕,折旋笑得君王。
《化学平衡》高考试题分析与复习备考建议华中科技大学附属中学贺文风化学平衡是重要的化学基本理论,是中学化学的重点和难点,是高考历久不衰的热点。
近几年高考对化学平衡的考查有哪些特点?我们应当如何复习化学平衡?本文将我们的分析和思考向各位专家和同仁进行简要汇报。
Ⅰ高考试题分析一、高考回眸1、2006年9套试卷对化学平衡的考查2、2005、2004年高考对化学平衡的考查(1)2005年全国卷Ⅰ、卷Ⅱ、卷Ⅲ及北京、天津卷各有一道选择题,主要考查化学平衡移动、平衡图象分析等。
全国卷Ⅱ为湖北卷,有一道关于平衡图象的选择题。
江苏卷第18题考查等效平衡的判断与分析,5分;广东卷第14、17、23题涉及平衡计算、平衡标志、平衡图象,17分;上海卷第25题考查平衡常数、平衡图象分析,延伸考查侯氏制碱法中的平衡移动原理,8分。
(2)2004年全国卷Ⅰ第29题是一道关于平衡的计算,16分;全国卷Ⅱ为湖北卷,几乎未考平衡知识;全国卷Ⅲ第9题是影响化学反应速率的因素,6分;北京卷、天津卷均考查等效平衡的计算和分析,各6分。
江苏卷第18题是平衡图象分析题,5分;广东卷第9、18题考查平衡计算和图象分析,8分;上海卷第24题考查了平衡常数、平衡计算与图象分析。
2003年江苏卷考查了一道等效平衡的大型综合题,理综卷中的选择题考查的也是等效平衡思想。
二、试题特点近三年是高考命题走向多元化的三年,每年都有一百多道高考试题呈现在我们面前,这些试题中既保留了大量的传统题,又创新了不少新颖题,其命题理念、创新手法、设计水平和呈现形式与时俱进,异彩纷呈,是研究高考、指导备考的重要依据。
分析近三年的化学平衡试题,总体上呈现以下特点。
1、题量稳定,赋分合理,体现本章地位化学平衡是高考中的必考知识,且题量和赋分基本保持稳定。
2020-2021高考化学化学反应速率与化学平衡综合题汇编及详细答案

2020-2021高考化学化学反应速率与化学平衡综合题汇编及详细答案一、化学反应速率与化学平衡1.影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究。
实验一:他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5 mol/L、2 mol/L、18.4 mol/L)。
设计实验方案来研究影响反应速率的因素。
甲同学研究的实验报告如下表实验步骤现象结论①分别取等体积的2mol/L的硫酸于试管中②反应速率Mg>Fe,Cu不反应金属的性质越活泼,反应速率越快(1)甲同学表中实验步骤②为____________________(2)甲同学的实验目的是:在相同的温度下,__________________________________。
实验二:乙同学为了更精确的研究浓度对反应速率的影响,利用下图所示装置进行定量实验。
(3)乙同学在实验中应该测定的数据是______________。
(4)乙同学完成该实验应选用的实验药品是______________________;该实验中不选用某浓度的硫酸,理由是_________________________。
【答案】分别投入大小、形状相同的Cu、Fe、Mg 研究金属(或反应物)本身的性质与反应速率的关系一定时间内产生气体的体积(或产生一定体积的气体所需时间) Mg(或Fe)和0.5 mol/L硫酸和2 mol/L硫酸常温下Mg与18.4 mol/L硫酸反应生成SO2,Fe在18.4 mol/L硫酸中钝化【解析】【分析】(1)要比较金属和稀硫酸的反应快慢,则应该使金属的形状和大小都是相同的,即分别投入形状、大小相同的Cu、Fe、Mg;(2)根据步骤和现象,目的是探究金属(反应物)本身的性质与反应速率的关系;(3)要定量研究,需要测定一定时间内产生气体的体积(或产生一定体积的气体所需要的时间);(4)浓硫酸和金属反应不能生成氢气,而铜与稀硫酸又不反应,所以选择的药品是Mg (或Fe)、0.5ol/L硫酸和2mol/L硫酸。
高考化学化学平衡考点汇总

高考化学化学平衡考点汇总化学平衡是高考化学中的重要考点之一,理解和掌握这部分知识对于应对高考至关重要。
接下来,让我们对高考中化学平衡的相关考点进行一个全面的汇总。
一、化学平衡的概念化学平衡状态是指在一定条件下,可逆反应中正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态。
需要注意的是,化学平衡是一种动态平衡,即正、逆反应仍在进行,只是速率相等。
达到平衡状态时,反应体系中各物质的浓度不再随时间改变,但反应并没有停止。
二、化学平衡的特征1、等:正反应速率等于逆反应速率。
2、定:平衡混合物中各组分的浓度保持一定。
3、动:化学平衡是动态平衡,正、逆反应仍在进行。
4、变:当外界条件改变时,原平衡被破坏,在新的条件下会建立新的平衡。
三、化学平衡状态的判断判断一个可逆反应是否达到化学平衡状态,可以从以下几个方面入手:1、正逆反应速率相等:同一物质的生成速率和消耗速率相等;或者不同物质的正、逆反应速率之比等于它们的化学计量数之比。
2、各组分的浓度保持不变:包括各物质的物质的量浓度、质量分数、体积分数等不再改变。
3、体系的物理量不变:如体系的温度、压强、颜色、密度等不再改变(前提是这些物理量与反应的平衡移动有关)。
四、影响化学平衡的因素1、浓度增大反应物浓度或减小生成物浓度,平衡向正反应方向移动;减小反应物浓度或增大生成物浓度,平衡向逆反应方向移动。
2、压强对于有气体参加且反应前后气体分子数发生变化的反应,增大压强,平衡向气体分子数减小的方向移动;减小压强,平衡向气体分子数增大的方向移动。
对于反应前后气体分子数不变的反应,改变压强,平衡不移动。
3、温度升高温度,平衡向吸热反应方向移动;降低温度,平衡向放热反应方向移动。
4、催化剂使用催化剂能同等程度地改变正、逆反应速率,化学平衡不移动,但能缩短达到平衡的时间。
五、勒夏特列原理如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动。
2014年—2023年高考化学弱电解质的电离平衡真题汇编+答案

2014年—2023年高考化学弱电解质的电离平衡真题汇编+答案(真题部分)1.(2023浙江1月选考,13,3分)甲酸(HCOOH)是重要的化工原料。
工业废水中的甲酸及其盐,通过离子交换树脂(含固体活性成分R3N,R为烷基)因静电作用被吸附回收,其回收率(被吸附在树脂上甲酸根的物质的量分数)与废水初始pH关系如图(已知甲酸K a=1.8×10-4),下列说法不正确...的是()A.活性成分R3N在水中存在平衡:R3N+H2O R3NH++OH-B.pH=5的废水中c(HCOO-)∶c(HCOOH)=18C.废水初始pH<2.4,随pH下降,甲酸的电离被抑制,与R3NH+作用的HCOO-数目减少D.废水初始pH>5,离子交换树脂活性成分主要以R3NH+形态存在2.(2022湖北,12,3分)根据酸碱质子理论,给出质子(H+)的物质是酸,给出质子的能力越强,酸性越强。
已知:N2H5++NH3N H4++N2H4 N2H4+CH3COOHN2H5++CH3COO-下列酸性强弱顺序正确的是()A.N2H5+>N2H4>N H4+B.N2H5+>CH3COOH>N H4+C.NH3>N2H4>CH3COO-D.CH3COOH>N2H5+>N H4+3.(2022湖北,15,3分)下图是亚砷酸As(OH)3和酒石酸(H2T,lg K a1=-3.04,lg K a2=-4.37)混合体系中部分物种的c-pH图(浓度:总As为5.0×10-4 mol·L-1,总T为1.0×10-3 mol·L-1)。
下列说法错误的是()A.As(OH)3的lg K a 1为-9.1B.[As(OH)2T]-的酸性比As(OH)3的强C.pH=3.1时,As(OH)3的浓度比[As(OH)2T]-的高D.pH=7.0时,溶液中浓度最高的物种为As(OH)34.(2022全国乙,13,6分)常温下,一元酸HA 的K a (HA)=1.0×10-3。
三年(2022-2024)高考化学真题分类汇编(全国通用)专题08化学反应速率与化学平衡(解析版)
三年真题二]4<08化肾反固速卑与化肾年衡昌字窖僵。
痹匆演考点三年考情(2022・2024)命题趋势考点1化学反应速率与化学平衡♦化学反应速率:2024安徽卷、2024江苏卷、2024甘肃卷、2023广东卷、2023山东卷、2023辽宁卷、2023浙江卷、2022广东卷、2022北京卷、2022河北卷、2022浙江卷♦化学平衡:2024黑吉辽卷、2024山东卷、2024江苏卷、2024浙江卷、2024湖南卷、2023北京卷、2023湖南卷、2023山东卷、2022天津卷、2022重庆卷、2022江苏卷、2022浙江卷、2022北京卷、2022辽宁卷、2022湖南卷选择题中对于化学反应速率和化学平衡内容的考查不算太多,这是因为在主观题中,化学反应速率和化学平衡才是考查的重头戏。
随着新高考单科卷的实行,选择题题量大增,有关化学反应速率和化学平衡试题的考查在选择题中开始有所增加,考查的核心知识还是有关化学反应速率的比较、计算和影响因素的判断,化学平衡常数、转化率、物质的浓度的计算,以及平衡移动原理的分析等,常结合坐标图像或表格进行考查。
考法01化学反应速率1.(2024.安徽卷)室温下,为探究纳米铁去除水样中SeO?-的影响因素,测得不同条件下SeC^-浓度随时间变化关系如下图。
"一。
点,0云下列说法正确的是A. 实验①中,。
〜2小时内平均反应速率v (SeO42-)=2.0mol ・L-i.h-i实验序号水样体积/mL纳米铁质量/mg 水样初始pH①5086②5026③5028B. 实验③中,反应的离子方程式为:2Fe+SeO 42+8H +=2Fe 3++Se+4H 2OC. 其他条件相同时,适当增加纳米铁质量可加快反应速率D. 其他条件相同时,水样初始pH 越小,SeCU2-的去除效果越好【答案】C【解析】A.实验①中,。
〜2小时内平均反应速率v (SeO ;)*5・0xl0 3-一3moi.L 』.h 」,A 不正确;B. 实验③中水样初始pH =8,溶液显弱碱性,发生反应的离子方程式中不能用H+配电荷守恒,B 不正确;C. 综合分析实验①和②可知,在相同时间内,实验①中SeO :浓度的变化量大,因此,其他条件相同时,适当增加纳米铁质量可加快反应速率,C 正确;D. 综合分析实验③和②可知,在相同时间内,实验②中Se 。
近几年高考化学平衡试题考查特点

近几年高考化学平衡试题考查特点一、图表题增多并突出计算创新,如用压强代替浓度,联系阿伏伽德罗定律考查平衡常数、转化率等相关计算。
1、一定量得CO2与足量得碳在体积可变得恒压密闭容器中反应:C(s)+CO2(g)2CO(g)。
平衡时,体系中气体体积分数与温度得关系如下图所示:已知:气体分压(P分)=气体总压(P总)×体积分数。
下列说法正确得就是( )A.550℃时,若充入惰性气体,v正,v逆均减小,平衡不移动B.650℃时,反应达平衡后CO2得转化率为25、0%C.T℃时,若充入等体积得CO2与CO,平衡向逆反应方向移动D.925℃时,用平衡分压代替平衡浓度表示得化学平衡常数K P=24、0P总【答案】B【解析】选项A中,因容器得体积可变,故充入惰性气体后容器体积变大,混合气体整体被稀释,反应应正向移动,故A错误。
选项B中,设转化得CO2为x,则CO为2X,剩下得CO2为(1-X),由题可知,(1-X)/2X=60%/40%,解得x=0、25,故选项B正确。
选项C中,当同时充入CO2与CO时若要保证平衡不移动,则需要按照反应系数进行添加,即在加入1体积CO2时加入2体积CO,而此时就是等体积加入,相当于CO加少了,平衡应正向移动,故C错误。
选项D中,通过题目所给条件计算KP应等于23、0P总,故D错误。
2、研究了下列反应:2HI(g)H2(g)+I2(g)在716K时,气体混合物中碘化氢得物质得量分数x(HI) t/min 0 20 40 60 80 120X(HI) 1 0、91 0、85 0、815 0、795 0、784X(HI) 0 0、60 0、73 0、773 0、780 0、784①根据上述实验结果,该反应得平衡常数K得计算式为:___________。
②上述反应中,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)x(I2),其中k正、k 逆为速率常数,则k逆为________(以K与k正表示)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
近几年高考化学平衡试题考查特点一、图表题增多并突出计算创新,如用压强代替浓度,联系阿伏伽德罗定律考查平衡常数、转化率等相关计算。
1、一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)2CO(g)。
平衡时,体系中气体体积分数与温度的关系如下图所示:已知:气体分压(P分)=气体总压(P总)×体积分数。
下列说法正确的是()A.550℃时,若充入惰性气体,v正,v逆均减小,平衡不移动B.650℃时,反应达平衡后CO2的转化率为25.0%C.T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动D.925℃时,用平衡分压代替平衡浓度表示的化学平衡常数K P=24.0P总【答案】B【解析】选项A中,因容器的体积可变,故充入惰性气体后容器体积变大,混合气体整体被稀释,反应应正向移动,故A错误。
选项B中,设转化的CO2为x,则CO为2X,剩下的CO2为(1-X),由题可知,(1-X)/2X=60%/40%,解得x=0.25,故选项B正确。
选项C 中,当同时充入CO2和CO时若要保证平衡不移动,则需要按照反应系数进行添加,即在加入1体积CO2时加入2体积CO,而此时是等体积加入,相当于CO加少了,平衡应正向移动,故C错误。
选项D中,通过题目所给条件计算KP应等于23.0P总,故D错误。
2、研究了下列反应:2HI(g)H2(g)+I2(g)在716K时,气体混合物中碘化氢的物t/min 0 20 40 60 80 120X(HI) 1 0.91 0.85 0.815 0.795 0.784X(HI) 0 0.60 0.73 0.773 0.780 0.784①根据上述实验结果,该反应的平衡常数K的计算式为:___________。
②上述反应中,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)x(I2),其中k 正、k逆为速率常数,则k逆为________(以K和k正表示)。
若k正=0.0027min-1,在t=40,min 时,v正=__________min-1③由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用下图表示。
当升高到某一温度时,反应重新达到平衡,相应的点分别为_________________(填字母)根据题意可知2HI(g)H2(g)+I2(g)初始1mol·L-1 0 0平衡0.784mol·L-10.108mol·L-10.108mol·L-1所以K=0.1082/0.7842;平衡时v正=v逆,所以k正x2(HI) =k逆x(H2)x(I2),结合平衡常数表达式可知k逆=K·k正,v正=k正x2(HI)=0.0027min-1ⅹ(0.85)2=1.95×10-3。
3、甲醇是重要的化工原料,又可称为燃料。
利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:①CO(g)+2H 2(g)CH3OH(g) △H1②CO 2(g)+3H2(g)CH3OH(g)+H2O(g) △H2③CO 2(g)+H2(g)CO(g)+H2O(g) △H3回答下列问题:(1)已知反应①中的相关的化学键键能数据如下:化学键H—H C—O C O H—O C—HE/(kJ.mol-1)436 343 1076 465 413由此计算△H1=kJ·mol-1,已知△H2=-58kJ·mol-1,则△H3=kJ·mol-1。
(2)反应①的化学平衡常数K的表达式为;图1中能正确反映平衡常数K随温度变化关系的曲线为(填曲线标记字母),其判断理由是。
(3)合成气的组成n(H2)/n(CO+CO2)=2.60时,体系中的CO平衡转化率(α)与温度和压强的关系如图2所示。
α(CO)值随温度升高而(填“增大”或“减小”),其原因是。
图2中的压强由大到小为_____ ,其判断理由是_____ 。
【答案】(1)—99;+41(2);a;反应①为放热反应,平衡常数应随温度升高变小;(3)减小;升高温度时,反应①为放热反应,平衡向向左移动,使得体系中CO的量增大;反应③为吸热反应,平衡向右移动,又产生CO的量增大;总结果,随温度升高,使CO的转化率降低;P3>P2>P1;相同温度下,由于反应①为气体分子数减小的反应,加压有利于提升CO的转化率;而反应③为气体分子数不变的反应,产生CO的量不受压强影响,故增大压强时,有利于CO的转化率升高4.化合物AX3和单质X2在一定条件下反应可生成化合物AX5。
回答下列问题:(1)已知AX3的熔点和沸点分别为-93.6 ℃和76 ℃,AX5的熔点为167 ℃。
室温时AX3与气体X2反应生成 1 mol AX5,放出热量123.8 kJ。
该反应的热化学方程式为____________________________________________。
(2)反应AX 3(g)+X 2(g)AX 5(g)在容积为10 L 的密闭容器中进行。
起始时AX 3和X 2均为0.2 mol 。
反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
①列式计算实验a 从反应开始至达到平衡时的反应速率v(AX 5)=______________________。
②图中3组实验从反应开始至达到平衡时的反应速率v(AX 5)由大到小的次序为____________(填实验序号);与实验a 相比,其他两组改变的实验条件及判断依据是:b________________________________________________,c____________________________________________。
③用p0表示开始时总压强,p 表示平衡时总压强,α表示AX 3的平衡转化率,则α的表达式为______________;实验a 和c 的平衡转化率:αa 为________,αc 为________。
(1)AX3(l)+X2(g)===AX5(s) ΔH =-123.8 kJ/mol (2)①0.10 mol 10 L×60 min=1.7×10-4 mol·L -1·min -1解:开始时n0=0.4 mol ,总压强为160 kPa ,平衡时总压强为120 kPa ,则n 为120 kPa 160 kPa=n 0.40 mol, n =0.40 mol×120 kPa 160 kPa=0.30 mol , AX3(g)+X2(g) AX5(g)起始时n0/mol :0.20 0.20 0平衡时n/mol :0.20-x 0.20-x x(0.20-x)+(0.20-x)+x =0.30x =0.10v(AX5)=0.10 mol 10 L×60 min=1.7×10-4 mol·L -1·min -1 ②bca 加入催化剂。
反应速率加快,但平衡点没有改变 温度升高。
反应速率加快,但平衡点向逆反应方向移动(或反应容器的容积和起始物质的量未改变,但起始总压强增大) ③α=2(1-p p0) 50% 40% [解析] (1)书写热化学方程式时要注意常温下AX3呈液态,AX5呈固态。
(2)②由图像知,达到平衡所需时间:a >c >b ,所以反应速率v(AX5)由大到小的顺序为b >c >a ;与实验a 相比,实验b 先达到平衡,化学反应速率快,但平衡点没有变化,说明实验b 加入了催化剂;反应为放热反应,与实验a 相比,实验c 平衡向逆反应方向移动,且反应速率加快,说明实验c 改变的条件是升高温度。
AX3(g) + X2(g)AX5(g)起始量(mol) 0.2 0.2 0变化量(mol) x x x平衡量(mol) 0.2-x 0.2-x x则有0.4-x 0.4=p p0,解得x =0.4(p0-p )p0,则AX3的转化率为0.4(p0-p )0.2×p0=2(1-p p0);分别将实验a 、c 的p 、p0的数据代入上式,得aa 、ac 分别为50%、40%。
5、用Cl 2生产某些含氯有机物时会产生副产物HC1。
利用反应A ,可实现氯的循环利用。
反应A :4HCl +O 22Cl 2+2H 2O(1)已知:Ⅰ反应A 中, 4mol HCI 被氧化,放出115.6kJ 的热量。
ⅡH 2O 的电子式是_______________.②反应A 的热化学方程式是_______________。
③断开1 mol H —O 键与断开 1 mol H —Cl 键所需能量相差约为__________KJ ,H 2O 中H —O 键比HCl 中H —Cl 键(填“强”或“若”)_______________。
(2)对于反应A ,下图是4种投料比[n(HCl):n(O 2),分别为1:1、2:1、4:1、6:1、]下,反应温度对HCl 平衡转化率影响的曲线。
①曲线b 对应的投料比是______________.②当曲线b, c, d 对应的投料比达到相同的HCl 平衡转化率时,对应的反应温度与投料比的关系是_________________ . ③投料比为2:1、温度为400℃时,平衡混合气中Cl 2的物质的量分数是_______________.答案:(1) 4HCl +O22Cl2+2H2O △H=-115.6kJ ·mol -1;32;强(2) 4:1;投料比越小时对应的温度越低;30.8%6、硼酸(H 3BO 3)在食品、医药领域应用广泛。
(1)请完成B 2H 6气体与水反应的化学方程式:B 2H 6 + 6H 2O=2H 3BO 3 +________。
(2)在其他条件相同时,反应H 3BO 3 +3CH 3OH B(OCH 3)3 +3H 2O 中,H 3BO 3的转化率( )在不同温度下随反应时间(t )的变化见图12,由此图可得出:6070 80 90 100反应温度/℃ H C l 的平衡转化率/% abc d 400℃ CuO/CuCl2O O Cl ClO O Cl Cl 243KJ/mol键断裂 498KJ/mol键断裂400℃ CuO/CuCl2①温度对应该反应的反应速率和平衡移动的影响是_______ ②该反应的H ∆_____0(填“<”、“=”或“>”).(3)H 3BO 3溶液中存在如下反应:H 3BO 3(aq )+H 2O (l ) [B(OH)4]-( aq)+H +(aq )已知0.70 mol ·L-1 H 3BO 3溶液中,上述反应于298K 达到平衡时,c 平衡(H+)=2.0×10-5mol ·L-1,c 平衡(H 3BO 3)≈c 起始(H 3BO 3),水的电离可忽略不计,求此温度下该反应的平衡常数K (H 2O 的平衡浓度不列入K 的表达式中,计算结果保留两位有效数字)【解析】(1)根据元素守恒,产物只能是H2, 故方程式为B2H6 + 6H2O=2H3BO3 +6H2。
