臭氧的破坏机理]
臭氧层破坏的机理

臭氧层破坏的机理一、引言臭氧层是地球大气层中非常重要的一部分,它能够吸收太阳紫外线,保护地球上的生物免受紫外线的危害。
然而,随着人类活动的不断增加,臭氧层破坏问题也越来越严重。
本文将从机理方面介绍臭氧层破坏的原因。
二、臭氧层的形成和作用1. 臭氧层形成臭氧层是由大量高能量紫外线辐射作用于大气中的氧分子(O2)形成的。
这种辐射会将O2分子分解为单个氧原子(O),随后这些单个氧原子会与其他O2分子结合形成臭氧(O3)。
2. 臭氧层作用臭氧层能够吸收太阳紫外线中最短波长(200-290纳米)的部分,这部分紫外线对生物体伤害最大。
如果没有臭氧层存在,这些紫外线将直接照射到地球表面,并对生物体造成伤害。
三、臭氧层破坏的原因1. 氯氟烃类物质氯氟烃类物质是臭氧层破坏的主要原因之一。
这些物质包括氯氟烷(CFCs)、卤代甲烷(Halons)和溴化物(Bromides)等。
这些物质在大气中会逐渐分解,释放出氯、溴等化学元素,这些元素会与臭氧反应,形成一系列的化合物,最终导致臭氧层的破坏。
2. 氮氧化物二氧化氮和一氧化二氮等氮氧化物也是臭氧层破坏的原因之一。
这些物质会与臭氧发生反应,生成一种叫做亚硝基过程的反应链,最终导致大量的臭氧被消耗掉。
3. 紫外线辐射紫外线辐射也是导致臭氧层破坏的原因之一。
紫外线能够将O3分解为O2和单个O原子,从而降低了臭氧层中O3的浓度。
4. 温室效应温室效应也可能对臭氧层产生影响。
随着温室气体的增加,大气层中的温度也会上升,这可能会导致臭氧层的下降。
四、结论臭氧层破坏是一个非常严重的问题,它对地球上的生物体造成了巨大的危害。
目前,国际社会已经采取了一系列措施来减缓臭氧层破坏问题。
这些措施包括限制和禁止使用氯氟烃类物质、减少二氧化碳等温室气体排放等。
我们应该认识到保护臭氧层是我们每个人都应该承担的责任。
氯原子对臭氧层破坏的作用机理

现状
虽然平流层臭氧对地球生命具有如此特殊 重要的意义,然而事实上臭氧层在大气中只是 极其微少和脆弱的一层气体。近三十年来,人 们逐渐认识到平流层大气中的臭氧正在遭受着 越来越严重的破坏。 目前已知的破坏臭氧层的物质有NOX、 HOX、ClOX等。
Cl原子对平流层臭氧层的破坏机 制
• 平流层中ClOX的来源:
• 参考文献: • 《大气臭氧化学研究进展》贾龙 • 《大气臭氧层的形成及破坏机理的研究》 王俊萍 • 《同温层臭氧层破坏的机理》杨启文 • 《环境化学》
在氯 臭原 氧子 层 破 坏 中 的 作 用 机 理
O3
臭氧层是指大气层的平流层中臭氧浓度 相对较高的部分,其主要作用是吸收短波 紫外线。犹如一件保护伞保护地球上的生 物得以生存繁衍 。 O 2→ 2 O O2+ O→ O3 Y主要是指平流层中的三类物质,即奇 Y+ O3→ YO+ O2 氮(NO,NO2),奇氢(OH,HO2)和奇氯(Cl, ClO) 等 YO+ O→ Y+ O2 O3+ O→ 2O2
• a.甲基氯光解 • b.氟氯甲烷的光解 • c.氟氯甲烷与O· (1D)的反应
Cl原子对平流层臭氧层的破坏机 制
• ClOX破坏O3层的过程可通过如下循环反应
进行
• Cl·+ O3 → ClOX + O2 • ClO ·+ O · → Cl ·+ O2 (决速步骤) • 总反应:O3 + O ·→ 2O2
Cl原子对南极上空臭氧层机制
• 机制B:
Cl原子对南极上空臭氧层的破坏 机制
• 机制C:
总结
臭氧层作为地球的保护伞,如今出现漏 洞,现状不容乐观。对臭氧层问题的深入研 究刚刚起步,对于Cl原子对臭氧层的破坏机 理的探究是一个不断发展的过程。虽然我们 并没有将破坏机理研究透彻,但这依然挡不 住我们保护环境的一点一滴。目前主要的保 护措施有减少氟利昂等污染物的使用,加快 开发替代品的进程。
自然科普知识:臭氧层破坏的原因

自然科普知识:臭氧层破坏的原因自从发现南极上空出现臭氧空洞以后,科学家们经过近十年的研究,最后得出一致的结论:臭氧层的破坏和臭氧空洞的出现,是人类自身行为造成的,也就是人们在生产和生活中大量地生产和使用“消耗臭氧层物质(ODS)”以及向空气中排放大量的废气造成的。
ODS主要包括下列物质:CFCs(氯氟烃)、哈龙(Halon,全溴氟烃)、四氯化碳、甲基氯仿、溴甲烷等。
ODS的用途:用作制冷剂、喷雾剂、发泡剂、清洗剂等。
废气:主要是汽车尾气、超音速飞机排出的废气、工业废气等。
在上述所有物质中,破坏力的(或者称之为“罪魁祸首”)是CFCs和哈龙。
而在我们生活中用的最多的就是我们大家所熟悉的CFCs。
CFCs是氟里昂的一部分。
是上世纪30年代由美国杜邦公司开发和生产的一种氯氟烃类的制冷剂,并且冠以商标名称为“氟里昂”。
而现今,人们习惯于把制冷剂统称为“氟里昂”。
有资料显示:从20世纪的30年代初到90年代的五六十年中,人类总共生产了1500万吨氯氟烃。
人类开发了氯氟烃,使自己的生活提升了档次,却带来了一个巨大的环境问题--臭氧层的破坏。
臭氧层破坏机理(1)、废气破坏臭氧层废气中含有大量的氮氧化物(如N0和N02等),这些氮氧化物能够破坏掉大量的臭氧分子,从而造成臭氧层的破坏。
(2)、CFCs和哈龙对臭氧层的破坏美国科学家莫里纳(Molina)和罗兰德(Rowland)提出:人工合成的一些含氯和含溴的物质是造成臭氧层被破坏的元凶,最典型的是氯氟烃类化合物(CFCs)和含溴化合物哈龙(Halons)。
CFCs和哈龙在生产和使用过程中总是要泄漏的,泄漏后首先进入大气的对流层中。
而这些物质在对流层中是化学惰性的,即它们在对流层中十分稳定,能够存有几十年甚至上百年不发生变化。
但这些物质不可能总是存有于对流层中,通过极地的大气环流以及赤道地带的热气流上升,最终使这些物质进入平流层。
然后又在风的作用下,把它们从低纬度地区向高纬度地区输送,在平流层内混合均匀。
臭氧层破坏及其原因
臭氧层破坏及其原因约10亿年前,随着生物的进化,地球上由于好氧生物的产生和光自养生物(主要是绿色植物)的增多,加速了大气中游离氧的含量,在平流层中逐渐形成了臭氧层。
O2+光(波长为242纳米)—→2OO2+O—→O3臭氧层主要分布在距地球表面25~40千米的平流层中,但即使在那里,10万个气体分子中也只有1个臭氧分子,总的累积厚度平均也仅0.3厘米左右,然而就是这一层薄薄的臭氧层成了生命的防线,能强烈地吸收太阳光中90%波长为220-330纳米的紫外线辐射:O3+紫外线—→O2+OO+O—→O2+热量如果没有臭氧层的保护,所有紫外线会落到地面上,那么,日光晒焦的速度将比夏天的烈日下快50倍,几分钟内地球上的树木全被烧焦,所有生物都将被杀死,生机勃勃的世界就会变成荒漠及焦土。
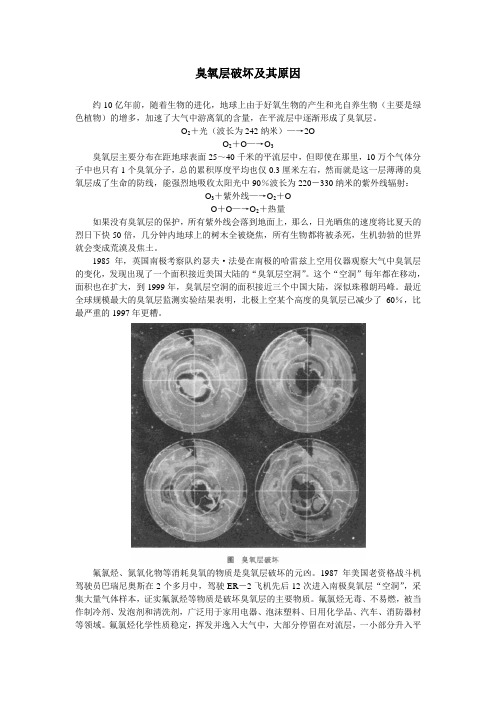
1985年,英国南极考察队约瑟夫·法曼在南极的哈雷兹上空用仪器观察大气中臭氧层的变化,发现出现了一个面积接近美国大陆的“臭氧层空洞”。
这个“空洞”每年都在移动,面积也在扩大,到1999年,臭氧层空洞的面积接近三个中国大陆,深似珠穆朗玛峰。
最近全球规模最大的臭氧层监测实验结果表明,北极上空某个高度的臭氧层已减少了60%,比最严重的1997年更糟。
氟氯烃、氮氧化物等消耗臭氧的物质是臭氧层破坏的元凶。
1987年美国老资格战斗机驾驶员巴瑞尼奥斯在2个多月中,驾驶ER-2飞机先后12次进入南极臭氧层“空洞”,采集大量气体样本,证实氟氯烃等物质是破坏臭氧层的主要物质。
氟氯烃无毒、不易燃,被当作制冷剂、发泡剂和清洗剂,广泛用于家用电器、泡沫塑料、日用化学品、汽车、消防器材等领域。
氟氯烃化学性质稳定,挥发并逸入大气中,大部分停留在对流层,一小部分升入平流层。
在对流层相当稳定的氟氯烃上升进入平流层后,在一定气象条件和紫外线的照射下会分解生成一种氯自由基(Cl·)。
这种氯自由基的反应能力极强,导致臭氧迅速分解。
CF3Cl+紫外线—→CF3·+Cl·Cl·+O3—→ClO·+O2在平流层中的自由氧原子还会与ClO·自由基反应:O+ClO·—→Cl+O2反应产生的Cl·又会进一步破坏臭氧。
臭氧层的形成和化学破坏

臭氧层的形成和化学破坏摘要:臭氧层的破坏,是人类面临的三大环境问题之一.臭氧层担当着防止高能紫外线辐射直接照到地球表层大气的作用,因而臭氧层的存在是与人类健康及生态平衡关系密切的问题.随着现代工业的发展,平流层大气受到污染,臭氧层遭到破坏.自从二十世纪70年代Crutzen发现臭氧层遭到破坏以来,世界各国对此问题非常重视,做了大量研究,已基本弄清臭氧层的形成、作用及被破坏机理等问题,并制定了保护臭氧层的一系列国际公约,使臭氧层被破坏的速度得以减缓.关键词:形成;机理;保护作者简介:王国栋(1985-),男,本科,中学二级教师,陕西户县人,研究方向:高中化学教学研究. 一、臭氧层的形成在平流层中,氧气吸收波长为180nm-240nmUV(紫外线)光而使氧气分子分解:O2+hν→O+O自由的O原子和其它的O2分子形成臭氧,该反应被认为是平流层中臭氧的唯一来源:O2+O+M → O3+M但臭氧也会发生光解而遭到破坏:O3+O → O2+O2可见,平流层中同时存在着臭氧的产生和臭氧的分解两种光化学过程,这两种过程在光的作用下会达到动态平衡.最终,在离地面25km-30km的高空,就形成一浓度相对较大和稳定的臭氧层,阻挡了对人类有害的高能紫外线. 二、臭氧层化学破坏的机理目前,人类认为直接破坏臭氧层的物质有:氮氧化物、氢氧自由基和卤代烷烃等.1.氮氧化物对臭氧层的破坏作用存在于大气中的氮氧化物有:N2O、NO、NO2. N2O是自然界微生物活动的产物,大气中含量很少,活性较小,在低层大气中被认为是非污染性气体,当其扩散至平流层后,可被转化为一氧化氮: N2O+O → NO+NO N2O+hν→ NO+N平流层中破坏臭氧的污染物为NO:O3+NO → NO2+O2NO2也能与平流层中较丰富的氧原子反应:NO2+O → NO+O2该反应速率较快,生成的一氧化氮再次破坏臭氧,可以认为是在一氧化氮催化下加速了臭氧与氧原子的反应:O3+ONOO2+O2据研究,一个N2O分子产生的NO引发上述链式反应,可破坏105个臭氧分子.一氧化氮来源有两种方式,自然来源由一氧化二氮产生,人工源主要来自于平流层下部飞行的超音速飞机排放的废气.其排放的废气中所含的氮氧化物及水气均可破坏臭氧.2.氢氧自由基对臭氧层的破坏平流层中HO?自由基的来源主要来自喷气机排放的废气中的水气,其与臭氧的反应:HO?+O3 → O2+HO2? HO2?+O → O2+HO?HO?自由基反复产生,其实质是在HO?自由基催化作用下臭氧与氧原子反应生成氧分子:O3+OHO?O2+O23.卤代烷烃对臭氧层的破坏(1)氟利昂氟利昂是含氟氯饱和烃类的总称.Rowland和Molina于1974年提出了CFCs理论,阐明了氟利昂影响臭氧层厚度的机理.以CCl2F2为例:CCl2F2+hν→ CF2Cl?+Cl光解产生的Cl原子与臭氧发生作用,使臭氧遭到破坏:O3+Cl → ClO?+O2ClO?+O → Cl+O2 ClO?+O3 → ClO2?+O2 ClO2?+hν → Cl+O2 … …其实质是在Cl原子催化下,臭氧与氧原子反应,生成氧分子:O3+O Cl O2+O2科学家证实,随着大气层高度的增加,氯原子对臭氧的破坏作用增强,当处于平流层时,一个氯原子可以分解掉105个O3分子.因此,氟利昂对平流层中的臭氧有巨大的破坏作用.(2)哈隆哈隆是一类含溴卤代甲、乙烷的商品名,主要用做灭火器.哈隆破坏臭氧层的机理与氟利昂类似,实质是在溴原子催化作用下,臭氧与氧原子反应: O3+O Br O2+O2研究结果表明,在平流层中,哈隆比氟利昂破坏更大. (3)其它卤代烷烃工农业生产中应用的氯仿(CHCl3)、甲基氯仿(CH3CCl3)等其它氯代烷?N也同样分解破坏臭氧.综上所述,氮氧化物、HO?自由基、氟氯代烃等破坏臭氧层的机理是:这些物质分别产生的NO、HO?自由基、氯或溴原子等作为催化剂,加速了臭氧与氧原子的反应. 几种破坏臭氧层的物质中,主要危害物为氮氧化物,约占破坏总量的65%,其次为HO?自由基,约为20%,卤代烷烃类约占10%,自然破坏仅占5%左右. 三、臭氧层的保护1987年,联合国26个会员国在加拿大蒙特利尔签署了环境保护公约《蒙特利尔破坏臭氧层物质管制议定书》,又称《蒙特利尔议定书》.该议定书禁止或淘汰使用耗蚀臭氧层的化学品,其中包括曾广泛用于冰箱和喷雾器中的氟氯碳化物,自1989年1月1日起生效,开始了全球保护臭氧层的行动.1995年联合国大会决定,每年的9月16日为国际保护臭氧层日.联合国组织300名科学家对大气臭氧水平进行持续监测,每4年为一个评估期.随着世界各国的努力,臭氧层在2000年�D2021年间变厚了4%,南极洲上空的臭氧空洞也停止扩大.臭氧层虽然有所恢复,但离痊愈还很遥远,人类的保护行动依然任重道远. 参考文献:[1]成广兴,邵军.臭氧层的化学破坏及其对策.化学通报,1999,(9):44~47.[2]汪桂斌.环境化学的回顾与展望.化学通报,1999,(11):14~15.[3]龚书椿,陈应新,韩玉莲,张静贞.环境化学,上海:华东师范大学出版社,1991:133~137.[4]大连理工大学无机化学教研室编.无机化学(第4版),北京:高等教育出版社,2001:14~15.感谢您的阅读,祝您生活愉快。
【精品】臭氧层破坏与防治对策

臭氧层破坏与防治对策臭氧层破坏与防治对策摘要:在距离地球表面15~25公里处,聚集了大气中90%的臭氧,我们将这一层高浓度的臭氧称为"臭氧层"。
臭氧对太阳的紫外线辐射有很强的吸收作用,能有效地阻挡对地表生物有伤害作用的短波紫外线。
因此,我们可以推测,直到臭氧层形成之后生命才有可能在地球上生存,延续和发展.臭氧层是地表生物系统的"保护伞".本文将着重讨论臭氧层空洞的形成原因与防治措施,并结合现状对臭氧层空洞的危害进行了详细的分析。
最后,呼吁加强环境保护,防治臭氧层空洞。
关键词:臭氧层原因现状危害防治措施目录摘要 (2)关键词 (2)一、引言 (4)二、臭氧层简介 (4)(一)臭氧层的作用 (4)(二)大气中臭氧层现状及发展 (5)三、臭氧层破坏以及危害 (6)(一)臭氧空洞的成因 (6)(二)臭氧空洞的危害 (8)四、臭氧层空洞的防范和保护措施 (9)参考文献 (14)一、引言1984年,英国科学家法尔曼等人在南极哈雷湾观测站发现:在过去 10 —15 年间,每到春天南极上空的臭氧浓度就会减少约 30%,极地上空的中心地带有近 95% 的臭氧被破坏。
从地面上观测,高空的臭氧层已极其稀薄,与周围相比像是形成一个“洞”,“臭氧洞”由此而得名,这是人类历史上第一次发现臭氧空洞,当时观察此洞覆盖面积只有美国的国土面积那么大。
臭氧空洞越来越大,危害越来越严重,已经逐渐引起了全社会的重视。
那么,地球大气中臭氧层的作用是什么,现状如何,臭氧空洞是如何形成的,对人类及地球有何危害呢,有没有补救的措施?现简单介绍如下。
二、臭氧层简介(一)臭氧层的作用臭氧层中的臭氧是在离地面较高的大气层中自然形成的,其形成机理是:O2 +hv——→O+O (高层大气中的氧气受波长短于242nm的紫外线照射变成游离的氧原子);O2+O =O3 (有些游离的氧原子又与氧气结合就生成了臭氧,大气中 90%的臭氧是以这种方式形成的);O3是不稳定分子,来自太阳的短于1140nm射线照射又使O3分解,产生O2分子和游离O原子,因此大气中臭氧的浓度取决于其生成与分解速度的动态平衡。
臭氧灭菌作用与原理介绍
•臭氧的基本性质•臭氧的灭菌作用•臭氧灭菌的原理•臭氧灭菌的应用范围及限制目录01臭氧的基本性质Chapter臭氧的定义臭氧的化学性质臭氧的定义与化学性质自然产生人为产生臭氧的产生与来源臭氧的稳定性在常温常压下,臭氧是极其不稳定的,容易分解为氧气。
影响因素温度、湿度、光照等环境因素都会影响臭氧的稳定性。
臭氧的稳定性及其影响因素02臭氧的灭菌作用Chapter臭氧(O3)是一种强氧化剂,能够迅速与微生物细胞膜上的脂类双键起化学反应,引起细胞膜的损坏,从而破坏微生物的细胞结构,达到杀灭微生物的目的。
臭氧还能与微生物的酶和蛋白质发生反应,使其失去活性,从而达到杀灭微生物的效果。
臭氧的灭菌效果取决于臭氧的浓度、作用时间和微生物的种类和数量。
臭氧对微生物的杀灭机理臭氧与其他消毒方法的比较VS与紫外线消毒相比,臭氧具有更强的氧化能力和更广泛的杀菌范围,能够杀灭细菌、病毒、霉菌等多种微生物。
与化学消毒剂相比,臭氧具有更环保、更安全的优点,不会产生有害残留物和抗药性。
03臭氧灭菌的原理Chapter产生活性氧臭氧在空气中分解会产生大量的活性氧,这些活性氧具有极强的氧化能力,能够快速与微生物表面的有机物质发生反应,破坏其细胞壁和细胞膜,导致微生物死亡。
臭氧在空气中分解产生的自由基灭菌机理破坏微生物的生物分子活性氧也能够破坏微生物的生物分子,如DNA 和RNA ,进一步干扰其正常生理功能,加速微生物的死亡。
产生氧气当臭氧在空气中分解时,除了产生活性氧外,还会生成氧气。
氧气是一种细胞呼吸过程中必不可少的物质,对于大多数微生物来说,氧气是它们正常生长和繁殖所必需的。
因此,臭氧在空气中分解时产生的氧气可以抑制某些厌氧微生物的生长。
04臭氧灭菌的应用范围及限制Chapter臭氧灭菌在医疗环境中的应用医院消毒在牙科治疗中,臭氧可以用于对牙椅、治疗器械等进行消毒,以减少交叉感染的风险。
牙科消毒血液透析中心消毒研究开发新型臭氧发生器及控制技术创新臭氧发生器设计发展智能控制技术探索臭氧在其他领域的应用拓展THANKS FOR WATCHING 感谢您的观看。
第二章 大气环境化学 (10)臭氧层的形成与耗损
十、臭氧层的形成与耗损1.臭氧层破坏的化学机理平流层中的臭氧来源于平流层中O2 的光解:O2 + hν(λ≤243nm) → O + OO + O2 + M → O3 + M平流层中的臭氧的消除途径有两种①臭氧光解:O3 + hν → O2 + O②能够使平流层的O3 真正被清除的反应为O3 与O 的反应:O3 + O → 2O2由于人类活动的影响,水蒸气、氮氧化物、氟氯烃等污染物进入了平流层,在平流层形成了HO x、NO x 和ClO x 等活性基团,从而加速了臭氧的消除过程,破坏了臭氧层的稳定状态。
(1)平流层中NO x对臭氧层破坏的影响平流层中NO x 主要存在于25km 以上的大气中,其数量约为10μL/m3。
在25km 以下的平流层大气中所存在的含氮化合物主要是HNO3。
①平流层中NO x的来源(a)N2O 的氧化N2O 是对流层大气中含量最高的含氮化合物,主要来自于土壤中硝酸盐的脱氮和铵盐的硝化。
因此,天然来源是其产生的主要途径。
由于N2O 不易溶于水,在对流层中比较稳定,停留时间较长,因此,可通过扩散作用进入平流层。
进入平流层的N2O 有90%会通过光解形成N2:N2O+ hν(λ≤243nm) →N2+O有2%会氧化形成NO:N2O + O → 2NO因此,N2O 在平流层的氧化是平流层中NO 和NO2 的主要天然来源。
(b)超音速和亚音速飞机的排放(c)宇宙射线的分解这个来源所产生的NO x 数量较少。
②NO x清除O3的催化循环反应NO + O3 → NO2 + O2NO2 + O• → NO + O2总反应:O3 + O• → 2O2该反应主要发生在平流层的中上部。
如果是在较低的平流层,由于O•的浓度低,形成的NO2 更容易发生光解,然后与O•作用,进一步形成O3:NO2 → NO + O•O• + O2 + M → O3因此,在平流层底部NO 并不会促使O3 减少。
③NO x的消除(a)由于NO 和NO2 都易溶于水,当它们被下沉的气流带到对流层时,就可以随着对流层的降水被消除,这是NO x 在平流层大气中的主要消除方式。
氮氧化合物破坏臭氧机理
氮氧化合物破坏臭氧机理
臭氧层是大气中一种非常重要的气体,它能够吸收紫外线,有效
地保护着地球及其生命系统。
然而,随着全球工业和人口的增加,臭
氧层遭到了严重破坏,其中一部分原因就是氮氧化合物的排放。
那么,氮氧化合物究竟是如何破坏臭氧层的呢?
首先,氮氧化合物包括NO、NO2、N2O等物质,这些化合物可以
通过人类活动的各种途径排放到大气中,比如农业、交通运输等。
对
于破坏臭氧层而言,最重要的是NO和NO2。
这是因为它们可以参与一
系列复杂的化学反应过程,从而导致臭氧的减少。
其次,NO和NO2在大气中可以互相转化。
其中,NO可以与O3反
应生成NO2和O2,在此反应中,NO起到催化剂的作用。
然而,NO2与
O3反应生成NO和O2,这一过程会直接破坏臭氧层。
因此,NO和NO2
两种化合物的排放量越高,臭氧层遭受的破坏就越严重。
第三,NO和NO2还可以与其他物质发生反应,从而进一步破坏臭氧层。
例如,NO2可以与羟自由基(OH)反应生成硝酸,而硝酸可以与水蒸气形成云雾,这会导致雾霾天气的出现。
此外,NO2还可以与其他碳氢化合物反应,产生一系列多种臭氧污染物,例如PAN等。
综上所述,氮氧化合物破坏臭氧层的机理比较复杂,而且受到各
种因素的影响。
然而,无论是从环保角度还是全球气候变化角度考虑,减少氮氧化合物的排放对于保护臭氧层和地球环境都是非常重要的。
因此,各国政府需要采取更加有力的措施,限制氮氧化合物的排放,
保护臭氧层和我们的地球。
大气中臭氧损耗和燃烧过程中污染物间反应机理
臭氧损耗会影响地球的能量平衡和气候变化。例如,平流 层中的臭氧损耗会导致地球表面温度升高,进而影响全球 气候。
空气质量恶化
臭氧损耗会导致空气中的污染物浓度增加,影响空气质量 ,对人类健康造成危害。
臭氧损耗的应对措施
控制工业排放
通过技术改造和升级,减少工业生产 过程中的污染物排放,降低氮氧化物 和挥发性有机物的排放量。
大气中臭氧损耗和燃烧过程 中污染物间反应机理
汇报人:文小库 2024-01-08
目录
• 大气中臭氧损耗 • 燃烧过程中污染物间反应机理 • 大气中臭氧损耗与燃烧过程污
染物间反应的关系 • 减少大气中臭氧损耗和燃烧过
程中污染物的措施 • 研究展望
01பைடு நூலகம்
大气中臭氧损耗
臭氧损耗的原因
工业排放
工业生产过程中排放的废气中含有大 量的氮氧化物、挥发性有机物等,这 些物质在大气中经过光化学反应会消 耗臭氧。
农业活动
城市交通
城市交通排放的废气中含有大量的氮 氧化物和挥发性有机物,这些物质在 大气中经过光化学反应会消耗臭氧。
农业活动中使用的化肥和农药等物质 ,经过挥发和分解会产生氮氧化物和 挥发性有机物,进而导致臭氧损耗。
臭氧损耗的影响
破坏臭氧层
臭氧层能够吸收紫外线,保护地球上的生命免受紫外线的 伤害。臭氧损耗会导致臭氧层变薄甚至出现空洞,增加紫 外线辐射对人类和生态系统的危害。
推广环保农业
减少化肥和农药的使用,推广环保农 业技术,降低农业活动对环境的污染 。
优化城市交通
发展公共交通,鼓励低碳出行方式, 减少城市交通对环境的污染。
加强国际合作
加强国际合作,共同应对臭氧损耗问 题,推动全球环保事业的发展。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
臭氧层损耗的危害
• 对对流层大气质量的影响: UV-B增加,大 气光化学反应增强,大气中活性物质增 多,加重城乡地区的大气污染。
• 对材料的影响:露天使用塑料、橡胶,加 速其老化,缩短使用寿命,由此全球每年 的经济损失达几十个亿。
三. 臭氧层破坏的原因
• 大气臭氧洞的出现及大气臭氧的损失,是人类有 史以来所面临的最为严重的全球性问题。因此, 越来越多的科学家将它们的注意力集中到了这个 问题上来,以研究它的原因、后果及对策。目 前,化学家们和空气动力学家分别提出了许多理 论,以解释大气臭氧损失的原因。其中比较有代 表性的有如下几种:
• 可稳定地面与大气之间温度。在平流层12∼50km的高度 中,O3层吸收了全部的UVC,90%的UVB,放出热量加热 了大气层,臭氧层在平流层的垂直分布直接影响平流层 温度结构和大气运动。所以臭氧具有加热平流层的作 用。平流层臭氧浓度一旦减少,该层温度会相应变化, 从而影响对流层。
• 平流层臭氧浓度降低,到达地球表面的紫外辐射即会增 加,从而使地球变暖。
平流层臭氧去除的催化反应机制(IV)
MeElroy等1986年提出的如果溴的浓度在15×109 ~30×10-9范围,它将通过BrO与ClO的偶联反 应对O3的减弱起重要作用。(由于BrO键能比ClO 小,溴的破坏作用比ClO更大):
BrO + ClO →Br + Cl + O2 Br + O3 →BrO + O2 Cl + O3 →ClO + O2
(1)宇宙高能粒子破坏
这种理论认为,地球每隔27天有两天半受到宇 宙高能粒子的簇射,而这种能量高达200—1500万电 子伏特的粒子在地球磁场作用下会沿磁力线向地球两 极射去。在南极大陆黑暗的冬季,大气平流层中的氮 、氢化合物浓度在高能粒子作用下升高。当南极早春 到来时,太阳对大气层的辐射使平流层气温升高。此 时,蓄积在大气层中的氮、氢化合物开始发生化学反 应并迅速消耗平流层中的臭氧。这一过程使大气臭氧 层遭到破坏,因而在南极上空形成臭氧洞。
Penguin Seal
臭氧层损耗的危害
• 对陆生植物的影响:植物生长缓慢,叶子减
小,有些松树的生长,由于UV-B增加,生长减慢 了一半。 • 对水生生物:全人类消费动物蛋白的30%以上来自 海洋, UV-B辐射能穿透10m水层,大多数在水面 生活的藻类、小鱼小虾将大量死亡,破坏了食物 链的基础,对渔业生产产生不利影响。
• 用从地面到高空垂直柱中O3的总层厚来反映大气 中O3的方法叫柱浓度法,采用多布森单位 (Dobson unit,简称DU),正常大气中O3柱浓 度约为300DU。低层大气中O3的本底值 20∼40ppb。
2. 臭氧层的作用
⑴. 过滤器的作用:几乎全部吸收了 对地球生命有伤害的太阳短波辐射(99%)
二.臭氧层损耗的
二.臭氧层损耗的发现和研发究现和研究
1. 平流层臭氧的测量
• 1920s,使用Dobson 紫外分光光度计,首次在地面 测量了大气臭氧浓度,Dobson Unit 由此而来, 沿用至今。1 Dobson Unit 等价于1ppb O3。
• 英国南极科考站自1950s开始在南极观测。 • 全球30多个地面站已有30多年大气O3监测记录,大
部分监测站分布在中纬度。 • 从1970年至今,卫星也一直在监测大气臭氧浓
度。
2. 臭氧层耗损的发现
1985年,英国法曼(J. Farman) 等人 发表了自1957年以来南极哈雷湾考 察站上空臭氧总量的数据。
1957∼1973年南极春季(8月下旬到10 月上旬)臭氧总量平均为 300DU, 1973年以后,O3浓度直线下降, 1984年降到200DU(下降了30%)。
末闭合,其面积:
1984年相当于1个美国, 1995年相当于2个多欧洲, 2000年达到历史最大值,2830万km2,比南极大陆
大一倍,3个美国大,白天不让老百姓出去。 今年(2006)创下新记录:南极臭氧洞大过北美洲!
臭氧层破坏是全球性的问题
• 1988年,美国科学家提出北极也有臭氧洞,面积 比南极小;
Sidney Chapman1930年以纯氧体系中氧的光 解离和再结合平衡模型为依据,提出了关于平 流层臭氧的形成理论。
O2 +h( עλ<240nm)→O + O
反应产生的氧原子具有很高的化学活性,很快与
其他O2发生进一步的化学反应,生成臭氧分子: O2 + O → O3
z生成的臭氧分子电离能很低(1.1eV),因而在太阳紫外线照 射下很容易被离解:
内容提要
一. 臭氧层的形成及其作用 二. 臭氧层耗损的发现和研究 三. 臭氧层破坏的原因 四. 保护地球臭氧层的十五年
一. 臭氧层的形成及其作用
—形成与去除机制
¾O3是大气圈中重要的化学组分,臭氧层是自然演化的产 物(大约在16 ∼ 20亿 年前)。在15∼40km上空的O2, 在太阳紫外辐射的作用下,发生着一系列化学和光化学反 应
第一九.臭章氧层的形成及其作用
臭氧层破坏—全球环境问题
ozone Depletion-A global Issue
近30年来,各国科学家经研究发现,在每年的春 季,南极上空臭氧层臭氧的浓度都会明显减 少,而且随着时间的推移,减少程度在逐年加 剧。
南极春季上 空臭氧浓度 的变化 1981-1999
一般所涉及到的O3问题大 都指的是UVB(280315nm),其波长和能量介 于UVC和UVA之间,刚好可 被平流层臭氧强烈地吸 收,O3是迄今为止所知道 的唯一能吸收UVB 的气 体。 臭氧的损耗产生的直接后 果就是使到达地表的UVB 增加,伤害地球生命。 臭氧层减1%,到达地表的 UVB增加2%。
臭氧层的脆弱性 —平流层臭氧去除的催化反应机制(I)
平流层中水汽对O3的破坏作用: H2O + O → 2OH OH + O3 → HO2 + O2 HO2 + O3 → OH + 2O2 净效应:2O3 →3 O2
平流层臭氧去除的催化反应机制(II)
• 奇氮(NO和NO2)催化去除机制 :
NO+ O3 → NO2 + O2
净效应:2O3 →3O2
2.臭氧层是地球生命的“保护伞”
• 通过生成及消耗反应过程,臭氧和氧气之间达到 动态的化学平衡,大气中形成了一个较为稳定的 臭氧层。这个臭氧层的高度大约在距离地球表面 15∼35km处。生成的臭氧对太阳的紫外辐射有很 强的吸收作用,有效地阻挡了对地表生物有伤害 作用的短波紫外线。
太阳的紫外辐射(UV)
• 波长在100∼400nm之间的太阳辐射,根据波长长短
可分为: UVA、UVB 和 UVC。
• UVC(200-280nm)波长最短能量最强,其能量可使O2 的化学键断裂成两个氧原子,每个氧原子又和一个 O2反应生成O3。故UVC在平流层被强烈吸收,从未到 达过地球表面。
• UVA(315-400nm)波长最长能量最弱,其能量仍可对 生命组织造成某些伤害,不能被平流层臭氧有效吸 收,可直接传播到地球表面。
O3 hole 形成的时间提前
8月后期生成并稳定;
O3 hole 的深度大于以往
延伸约24 km, 中心部分的O3 几乎为零
3. 臭氧层损耗的危害
对人体健康的影响: • 抑制人体免疫力。因蛋白质DNA被UV-B破
坏,导致细胞死亡,损害人体免疫力。 • UV-B对眼睛的伤害,O3每增加1%,失明增
加10∼15万人。 • 皮肤癌患者增加,尤其是白种人。
O3 +h → עO + O2
O + NO2 → NO + O2 II)
• 奇氯( Cl和ClO)催化去除机制 :
O3 +h→ עO + O2
O + ClO → Cl + O Cl + O2 → ClO + O
净效应:2O3 → 3O2
臭氧洞
• 臭氧洞被定义为臭氧的柱 浓度小于200DU,即臭氧 的浓度较臭氧洞发生前减 少超过30%的区域。
• 臭氧洞可用其面积、深度 以及延续时间来表征。
臭氧层
1993年臭氧洞达到100DU
1995年南极春季臭氧洞变化
1998年:
O3 hole的面积破记录
达2600多万 km2, 相当于三 个澳大利亚,大于北美; 比1997年大15%;
1984年以后,浓度下降非常明显, 最高值是1988年的250DU,最低值 是1994年的88DU。
Antarctic Halley Bay Station
Syowa station
Nimbus 7, USA
自1970s中期以来,平流层臭氧浓度一直在减少。 1984-1985年卫星观测到的数据是如此之低,使人们 难以置信,结果震惊全球。南极臭氧洞春初出现,春
[O3]=[O2](
k2f1[M] k4f3
)1/2
理论预测值与实测值的对照: 全球浓度过高估计了约2倍。
平流层臭氧去除的催化反应机制
Chapman提出的纯氧理论所存在的重要缺陷是O3去除 得太慢,若按纯理论推断,平流层中O3的浓度应 比目前所观测到的大得多。
进一步研究发现,平流层臭氧更重要的去除途径是 催化反应机制,即平流层中存在的三类物质:奇 氮(NO、NO2)、奇氢(OH、HO2)和奇氯(Cl、 ClO)等。
O3 +h( עλ<320nm)→O + O2
•在15∼40km的大气层,形成了O3层,实际上是O2 、O、和 O3达
到动态平衡的一层。
Chapman 机制
O2 + hγ → 2O O2 + O + M → O3 + M O3 + hγ → O2 + O O3 + O → 2O2
