三组分体系相图的制备实验报告
实验2 三组分液—液相图的绘制

实验2 三组分液—液相图的绘制实验目的1熟悉相律,掌握由三角形坐标法表示的三组分系统相图。
2 用溶解度法作出具有一对共轭溶液的正戊醇—醋酸—水系统的相图。
基本原理三组分系统组分数K=3, 当系统处于恒温恒压条件时,根据相律, 系统的条件自由度为:φ-=*3f式中φ为系统的相数。
系统最大条件自由度为213max =-=*f , 因此,浓度变量最多只有两个, 可用平面图表示系统的状态和组成间的关系, 称三组分相图。
通常用等边三角形坐标表示,如图1所示。
等边三角形顶点分别表示纯物质A 、B 、C, AB 、BC 、CA 三条边分别表示A 和B 、B 和C 、C 和A 所组成的二系统组成, 三角形内任何一点都表示三族分系统的组成。
将三角形的每一边分为100等份, 通过三角形内任何一点O 引平行各边直线, 根据几何原理,a+b+c=AB=BC=CA=100%, 因此O 点组成可用a 、b 、c 来表示。
即O 点表示的三个组成的百分组成为B%=b, C%=c, A%=a 。
如果已知三组分中任两个百分组成,只须作两条平行线,其交点就是被测系统的组成点。
在正戊醇—醋酸—水三组分系统中, 正戊醇和水几乎完全不互溶的,而醋酸和正戊醇及醋酸和水都是互溶的, 在正戊醇和水系统中加入醋酸则可促使正戊醇和水的互溶。
由于醋酸在正戊醇层和水层中非等量分配,因此,代表两层浓度的a 、b 点的连线并不一定与底边平行(如图2) 。
设加入的醋酸后系统总组成为c, 平衡共存的两相叫共轭溶液,其组成由通过c 的连线上的a 、b 两点表示 。
图中曲线以下区为两相共存区,其余部分为单相区。
图1 图2 图3 现有一个正戊醇和水的二组分系统,其组成为k 。
于其中逐渐加入醋酸,则系统总组成沿kB 变化(正戊醇和水比例保持不变),在曲线以下区域内则存在互不混溶的两共轭相,将溶液振荡时则出现混浊状态。
继续滴加醋酸直到曲线上的d 点, 系统将由两相区进入单相区,液体将由混浊转为清澈, 继续加醋酸至e 点,液体仍为清澈的单相。
实验一、三组分液-液体系相图的绘制

3.求出反应的半衰期。
21
实验四、最大气泡压力法测定溶 液表面张力
22
【实验目的】
➢测定不同浓度正丁醇溶液的表面张力,考察吸 附量与浓度的关系。
➢了解表面张力、表面自由能的意义以及与溶液 界面吸附的关系。
➢掌握最大气泡压力法测定表面张力的原理和技 术,由Gibbs公式用图解法求算不同浓度溶液 的界面吸附量。
11
【数据记录与处理】 • 记录室温及大气压。
• 设计数据记录表格,并用lgCA对lgCB作图, 由直线的斜率和截距计算出分配系数K,缔 合度n。
12
【注意事项】 • 实验中所用苯对环境有较大污染,废液应
倒入回收瓶中,统一处理。 【思考题】 • 分配系数的影响因素有哪些?
13
实验三、 旋光法测定蔗糖转化反应 的速率常数
10.00
0.80 10.00
20.00
25.00
6
【注意】
– 使用的三角瓶必须事先干燥。 – 当 Nhomakorabea体由浊变清时,须小心,勿使乙醇过量加入。 – 相变点的判断。
【思考题】
– 当体系总组成在曲线内与曲线外时,相数有何不同? 总组成点通过曲线时发生什么变化?
– 用相律说明当温度、压力恒定时,单相区的自由度是 多少?
三组分体系中浓度独立变量最多只有2个。这样就可用 平面图形来表示体系的状态和组成的关系。
– 通常用等边三角形来表示三组分体系中各组分的组成。 三角形的3个顶点分别代表纯组分A、B和C,三条边AB、 BC、CA分别代表A和B、B和C、C和A所组成的二组分 体系的组成,而三角形内任何一点表示三组分体系的 组成。
环己烷(取代苯)-乙醇-水三组分液系相图

图4-1三角形坐标实验四三元液-液系统相图一、目的:(1)测绘环己烷(或取代苯)-水-乙醇三组分系统的相图。
(2)掌握三角形坐标的使用方法。
二、原理三组分系统的相律为F =C +2-P =5-P ,最大自由度(单相即P =1时)F =4,相图难以绘制。
恒压时自由度F =4-P ,最大自由度F =3,相图可用三维空间坐标来表示,通常使用正三棱柱,柱高表示温度。
若温度和压力均恒定,F =3-P ,最大自由度F =2,可用平面图来表示组成关系。
若用质量分数w (或摩尔分数x )描述系统的组成时,常用等边三角形坐标来表示三组分相图(图4-1),等边三角形的三个顶点分别代表纯组分A 、B 、C ,三条边AB 、BC 、CA 上的点代表一个二组分的组成,三角形内任意一点表示三组分的组成。
以图4-1中点P 为例,经点P 作平行于三角形三边的直线Pa 、Pb 、Pc ,则点P 对应组分A 、B 、C 的相对含量分别为w A =C a =Pc ,w B =A b =Pa ,w C =B c =Pb 。
反之,若已知系统的组成,要在三角形内确定系统的组成点时,可在CA 边上取线段C a 长度等于组分A 的组成w A ,在AB 边上取线段A b 长度等于组分B 的组成w B ,通过点a 作平行于BC 的直线,通过点b 作平行于AC 的直线,这两条直线的交点p 即为系统的组成坐标点。
在环己烷(或取代苯)-水-乙醇三组分系统中,环己烷和水完全不互溶,而乙醇和环己烷及乙醇和水完全互溶。
在环己烷-水系统中加入乙醇时可促使环己烷和水的互溶。
设有一个环己烷-水的二组分系统,其组成点为K ,于其中加入乙醇,则系统总组成沿K C 变化(环己烷-水比例保持不变),在曲线以下区域内存在互不溶混的两共轭相,将溶液振荡时出现浑浊状态。
继续滴加乙醇直至曲线的点d ,系统将由两相区进入单相区,液体由浑浊转为清澈。
继续滴加乙醇至点e ,液体仍为清澈的单相。
三相图的绘制(氯化钾、盐酸、水)

Ⅰ、目的要求1.掌握用三角坐标表示三组分相图的方法;2.能正确利用溶解度方法绘制KCl-HCl-H2O三组分系统的相图;3.了解湿固相法的原理,学会确定溶液中纯固相组成点的方法。
Ⅱ、基本原理为了绘制相图就需要通过实验获得平衡时各相间的组成及二相的连接线,即先使体系达到平衡,然后把各相分离,再用化学分析法或物理方法测定达成平衡时各相的组成。
但体系达到平衡的时间,可以相差很大。
对于互溶的液体,一般平衡达到的时间很快;对于溶解度较大,但不生成化合物的水盐体系,也容易达到平衡。
对于一些难溶的盐,则需要相当长的时间,如几个昼夜。
由于结晶过程往往要比溶解过程快得多,所以通常把样品置于较高的温度下,使其较多溶解,然后将其移至温度较低的恒温槽中,使之结晶,加速达到平衡。
另外,摇动、搅拌、加大相界面也能加快各相间的扩散速度,加速达到平衡。
由于在不同温度时的溶解度不同,所以系统所处的温度应该保持不变。
湿固相法的基本原理:在等边三角形相图中凡带有饱和溶液的固相组成点,必定处于饱和溶液组成点和纯固相点的连结线上,测定一组饱和溶液和湿固相(饱和溶液所对应的固相)的组成,它们的连结延长线将交于一点,即纯固相组成点。
本实验是测定在一定温度和压力下,KCl-HCl-H2O三组分体系中各组分的质量百分组成,从而绘制出三组分相图(体系中KCl处于饱和状态,溶解的KCl与KCl固体处于平衡状态)。
由KCl、HCl、H2O组成的三组分体系,在HCl的含量不太高时,HCl完全溶于水而成盐酸溶液,与KCl有共同的负离子Cl-。
所以当饱和的KCl水溶液中加入盐酸时,由于同离子效应使KCl的溶解度降低。
本实验即是研究在不同浓度的盐酸溶液中KCl的溶解度,通过此实验熟悉盐水体系相图的构筑方法和一般性质。
为了分析平衡体系各相的成分,可以采取各相分离方法。
如对于液体可以用分液漏斗来分离。
但是对于固相,分离起来比较困难。
因为固体上总会带有一些母液,很难分离干净,而且有些固相极易风化潮解,不能离开母液而稳定存在。
三组分相图的绘制

实验三组分相图的绘制一实验目的绘制苯一醋酸一水体系的互溶度相图。
为了绘制相图就需通过实验获得平衡时,各相间的组成及二相的连结线。
即先使体系达到平衡,然后把各相分离,再用化学分析法或物理方法测定达成平衡时各相的成分。
但体系达到平衡的时间,可以相差很大。
对于互溶的液体,一般平衡达到的时间很快;对于溶解度较大,但不生成化合物的水盐体系,也容易达到平衡;对于一些难溶的盐,则需要相当长的时间,如几个昼夜。
由于结晶过程往往要比溶解过程快得多,所以通常把样品置于较高的温度下,使其较多溶解,然后把它移放在温度较低的恒温槽中,令其结晶,加速达到平衡。
另外摇动、搅拌、加大相界面也能加快各相间扩散速度,加速达到平衡。
由于在不同温度时的溶解度不同,所以体系所处的温度应该保持不变。
二实验原理水和苯的互溶度极小,而醋酸却与水和苯互溶,在水和苯组成的二相混合物中加入醋酸,能增大水和苯之间的互溶度,醋酸增多,互溶度增大。
当加入醋酸到达某一定数量时,水和苯能完全互溶。
这时原来二相组成的混合体系由浑变清。
在温度恒定的条件下,使二相体系变成均相所需要的醋酸量,决定于原来混合物中水和苯的比例。
同样,把水加到苯和醋酸组成的均相混合物中时,当水达到一定的数量,原来均相体系要分成水相和苯相的二相混合物,体系由清变浑。
使体系变成二相所加水的量,由苯和醋酸混合物的起始成分决定。
因此利用体系在相变化时的浑浊和清亮现象的出现,可以判断体系中各组分间互溶度的大小。
一般由清变到浑,肉眼较易分辨。
所以本实验采用由均相样品加人第三物质而变成二相的方法,测定二相间的相互溶解度。
当二相共存并且达到平衡时,将二相分离,测得二相的成分,然后用直线连接这二点,即得连结线。
一般用等边三角形的方法表示三元相图(图1)。
等边三角形的三个顶点各代表纯组分;三角形三条边AB、BC、CA分别代表A和B、B和C、C和A所组成的二组分的组成;而三角形内任何一点表示三组分的组成。
例如图1-1中的P点,其组成可表示如下:经P点作平行于三角形三边的直线,并交三边于a、b、c三点。
实验三--三组分系统相图

5
❖ 等边三角形图示规律:
❖ 1) 在平行于底边的任意一条线上,所有代 表物系的点含顶角组分的质量分数相等。例 如图2中的D,O,Q 物系点,含A的质量分 数相同。
取8只干燥的具塞锥形瓶,按表1中乙酸正丁酯、水、乙醇的体积配制 1-8号溶液,分别往1-2号溶液中滴定乙酸正丁酯至清液变浊,往3-8号溶 液中滴定[1]水至清液变浊,记录相应的滴定体积于表1中。
❖ 2.连接线的测定
按表2 “共轭溶液” 项中的体积将乙酸正丁酯、乙醇、水(H液)置于干 燥的50mL分液漏斗中,充分摇动后静置分层(H液先配好静置待用), 取水层(下层)约1mL于干燥的50mL具塞锥形瓶并称重(实验前需将空 的具塞锥形瓶称重),可得WG。然后用干燥的滴管逐滴加入表2中乙酸 正丁酯-乙醇溶液(E液),边滴边摇,滴至由浊变清后称重,可得WE, 所有数据记录于表2。
❖ 2) 过某一顶点的直线上,物系中其它两个 顶角组分的含量比相同。例如在图2中通过 顶点A的直线AN上,组分B和C含量之比都 相同。
❖ 3) 通过顶点的任一条线上,离顶点越近, 代表顶点组分的含量越多,反之亦然。例如 图2的M点中含A多;N点中含A少 。
图2 等边三角形图示规律
6
❖ 4) 若把任意两个三组分系统(其物系点分别为图 3中的M和N)混合成一个新的物系(图3中的O点 ),则O点一定在MN的连线上。O点的位置靠近 量多的物系点,可用杠杆规则求算。
❖ 5) 由三个三组分系统D,Q,F混合而成的新系统 的物系点(见图3),落在这三点组成三角形的重心 位置,即H点。先用杠杆规则求出D,Q混合后新 体系的物系点E,再用杠杆规则求出E,F混合后 的新体系物系点H,H即为三角形DQF的重心。 这一规则称为重心规则 。
三元体系相图的绘制
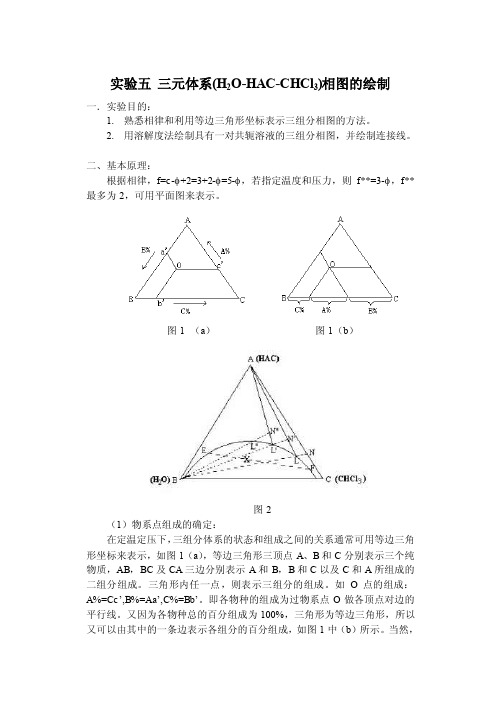
实验五三元体系(H2O-HAC-CHCl3)相图的绘制一.实验目的:1.熟悉相律和利用等边三角形坐标表示三组分相图的方法。
2.用溶解度法绘制具有一对共轭溶液的三组分相图,并绘制连接线。
二、基本原理:根据相律,f=c-φ+2=3+2-φ=5-φ,若指定温度和压力,则f**=3-φ,f**最多为2,可用平面图来表示。
图1 (a)图1(b)图2(1)物系点组成的确定:在定温定压下,三组分体系的状态和组成之间的关系通常可用等边三角形坐标来表示,如图1(a),等边三角形三顶点A、B和C分别表示三个纯物质,AB,BC及CA三边分别表示A和B,B和C以及C和A所组成的二组分组成。
三角形内任一点,则表示三组分的组成。
如O点的组成:A%=Cc’,B%=Aa’,C%=Bb’。
即各物种的组成为过物系点O做各顶点对边的平行线。
又因为各物种总的百分组成为100%,三角形为等边三角形,所以又可以由其中的一条边表示各组分的百分组成,如图1中(b)所示。
当然,给出一定组成的溶液百分比,按照上述表示方法,也应该能找出对应的物系点。
(2)溶解度曲线的绘制对于具有一对共轭溶液的三液系相图,如图2,该三液系相图中A和B,A和C为完全互溶而B和C为部分互溶,曲线abc为溶解度曲线。
曲线上方为单相区,曲线下方为二相区,物系点落在二相区内,即分为二相,如X 点则分成组成为E和F的二相,而EF线称为连接线。
对于溶解度曲线的绘制,本实验是先以完全互溶的两个组分(如A和C),以一定的比例混合所组成的均相溶液,如图2上的N点,滴加入组分B,根据平衡相图的直线规则,物系点则沿着NB移动,直至溶液变混,即为L点。
再加入A,物系点由LA上升至N’点而变清。
再加入B,此时物系点又沿着N’B由N’移动至L’而再次变混,再滴加A使变清……,如此反复,最后连接L,L’,L’’……即可画出溶解度曲线。
(3)连接线的绘制由于连接线是表示在两相区内呈平衡两相的组成(或A在两相中的分配),所以可以在两相区内配制溶液,待平衡后分析每相中的任何一种组成的含量,连接在溶解度曲线上该两含量的组成点而得出。
三组分体系相图实验报告(精品DOC)

三组分体系相图实验报告(精品DOC)三组分体系相图的制备一:实验目的制备等温、等压下苯-水-乙酸三组分体系相图。
二、实验原理三组分体系的组成可用等边三角坐标表示。
等边三角形三个顶点分别代表纯组分A、B和C。
则AB线上各点相当于A和B组分的混合体系,BC线上各点相当于B 和C组分的混合体系,AC线上各点相当于A和C组分的混合体系。
在苯-水-乙酸三组分体系中,苯与水是部分互溶的,而乙酸和苯、乙酸和水都是完全互溶的。
设由一定量的苯和水组成一个体系,其组成为K,此体系分为两相:一相为水相,一项为苯相。
当在体系中加入乙酸时,体系的总组成沿AK线移至N 点。
此时乙酸溶于水相及苯相,同时乙酸促进苯与水互溶,故此体系由两个分别含有三个组分的液相组成,但这两个液相的组成不同。
若分别用b1、c1表示这两个平衡的液相的组成,此两点连线称为连接线,这两个溶液称为共轭溶液。
代表液-液平衡体系中所有共轭液相组成的点的连线称为溶解度曲线。
曲线以下区域为两相共存区,其余部分为均相区。
此图称为含一对部分互溶组分的三组分体系液-液平衡相图。
按照相律,三组分相图要画在平面上,必须规定两个独立变量。
本实验中,它们分别是温度(为室温)和压力(为大气压)。
三、实验仪器与药品1、仪器25ml酸式滴定管2支、5ml移液管1支、盖锥形瓶。
2、药品苯(分析纯)、乙酸(分析纯)、蒸馏水。
四、实验步骤1、取8个干燥的5毫升带盖锥形瓶,按照记录表格中的规定提及用滴定管即移液管配制六种不同浓度的苯乙醇溶液,即两种不同浓度的水乙醇溶液。
2、用滴定管向已配好的水-乙醇溶液中滴苯,至清液变浑浊,记录此时每种清液中水的体积。
滴定时必须充分摇荡,同时注意动作迅速,尽量避免由于苯、乙醇的挥发而引起的误差。
3、读取室温。
4、记录表格。
五、实验数据表1-2 溶解度曲线有关数据记录表室温:22?体积(ml) 溶液编号苯水乙醇1 0.20 3.50 1.502 0.25 2.50 2.503 1.00 3.00 5.004 1.50 1.60 4.005 2.50 0.90 3.506 3.00 0.60 2.507 3.50 0.35 1.508 4.00 0.15 1.00六、数据处理将各溶液滴定终点时各组分的体积,根据它们在实验温度下的密度(查附录二和附录三)换算为质量,求出各溶液滴定终点时的质量分数或质量分数的浓度。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
中国石油大学化学原理(二)实验报告
实验日期:2012.10.17 成绩:
班级:石工11-12班学号:11021579 姓名张伟教师:王增宝
同组者:李云浩赵红帅
三组分体系相图的制备
一:实验目的
制备等温、等压下苯-水-乙醇三组分体系相图。
二、实验原理
三组分体系的组成可用等边三角坐标表示。
等边三角形三个顶点分别代表纯组分A、B和C。
则AB线上各点相当于A和B组分的混合体系,BC线上各点相当于B和C组分的混合体系,AC线上各点相当于A和C组分的混合体系。
在苯-水-乙醇三组分体系中,苯与水是部分互溶的,而乙醇和苯、乙醇和水都是完全互溶的。
设由一定量的苯和水组成一个体系,其组成为K,此体系分为两项:一相为水相,一项为苯相。
当在体系中加入乙醇时,体系的总组成沿AK 线移至N点。
此时乙醇溶于水相及苯相,同时乙醇促进苯与水互溶,故此体系由两个分别含有三个组分的液相组成,但这两个液相的组成不同。
若分别用b1、c1表示这两个平衡的液相的组成,此两点的连线称为连系线,这两个溶液称为共轭溶液。
代表液-液平衡体系中所有共轭液相组成点的连线称为溶解度曲线(如图1-1)。
曲线以下区域为两相共存区,其余部分为均相区。
此图称为含一对部分互溶组分的三组分体系液-液平衡相图。
图1-1 三组分体系液-液平衡相图
按照相律,三组分相图要画在平面上,必须规定两个独立变量。
本实验中,它们分别是温度(为室温)和压力(为大气压)。
三、实验仪器与药品
1、仪器
25ml酸式滴定管2支、5ml移液管1支、50ml带盖锥形瓶8个。
2、药品
苯(分析纯)、无水乙醇(分析纯)、蒸馏水。
四、实验步骤
1、取8个干燥的5毫升带盖锥形瓶,按照记录表格中的规定提及用滴定管即移液管配制六种不同浓度的苯乙醇溶液,即两种不同浓度的水乙醇溶液。
2、用滴定管向已配好的水-乙醇溶液中滴苯,至清液变浑浊,记录此时每种清液中水的体积。
滴定时必须充分摇荡,同时注意动作迅速,尽量避免由于苯、乙醇的挥发而引起的误差。
3、读取室温。
4、记录表格。
五、实验数据
表1-2 溶解度曲线有关数据记录表
室温:22℃
溶液编号
体积(ml)
苯水乙醇
1 0.10 3.50 1.50
2 0.21 2.50 2.50
3 1.00 2.73 5.00
4 1.50 1.50 4.00
5 2.50 1.04 3.50
6 3.00 0.55 2.50
7 3.50 0.37 1.50
8 4.00 0.15 1.00
六、数据处理
将各溶液滴定终点时各组分的体积,根据它们在实验温度下的密度(查附录二和附录三)换算为质量,求出各溶液滴定终点时的质量分数或质量分数的浓度。
求出各溶液滴定终点时的质量分数或质量分数的浓度。
将所得的点及笨与水的相互溶解的点(见附录一)绘于三角坐标纸上,并将各点连成平滑曲线。
实验数据的处理方法如下:
已知苯、水、乙醇的体积,参照附录二、附录三以及其中的公式,可求出各自的密度,再换算为质量。
公式为:d =A +B+Ct2+Dt3
式中:d -密度(g/cm3);
t -温度(℃),。
实验中t=22℃
可得水的密度d(水)=0.9983g/cm3,
d(苯)=0.876509g/cm3
d(乙醇)=0.79032g/cm3
表1-3 溶解度曲线数据处理表
溶液编号
体积(ml)质量(g)质量百分数(%)苯水乙醇苯水乙醇合计苯水乙醇
1 0.10 3.50 1.50 0.088 3.494 1.185 4.767 1.85 73.30 24.86
2 0.21 2.50 2.50 0.18
3 2.496 1.976 4.655 3.93 53.62 42.45
3 1.00 2.73 5.00 0.877 2.725 3.95 7.552 11.61 36.08 52.31
4 1.50 1.50 4.00 1.31
5 1.497 3.161 5.973 22.02 25.0
6 52.92
5 2.50 1.04 3.50 2.191 1.038 2.76
6 5.995 36.55 17.31 46.14
6 3.00 0.55 2.50 2.630 0.549 1.975 5.154 51.03 10.65 38.32
7 3.50 0.37 1.50 3.068 0.369 1.185 4.622 66.38 7.98 25.64
8 4.00 0.15 1.00 3.506 0.150 0.790 4.446 78.85 3.38 17.77
例如
对第一组数据进行处理
m(苯)=0.876509g/cm3×0.10ml=0.088g
m(水)=0.9983g/cm3×3.50ml=3.494g
m(乙醇)=0.79032g/cm3×1.50ml=1.185 g
m= m(苯)+m(水)+m(乙醇)=4.767g
w(苯)=0.088g/4.767g×100%=1.85%
w(水)=3.494g/4.767g×100%=73.30%
w(乙醇)=1.185g/4.767g×100%=24.86%
七、注意事项
1、用蒸馏水瓶将蒸馏水倒入酸式滴定管,并记录初始刻度值;
2、用烧杯量取30mL苯倒入酸式滴定管中,待用;
3、实验完毕,酸式滴定管中的苯回收至原瓶中;
4、锥形瓶中的废液倒入废液桶中,把锥形瓶冲洗干净,放入烘干箱烘干,
再换上8个烘干瓶摆好。
八思考题
1.本实验所用的滴定管(盛苯的)、锥形瓶、移液管等为什么必须干燥?
答::由于本实验对数据要求比较精确,微小的误差就会对实验产生较
大的误影响,会影响三组分体系相图的绘制。
因此,实验前将滴定管(盛苯
的)、锥形瓶、移液管等干燥是为了减小实验误差,提高实验的准确度。
如
果上述仪器不干燥,会使苯,水和乙醇质量有所误差,影响三相体系图的绘
制和实验结果精度。
2.当体系组成分别在溶解度曲线上方及下方时,这两个体系的相数有什么不同?在本实验中是如何判断体系总组成正处于溶解度曲线上的?此
时为几相?
答:在溶解度曲线上方时,体系为均相,相数为1,在溶解度曲线下方时,体系的相数为2;溶液刚出现浑浊时体系总组成正处于溶解度曲线上,
此时为单相。
3.温度升高,体系的溶解度曲线会发生什么样的变化?在本实验操作中应注意哪些问题,以防止温度变化而影响实验的准确性?
答:当温度升高时,溶解度增大,三组分体系溶解度曲线会下降,曲线包围面积变小。
实验时应尽量避免用手接触溶液附近的容器壁,避免用手捂住容器,防止因温度升高而影响实验结果;还有滴定时动作要迅速,减少震荡时因乙醇等挥发的影响。
九、实验小结
通过这次“三组分体系相图的制备”的实验,我学会了如何制备在等温等压下苯—水—乙醇三组分体系相图的方法,掌握了移液管量取液体的操作和酸式滴定管的使用方法。
在实验过程中,需要细心和耐心,再往水和乙醇混合溶液中滴加苯时,要不断摇晃小锥形瓶。
千万不要因粗心失误引入人为误差。
动手操作能力是慢慢锻炼出来的,希望在以后的实验中也会不断总结,逐渐提高。
