三组分体系等温相图的绘制.
三元系统相图

三元系统相图
一、三元系统相图概述
三元凝聚系统相律: F=C-P+1=4-P
1、三元系统组成表示方法
——浓度(组成)三角形 应用: 1)已知点 的位置, 确定其组成; 2)已知组成,确定 点的位置;
双线法:
2、浓度三角形规则
(1)等含量规则 等含量规则:平行于浓度 三角形一边的直线上的各点, 其第三组分的含量不变,即: MN线上C%相等。
在在mn外mpn二三元系统相图基本类型一具有一个低共熔点的简单三元系统相图二生成一个一致熔融二元化合物的三元系统相图三具有一个一致熔融三元化合物的三元系统相图四生成一个不一致熔融二元化合物的三元系统相图五具有一个不一致熔融三元化合物的三元系统相图六生成一个固相分解的二元化合物的三元系统相图七具有多晶转变的三元系统相图八形成一个二元连续固溶体的三元系统相图九具有液相分层的三元系统相图一具有一个低共熔点的简单三元系统相图1立体相图2平面投影图投影图上温度表示法
T转 > Te3 、 T转 < Te2——多晶转变点P
T转 < Te2 、Te3——多晶转变点P1、P2
(八)形成一个二元连续固溶体的三元系统相图
(九)具有液相分层的三元系统相图
总结:
分析实际三元系统(复杂三元系统)相图的步骤
一、判断化合物的性质;
二、划分副三角形; 三、判断界线上温度变化——连(结)线规则; 四、判断界线性质——切线规则; 五、确定三元无变量点的性质——重心原理;
(三) 具有一个一致熔融三元化合物的三元系统相图
(四) 生成一个不一致熔融二元化合物的三元系统相图 1、相图组成
(1)不一致熔融化合物S不在自己的相区内; (2)化合物S性质的改变,导致CS连线、无变 量点P、界线的性质改变。 (a)CS连线 (b)无变量点:P点
实验一、三组分液-液体系相图的绘制

3.求出反应的半衰期。
21
实验四、最大气泡压力法测定溶 液表面张力
22
【实验目的】
➢测定不同浓度正丁醇溶液的表面张力,考察吸 附量与浓度的关系。
➢了解表面张力、表面自由能的意义以及与溶液 界面吸附的关系。
➢掌握最大气泡压力法测定表面张力的原理和技 术,由Gibbs公式用图解法求算不同浓度溶液 的界面吸附量。
11
【数据记录与处理】 • 记录室温及大气压。
• 设计数据记录表格,并用lgCA对lgCB作图, 由直线的斜率和截距计算出分配系数K,缔 合度n。
12
【注意事项】 • 实验中所用苯对环境有较大污染,废液应
倒入回收瓶中,统一处理。 【思考题】 • 分配系数的影响因素有哪些?
13
实验三、 旋光法测定蔗糖转化反应 的速率常数
10.00
0.80 10.00
20.00
25.00
6
【注意】
– 使用的三角瓶必须事先干燥。 – 当 Nhomakorabea体由浊变清时,须小心,勿使乙醇过量加入。 – 相变点的判断。
【思考题】
– 当体系总组成在曲线内与曲线外时,相数有何不同? 总组成点通过曲线时发生什么变化?
– 用相律说明当温度、压力恒定时,单相区的自由度是 多少?
三组分体系中浓度独立变量最多只有2个。这样就可用 平面图形来表示体系的状态和组成的关系。
– 通常用等边三角形来表示三组分体系中各组分的组成。 三角形的3个顶点分别代表纯组分A、B和C,三条边AB、 BC、CA分别代表A和B、B和C、C和A所组成的二组分 体系的组成,而三角形内任何一点表示三组分体系的 组成。
三组分体系相图的制备

中国石油大学化学原理(二)实验报告实验日期:2013-10-24 成绩:班级:石工12-11 学号:12093406 姓名:王景乐教师:同组者:赵润达三组分体系相图制备一、实验目的制备等温等压下甲苯—水—乙醇三组分体系相图二、实验原理三组分体系相图的组成可用等边三角形坐标表示。
等边三角形三个顶点分别代表纯组分A、B和C。
则AB线上各点相当于A和B组分的混合体系,BC线上各点相当于B和C的组分的混合体系,AC线上各点相当于A和C的组分的混合体系。
在甲苯—水—乙醇三组分体系中。
甲苯与水是部分互溶的,二乙醇和甲苯、乙醇和水都是完全互溶的。
设由一定量的甲苯与水组成一个体系,其组成为K,此体系分为两相:一相为水相,另一相为甲苯相。
当在体系中加入乙醇时,体系的总组成沿AK线移至N点。
此时乙醇溶于水相和甲苯相,同时乙醇促使水与甲苯互溶,故此体系由两个分别含有三个组分的液相组成。
但这两个的液相的组成不同,若分别用、表示这两个平衡的液相的组成,此两点的连线成为连系线,这两个溶液称为共轭溶液。
代表液—液平衡体系中所有共轭溶液相组成点的连线称为溶解度曲线(如图1—1)。
曲线以下区域为两相共存区,其余部分均为相区。
此图称为含一对部分互溶组分的三组分体系液—液平衡相图按照相律,三组分相图要画在平面上,必须规定两个独立变量。
本实验中,它们分别是温度(即室温)和压力(大气压力)。
三、实验仪器与药品1.仪器25ml酸式滴定管2支,5ml移液管1支,50ml带盖锥形瓶8个。
2.药品甲苯(分析纯),无水乙醇(分析纯),蒸馏水。
四、实验步骤1.取8个干燥的50ml带盖锥形瓶,按照记录表格中的规定体积用滴定管及移液管配制6种不同浓度的甲苯—乙醇溶液,及两种不同浓度的水—乙醇溶液。
2.用滴定管向已配制好的水—乙醇溶液中滴甲苯,至清夜变浊,记录此时甲苯的体积。
用滴定管向已配制好的甲苯—乙醇溶液中滴甲苯,至清夜变浊,记录此时水的体积。
滴定时必须充分震荡,同时注意动作迅速,尽量避免由于甲苯、乙醇的挥发而引入的误差。
三组分相图的绘制

实验三组分相图的绘制一实验目的绘制苯一醋酸一水体系的互溶度相图。
为了绘制相图就需通过实验获得平衡时,各相间的组成及二相的连结线。
即先使体系达到平衡,然后把各相分离,再用化学分析法或物理方法测定达成平衡时各相的成分。
但体系达到平衡的时间,可以相差很大。
对于互溶的液体,一般平衡达到的时间很快;对于溶解度较大,但不生成化合物的水盐体系,也容易达到平衡;对于一些难溶的盐,则需要相当长的时间,如几个昼夜。
由于结晶过程往往要比溶解过程快得多,所以通常把样品置于较高的温度下,使其较多溶解,然后把它移放在温度较低的恒温槽中,令其结晶,加速达到平衡。
另外摇动、搅拌、加大相界面也能加快各相间扩散速度,加速达到平衡。
由于在不同温度时的溶解度不同,所以体系所处的温度应该保持不变。
二实验原理水和苯的互溶度极小,而醋酸却与水和苯互溶,在水和苯组成的二相混合物中加入醋酸,能增大水和苯之间的互溶度,醋酸增多,互溶度增大。
当加入醋酸到达某一定数量时,水和苯能完全互溶。
这时原来二相组成的混合体系由浑变清。
在温度恒定的条件下,使二相体系变成均相所需要的醋酸量,决定于原来混合物中水和苯的比例。
同样,把水加到苯和醋酸组成的均相混合物中时,当水达到一定的数量,原来均相体系要分成水相和苯相的二相混合物,体系由清变浑。
使体系变成二相所加水的量,由苯和醋酸混合物的起始成分决定。
因此利用体系在相变化时的浑浊和清亮现象的出现,可以判断体系中各组分间互溶度的大小。
一般由清变到浑,肉眼较易分辨。
所以本实验采用由均相样品加人第三物质而变成二相的方法,测定二相间的相互溶解度。
当二相共存并且达到平衡时,将二相分离,测得二相的成分,然后用直线连接这二点,即得连结线。
一般用等边三角形的方法表示三元相图(图1)。
等边三角形的三个顶点各代表纯组分;三角形三条边AB、BC、CA分别代表A和B、B和C、C和A所组成的二组分的组成;而三角形内任何一点表示三组分的组成。
例如图1-1中的P点,其组成可表示如下:经P点作平行于三角形三边的直线,并交三边于a、b、c三点。
物理化学实验智慧树知到答案章节测试2023年枣庄学院

绪论单元测试1.实验室出现火情,应立即:()A:打开实验室门,尽快疏散,撤离人员B:用干毛巾覆盖火源,使火焰熄灭C:停止加热,移开可燃物,切断电源,用灭火器灭火D:其余说法都不对答案:C2.物理化学实验报告基本要求主要包括:()A:实验总结B:实验步骤以及实验数据处理C:实验目的以及实验原理D:课后习题答案:ABCD3.关于物理化学实验预习,正确的是()。
A:明确操作步骤B:熟悉基本原理C:了解仪器使用D:撰写预习报告答案:ABCD4.进入实验室,以下说法不正确的是?()。
A:进入实验室,如果不接触有毒有腐蚀性的药品,就可以不穿实验服。
B:在实验过程中,等待仪器测试的过程中,要认真观察,操作仪器,不允许玩手机。
C:实验完毕必须洗手D:严禁饮食答案:A5.物理化学实验数据的表达主要有?()。
A:观察法。
B:图解法与列表法。
C:分析法。
D:模拟法。
答案:B6.周期性数据一定是确定性数据。
()A:对B:错答案:A7.绝对误差可以衡量测量结果的精度。
()A:对B:错答案:B8.单次测量和多次测量情况下误差合成的公式是相同的。
()A:对B:错答案:B9.电气线路着火,要先切断电源,再用干粉灭火器火二氧化碳灭火器灭火,不可直接泼水灭火,以防触电或电气爆炸伤人。
()A:对B:错答案:A10.在实验室必须保持严肃、严密、严格、严谨,室内保持整洁有序,不准喧哗、打闹。
玩手机。
()A:错B:对答案:B第一部分测试1.实验过程中,点火一分钟后,实验数据没有上升,正确的操作方法是()A:将氧弹取出检查是否短路,如果没有短路再将氧弹放入内筒重新实验。
B:继续实验。
C:停止实验,检查原因。
D:重新点火进行实验。
答案:C2.完全互溶双液系的平衡相图绘制时,选择测定物系的折光率来测定物质的组成,以下说法哪个是错误的:()A:对任何双液系都适用B:测定用时少、速度快C:测定折光率操作简单D:测定所需试样量少答案:A3.为测定二元完全互溶双液系沸点-组成图,需在气液相达平衡后,同时测定()A:气相组成,液相组成和溶液沸点B:液相组成和溶液沸点C:气相组成和溶液沸点D:气相组成,液相组成答案:A4.以下分光光度计的操作中,不正确的是()。
实验三--三组分系统相图

5
❖ 等边三角形图示规律:
❖ 1) 在平行于底边的任意一条线上,所有代 表物系的点含顶角组分的质量分数相等。例 如图2中的D,O,Q 物系点,含A的质量分 数相同。
取8只干燥的具塞锥形瓶,按表1中乙酸正丁酯、水、乙醇的体积配制 1-8号溶液,分别往1-2号溶液中滴定乙酸正丁酯至清液变浊,往3-8号溶 液中滴定[1]水至清液变浊,记录相应的滴定体积于表1中。
❖ 2.连接线的测定
按表2 “共轭溶液” 项中的体积将乙酸正丁酯、乙醇、水(H液)置于干 燥的50mL分液漏斗中,充分摇动后静置分层(H液先配好静置待用), 取水层(下层)约1mL于干燥的50mL具塞锥形瓶并称重(实验前需将空 的具塞锥形瓶称重),可得WG。然后用干燥的滴管逐滴加入表2中乙酸 正丁酯-乙醇溶液(E液),边滴边摇,滴至由浊变清后称重,可得WE, 所有数据记录于表2。
❖ 2) 过某一顶点的直线上,物系中其它两个 顶角组分的含量比相同。例如在图2中通过 顶点A的直线AN上,组分B和C含量之比都 相同。
❖ 3) 通过顶点的任一条线上,离顶点越近, 代表顶点组分的含量越多,反之亦然。例如 图2的M点中含A多;N点中含A少 。
图2 等边三角形图示规律
6
❖ 4) 若把任意两个三组分系统(其物系点分别为图 3中的M和N)混合成一个新的物系(图3中的O点 ),则O点一定在MN的连线上。O点的位置靠近 量多的物系点,可用杠杆规则求算。
❖ 5) 由三个三组分系统D,Q,F混合而成的新系统 的物系点(见图3),落在这三点组成三角形的重心 位置,即H点。先用杠杆规则求出D,Q混合后新 体系的物系点E,再用杠杆规则求出E,F混合后 的新体系物系点H,H即为三角形DQF的重心。 这一规则称为重心规则 。
三元体系相图的绘制
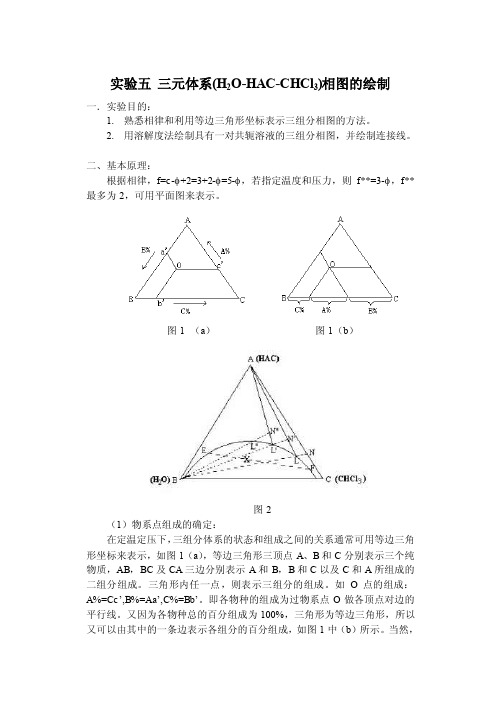
实验五三元体系(H2O-HAC-CHCl3)相图的绘制一.实验目的:1.熟悉相律和利用等边三角形坐标表示三组分相图的方法。
2.用溶解度法绘制具有一对共轭溶液的三组分相图,并绘制连接线。
二、基本原理:根据相律,f=c-φ+2=3+2-φ=5-φ,若指定温度和压力,则f**=3-φ,f**最多为2,可用平面图来表示。
图1 (a)图1(b)图2(1)物系点组成的确定:在定温定压下,三组分体系的状态和组成之间的关系通常可用等边三角形坐标来表示,如图1(a),等边三角形三顶点A、B和C分别表示三个纯物质,AB,BC及CA三边分别表示A和B,B和C以及C和A所组成的二组分组成。
三角形内任一点,则表示三组分的组成。
如O点的组成:A%=Cc’,B%=Aa’,C%=Bb’。
即各物种的组成为过物系点O做各顶点对边的平行线。
又因为各物种总的百分组成为100%,三角形为等边三角形,所以又可以由其中的一条边表示各组分的百分组成,如图1中(b)所示。
当然,给出一定组成的溶液百分比,按照上述表示方法,也应该能找出对应的物系点。
(2)溶解度曲线的绘制对于具有一对共轭溶液的三液系相图,如图2,该三液系相图中A和B,A和C为完全互溶而B和C为部分互溶,曲线abc为溶解度曲线。
曲线上方为单相区,曲线下方为二相区,物系点落在二相区内,即分为二相,如X 点则分成组成为E和F的二相,而EF线称为连接线。
对于溶解度曲线的绘制,本实验是先以完全互溶的两个组分(如A和C),以一定的比例混合所组成的均相溶液,如图2上的N点,滴加入组分B,根据平衡相图的直线规则,物系点则沿着NB移动,直至溶液变混,即为L点。
再加入A,物系点由LA上升至N’点而变清。
再加入B,此时物系点又沿着N’B由N’移动至L’而再次变混,再滴加A使变清……,如此反复,最后连接L,L’,L’’……即可画出溶解度曲线。
(3)连接线的绘制由于连接线是表示在两相区内呈平衡两相的组成(或A在两相中的分配),所以可以在两相区内配制溶液,待平衡后分析每相中的任何一种组成的含量,连接在溶解度曲线上该两含量的组成点而得出。
三元相图等温截面图

1200℃:由CAS2、SiO2(鳞石英)和液相b
CAS2
S
S e CAS2
100 50%
SiO2
(鳞石英)
CAS2 d S CAS2
100
5%
液相b d e 100 45%
S CAS2
1170℃:冷却平衡状态为CAS2、S和CS三相平衡
gS CAS2 S CAS2 100 68% CS f g 100 13%
②将纯MgO和白云石(50wt%℃aO,50wt%MgO)于1600℃在 CaO/SiO2=1(质量)和1.5(摩尔)系炉渣条件下使用,比较它们的抗侵蚀能力。
对于MgO:吸收炉渣组成由M→Y的变化 过程为,一旦吸收炉渣即刻形成液相,进 入⑤MgO+L两相平衡相区,液相量随吸 收炉渣量增加,大约相当于吸收78wt% 的炉渣液相量达100%,进入单一液相区 ⑧。 对于白云石(D):由D→Y约吸收53wt% 的炉渣方开始出现液相,大约吸收 82wt%的炉渣液相量达100wt%,进入单 一液相区。
② 给出组成相X(25%Al2O3,20%CaO,55%SiO2)Y(30%Al2O3,30%CaO,40%SiO2)冷却析晶路线,并分 别求组成X(1400℃,1200℃,1170℃)和Y( 1400℃,1300℃,1100℃)各温度下的平衡相及 其比例。
1400℃:由CAS2和组成为a的液相
X a CAS2 CAS2 a 100 26% 液相a CAS2 X 100 74%
3、CaO-MgO-SiO2系相图
①把比例为MgO:CaO:C3S=40:40:20的混合物组成点标注在相图上, 并指出该混合物的组成,若将这个混合物加热,指出其开始与完全熔 融的温度,将该熔体冷却至2000℃,其平衡相及其比例如何?
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实验八三组分体系等温相图的绘制
【目的要求】
1. 熟悉相律,掌握用三角形坐标表示三组分体系相图。
2. 掌握用溶解度法绘制相图的基本原理。
【实验原理】
对于三组分体系,当处于恒温恒压条件时,根据相律,其自由度f*为:
f*=3-Φ
式中,Φ为体系的相数。
体系最大条件自由度f*max=3-1=2,因此,浓度变量最多只有两个,可用平面图表示体系状态和组成间的关系,通常是用等边三角形坐标表示,称之为三元相图。
如图2-8-1所示。
等边三角形的三个顶点分别表示纯物A、B、C,三条边AB、BC、CA分别表示A和B、B和C、C和A所组成的二组分体系的组成,三角形内任何一点都表示三组分体系的组成。
图2-8-1中,P点的组成表示如下:
经P点作平行于三角形三边的直线,并交三边于a、b、c三点。
若将三边均分成100等份,则P点的A、B、C组成分别为:A%=Pa=Cb,B%=Pb=Ac,C%=Pc=Ba。
苯-醋酸-水是属于具有一对共轭溶液的三液体体系,即三组分中二对液体A和B,A和C 完全互溶,而另一对液体B和C只能有限度的混溶,其相图如图2-8-2所示。
图2-8-1 等边三角形法表示三元相图图2-8-2 共轭溶液的三元相图
图2-8-2中,E、K2、K1、P、L1、L2、F点构成溶解度曲线,K1L1和K2L2是连结线。
溶解度曲线内是两相区,即一层是苯在水中的饱和溶液,另一层是水在苯中的饱和溶液。
曲线外是单相区。
因此,利用体系在相变化时出现的清浊现象,可以判断体系中各组分间互溶度的大小。
一般来说,溶液由清变浑时,肉眼较易分辨。
所以本实验是用向均相的苯-醋酸体系中滴加水使之变成二相混合物的方法,确定二相间的相互溶解度。
【仪器试剂】
具塞锥形瓶(100mL,2只、25mL,4只);酸式滴定管(20mL,1支);碱式滴定管(50mL,1支);移液管(1mL,1支、2mL,1支);刻度移液管(10mL,1支、20mL,1支);锥形瓶(150mL,
2
第二篇基础实验
2只)。
冰醋酸(A.R.);苯(A.R.);NaOH (0.2000mo1·dm-3);酚酞指示剂。
【实验步骤】
1. 测定互溶度曲线
在洁净的酸式滴定管内装水。
用移液管移取10.00mL苯及4.00mL醋酸,置于干燥的100mL具塞锥形瓶中,然后在不停地摇动下慢慢地滴加水,至溶液由清变浑时,即为终点,记下水的体积。
向此瓶中再加入5.00mL醋酸,使体系成为均相,继续用水滴定至终点。
然后依次用同样方法加入8.00mL、8.00mL醋酸,分别再用水滴至终点,记录每次各组分的用量。
最后一次加入10.00mL苯和20.00mL水,加塞摇动,并每间隔5min摇动一次,30min后用此溶液测连结线。
另取一只干燥的100mL具塞锥形瓶,用移液管移入1.00mL苯及2.00mL醋酸,用水滴至终点。
之后依次加入1.00mL、1.00mL、1.00mL、1.00mL、2.00mL、10.00mL醋酸,分别用水滴定至终点,并记录每次各组分的用量。
最后加入15.00mL苯和20.00mL水,加塞摇动,每隔5min摇一次,30min后用于测定另一条连结线。
2. 连结线的测定
上面所得的两份溶液,经半小时后,待二层液分清,用干燥的移液管(或滴管)分别吸取上层液约5mL,下层液约1mL于已称重的4个25mL具塞锥形瓶中,再称其质量,然后用水洗入150mL锥形瓶中,以酚酞为指示剂,用0.2000mol·dm-3标准氢氧化钠溶液滴定各层溶液中醋酸的含量。
【注意事项】
因所测体系含有水的成分,故玻璃器皿均需干燥。
在滴加水的过程中须一滴一滴地加入,且需不停地摇动锥形瓶,由于分散的“油珠”颗粒能散射光线,所以体系出现浑浊,如在2~3min内仍不消失,即到终点。
当体系醋酸含量少时要特别注意慢滴,含量多时开始可快些,接近终点时仍然要逐滴加入。
在实验过程中注意防止或尽可能减少苯和醋酸的挥发,测定连结线时取样要迅速。
用水滴定如超过终点,可加入1.00mL醋酸,使体系由浑变清,再用水继续滴定。
【数据处理】
1. 从附录中查得实验温度时苯、醋酸和水的密度。
2. 溶解度曲线的绘制
根据实验数据及试剂的密度,算出各组分的质量百分含量。
图2-8-2中E、F两点数据如
将以上组成数据在三角形坐标纸上作图,即得溶解度曲线。
2. 连结线的绘制
(1) 计算二瓶中最后醋酸、苯、水的质量百分数,标在三角形坐标纸上,即得相应的物系
实验八三组分体系等温相图的绘制 3 点Q1和Q2。
(2) 将标出的各相醋酸含量点画在溶解度曲线上,上层醋酸含量画在含苯较多的一边,下层画在含水较多的一边,即可作出K1L1和K2L2两条连结线,它们应分别通过物系点Q1和Q2。
思考题
1. 为什么根据体系由清变浑的现象即可测定相界?
2. 如连结线不通过物系点,其原因可能是什么?
3. 本实验中根据什么原理求出苯-醋酸-水体系的连结线?
【讨论】
1. 该相图的另一种测绘方法是:在两相区内以任一比例将此三种液体混合置于一定的温度下,使之平衡,然后分析互成平衡的二共轭相的组成,在三角坐标纸上标出这些点,且连成线。
此法较为繁琐。
2. 含有两固体(盐)和一液体(水)的三组分体系相图的绘制常用湿渣法。
原理是平衡的固、液分离后,其滤渣总带有部分液体(饱和溶液),即滤渣,但它的总组成必定是在饱和溶液和纯固相组成的连结线上。
因此,在定温下配制一系列不同相对比例的过饱和溶液,然后过滤,分别分析溶液和滤渣的组成,并把它们一一连成直线,这些直线的交点即为纯固相的成分,由此亦可知该固体是纯物还是复盐。
